| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Datorita agitatiei termice, gazul exercita o presiune asupra peretilor vasului.
In S.I. unitatea de presiune este pascalul (Pa).
1 Pa = 1 N ∙ m-2
Alte unitati de masura utilizate in practica sunt: atmosfera, torr, avand urmatoarele relatii de transformare:
1 atm = 1,013 ∙ 105 Pa
1 atm = 760 torr (mmHg)
a) Legea Boyle - Mariotte
La temperatura constanta, volumul unei anumite cantitati de gaz variaza invers proportional cu presiunea:
![]() (2.2)
(2.2)
Ecuatia (2.2) reprezinta ecuatia izotermei gazului perfect.
Prin derivarea ecuatiei (2.2) in raport cu p se obtine:
![]() (2.3)
(2.3)
Valoarea constantei k din ecuatia (2.2) depinde de temperatura.
Valoarea constanta a produsului pV nu se pastreaza, mai ales la presiuni mari.
La presiuni mici, ea se aplica ca o lege limita.
Pentru mai multe stari ale gazului, legea (2.2) se poate scrie:
p1V1 = p2V2 = = pnVn = k (2.4)
In reprezentare grafica, izoterma p V este o hiperbola echilatera:
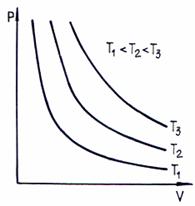
Fig. 2.1. Izotermele gazului perfect
b) Legea Gay - Lussac (legea dilatabilitatii izobare)
La presiune constanta, volumul unei mase determinate de gaz variaza direct proportional cu temperatura absoluta:
![]() (2.5)
(2.5)
respectiv
![]() (2.6)
(2.6)
Gay - Lussac a stabilit ca toate gazele se dilata in mod egal, avand acelasi coeficient de dilatare.
Coeficientul de dilatare in volum al gazelor ( sau V) este constant si este independent de temperatura si presiune:
![]() (2.7)
(2.7)
sau
![]() (2.8)
(2.8)
Prin integrarea ecuatiei (2.5), se obtine:
![]() (2.9)
(2.9)
unde: ![]() = volumul ocupat de gaz la 273 K (0 C);
= volumul ocupat de gaz la 273 K (0 C);
t = temperatura in C (numarul de grade cu care se modifica starea gazului);
V = volumul final al gazului.
Relatia (2.9) se numeste ecuatia izobarei gazului perfect.
Pentru doua stari ale gazului, legea (2.5) devine:
![]() (2.10)
(2.10)
Reprezentarea grafica a legii Gay - Lussac este ilustrata in fig. 2.2. a si b.
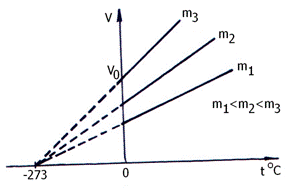
a)
b)
Fig. 2.2. Izobarele gazului perfect
c) Legea Charles (legea dilatabilitatii izocore)
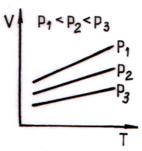
La volum constant, presiunea unei mase determinate de gaz variaza direct proportional cu temperatura absoluta.
![]() (2.11)
(2.11)
respectiv
![]() (2.12)
(2.12)
Prin integrarea ecuatiei (2.11) se obtine:
![]() (2.13)
(2.13)
unde: = coeficientul termic al presiunii;
pentru acelasi gaz;
![]() =
presiunea la 0 C;
=
presiunea la 0 C;
p = presiunea la t.
Ecuatia (2.13) se numeste ecuatia izocorei gazului perfect.
Pentru doua stari ale gazului, legea (2.11) devine:
![]() (2.14)
(2.14)
Reprezentarea grafica a legii Charles este prezentata in fig. 2.3. a si b.
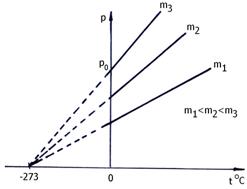
a)
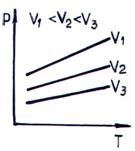
b)
Fig. 2.3. Izocorele gazului perfect
Relatiile Boyle - Mariotte, Gay - Lussac si Charles sunt valabile in cazul gazelor reale numai ca legi limita si la presiuni joase.
d) Legea generala a gazului perfect
Cand variaza cei trei parametrii (p, V, T) se obtine:
pV = ![]() (1 + t) (2.15)
(1 + t) (2.15)
care este o expresie a legii generale a gazului perfect.
Introducand valoarea lui in relatia (2.15), se obtine:
![]() (2.16)
(2.16)
unde: ![]() = volumul molar al gazului;
= volumul molar al gazului;
![]() =
22,41 l pentru 1 mol de gaz (c.n. - 0C si 1 atm)
=
22,41 l pentru 1 mol de gaz (c.n. - 0C si 1 atm)
![]() (2.17)
(2.17)
unde: R = constanta generala a gazelor. R nu depinde de masa si natura gazului.
Relatia (2.17) se numeste ecuatia de stare a gazului perfect, aplicata la 1 mol de gaz.
![]() (2.18)
(2.18)
Valoarea lui R depinde de unitatile alese pentru parametri de stare:
R = 0,082 dm3∙atm/K∙mol;
R = 62400 cm3∙mmHg/K∙mol;
R = 8,31 J/mol∙K
R reprezinta initiala numelui lui H.V. Regnault.
Stiind ca:
V = V(p, T) (2.19)
prin diferentierea relatiei (2.19) se obtine:
![]() (2.20)
(2.20)
Inlocuind derivatele partiale din relatia (2.20) cu expresiile din ecuatiile (2.3) si (2.6) se obtine:
![]() (2.21)
(2.21)
Separand variabilele in relatia (2.21), rezulta:
dlnp + dlnV = d lnT (2.22)
iar prin integrare:
pV = const∙T
adica se ajunge la relatia (2.17).
Daca vom raporta ecuatia de stare a gazului perfect la n moli de gaz, ecuatia (2.17) devine:
pV = nRT (2.23)
Stiind ca:
![]()
![]() (2.24)
(2.24)
unde: m = masa gazului;
M = masa moleculara a gazului.
Rezulta:
![]() (2.25)
(2.25)
Relatia (2.25) se numeste ecuatia Clapeyron - Mendeleev.
Ecuatia Clapeyron - Mendeleev se foloseste pentru determinarea:
masei moleculare a unui gaz sau a unui amestec de gaze;
densitatii unui gaz;
densitatii relative a unui gaz sau amestec de gaze.
Din ecuatia (2.25) rezulta:
![]() (2.26)
(2.26)
si
![]() (2.27)
(2.27)
unde: ρ = densitatea gazului.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 5298
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved