| CATEGORII DOCUMENTE |
| Bulgara | Ceha slovaca | Croata | Engleza | Estona | Finlandeza | Franceza |
| Germana | Italiana | Letona | Lituaniana | Maghiara | Olandeza | Poloneza |
| Sarba | Slovena | Spaniola | Suedeza | Turca | Ucraineana |
Adice na C=C vazbu
Elektrofilní adice
Adice bromu
Jestliže smícháme vysušený brom a ethylen za tmy v nádobě pokryté parafinem, nebudou spolu reagovat. Za světla dochází k reakci, ale díky homolytickému mechanismu, ke kterému se vrátíme později. Avšak i za tmy dochází k reakci, jestliže jsou přítomny stopy vlhkosti, anebo jestliže reagenty mohou interagovat s volným povrchem např. skleněné nádoby. Tyto skutečnosti podporují reakci s polárním mechanismem. Ethylen sám o sobě nereaguje s roztokem NaCl, ale jestliže přidáme NaCl k bromové vodě, potom reakce poskytuje jak
1,2-dibromethan, tak i 1-brom-2-chlorethan. Toto chování je v souladu s dvoukrokovým mechanismem, jehož prvním krokem je elektrofilní adice bromu na ethylen.
|
|
Pozorovaný substituční efekt je také v souladu s tímto mechanismem - elektrondonory urychlují tuto reakci, elektronakceptory ji zpomalují. Následující tabulka tuto skutečnost ilustruje na příkladu alkylové substituce.
Rychlostní konstanty reakce druhého řádu (k2/ l mol-1s-1) pro rekce alkenů s bromem v methanolu při 25oC
|
Alken |
k2 |
Alken |
k2 |
Alken |
k2 |
|
CH2=CH2 |
Me2C=CH2 |
3.7 x 104 |
PhCH=CH2 |
1.5 x 103 |
|
|
MeCH= CH2 |
4.0 x 102 |
Me2C=CHMe |
1.3 x 106 |
PhCH=CHMe (Z) |
7.9 x 102 |
|
MeCH=CHMe (Z) |
2.4 x 104 |
Me2C=CMe2 |
1.2 x 107 |
PhCH=CHMe (E) |
3.2 x 103 |
|
MeCH=CHMe (E) |
1.3 x 104 |
PhCMe=CH2 |
1.4 x 105 |
Izomerní 2-buteny reagují s bromem stereospecificky za vzniku antiaduktu, tzn., že trans-derivát poskytuje výlučně mesodibromid a cis-derivát dává racemický dibromid.
|
|
Vysvětlení tohoto chování je založeno na vzniku cyklického bromoniového iontu, který je v druhém kroku otevírán a doprovázen Waldenovým zvratem.

Existence řady podobných bromoniových iontů byla prokázána NMR studiemi. Jejich generace je ovšem založena na reakci v kapalném SO2:
|
|
Vzhledem k velmi rozdílným podmínkám není ovšem jisté, že podobný kationt je tvořen adicí bromu na alkeny. Nicméně vliv alkylové substituce na dvojné vazbě poskytuje další důkaz můstkového tranzitního stavu. Z údajů v tabulce vyplývá, že všechny tři dimethylethyleny reagují podobnou rychlostí. Jestliže bychom předpokládali, že náboj bude lokalizován na jednom z uhlíků, potom by izobutan, který tvoří terciární karbokationt, musel reagovat mnohem rychleji než ostatní 2-buteny. Tak tomu není a kationt tedy nemůže být lokalizován na žádném z uhlíků. Po řadu let byla anti-adice považována za velmi obecnou. Nicméně byla nalezena i řada výjimek - ačkoliv 2-buteny reagují stereospecificky, b-methylstyreny dávají směs erythro- a threo-dibromidů, s anti-aduktem sice v převaze, ale syn-adukt je tvořen až z 28%. To ukazuje, že struktura kationtového intermediátu a příslušného tranzitního stavu závisí na struktuře alkenu. Mezi oběma extrémy - cyklickým bromoniovým iontem na straně jedné a otevřeným karbokationtem na straně druhé - je možno si představit řadu symetrických i nesymetrických struktur s nábojem delokalizovaným mezi uhlík a brom.
symetrických i nesymetrických struktur s nábojem delokalizovaným mezi uhlík a brom.
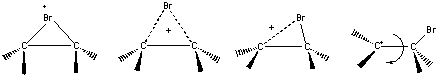
Elektrondonorové substituenty na dvojné vazbě zvýrazňují karbokationtový charakter intermediátu, elektronakceptory zvýrazňují náboj na bromu. Např. v b-methylstyrenu je náboj delokalizován v rámci interakce s benzenovým p systémem za vzniku nesymetrického můstkového intermediátu. Efekt methylové substituce na styrenové dvojné vazbě je jiný než stejný efekt v ethylenové řadě - a-methylstyren je mnohem reaktivnější než jeho b-izomer, zřejmě v důsledku vzniku významného kladného náboje na a-uhlíku tranzitního stavu. Jestliže je intermediátem necyklický karbokationt, potom geometricky izomerní alkeny
poskytují shodnou směs diastereoizomerních dibromidů. Částečná ztráta stereospecifity, jako např. u b-methylstyrenu, zřejmě souvisí s pomalou rotací kolem C-C vazby ve slabě vázaném cyklickém intermediátu.
|
|
Ale i tento obrázek je přílišným zjednodušením. V nukleofilních rozpouštědlech (kys. octová, methanol) je tvorba dibromidů vždy doprovázena tvorbou brom/solventa/duktu, vznikajícího solvolýzou kationtového intermediátu.
|
|
Avšak dokonce i v případě b-methylstyrenu tento adukt vzniká výlučně anti-adicí. Zdá se tedy, že bromoniový iont je tvořen jako těsný iontový pár se svým partnerem - bromidovým aniontem - na stejné straně uhlíkatého skeletu jako bromoniový můstek. Ze sterických i stereoelektronických důvodů je toto uspořádání nevýhodné pro rozpad za vzniku syn-aduktu. Místo toho musí dojít k vnitřní reorganizaci, aby bromidový iont mohl přistoupit z opačné strany C-Br+ jednoduché vazby. Přitom může, ale také nemusí dojít k rotaci kolem C-C vazby. Takováto reorganizace není nezbytná pro atak rozpouštědla, protože vždycky jsou v okolí vhodně orientované molekuly rozpouštědla. Odhadnout důležitost volně vázaných cyklických intermediátů, anebo otevřených karbokationtů je velmi obtížné. Např. studie adice bromu na substituované stilbeny ukazuje, že vzájemný posun mezi nimi může být velmi snadný. Hammettova rovnice ukazuje zlom zřejmě v důsledku změny mechanismu - viz následující obrázek.
 |
při 25o C.
|
|
Obvykle tato změna bývá interpretována jako vznik dvou alternativních karbokationtových intermediátů.
Z kinetického pohledu probíhá adice bromu na alkeny při nízkých koncentracích jako reakce druhého řádu, proto bývá někdy označována symbolem AdE2. Při vyšších koncentracích však vykazuje kinetické charakteristiky třetího řádu.
Rychlost = k2[alken][Br2] + k3[alken][Br2]2
Toto chování bývá obvykle vysvětlováno vznikem rychlé rovnovážné reakce mezi molekulou alkenu a bromu, následovanou potom v rychlost limitujícím kroku atakem druhé molekuly bromu.
|
|
Podobné molekulární komplexy mezi jodem a alkenem jsou známy a vznikají exotermně. Důkaz takovýchto komplexů pro brom pochází především ze studia UV-VIS spekter směsi bromu a alkenu. Vlnová délka absorbce závisí především na ionizační energii alkenu, ale také na vzdálenosti mezi uhlíkovým a bromovým atomem v molekulárním komplexu. Tohoto chování bylo využito i jako míry sterických interakcí mezi bromem a alkenem. Podobná analýza bývá používána i u studia oxymerkurací, u nichž se všeobecně předpokládá, že probíhají stejným mechanismem jako adice bromu. Liší se od nich ovšem v tom, že jsou zpomalovány alkylovou substitucí na dvojné vazbě, na rozdíl od adice bromu.
Adice chloru
Adice chloru na alkeny obecně připomíná adice bromu a většina rozdílů je spojována s vyšší elektronegativitou chloru. Kinetika adicí je většinou druhého řádu, což naznačuje, že tvorba molekulárních komplexů, pokud existují, je kineticky nevýznamná. Stereospecifická anti-adice probíhá u 2-butenů a podobných jednoduchých alkenů zřejmě opět díky existenci můstkového chloroniového iontu . Efekt alkylové substituce je podobný jako v případě adice bromu - izobuten reaguje zhruba stejně rychle jako 2-buten. Avšak adice chloru na
b-methylstyren je mnohem méně stereospecifická než v případě bromu.
Složení produktu při reakci chloru s b-methylstyrenem (zbytek do 100% odpovídá substitučnímu produktu)
|
Dichlorderivát |
Chlor-acetátový produkt |
|||
|
anti |
syn |
anti |
syn |
|
|
trans-alken | ||||
|
v CCl4 při 0-5oC | ||||
|
v AcOH při 25oC |
24.5 |
21.5 |
8.5 |
|
|
cis-alken | ||||
|
v CCl4 při 0-5oC | ||||
|
v AcOH při 25oC |
|
|||
Převaha syn-adice chloru a nízká stereoselektivita adice rozpouštědla ukazuje na otevřenou strukturu karbokationtového intermediátu.
|
|
Rotace kolem C-C jednoduché vazby, přesun chlorového aniontu i tvorba produktu probíhají zřejmě podobnou rychlostí.
Adice chlorovodíku a bromovodíku
Detailní mechanismus těchto jednoduchých reakcí je velice složitý a do jisté míry je i dosud neznámý. Substituční efekt ukazuje, že rychlost limitujícím krokem je protonace dvojné vazby. Pořadí reaktivity alkenů je: R2C=CHR R2C=CH2 >> RCH=CHR RCH=CH2. Je tedy zřejmé, že reakce zahrnuje tvorbu kationtového intermediátu, ale mechanismus je určitě složitější než následující formulace
|
|
Reakce probíhají většinou stereospecificky a tedy zřejmě nikoliv přes volný karbokationt. Reakce přes iontový pár může usnadňovat syn-adice a některé příklady tomu skutečně nasvědčují.
|
|
|
|
Ačkoliv popisované chování existuje, nepředstavuje obvyklý průběh reakce. V reakci chlorovodíku s cyklohexenem v kys. octové zcela převládá anti-adice nad syn. Obvyklé vysvětlení spočívá v převaze procesu zahrnujícího atak chloridového aniontu na molekulový komplex alken - chlorovodík.
Toto vysvětlení podporuje i skutečnost, že vedlejší produkt - alkylacetát - vzniká téměř výlučně anti-adicí a že se vzrůstající koncentrací chlorovodíku, anebo přídavkem chloridu sodného se snižuje poměr acetát/chlorderivát a podíl chlorderivátu vzniklého anti-adicí vzrůstá. Jiná varianta chování byla nalezena u 1,2-dimethylcyklohexenu, který protonací poskytuje terciární karbokation a při nízkých koncentracích chlorovodíku poskytuje syn-adukt, ale při vyšších koncentracích chlorovodíku anti-adukt. Bromovodík se v této reakci chová podobně, ale poskytuje vždy z vyšší míry anti-adukt ve srovnání s adicí chlorovodíku za stejných podmínek. Při vyšších koncentracích bromovodíku je také mnohem efektivněji potlačena tvorba acetátu ve srovnání s adicí chlorovodíku. To je zřejmě způsobeno vyšší disociací bromovodíku a vyšší nukleofilitou bromidového aniontu. V nepolárních rozpouštědlech jsou reakce jak s chlorovodíkem, tak i bromovodíkem většinou 3. řádu vzhledem k halogenvodíku, pravděpodobně v důsledku nutnosti třetí molekuly halogenvodíku k přeměně slabě elektrofilní molekuly HX na H+HX2-.
Markovnikovo pravidlo
Adice nesymetrického elektrofilu na nesymetrický alken může v principu dát směs produktů. Markovnikov před více než 100 lety prvý zjistil, že tomu tak není, a že adice elektrofilu HX probíhá tak, že vodík se aduje na méně substituovaný konec a X na více substituovaný konec dvojné vazby. Tato skutečnost je obvykle vysvětlována relativní stabilitou vzniklých intermediátů - karbokationtů. Přesnější formulace by jistě vycházela z relativních energií tranzitních stavů, ale je pravděpodobné, že jejich nábojová distribuce se příliš neliší od distribuce jejich karbokationtů. Markovnikovo pravidlo bylo původně odvozeno z adice halogenvodíků na olefiny, ale v principu může být použito na jiné reakce.
Vinylchlorid aduje chlorovodík výlučně za vzniku geminálního 1,1-dichlorethanu. V tomto případě není jednoduché říci, který ze dvou možných karbokationtových intermediátů bude stabilnější. 2-chlorethylový kation je jistě méně stabilní než ethylový v důsledku elektron-polárního efektu chloru. V 1-chlorethylovém kationtu je kladný náboj blíže chlorového atomu a polární destabilizace je jistě větší, ale je částečně vyvážena mezomerní interakcí s volnými elektronovými páry chloru . Tento efekt je zřejmě dostatečný k tomu, aby energie 1-chlorkationtu byla nižší než 2-chlorizomeru. Vzhledem k tomu, že adice na vinylchlorid je pomalejší než na ethylen za podobných podmínek, je zřejmé, že výsledný efekt chloru je spíše elektronakceptorní. Mezomerní dotace tedy nevyváží toto elektronakceptorní chování a 1-chlorethylový kationt je tedy méně stabilní než ethylový.
Orientace v adicích, které probíhají přes cyklický iont, je obtížněji předpověditelná. Např. Markovnikův adukt v reakci propenu s HOCl, HOBr a ClBr vzniká z 91, 79 a 54%. Je evidentní, že existuje jemná rovnováha efektů v odpovídajícím tranzitním stavu, ve kterém nukleofil atakuje halogenidový iont.
|
|
Sterické interakce zřejmě diskvalifikují atak na centrálním atomu a upřednostňují tvorbu anti-Markovnikova aduktu. Na druhé straně stejný uhlík má větší kladný náboj. Velikost elektronických efektů závisí na obou částicích - jak na elektrofilním halogenu, tak i na nukleofilu. Rozdíl mezi HOCl a HOBr odráží větší neochotu chloru přijmout část kladného náboje, což vede ke zvýšení důležitosti elektronických efektů a favorizuje Markovnikův adukt. Porovnání nukleofilů v reakci s HOBr a ClBr ukazuje, že hydroxid jako tvrdý nukleofil je silněji přitahován ke kladnému náboji na centrálním uhlíkovém atomu ve srovnání s poněkud měkčím chloridovým aniontem.
Radikálové adice
Radikálové adice na olefinickou vazbu probíhají klasickou řetězovou reakcí.
|
|
Přítomnost radikálového mechanismu je dána typickými podmínkami iniciace, tj. fotolýzou nebo přídavkem radikálových iniciátorů a na druhé straně brzdícím efektem obvyklých radikálových zhášečů. Radikálová polymerace ethylenu může být takovým příkladem reakce, která je iniciována stopami kyslíku. Vyšší koncentrace kyslíku však polymeraci potlačují, protože přerušují řetězovou reakci. Ze studia radikálových reakcí vyplývá, že adice probíhá anti-Markovnikovsky. Např. při adici HBr na styren, iniciované dibenzoylperoxidem, převládá vznik 1-brom-2-fenylethanu. Klíčovou roli zjevně hraje stabilizace tranzitního stavu, ve kterém je nepárový elektron delokalizován do benzenového p systému.
|
|
Obecně řečeno, předpověď orientace při radikálových adicích je mnohem obtížnější. Monosubstituované alkeny XCH=CH2 jsou přednostně atakovány vždy na nesubstituovaném uhlíku, s výjimkou těch, u nichž substituent X může svými p elektrony interagovat se vzniklým radikálovým centrem (příkladem je uvedená adice HBr na styren). Substituent X sám o sobě má malý vliv na rychlost reakce. Propen a 3,3,3-trifluorpropen reagují prakticky stejnou rychlostí s CH3 radikálem. V těchto reakcích hrají zřejmě hlavní roli sterické faktory. Objemné radikály silně preferují méně bráněný konec dvojné vazby. Na druhé straně význam polárních efektů v radikálových reakcích je často podceňován. Např. methylový radikál reaguje s ethylenem 10x rychleji než s tetrafluorethylenem, ale pro trifluormethylový radikál platí opak. Vysvětlení této skutečnosti je založeno na chování obou radikálů - methylový radikál je nukleofilem, a je tedy přitahován do oblasti s nízkou elektronovou hustotou, naopak trifluormethylový radikál je elektrofil. Tento rozdíl se projevuje např. i v konkrétní reakci s trifluorethylenem - methylový radikál atakuje především CF2 uhlík, zatímco trifluormethylový radikál CHF uhlík.
Většina radikálových adicí probíhá nestereoselektivně, tedy např. fotoadice BrCCl3 na cis- i trans-2-buten poskytuje stejnou směs diastereoizomerů.
Nukleofilní adice
Ethylen sám o sobě podléhá reakci s mimořádně silnými nukleofily - např. s terc.butyllithiem vzniká t-BuCH2CH2Li. Podobná reakce probíhá i u aniontové polymerace ethylenu a jiných jednoduchých olefinů katalyzovaných alkylhlinitými sloučeninami. Polyhalogenalkeny jsou vůči nukleofilnímu ataku mnohem citlivější. Např. CF2=CCl2 aduje ethanol za přítomnosti ethoxidu sodného za vzniku EtOCF2CHCl2. Orientace adice je zřejmě řízena možností delokalizace záporného náboje do d orbitalu chloru.
|
|
Jediný dostatečně silný elektronakceptorní substituent postačí, aby aktivoval substrát k nukleofilní adici. Např. 3,3,3-trifluorpropen nepodléhá elektrofilní adici ani působením silných kyselin, ale reaguje ve smyslu nukleofilní adice s ethanolem za přítomnosti ethoxidu sodného.
Michaelova reakce je snad nejdůležitějším příkladem nukleofilních adicí na C=C vazbu, aktivovanou v tomto případě konjugací s karbonylovou nebo jinou, p elektrony obsahující skupinu.
|
|
Nukleofilní adice může být katalyzována i kysele:
|
|
Průběh reakce nukleofilním mechanismem lze snadno prokázat zpomalujícím účinkem alkylových skupin navázaných na dvojnou vazbu. Např. hydrogensiřičitanový iont reaguje 500x pomaleji s a-methylakrylonitrilem než s akrylonitrilem.
Adice bromu na Michaelovské substráty může být elektrofilní i nukleofilní v závislosti na struktuře substrátu a reakčních podmínkách. Reakce mohou někdy vykazovat i komplikovanější chování. V některých případech jsou autokatalyzovány vznikajícími produkty nebo produkty vedlejších reakcí. Změna substituce substrátu může vést až ke změně mechanismu. Např. kyselina krotonová reaguje mnohem pomaleji než kyselina akrylová v souladu s očekávaným nukleofilním mechanismem, ale zavedení druhé methylové skupiny reakci opět urychluje, zřejmě tím, že mechanismus se změní na elektrofilní adici.
Adice HBr v kyselině octové při 24oC
|
CH2=CHCOOH |
MeCH=CHCOOH |
Me2C=CHCOOH |
|
|
k2/10-4l mol-1 s-1 |
Hydroborace
Diboran reaguje pomalu v plynné fázi s ethylenem za vzniku diethylboranu. Reakce má složitou kinetiku a předchází jí rovnováha mezi boranem, diboranem a triboranem, z nichž teprve poslední skutečně reaguje s ethylenem. V etherickém roztoku je reakce mnohem rychlejší a je důležitou syntetickou metodou. Oxidativní štěpení alkylboranů alkalickým roztokem peroxidu vodíku poskytuje odpovídající alkohol.
|
|
Adice v této reakci probíhá stereospecificky syn. Např. hydroborace 1-methyl- a 1,2-dimethylcyklopentenu a cyklohexenu dávají méně než 3% anti-alkoholu. To je zřejmě důsledkem uplatnění součinného cyklického tranzitního stavu, ve kterém vazby C-H a C-B vznikají současně. To bylo potvrzeno i existencí 1H/ 3H a 10B/ 11B izotopových efektů. Hydroborace je také vysoce regioselektivní reakcí. Terminální alkeny typu RCH=CH2 poskytují až 94% primárního alkoholu, dialkylolefiny typu R2C=CH2 dávají více než 99% primárního alkoholu. Sterické faktory jsou velmi důležité - v cyklickém tranzitním stavu je boranový zbytek navázán přednostně na méně objemný konec C=C vazby. Elektronické efekty jsou také důležité. Např. stupeň regioselektivity v případě arylsubstituovaných styrenů závisí na charakteru substituce. V případě alkenů má substituce poměrně malý vliv na reakční rychlost, zřejmě díky kompenzaci sterických a elektronických efektů. Tato skutečnost byla potvrzena opět izotopovým efektem. V případě adicí objemných boranů začíná vzrůstat důležitost sterického efektu. Např. reakce 9-borabicyklo[3.3.1]nonanu se styrenem vede k hydroboraci téměř výlučně na primární, méně bráněné pozici, bez ohledu na substituci benzenového jádra. Vzájemné působení sterických a elektronických efektů je dobře pozorovatelné na relativní reaktivitě alkenů a chloroalkenů vůči 9-borabicyklo[3.3.1]nonanu.
Relativní reaktivity alkenů a chloralkenů vůči 9-borabicyklo[3.3.1]nonanu (R je nerozvětvený alkyl)
|
|
Charakter tranzitního stavu hydroborací - tj. [2s p] součinný proces zahrnující s elektrony B-H vazby a p elektrony dvojné vazby, formálně nesplňuje požadavky kladené na pericyklické procesy. Skutečnost, že hydroborace jsou velmi exothermní ukazuje, že tranzitní stav se velmi podobá reaktantům. V takovém případě antivazebné interakce, které destabilizují zakázaný pericyklický proces, jsou velmi málo vyvinuty a neumožňují aplikovat normální pravidla.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3603
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved