| CATEGORII DOCUMENTE |
| Bulgara | Ceha slovaca | Croata | Engleza | Estona | Finlandeza | Franceza |
| Germana | Italiana | Letona | Lituaniana | Maghiara | Olandeza | Poloneza |
| Sarba | Slovena | Spaniola | Suedeza | Turca | Ucraineana |
Eliminační reakce
Tato kapitola se zabývá jenom jednou kategorií eliminací - rekcemi typu: H-C-C-Z à C = C. Tyto reakce představují nejdůležitější a nejprostudovanější skupinu eliminací, i když jejich celková šíře je větší - zahrnuje tvorbu trojných vazeb a dvojných vazeb uhlík - kyslík nebo jiný heteroatom, reakce, v nichž vodík není jednou z odstupujících skupin (dehalogenace a fragmentace) a eliminace z nesousedních atomů.
Soubor mechanismů E1 - E2 - E1cB
Navrhované mechanismy klasických eliminací jsou analogií SN2 a SN1 - viz schéma
|
|
Třetím mechanismem je E1cB (monomolekulární eliminace z konjugované báze), který se uplatňuje u substrátu s relativně kyselým protonem, kde reakce probíhá přes karbaniontový intermediát - viz schéma.
|
|
Samozřejmě je možné si představit celou řadu mezistupňů mezi E1 a E1cB extrémy v závislosti na relativní časové souslednosti zániku vazeb C-H a C-Z. Ideální E2 mechanismus je přesně ve středu s oběma vazbami zanikajícími současně. Podobně jako u nukleofilních substitucí je aktuální otázka, jestli existuje kontinuální přechod od bimolekulárního k monomolekulárnímu mechanismu. Setkáváme se tu se stejnými otázkami
a problémy jako v případě nukleofilních substitucí (viz dále).
Charakteristiky E1 a E2 mechanismů
Rychlost určující krok v E1 a SN1 reakcích je shodný a jejich kinetické chování je tedy také shodné. E1 reakce jsou prvního řádu vzhledem k substrátu, nejsou ovlivňovány přidanou bází a nejsou ani bržděny vznikajícím iontem za předpokladu, že karbokationt je dostatečně selektivní a že ionizace probíhá za tvorby volného iontového páru. E2 reakce se řídí kinetikou druhého řádu. U solvolytických eliminací se setkáváme s obvyklým problémem rozlišení mezi kinetikou pseudoprvního řádu bimolekulární reakce a skutečným procesem prvého řádu. V E1 reakci je obvykle jen velmi malý H/D kinetický izotopový efekt, ale většinou významný kinetický efekt pro odstupující skupinu. Na druhé straně v E2 reakci jsou vazby H-Cb a Ca-Z v tranzitním stavu částečně přerušeny a obě tedy vykazují kinetický izotopový efekt. Jeho velikost je velice různá v závislosti na struktuře tranzitního stavu a poměr kH/kD je obvykle v rozsahu 3 až
Charakteristiky E1cB mechanismu
a) kinetika
|
|
Kinetická analýza není příliš vhodná pro charakterizaci E1cB mechanismu. Jestliže aplikujeme aproximaci ustáleného stavu pro karbaniont ve schématu:
můžeme odvodit následující kinetickou rovnici
Rychlost = k1k2 [HCCZ][B-]/(k -1[BH] + k2)
Jestliže ionizace je rychlost limitujícím krokem, tj. k-1[BH] << k2, potom pro rychlost můžeme psát
Rychlost = k1 HCCZ][B-]
Rychlost je tedy nerozlišitelná od reakce typu E2. Tento extrémní případ je obvykle nazýván nevratnou E1cB reakcí. Rychlá rovnováha mezi reaktanty a karbaniontem ( k-1[BH] >> k2 ) vede k mnohem komplikovanějšímu chování.
Rychlost = k1k2 HCCZ][B-]/ k -1[BH]

Jestliže ovšem
je báze aniontem rozpouštědla, jak je obvyklé, [BH] je konstantní a kinetická
rovnice je opět druhého řádu. Tato
varianta je nazývána E1cB mechanismem s předřazenou rovnováhou. Obrázek
ukazuje rozdíl mezi oběma typy E1cB a
mechanismem E2.
Zůstává ještě třetí možnost - velmi kyselé substráty (např. s nitroskupinou aktivující b proton) mohou v přítomnosti přebytku báze kompletně ionizovat na anionty. Ve druhém kroku může potom rozpad probíhat kinetikou prvního řádu nezávislou na změně [B-].
b) izotopový efekt v E1cB mechanismu s předřazenou rovnováhou
Existence rychlé rovnováhy může být prokázána deuteriovou výměnou. Jestliže je reakce ve svém průběhu zastavena, deuterium se dostává do substrátu z rozpouštědla. Taková reakce v důsledku toho vykazuje H/D kinetický izotopový efekt, ačkoliv zde ještě mohou existovat efekty odstupující skupiny a také kinetický izotopový efekt rozpouštědla.
c) efekt odstupující skupiny v nevratné E1cB reakci
|
|
Vazba C-Z zůstává neporušena v rychlost limitujícím kroku nevratného E1cB mechanismu a nepřítomnost izotopového efektu odstupujícího nukleofilu je důkazem tohoto mechanismu. Dehydrochlorace DDT silnými bázemi je příkladem takovéto nevratné E1cB reakce. Ale blízce podobné sloučeniny (DDD a Ar2CHCHCl2 ) obecně reagují mechanismem E2 - jejich dehydrochlorace je rychlejší než dehydrochlorace DDT analogů, protože ionizace na karbaniont je pomalejší v systémech obsahujících o jeden elektronakceptorní atom chloru méně. Para-nitrosloučeniny tohoto typu reagují rychlostí úměrnou tvorbě aniontů a E1cB mechanismus je zde potvrzen existencí 35Cl/37Cl kinetického izotopového efektu. Pro ostatní substráty typu DDD je tento efekt malý, ale významný, a ukazuje na určitý podíl rozštěpení vazby Ca -Cl v tranzitním stavu. U para-nitrosloučenin není tento efekt detekovatelný. Ze stejného důvodu, kdy vazba C-Z není přerušena v rychlost limitujícím kroku, neplatí v těchto eliminacích normální pořadí efektu odstupující skupiny (I> Br> Cl> F). V reakci trans-1-chlor-2-fluoracenaftenu s terc.butanolátem draselným je eliminován fluorovodík, poněvadž v rychlost limitujícím kroku, tj. tvorbě karbaniontu, nastává jeho stabilizace delokalizací náboje do d orbitalu sousedního atomu chloru.
Variace E2 tranzitního stavu
Myšlenka širokého spektra E2 mechanismů (od těch s především karbaniontovým charakterem b uhlíku až k těm s převážně kationtovým charakterem a uhlíku ) je velmi užívána. Obvykle je tato situace konvenčně zobrazována jako hypotetický trojrozměrný potenciálový povrch schematicky promítaný do roviny papíru.

Různé E2 tranzitní stavy. Horní diagramy reprezentují
v perspektivním a rovinném zobrazení úplně symetrický E2 proces. Spodní
diagramy zobrazují efekt snížení energie karbokationtu a tím posun reakce
směrem k E1 mechanismu.
Tyto diagramy můžeme interpretovat v pojmech zeměpisných analog: bod na vodorovné rovině odpovídá geometrii reagujících molekul a výška odpovídá potenciální energii systému. Reakce je potom zobrazena jako cesta od reaktantu z jednoho údolí k produktům v údolí druhém, přecházejíc přes sedlo, tedy tranzitní stav. Např. geometrické proměnné v obrázku - tedy Cb-H a Ca-Z vzdálenosti - přecházejí od rovnovážných vazebných délek v reaktantech až k úplné separaci v produktech. Horní dvojice diagramů popisuje úplně symetrickou reakční cestu s tranzitním stavem, v němž jsou vazby Cb-H a Ca-Z z poloviny přerušeny. Spodní dvojice ukazuje chování substrátu, který může stabilizovat kladný náboj na a uhlíku a reakce tedy vykazuje významný podíl E1 charakteru. Takovéto diagramy mohou být užity k předpovědi změny charakteru tranzitního stavu v souvislosti s měnícími se harakteristikami reakce. Jestliže změna snižuje energii systému ve směru kolmém k reakční koordinátě, potom se tranzitní stav posouvá směrem k nižší energii. Jestliže změna je rovnoběžná s reakční koordinátou, potom, ačkoliv se to na první pohled zdá podivné, se tranzitní stav pohybuje směrem od nižší energie. To je v souladu s Hammondovým postulátem, že tranzitní stav se podobá více stavu s vyšší energií.

Hammondův postulát: se snížením energie na jedné straně reakce dochází k posunu tranzitního stavu směrem k druhé straně reakce
Aplikace tohoto přístupu může být ilustrována na příkladu odstupující skupiny, anebo atakující báze - viz tabulky.
První tabulka ukazuje, že s klesající ochotou skupiny odstoupit hodnota r vzrůstá, odrážejíc vzrůstající záporný náboj na uhlíku Cb a zvyšující se podíl E1cB mechanismu. Slabá schopnost odstoupit koresponduje v první aproximaci s částicemi, u nichž Z.- má relativně vysokou energii.
Vliv odstupující skupiny při eliminacích z ArCH2CH2Z užitím EtO-/EtOH při 30oC
|
Odstupující skupina Z |
Relativní rychlost (Ar-Ph) |
r |
kH/kD (Ar=Ph) |
|
I | |||
|
Br |
4 100 |
7.1 |
|
|
OTos |
392 |
5.7 |
|
|
Cl |
68 | ||
|
SMe2+ |
7.7 |
5.1 |
|
|
F |
1 | ||
|
NMe3+ |
a |
3.0 (při 50oC) |
a: vzhledem k různým reakčním teplotám nelze stanovit
Vliv této skutečnosti na tranzitní stav je zvýšení rozsahu Cb -H rozpadu.
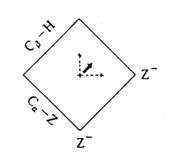
Vliv neochotně odstupující skupiny (vysoká energie Z-) na E2 tranzitní stav. Přerušované šipky ukazují pohyb centrálního TS směrem k Z- podél reakční koordináty a směrem od Z- kolmo k reakční koordinátě. Výsledná změna struktury TS je potom zobrazena zvýrazněnou šipkou.
Tato interpretace byla podpořena H/D kinetickým izotopovým efektem - maximální hodnota pro Z=Br odpovídá tranzitnímu stavu, ve kterém je proton právě z poloviny přenesen na bázi a zmenšující se hodnota je v souladu s postupujícím rozpadem vazby Cb-H. Obecně platí, že čím nižší je ochota skupiny odstoupit, tím více je proton přenesen ze substrátu na bázi v tranzitním stavu. Následující tabulka ukazuje, že vzrůstající síla báze není, jak by se dalo čekat, doprovázena zvýšením míry přenosu protonu ze substrátu. Izotopový efekt ve skutečnosti ukazuje opak - vazba je více než z poloviny přerušena v tranzitním stavu, zvýšení kH/kD odpovídá snížení podílu rozpadu C-H vazby.
Vliv báze na eliminaci z ArCH2CH2NMe3+ v dimethylformamidu při 56oC
|
Báze |
r |
kH/kD (Ar=Ph) |
|
PhO- | ||
|
m-NO2C6H4O- |
Vzrůstající karbanionický charakter se odráží ve vzrůstající hodnotě r, poněvadž silná báze zmenšuje rozsah rozpadu Ca-Z vazby v tranzitním stavu.

Vliv silné báze (nízká energie HB) na E2 tranzitní stav. Přerušované šipky ukazují pohyb centrálního TS směrem od HB podél reakční koordináty a směrem k HB kolmo k reakční koordinátě. Výsledná změna struktury TS je potom zobrazena zvýrazněnou šipkou.
Stereochemie
Stereochemie E2 eliminací
U součinného E2 mechanismu je oprávněné do jisté míry předpokládat určitou stereoelektronickou korelaci mezi vodíkem a odcházející skupinou Z. MO výpočty i princip nejmenšího jaderného pohybu ukazují, že anti-periplanární konformace je preferována. Jestliže tato není možná, potom druhé nejvýhodnější je syn-periplanární a nejméně výhodné je neplanární uspořádání.
|
|
a) Diastereoizomerní substráty jasně prokazují preferenci anti-eliminace v geometrické izomerii vzniklých alkenů.
|
|
|
|
Značení deuteriem ukazuje, že i jednodušší systémy se chovají stejně.
b) Cyklohexylové substráty mohou být modelem s dobře definovanými geometrickými parametry. Dehydrochlorace neomenthylchloridu dává směs izomerních 2- a 3-menthenů. Menthylchlorid poskytuje výlučně 2-menthen, protože 3-izomer může vzniknout pouze z neplanární konformace odstupujících skupin.
|
|
c) Systémy s přemostěnými kruhy nemají prakticky žádnou možnost konformační mobility a umožňují stanovit význam syn-periplanárních a anti-klinálních uspořádání pro eliminaci.
|
|
|
|
d) Neobvyklá stereochemie vedoucí k syn eliminaci je častá v cyklických systémech buď v případě rigidních skeletů, anebo u středně velkých monocyklických systémů (C9 - C12), ve kterých anti eliminace je často znemožněna transanulárními interakcemi. Acyklické substráty s dostatečně dlouhým řetězcem (nejméně tři uhlíkaté atomy na každé straně vznikající nové dvojné vazby) vykazují často značný podíl syn eliminace při tvorbě trans-alkenů, ale ne při tvorbě cis-izomerů. Vysvětlení této skutečnosti není dosud zcela jasné, ale spočívá pravděpodobně ve sterickém bránění přístupu báze.
|
|
e) Ylidový mechanismus je alternativní reakční cestou pro některé amoniové a sulfoniové soli, u nichž je normální E2 mechanismus ze sterických důvodů nevýhodný. Např. pyrolýza t-Bu2CD-CH2NMe3+OH- poskytuje t-butyl2C=CH2 spolu s trimethylaminem, který je ze 75% monodeuterovaný Me2NCH2D v souladu s jeho tvorbou přes ylidový intermediát. V této reakci musí být odstupující skupiny vůči sobě nezbytně nutně syn orientovány.
Eliminace ze značeného norbornylového systému dává neznačený norbornen a trimethylamin značený jenom ze 6%. To znamená, že syn-periplanární E2 orientace je preferována vůči ylidovému mechanismu, pokud sterické interakce nejsou mimořádně silné.
|
|
Stereochemie E1 a E1cB mechanismu
V extrémním případě může být E1 reakce zcela nestereoselektivní, protože neexistuje žádná korelace mezi dvěma kroky, v nichž zanikají vazby. Ve skutečnosti bývá často pozorována určitá selektivita, ale nižší než u E2 reakcí. Podobně jako v SN1 reakcích, tvorba iontových párů umožňuje odstupující skupině účast v tranzitním stavu zodpovědném za vznik produktu. Porovnejme chování menthyl- a neomenthylchloridů za podmínek solvolýzy s E2 reakcí (viz předchozí část)
|
|
Rovnovážné E1cB reakce by také měly být nestereoselektivní, ale existují určité důkazy, že je preferována syn-eliminace v oblasti hranice mezi nevratným E1cB a E2 mechanismem. Podporou této skutečnosti je průběh reakce 1,2-dihalogenoacenaftenů (viz 8.1.1). Cis-izomer, kde eliminace musí být anti-klinální, reaguje především součinným E2 mechanismem a např. HCl je eliminován mnohem rychleji než HF. V případě trans-izomerů musí být ovšem eliminace syn. Působení t-BuOK /t-BuOH ukazuje jasně na nevratný E1cB mechanismus. V případě působení EtOK/EtOH je vliv odstupující skupiny velmi malý a mechanismus je neurčitý. Možné vysvětlení pro syn-stereochemii je, že E1cB tranzitní stav může být stabilizován elektrostatickými interakcemi mezi kationtem atakující báze a odstupující skupinou.
|
|
V současnosti se ukazuje, že nevratný E1cB mechanismus zřejmě převládá v syn-eliminacích namísto klasického E2 mechanismu.
Izomery
Dehydrochlorace 2-chlorbutanu dává směs tří butenů. Následující obrázek ilustruje tuto skutečnost spolu s běžně užívanou terminologií.
|
|
Polohové izomery
Převaha Zajcevova produktu je pravidlem ve všech E1 a většině E2 reakcí. To není překvapující, protože v obou mechanismech vzniká tranzitní stav s parciálně dvojnou vazbou. Dvojná vazba C=C je stabilizovaná alkylovou substitucí. Vysvětlení této skutečnosti není dosud zcela jasné, ale vlastní fakt je neoddiskutovatelný. Ať je tedy příčina jakákoli, platí zřejmě totéž o stabilitě vznikající dvojné vazby v tranzitním stavu.
|
|
a) Sterická destabilizace Zajcevova produktu
Nejjednodušší příčinou vzniku Hofmannova produktu je skutečnost, že objemné substituenty v některých alkenech destabilizují Zajcevův produkt.
|
|
b) Vliv odstupující skupiny
Následující tabulka ukazuje vliv odstupující skupiny na tvorbu polohových izomerů v E2 reakci
Tvorba polohových izomerů v E2 reakci CH3CH2CH2CHZCH3 (EtOK/EtOH, 80-130oC)
|
Z |
Br |
I |
OTos |
SMe2 |
SO2Me |
NMe3+ |
|
Hofmann % | ||||||
|
Zajcev % |
V současnosti existují přinejmenším dvě teorie, které se snaží vysvětlit toto chování. Prvá z nich vychází z elektronických vlastností odstupující skupiny a vede k definici variabilního E2 tranzitního stavu. Jestliže Z je silný elektonakceptor, má tendenci stabilizovat vzniklý karbaniont a tranzitní stav se dostává do oblasti E1cB části mechanistického spektra. Podobně, jestliže Z jeví malou ochotu k odštěpení, potom tranzitní stav je posunut do oblasti zvýšeného podílu rozpadu Cb-H vazby. Oba efekty zvyšují vznik negativního náboje na
a-uhlíkovém atomu. Na druhé straně, posun směrem k E1cB mechanismu zmenšuje podíl dvojné vazby na charakteru tranzitního stavu a klesá tím tedy význam stabilizace Zajcevova produktu. V důsledku toho odstupující skupiny, jako SMe2+, SO2Me a NMe3+, které v sobě kombinují vlastnosti silného elektronakceptoru s relativně nízkou ochotou odstoupit, se odštěpují přednostně za vzniku méně substituovaného b-uhlíkového atomu - tedy za vzniku Hofmannova produktu. Alternativní vysvětlení vychází z předpokladu, že Hofmannova eliminace je řízena čistě stericky. Uvedené tři skupiny mají jednu společnou vlastnost - jsou velmi objemné. Konformace vyžadovaná pro anti-eliminaci je tedy destabilizována b-alkylovými substituenty.
|
|
Obě vysvětlení ukazují, že přechod k Hofmannovu produktu je spíše výsledek zpomalení tvorby Zajcevova produktu než urychlení tvorby Hofmannova produktu. Následující tabulka ukazuje, že b-substituce podstatně zpomaluje reakce s odstupujícími skupinami „Hofmannovského“ typu.
Vliv b-substituce na rychlost eliminace z RR’ CbH-CaH2Z (EtO-/EtOH, jsou uvedeny rychlostní konstanty druhého řádu k2/10-5 lmol-1s-1)
|
R |
R |
Z = SMe3+, 64oC |
Z = NMe3+, 104oC |
|
H |
H | ||
|
H |
Me |
5.2 |
|
|
Me |
Me |
1.7 |
|
|
H |
Et |
2.8 |
|
|
H |
i-Pr |
1.1 |
|
|
H |
t-Bu |
0.43 |
0.0084 |
Ve skutečnosti obě vysvětlení mají svoji platnost. Eliminace fluorovodíku z fluoroalkanu dává především Hofmannův produkt. To musí být důsledkem elektronických efektů: fluor je silný elektronakceptor s malou schopností odstupovat a je současně také malý. Na druhé straně dramatický efekt terc.butylové skupiny (viz poslední řádek předcházející tabulky) je určitě sterického původu.
c) efekt báze
2-brombutan dává kolem 20% Hofmannovského produktu při reakci s EtOK v ethanolu, ale při reakci s terc.butoxidem v terc.butanolu vznikají Hofmannovský a Zajcevův produkt ve stejné míře. Ještě mnohem dramatičtější změna poměrů byla nalezena při reakci Me2CHCBrMe2.
|
RO- (v ROH při cca70oC) |
EtO- |
t-BuO- |
Et3CO- |
|
Hofmann % |
Pro toto chování existují opět dvě vysvětlení: silnější báze ve špatně ionizujícím rozpouštědle podporuje vznik reaktantů podobného tranzitního stavu s poněkud zvýrazněným karbaniontovým charakterem. b alkylace tedy znevýhodňuje elektronově vznik Zajcevova produktu. Ale silnější báze je také objemnější a má tedy tendenci atakovat méně bráněný b vodíkový atom. Elektronické efekty jsou pravděpodobně dominantní, jak ukazuje existence lineární závislosti Gibbsovy energie pro orientační preferencí a pKBH+ pro všechny, i nejobjemnější báze. Solvatační efekty jsou také důležité, ale dosud nejsou dostatečně prozkoumány.
Geometrické izomery
Při eliminaci ze substrátů typu RCH2CHZCH3 je často pozorována paralela mezi poměrem cis- a trans-izomerů a zastoupením Hofmannova a Zajcevova produktu. Trans-izomer obvykle převládá, ale jak vzrůstá zastoupení Hofmannova produktu, tak vzrůstá zastoupení cis-izomeru ve zbývajícím Zajcevově produktu. Např. při eliminaci z pentyljodidu vzniká 70% 2-pentenu, který je složen z 54% trans- a jenom 16% cis-izomeru. Při eliminaci ze sulfoniové soli vzniká stejného Zajcevova produktu 13% a poměr geometrických izomerů je 8:5. Na struktuře reaktantům podobného nebo E1cB tranzitního stavu má dvojný charakter vazeb relativně malý podíl a vznikající cis-alkylová skupina interaguje s ostatními v menší míře než v E2 tranzitním stavu.
|
|
Ale i jiné faktory mají značný a velmi komplexní význam. Např. při reakci 2-terc.butyltosylátu v terc.butanolu dávají některé báze více cis- než trans-butenu a v dimethylsulfoxidu je obvyklé paralelní chování pozičních
a geometrických orientací obrácené. Podobné rozpouštědlové efekty nebyly dosud uspokojivě vysvětleny.
Poměr mezi eliminací a substitucí
Uvažujme solvolytické chování terciárního substrátu, který ionizuje úplně na karbokationty nebo karbanionty a odstupující skupina nemá žádný vliv na poměr mezi substitucí a eliminací. Dominantním faktorem je potom rozsah Zajcevovy stabilizace ve výsledném alkenu.
Procentuální zastoupení eliminace při solvolýze v 80% EtOH při 25oC
|
Reaktant |
Produkt |
Výtěžek (%) |
|
Me3CCl |
Me2C=CH2 | |
|
Et3CCl |
Et2C=CHMe | |
|
i-Pr2MeCCl |
i-PrMeC=CMe2 |
Přídavek báze způsobí posun mechanismu směrem k E2 eliminaci. Pořadí reaktivity E2 eliminací je normálně terc > sec > prim v důsledku Zajcevovy stabilizace. Sterické faktory, které způsobují zcela opačné pořadí v SN2 substituci nejsou důležité, protože báze neatakuje bráněný uhlíkový atom. Přidaná báze nemá vliv na monomolekulární proces a (s terciárním substrátem) nemůže působit jako nukleofil v SN2 reakci. Výsledný efekt je zvýšení podílu eliminace. U primárních substrátů je reaktivita posunuta ve prospěch substituce, ale substituenty na b uhlíku mohou mít značný vliv. Následující tabulka ukazuje chování primárních a sekundárních substrátů, u nichž Zajcevova stabilizace produktu usnadňuje eliminaci.
Eliminace a substituce (EtONa/EtOH)
(rychlostní konstanty druhého řádu k2/10-5l mol-1s-1)
|
Substrát |
SN2 |
E2 |
Alken (%) |
|
CH3CH2Br |
172 |
1.6 |
0.9 |
|
CH3CH2CH2Br |
5.3 |
8.9 |
|
|
(CH3)2CHCH2Br |
5.8 |
8.5 | |
|
(CH3)2CHBr |
(1.6) |
(7.6) | |
|
(CH3CH2)2CHBr |
(1.5) |
(13) |
Obecně silnější báze zvyšuje podíl eliminace na daném substrátu. Silná báze je také tvrdým nukleofilem a má tedy větší afinitu k protonu než k měkčímu elektrofilnímu uhlíku. Řada silných bází je také značně objemná a to také znevýhodňuje substituci. Rozpouštědla mají také určitý vliv na působení báze. Odstupující skupina také ovlivňuje poměr E2/SN2. Kationty, jako SMe2+ a NMe3+, podporují výhradně eliminaci a k substituci téměř nedochází. Takovéto skupiny způsobují vznik E1cB tranzitního stavu s podstatným rozpadem Cb-H vazby a jejich objemnost znemožňuje tvorbu SN2 tranzitního stavu. Eliminace mají obvykle vyšší entalpii aktivace než substituce, protože silná Cb-H vazba musí být přerušena v E2, anebo v produkt tvořícím E1 tranzitním stavu. Zvýšení teploty tedy obvykle zvyšuje podíl eliminace.
E2C mechanismus
Zobecnění, že silný nukleofil, který je také slabou bází podporuje substituci obvykle platí, ale ne vždy. Halogenidové ionty v dipolárních aprotických rozpouštědlech a thioláty v alkoholech obvykle iniciují eliminaci. Např. PhS- je 1010 slabší bází než EtO-, ale v ethanolickém roztoku způsobuje 10x rychlejší eliminaci terc.butylchloridu. Je tedy zřejmé, že se musí uplatňovat nějaký jiný mechanismus. Většina modelů předpokládá, že v tranzitním stavu existuje určitá interakce jak mezi bází (nukleofilem) a a uhlíkem, tak i s b vodíkovým atomem. Proto je tento mechanismus označován jako E2C a normální E2 mechanismus, ve kterém báze interaguje pouze s b vodíkem, je někdy označován E2H. E2C tranzitní stav je obvykle reprezentován jako podobný SN2, ale se současnou interakcí s b vodíkem. Pozorovaný sterický efekt na a uhlíku je ale menší, než by bylo možno očekávat pro takovouto strukturu. Proto někdy bývá na místo tohoto tranzitního stavu navrhován modifikovaný E2 tranzitní stav s bází elektrostaticky interagující s kladně nabitým uhlíkem a.
|
|
Vezmeme-li v úvahu variabilitu E2 tranzitního stavu, může mít i slabá báze tendenci ke zvýraznění generace karboniových iontů a tím i stupně rozpadu Ca -Z vazby. Odstupující skupiny mají obvykle větší vliv na rychlost E2C reakcí než E2H reakcí (za předpokladu, že ostatní faktory jsou shodné). Tedy cyklohexylbromid reaguje 66x rychleji než chlorid v soustavě EtO-/EtOH, ale v soustavě PhS-/EtOH reaguje 140x rychleji. To naznačuje, že v E2C tranzitním stavu je vazba Ca-Z téměř úplně přerušená. Charakteristickým rysem E2C reakcí je velmi silná preference vzniku Zajcevova produktu, která je mnohem výraznější než v E2H reakcích. To je i synteticky využíváno: objemné silné báze podporují Hofmannovu eliminaci. MeCHBrCH2CHMe2 dává 98 % Zajcevova produktu při reakci s tetrabutylamoniumbromidem v acetonu a 96 % Hofmannova produktu při reakci s terc.butoxidem draselným v terc.butanolu.
Pyrolytické eliminace
Ylidový mechanismus (viz 8.2.1) je speciálním příkladem tzv. pyrolytických eliminací. Většina pyrolytických reakcí probíhá bez přídavku báze nebo rozpouštědla obvykle v plynné fázi. Nejběžnější typy těchto reakcí jsou:
|
|
Všechny reakce vykazují několik společných rysů - silnou preferenci pro syn-eliminaci, kinetiku prvního řádu, zápornou entropii aktivace a necitlivost na přítomnost radikálových zhášečů. Tato pozorování jsou v souladu s uvedeným cyklickým mechanismem obvykle značeným Ei. Tento mechanismus ovšem může představovat celé mechanistické spektrum s různým stupněm zániku Cb-H a Ca-Z vazby v tranzitním stavu. Extrémy mohou představovat až mechanismy zahrnující iontový pár.
|
|
Důkazy pro existenci takovéhoto mechanistického spektra pocházejí ze studia substitučního efektu, který odráží rozsah vzniku náboje na a nebo b uhlíkovém atomu. Zůstává ještě vyřešit otázku, zdali pyrolýzy jsou skutečnými reakcemi v plynné fázi, anebo zdali jsou katalyzovány povrchem reakční nádoby. Dosavadní poznatky ukazují, že katalytické pochody jsou významné při pyrolýzách za vysoké teploty ve studených nádobách. Podobnou kategorií eliminačních reakcí jsou pyrolýzy alkylhalogenidů při teplotách 500o C. I přes možnost radikálových mechanismů se ukazuje, že tyto reakce probíhají přes cyklický tranzitní stav s velmi dobře vyvinutým stádiem uhlíkatých iontových párů.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2393
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved