| CATEGORII DOCUMENTE |
| Bulgara | Ceha slovaca | Croata | Engleza | Estona | Finlandeza | Franceza |
| Germana | Italiana | Letona | Lituaniana | Maghiara | Olandeza | Poloneza |
| Sarba | Slovena | Spaniola | Suedeza | Turca | Ucraineana |
DOCUMENTE SIMILARE |
|
TERMENI importanti pentru acest document |
|
|
|
|
|
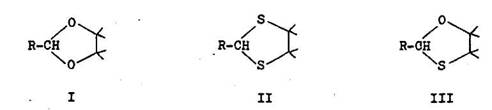
Na hydrol zu scet lov stafii zvyttajne kr tke ohrievanie so zrieden mi miner lnymi (HC1, H2S04, H3PO4) alebo organick mi kyselinami (kyselina ave o–v , kyselina citr nov ). R chlos hydrol zy sa zvy uje kontinu lnym odstra ovan m vznikaj cej karbonylovej zl eniny napr. destil ciou s vodnou parou.
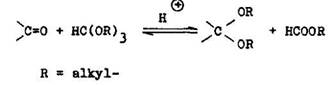
Acet ly a tioacet ly vznikaj z karbonylov ch zl en n po as katal zy siln mi miner lnymi kyselinami, organick mi kyselinami, silno kysl mi i nov mi meni mi zalo en mi na polym rnych aromatick ch sulfokyselin ch. Posledn typ je vhodn aj na acetaliz ciu karbonylov ch zl en n citliv ch na kyseliny, napr. furalu. Ve mi inn m katalyz torom je ter t fluoridu bori–t ho. Cyklick acet ly (1,3–dioxol ny) I, tioacet ly (1,3–diti ny) II vznikaj z 1,2–diolov alebo z 1,2–ditiolov. 1,3–oxatiol ny III vznikaj analogicky z 2–hydroxytiolov. Cyklick acet ly s v porovnan s acyklick mi st lej ie pri hydrol ze a tepelnom rozklade (6.1.2).
Formaldehyd reaguje najochotnejgie spomedzi v etk ch karbonylov ch zl en n. Dobr v a ky acet lov a ditioacet lov d vaj za miernych podmienok aj alifatick aldehydy. Odstra ovanie reak nej vody z reak nej zmesi alebo pou itie nadbytku jednej z reak n ch komponentov m pod a princ pu pohyblivej rovnov hy kladn vplyv na v ku v a kov. asto sa uveden sp soby kombinuj : pou va sa nadbytok jednej z v chodiskov ch surov n a odstra uje sa jeden z reak n ch produktov, naj astej ie voda. Je ve mi v hodn , ak sa v priebehu reakcie rozdel reak n zmes na organick a vodn vrstvu. Reakcia alej pokra uje len v organickej vrstve, im sa s stavne poru uje reak n rovnov ha v prospech acet lu. Katal za chloridu v penat ho sa vyu va pri pr prave acet lov ni ch lenov homologick ho radu aldehydov, preto e prchavos v chodiskov ch zlo iek aj acet lov nedovo uje azeotropick odstra ovanie vody. Chlorid v penat s asne zni uje rozpustnos organick ch zl en n vo vodnej f ze (6.1.3).
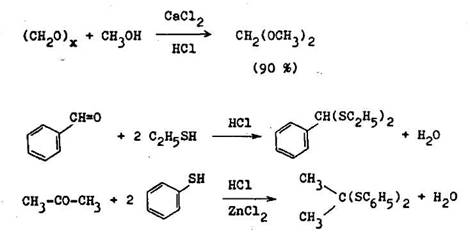
Pri pou it aromatick ch aldehydov je potrebn nadbytok alkoholovej zlo ky, niekedy zv en teplota. Tioljr reaguj u pri laborat rnej teplote. Reaktivite aromatick ch aldehydov z vis od substit cie aromatick ho jadra. 4–nit–r substituovan deriv ty reaguj omnoho ochotnej ie ako nesubstituovan benz–aldehyd; opa ne je to pri hydroxyaldehydoch. PrioC,/3 –nenas ten ch aldehydoch m e nasta konkuren n 1,4–ad cia najm pri pou it silno nukleofiln ch tio–lov. Vhodnou vo bou reak n ch podmienok mo no dosiahnu e oC, –nenas ten acet l je hlavn reak n produkt. Pou itie t,2–diolov a 1,2–ditiolov (naj as–tejSie 1,2–et ndiolu a 1,2–et nditiolu m v porovnan s jednoduch mi alkoholmi a tiolmi za n sledok zv enie reak nej r chlosti tvorby 1,3–dioxol nov a 1,3–diti nov a ich v a kov. Najr chlej ie reaguj 1,2–dioly, resp. 1,2–di–tioly a cis–usporiadan m (6.1.4). Napr klad cis–t,2–cyklopent ndiol reaguje asi stokr t r chlej ie ako etyl nglykol.
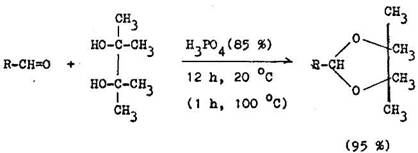
Zatia aldehydy d vaj acet ly ve mi ochotne, pri ket noch v d sledku nepriazniv ho sf rick ho aj induk n ho vplyvu dvoch uhl kov ch skup n je rovnov ha posunut v neprospech acet lu. Cyklick acet ly, a najm tioacet ly vznikaj ve mi ochotne. Synteticky sa vyu vsj len acet ly vznikaj ce z acet nu pri ostatn ch ket noch sa prakticky vyu vaj len tioacet ly (6.1.5).
Mimoriadny v znam m vyu itie 1,2–et nditiolu. Reaguje aj s tak mi steroid–n mi ket nmi, ktor nereaguj s jednoduch mi tiolmi. S o , /3–nenae ten mi ket nmi d va tioacet ly bez konkuren nej 1,4–ad eie. E te vhodnej je 1,3–pro–p nditiol, ten je vSak menej dostupn
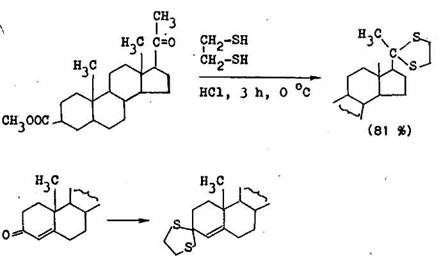
l on ot i ogly koly d vaj 8 karbonylov mi zl eninami 1,3–oxatiol ny, ktor maj v hody acet lov aj tioacet lov, preto e ochotne vznikaj , s tak isto st le v z saditom prostred , ale na rozdiel od tioacet lov sa dobre hydroly uj kyselinami (6.1.7) 1,3–oxatiol ny dost vaj prednos pred 1,3–dioxol n–mi vtedy, ak sa odstr nenie chr niacej skupiny ned uskuto ni v kyslom prostred . Z 1,3–oxatiol nov sa d regenerova karbonylov zl enina aj redukciou na Raneyovom nikle v alkohole v slabom alkalickom prostred . Ak je potrebn regenerov karbonylov skupinu mimo kysl ho prostredia, pou ije sa na jej chr nenie /3–halog n–i,2–diol, z ktor ch vznikaj ce 1,3–dioxol ny sa daj previes sp na karbonylov zl eniny p soben m kovov ho zinku(6.1.8).
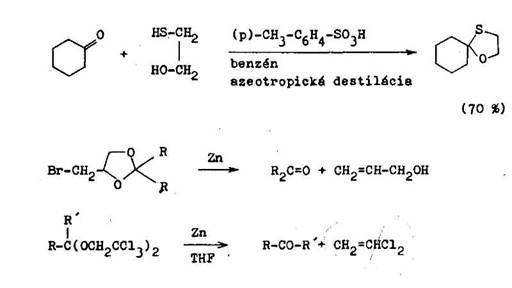
Nev hoda tvorby acet lov z ket nov priamo acetaliz ciou odpad pri ich pr prave pomocou esterov kyseliny ortomrav ej (Claisenova met da). Ako katalyz tor sa pou va chlorovod k alebo chlorid am nny. Met da sa naj astej ie vyu va na pr pravu dietylacet lov (6.1.9).
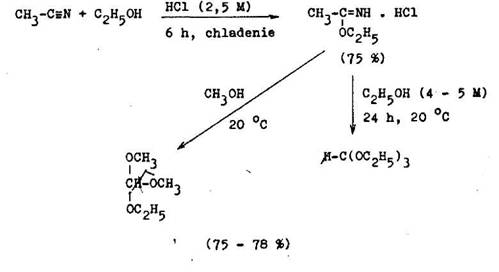
Ortoestery karboxylov ch kysel n sa pripravuj alkohol ssou hydrochloridov imino terov vznikaj cich zav dzan m bezvod ho chlorovod ka do ekvimol rnej zmesi nitrilu a alkoholu za chladenia (6.1.10). Syntetick v znam acet lov tioacet lov je v tom, e s inertn vo i katalytickej hydrogeniz cii, redukcii sod kom v alkohole aj kvapalnom amoniaku alebo tetrahydridohlinita–nom l tnym. Odol vaj inku oxida n ch inidiel, ako s manganistan draseln , octan oloviCit , chl rnan sodn . Takto chr nen karbonylov skupina str ca svoju reaktivitu vo i nukleofiln m inidl m, ako s Grignardove i–nidl , vodn mu amoniaku, alifatick m am nom alebo kyanidu draseln mu. Mimoriadna stabilita 1,3–diti nov sa vyu va na synt zy zalo en na prep lovani reaktivity karbonylov ch zl en n prostredn ctvom ich organol tnych sol
Vybran pr klady dokumentuj syntetick u ito nos acet lov (6.1.11).
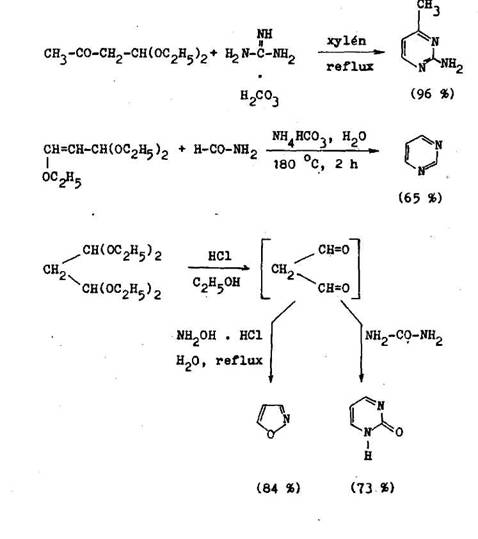
1,3–dikarbonylov zl fieniny sa asto pou vaj na pr pravu pa – a es l nko v ch heterocyklov. /3–dialdehydy a /3–ketoaldehydy s pre nestabilitu pou ite n len vo forme acet lov. Spolu a dus kov mi zl eninami vhodnej trukt ry umo uj synt zu pyrimidlnov ch deriv tov a s hydroxylam nom, resp. hyd–raz nom pr slu n 1,2–oxazoly, resp. 1,2–diazoly (6.1.12).
|
|
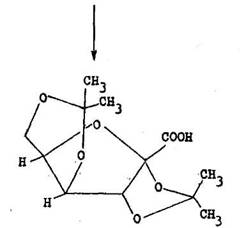
kyselina 2,3,4,6–diizopropyli n––2–ketogul nov
Sch ma zobrazuje 'as synt zy kyseliny askorbovej (vitam nu C).
Aromatick , heteroaromatick a oC, –nenas ten aldehydy a ket ny d vaj 8 anhydridmi kysel n pri pou it kysl ch katalyz torov (H2S04> a za miernych podmienok alkylid ndiestery. V be zvodom prostred s zna ne st le, a vyu vaj sa na ochranu aIdehydovej skupiny pri oxid ci ch, redukci ch a nitr ci ch
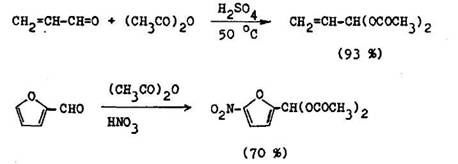
Karbonylov zl enina sa m e regenerova p soben m zrieden ch kysel n alebo vodnou suspenziou oxidu hore nat ho. Pri jeho pou it nenast va konkuren n Cannizarova reakcia; t nast va, ak pou ijeme na regener ciu zrieden roztok alkalick ch hydroxidov.
Enolizovate n aldehydy a ket ny p soben m anhydridov kysel n v pr tomnosti z sadit ch katalyz torov, teda za podmienok, pri ktor ch d vaj aromatick aldehydy o –nenas ten kyseliny, d vaj enolestery. Karbonylov zl enina sa uvo uje z enolesteru varen m s vodou (6.1.14).
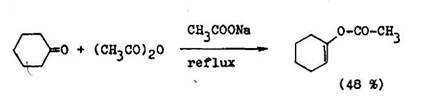
Na chr nenie karbonylov j skupiny sa e te pou vaj ox my, hydraz ny a semi–karbaz ny. Zvy ajne vznikaj ve mi ochotne, na sp tn z skanie karbonylov j zl eniny v ak vo v ine pr padov nemo no pou i mierne podmienky. Hydraz ny a semikarbaz ny sa pou vaj v ch mii cukrov na ich izol ciu a charakteriz ciu, preto e dobre kry talizuj . Uvo nenie karbonylovej zl eniny zo semi–karbaz nu kyslou hydrol zou je zvy ajne bez probl mov, najv hodnej ie je pou i 10 – 20 % roztoky kyseliny ave ovej. Pri jej pou it nedoch dza k zmene konfigur cie na opticky akt vnom centre na uhl ku vo i karbonylu. Semikarbaz ny sa daj tiepi aj p soben m kyseliny dusitej v kyseline octovej, met da v ak nie je vhodn na regener ciu oC , –nenas ten ch karbonylov ch zl en n.
Hydraz ny odvoden od silno z sadit ho hydraz nu sa hydrolyzuj kyselinami relat vne ahko v porovnan s hydraz nmi vytvoren mi z aromatick ch hydrazl–nov. Na regener ciu cukrov z rozli n ch aromatick ch hydraz nov sa vyu va
schopnos benzaldehydu tvori stabiln aromatick hydraz ny e hydraz nom u–vo ftuj cim sa pri hydrol ze. Na uvo nenie karbonylovej zl eniny z ve mi st lych 2,4–dinitrofenylhydraa nov (vyu vaj sa na identifik ciu karbonylov ch zl en n^ sa vyu va aj schopnos kyseliny pyrohroznovej vytv ra ve mi stabiln hydraz ny (6.1.15).
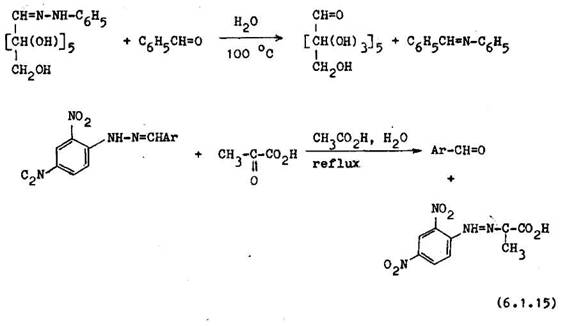
6.2 OCHRANA KARBOXYLOVEJ SKUPINY
Hydroxylov fias karboxylovej kyseliny sa vo v ine pr padov d chr ni es–terifik ciou. Esterov skupina nem kysl vlastnosti a nebr ni nukleofiln m reakci m na karbonylovom uhl ku, napr. s Grign rdov mi alebo organokovov mi inidlami.
Ve mi asto sa vyu vaj metylov a etylov estery. Ako katalyz tory sa pou vaj anorganick kyseliny: kyselina s rov , chlorovod kov a polyfosfore n . Spomedzi organick ch kysel n sa pou vaj kyselina p–tolu nsul nov a 2–naftal nsulf nov , ktor s v hodnej ie ako anorganick , preto e nesp sobuj ved aj ie reakcie. Koncentr cia katalyz tora ovplyv uje reak n r chlos , ale nem vplyv na v ku v a ku, ktor z vis od mol rneho pomeru reaguj cich zlo iek alebo od odstra ovania jedn ho produktu esterifik cie z reak nej zmesi.
Naj astej m sp sobom regener cie karboxylovej skupiny je alkalick hydrol za. Uskuto uje sa zahrievan m esteru s ekvivalentn m mno stvom alebo nadbytkom vodn ho alebo alkoholick ho roztoku alkalick ho hydrox du. Pou veme ju v ade tam, kde nenast vaj ved ajfiie reakcie vplyvom z sadit ho prostredia, ako je aldoliz cia, aldolov kondenz cia, elimina n reakcie halog nde–riv tov a pod.
Pr tomnos kv rt ray ch am niov ch soli (katalyz torov f zov ho prenosu) v znamne ur ch uje hydrol zu najm nlzkomolekulov ch esterov, napr. dimetyles–ter kyseliny adipovej je inertn vo i 50 % NaOH pri laborat rnej teplote. Pr davok tris/hex decyl/metylam niumchloridu vyvol exotermick reakciu a u–konS hydrol zu sa 30 min t.
V pr padoch,
ke nie
je mo n pou i
alkalick
hydrol zu,
pripravujeme ben–
zylestery, ktor sa daj rozlo i hydrogenol zou
(7.2). .
Terci rne butylov estery sa Stiepia v mierne kysl ch podmienkach v d sledku ahk ho trhania v zby alkylov ho uhl ka s kysl kom. V niektor ch peci lnych pr padoch sa pou vaj 2,2,2–trichl Vetylov estery. T to skupina sa odstra uje redukciou zinkov m prachom vo vodnej kyseline octovej (6.2.1).
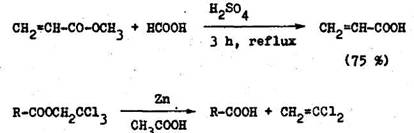
V praxi s ast pr pady, ke3 klasick kyslo katalyzovan esterifik cia pre pecifick usporiadanie uhl kovej kostry kyseliny alebo alkoholu, resp. pre in pr iny prebieha s n zkymi v a kami, alebo v bec neprebieha* Stericky br nen '–disubstituovan aromatick karboxylov kyseliny sa esterirituj tak, e sa rozpustia v koncentrovanej HgSO. a vylej do nadbytku absol tneho alkoholu. Po zrieden reak nej zmesi vodou sa z skaj estery vo vysokom v a ku (Nemnannova met da). V born v a ky esterov kyseliny 2,2–dimetylpro–p novej sa z skaj pomocou anhydridu kyseliny triflu roctovej, s ktor m d va t to kyselina zrnesovy anhydrid ochotne reaguj ci s alkoholmi, pri om vznikaj estery (6.2.2).
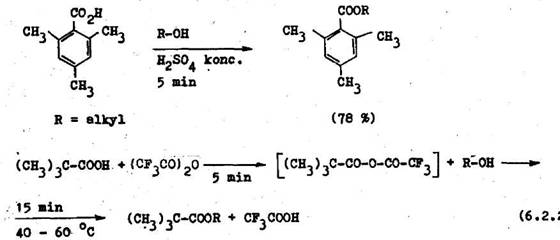
Z sadit am nov skupina v aminokyselin ch via e mol rny ekvivalent kysl ho katalyz tora, a takto vzniknut am niov i n neochotne aduje d*al . prot n potrebn na katal zu esterifik cie v zmysle v eobecn ho mechanizmu tejto reakcie.
Estery aminokysel n sa vo v born ch v a koch z skavaj esterifik ciou aminokysel n v nadbytku absol tneho alkoholu nas ten ho bezvod m chlorovod kom. Ak e v molekule aminokyseliny dve karboxylov skupiny rozdielnej reaktivity, d sa selekt vne esterifikova reakt vnejSia z nich (6.2.3).
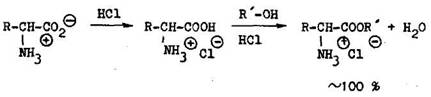
R H–, C^–C^ alkyl–, arylalky1–, heteroaryl–, aryl–R'= rozli n alkyly, najvhodnej ie CH,–, C2H~–
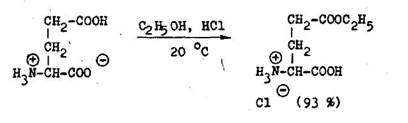
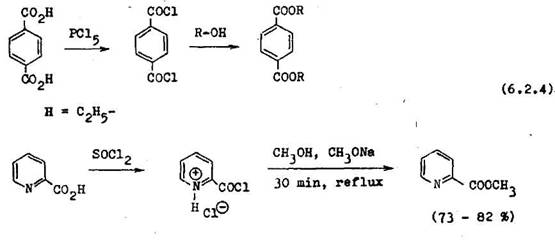
Ak priama eeterifik cia kyseliny prebieha a ko pre jej nlsku rozpustnos v pou itom alkohole, pou vame na pr pravu esterov alkohol 2u acylhalogeni–dov. Napr. kyselina 1,4–benz ndikerboJtylov pre jej nepatrn rozpustnos vo vriacom etanole sa mus najprv premeni na chlorid, kyseliny, a ten potom d va estery. Estery niektor ch pyrid nkarboxylov ch kysel n je v hodn pripravova aj z pr slu n ch am niov ch sol chloridov kysel n, a nie priamou es–terifik ciou (6.2.4).
Al'kohol za dichloridu kyseliny uhli itej (fosg nu) s alkoholmi sa vyu va na synt zu d le it ch z kladn ch surov n organickej synt zy. Pri n zkych teplot ch vznikaj ntonoestery kyseliny chl mravCej a pri vyS ch teplot ch a nadbytku alkoholu v pr tomnosti z sad dialkylestery kyseliny uhli itej (6.2.5).

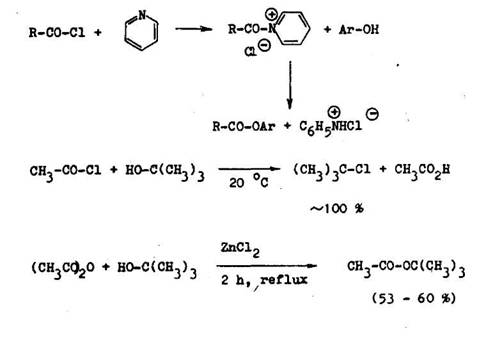
Acylhalogenidy sa tie vyu vaj na pr pravu arylov ch a terci rnyeh alkylo–v ch esterov. Pri priamej esterifik cii kysel n s fenolmi s velini n zke v a ky a pri pr prave terci rnych alkylov eh esterov s asne nast va elimin cia vody a vznik alk nov . Alkohol za acylhalogenidov a alkohol za anhydri–dov kysel n je jednou z mala v eobecn ch synt z esterov tohto typu. Pri, al–kohol ze m ve k v znam pr davok pyridlnu tvoriaceho s acylhalogenidom reakt vny komplex lanko podliehaj ci alkohol ze. Bez jeho pr tomnosti poskytuj acylhalogenidy s terci rnymi alkoholmi len terci rne alkylhalogenidy
mnohokr t v pr padoch, ke3 metyl– a etylestery vznikaj ochotne kyslo kata–lyzova ou esterifik ciou, in prim rne a sekund rne estery vznikaj len v n zkych v a koch. Vtedy mo no vySSie estery pripravi preesterifik ciou metyl– alebo etylesterov, ktor prebieha, v kyslom aj v z saditom prostred N zkovr ci metanol alebo etanol sa s stavne oddestilov va z reak nej zmesi ako bin rne zmes s benz nom a reak n rovnov ha sa t m pos va v smere elan ho esteru. Preesterifik cia je v znamn met da pr pravy esterov v laborat rnej aj technologickej praxi. Ako katalyz tory sa naj astej ie pou vaj alkalick alkohol ty, v borne sa osved ili alkohol ty hlinit
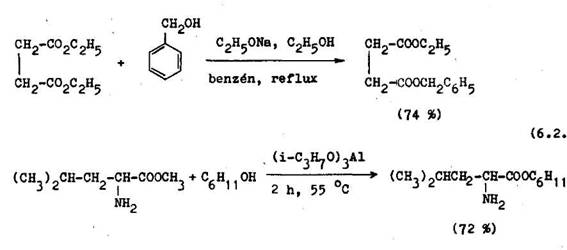
Terci rne alkylestery sa tie z skavaj preesterifik ciou metylesterov pou it m terci rneho alkylesteru kyseliny mrav ej. Potrebn terci rny alkyles–ter sa pripravuje reakciou terci rneho alkoholu so zmesov m anhydridom kyseliny mrav ej a octovej (6.2.8).
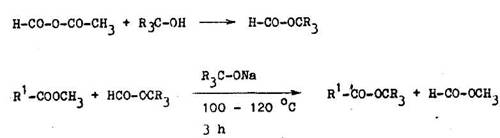
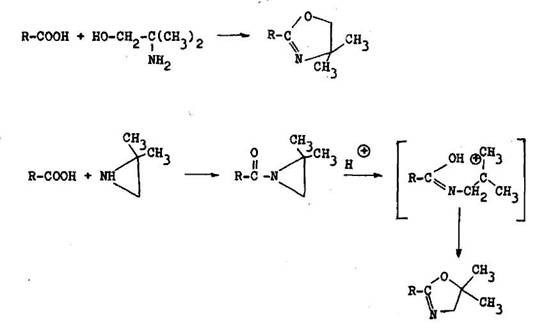
Ochrana karbonylovej asti karboxylovej skupiny je ob a nej ia loha ako chr nenie hydroxylovej asti. Karboxylov skupina sa p soben m 2–amino–2–aetyl––1–propanolu alebo 2,2–dimetylazirid nu premen na 4,4– alebo 5|5–3imetyl––1,3–oxazol n. Karboxylov skupina sa regeneruje kyslou hydrol zou. Ak sa regener cia uskuto uje v alkoholickom prostred , vznikaj estery (6.2.9).
6.3 OCHBANA HYDROXILOVEJ SKUPINY
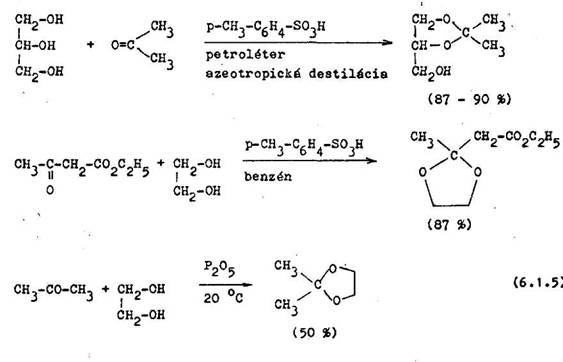
Hydroxylov skupiny alkoholov sa naj astej ie chr nia premenou na tery, estery alebo acet ly. Jednoduch tery s zvy ajne inertn vo i organokovo–v m zl enin m. V ber typu terove'j skupiny z vis od podmienok, v ktor ch bude potrebn regenerova hydroxylov skupinu. Aby bolo mo n chr niacu skupinu odstr ni mierne kyslou hydrol zou, vyu va sa na chr nenie tetrahydro–pyr n. Tetrahydropyranov skupina je ako in acet ly inertn vo i nufcleofil–n m inidl m, redukcii komplexn mi hydridmi a reakci m s organokovov mi zl eninami. Met da je vhodn len na chr nenie achir lnych alkoholov. Ak m alkohol asymetrick centrum, vznik nov asymetrick centrum na C uhl ku py–r novej kostry, m sa vytv ra zmes diastereoizom rnych terov, 80 s a uje istenie a ich identifik ciu. Tento probl m sa rieSi v menou dihydropyr nu za metylpropenyl ter. Asymetrick centrum nevznik a acet l sa hydrolyzuje v miernej ch podmienkach ako v pr pade tetrahydropy ranov ch terov. Na tento el sa vyu va aj etylvinyl ter, ktor tie d va diastereoizom ry v pr pade chr nenia achir lneho alkoholu (6.3.1).
Tvorba jednoduch ch alkylov ch terov nie je ve mi vhodn sp sob chr nenia hydroxylov ch funk n ch skup n, preto e na ich sp tn uvo nenie s potrebn tvrd podmienky. Napr. pou van koncentrovan kyselina bromovod kov asto sp sobuje al ie n sledn reakcie hydroxylov j skupiny. V nimkou s ter iarne butylov tery, ktor sa tiepia v mierne kyslom prostred . Benzylov –tery sa pou vaj na chr nenie hydroxylovej skupiny vtedy, ak tiepenie te*
|
|
|
ru nemo no uskuto ni v kyslom prostred . Benzylov C–Q v zba sa tiepi katalytickou hydrogeniz ciou alebo p soben m sod ka v kvapalnom amoniaku |
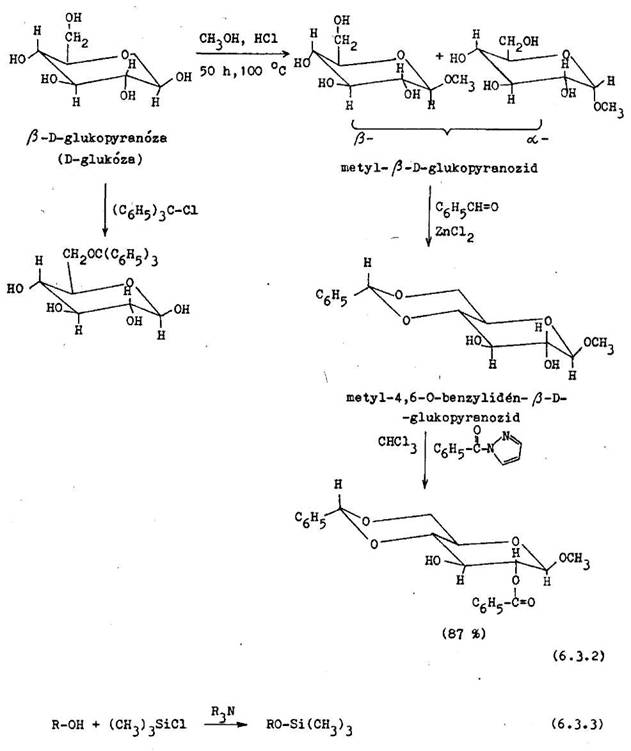
Sp sob chr nenia nerovnocenn ch hydroxylov ch skup n v oukroch m osobitne ve k v znam, preto e asto potrebujeme ich selekt vne chr nenie. P soben m alkoholu nas ten ho chlorovod kom (Fischerova met da) alebo v pr tomnosti kysl ho i nov ho meni a vznikaj diastereoizom rne od– a /3–alkylglykozidy. Sekund rne hydroxylov skupiny cukrov reaguj v kyslom prostred s acet nom alebo benzaldehydom, pri om vznik izopropyl n–, resp. benzylid n deriv t. Na tvorbe acet lovej skupiny sa zvy ajne z ast uj cis– orientovan hydroxylov skupiny na susediacich uhl koch.
Trifenylmetyl nov skupina (tritylov ) sa zav dza do molekuly reakciou tri–fenylmetylchloridu s alkoholom. Pre svoju objemnost triarylmetylov skupiny reaguj len s prim rnymi alkoholmi. Jej hydrol za nast va v hor cej vodnej kyseline octovej.
asto sa na chr nenie hydroxylov ch skup n vyu vaj ich estery s kyselinou octovou alebo benzoovou. Stericky br nen alkoholy d vaj estery s reakt vnymi amidmi ako s N–ecylimidazolmi (6.3.2). Estery ochotne vznikaj zo ste–' rieky nebr nen ch alkoholov s anhydridom kyseliny octovej alebo benzoylchlo–ridom v pr tomnosti pyrid nu alebo inej terci rnej z sady.
Ve mi d le it chr niace skupiny s silylov tery. Ochotne vznikaj pri reakcii alkoholov s trimetylsilylchloridom v pr tomnosti z sady alebo x hexa–metyldisilaz nu. Tieto zl eniny sa vyu vaj vtedy, ak je potrebn pracova v al ej synt ze s m lo pol rnymi zl eninami alkoholu {6*3.3). Trime–tylsilylov skupina je ve mi n chyln k hydrol ze alebo nukleofilnej v mene, o ve mi limituje jej pou vanie. V menou za dimetylterci rnubutylov skupinu sa zvy uje stabilita silylovej skupiny a umo uje jej pou vanie pri redukcii hydridmi, napr. diizobutoxydihydridohlinitanom l tnym alebo pri oxid cii kyselinou chr movou v acet ne. Silyl cia alkoholu s dimetylterci rnyn butylsilylchloridom sa uskuto uje v dimetylformamide pri katal ze imidazo–lom. Hydrol za tejto chr niacej skupiny je pomal a ur ch uj ju fluoridov i ny, ktor sa prid vaj do reak nej zmesi vo forme tetrabutylam niumfluori–du v tetrahydrofur ne.
Chr nenie alkoholov tvorbou zlo it ho teru m niekedy prednos pred acet –lovou skupinou. Acet ly s inertn v z saditom prostred a citliv v kyslom prostred . Zlo it tery s stabilnej ife v kyslom prostred , ale ahko hyd–rolyzuj v z saditom prostred . Preto sa vyu vaj najm v oxida n ch reakci ch, nemo no ich v ak pou i v synt zach organokovovymi fiinidlami.
Reaktivita a ko reaguj cich alkoholov sa zvySuje ich premenou na alkohol –ty pomocou siln ch z sad, napr.n–butyll tie alebo etylmagn ziumbromidu. Ak sa nedaj pripravi alkohol ty, pou vaj aa reakt vne aeylafin inidl ,napr. zmie an anhydridy; pripravuj sa zmieSan m karboxylov ch kysel n s anhydri–dom kyseliny triflu roctovej, neizoluj sa, ale sa pou vaj in situ.
Na aktiv ciu karboxylov ch skup n sa vyu va dicyklonexylkarbodiimid vytv raj ci s nimi amidoanhydrid (7.7.9). Cyklick karbon ty vznikaj z 1,2–dio–lov a N, N–karbonyldiimidazolu alebo preesterifik ciou dietylkarbon tu. S to vhodn n hrady cyklick ch acet lov. N,N –d icyklohexylkarbodiimid a dietyl–karbon t v hodne nahradzuj fosg n, ktor tie mo no pou i na tieto ely
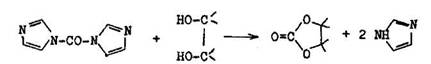
6.4 OCHRANA AMINOSKUPINY
Nechr nen aminoskupina je nukleofiln a je donorom slabo kysl ch prot nov. Ak s v procese synt zy tieto je,i dve vlastnosti na prek ku, mus me ju chr ni
Nukleofiln schopnosti nechr nenej aminoskupiny sa daj odstr ni acyl ciou. Najvhodnej ia je benzyloxykarbonylov skupina, preto e sa d mimoriadne ahko odstr ni hydrogenol zou (7.2.1.1). Na chr nenie aminoskupiny sa vyu vaj aj terci rne alkoxykarbonylov skupiny tankos ich odStiepenia je podmienen stabilitou vznikaj ceho terci rneho karbokati nu pri ich odstra ovan . Od tiepenie nast va v kyslom prostred , napr. v kyseline triflu roctovej
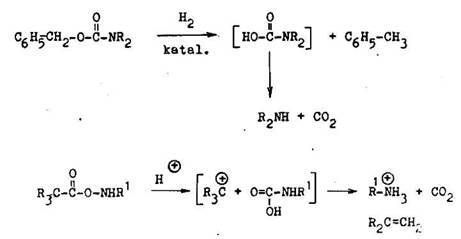
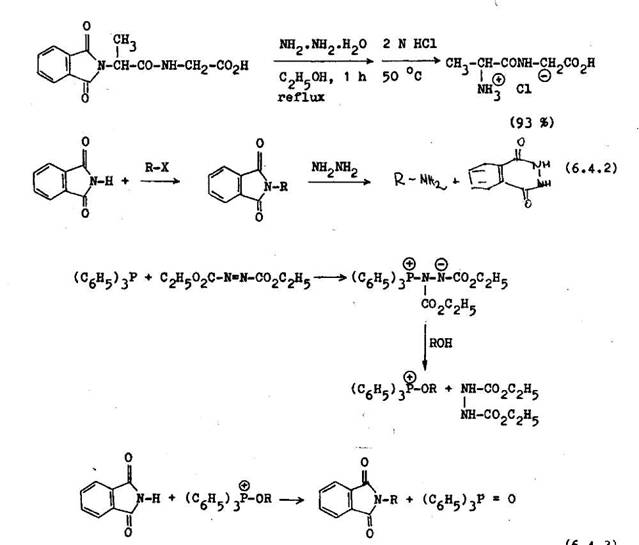
Jednoduch amidy s dobr mi chr niacimi skupinami len tom pr pade, ak je chr nen molekula atabiln v silnom kyalom alebo silno z saditom prostred potrebnom na ich hydrol zu. Na ochranu prim rnych aminoskup n sa vyu va ftaloylov skupina. Odstra uje sa hydrol zou alebo hydrazinol zou.Druh met da vedie k cyklick mu hydrazidu kyseliny ftelovej, vyu van mu ne synt zu benzo[c]1,2–diazinu. a ko bydrolyzuj ce N–alkylftalimidy ochotne reaguj s hydrezinom alebo fenylhydraz nom za varu v alkoholickom roztoku. T to met da sa vyu va pri synt ze peptidor na odstr nenie taloylov ho zvy ku z oL––aminoskup n. D le itos tejto met dy st pla so zisten m, e pri hydrazino–l ze nenast va zmena konfigur cie na opticky akt vnom <£ –uhl ku.
Ftaloylimid alebo cyklick deriv ty amoniaku sa ahko alkyluj pre kyslos ich vod ka. Vyu va sa to na synt zu prim rnych am nov (Gabrielova synt za) (6.4.2). Alkyl cia ftalimidu sa tie d uskuto ni p soben m alkoholu, di ty lesteru kyseliny azodikarboxylovej a trifenylfosf nu (6.4.3) /'<'
V niektor ch pr padoch amidov skupina d selekt vne odstr ni redukciou hydridmi. Trichl raeetamidy sa ahko rozkladaj tetrahydridoboritanom sodn m v alkohole alebo diizobutylalum niumhydridom. Pri n zkych teplot ch sa redukcia s hydridom zastavuje na stupni aminoalkoholu (6.4.4). V niektor ch pr padoch je na chr nenie v hodn pou i triflu racetylovu skupinu, ktor sa v d sledku elektr novo akceptorn ho inku triflu rmetylovej skupiny ahko hydrolyzuje v alkalickom prostred
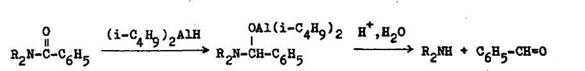
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1706
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved