| CATEGORII DOCUMENTE |
| Bulgara | Ceha slovaca | Croata | Engleza | Estona | Finlandeza | Franceza |
| Germana | Italiana | Letona | Lituaniana | Maghiara | Olandeza | Poloneza |
| Sarba | Slovena | Spaniola | Suedeza | Turca | Ucraineana |
DOCUMENTE SIMILARE |
|
TERMENI importanti pentru acest document |
|
Rovnováhy v roztocích elektrolytů – acidobazické rovnováhy, pufry
Slabé kyseliny a slabé zásady ve vodném roztoku narozdíl od silných kyselin nedisociují kompletně ale jen zčásti (jen část molekul podléhá reakci disociace):
HA (aq) Û H+ (aq) + A- (aq)
B (aq) + H2 O Û B+ (aq) + OH- (aq)
V roztoku slabých kyselin a slabých zásad jsou tedy přítomné jak nedisociované molekuly tak anionty (u kyselin) či kationty (u bazí) a ionty H+ (u kyselin) či OH- (u bazí).
Rovnovážná konstanta disociace se nazývá disociační konstanta, a označuje se
Ka (disociační konstanta slabých kyselin) či Kb (disociační konstanta slabých bazí).
Ka = ![]() Kb =
Kb = ![]()
Množství molekul, které disociovalo, je charakterizováno rovnovážným stupněm konverze pro disociaci, tzv. disociačním stupněm, který se označuje a u slabých kyselin a b u slabých bazí. Disociační stupeň můžeme chápat buď jako část molekul, která je za rovnováhy disociovaná nebo – protože víme, že každá rovnováha je dynamická – jako čas, po který je molekula v disociované formě.
Stupeň disociace závisí na koncentraci, s rostoucím zřeďováním roztoku disociace slabých elektrolytů roste, takže při dostatečném zředění (u běžných kyselin jako octová, mravenčí tak od koncentrace 10-6 mol/l) se slabá kyselina chová jako kyselina silná, tedy zcela disociovaná.
Protože hodnoty disociačních konstant slabých kyselin a zásad jsou malé, udávají se často ve formě záporného dekadického logaritmu a značí se pKa a pKb.
Příklad:
Kolik procent molekul kyseliny octové bude disociováno a jaké bude pH pro roztoky kyseliny octové o koncentracích:
a) 0,1 mol/l
b) 0,01 mol/l
c) 0,001 mol/l
d) 0,0001 mol/l
Řešení:
Potřebujeme nejdříve znát hodnotu disociační konstanty. V tabulkách jsme nalezli hodnotu pKa = 4,76, z čehož jsme vypočítali Ka = 1,74 x 10-5.
Napíšeme si rovnici disociace kyseliny octové a pomocí stupně konverze a počáteční koncentrace vyjádříme koncentrace jednotlivých komponent v reakci:
CH3COOH Û CH3COO- + H+
co (1 - a coa coa
Koncentrace vyjádřené pomocí rovnovážného stupně konverze dosadíme do rovnice pro rovnovážnou konstantu:
Ka = ![]()
pro zjednodušení budeme nyní předpokládat, že a vyjde mnohem menší než 1, takže jmenovatel je přibližně roven jedné a ze zjednodušeného vzorce:
Ka = co a2
vypočteme hodnotu disociačního stupně pro počáteční koncentraci 0,1 mol/l. Výsledek vyjde a = 1,32 x 10-2. V tomto případě byl tedy zjednodušující předpoklad, že a<< 1, oprávněný a nemusíme výpočet opakovat s nezjednodušenou kvadratickou rovnicí (přes diskriminant). V roztoku o této koncentraci je tedy 1,32 % molekul disociovaných na ionty.
Hodnotu koncentrace vodíkových iontů vypočteme součinem počáteční koncentrace a disociačního stupně: [H+] = co . a
Nyní můžeme vypočítat pH (pH = -log [H+]) a vyjde pH = 2,88.
Vidíme, že pH pro 0,1M kyselinu octovou se výrazně liší od pH stejně koncetrované silné kyseliny (pH = 1) a to o 1,88 jednotky pH.
Stejně postupujeme i pro další koncentrace.
Pro
Pro
Pro 1 x
10-
Dalšími výpočty bychom zjistili, že od koncentrace cca 5,5 x 10-4 je kyselina octová plně disociovaná.
Jako vícesytné kyseliny označujeme takové kyseliny, které mohou poskytovat více vodíkových iontů. Disociace těchto vodíků probíhá postupně, neboť síla kyseliny se pro disociace do jednotlivých stupňů významně liší. Jednotlivé disociační konstanty označujeme K1 (disociace 1. vodíku – tzv. disociace do prvního stupně), K2 (disociace 2. vodíku – tzv. disociace do druhého stupně), K3 (disociace třetího vodíku – tzv. disociace do třetího stupně).
Hodnoty disociačních konstant jsou např. pro kyselinu fosforečnou:
K1 = 7,5 x 10-3
K2 = 6,2 x 10-8
K3 = 4,8 x 10-13
Soli vzniklé neutralizací silných kyselin a silných zásad (NaCl, KNO3,) v roztoku disociují na kation a anion (disociace u solí je 100 % ní), vzniklé ionty jsou obaleny hydratačním obalem molekul vody. Roztok tedy má výslednou reakci neutrální (pH = 7).
Soli vzniklé neutralizací slabých kyselin se silnými zásadami (CH3COO Na – octan sodný, HCOOK – mravenčan draselný), slabých zásad se silnými kyselinami (NH4NO3) či slabých kyselin se slabými zásadami (CH3COO NH4) musí ve vodných roztocích zachovávat rovnováhu danou disociační konstantou slabé komponenty (eventuálně obou komponent). Při ustavení těchto rovnováh vznikají OH- či H+ ionty a roztoky solí obsahujících slabou komponentu reagují zásaditě (octan sodný, mravenčan draselný) nebo kysele (dusičnan amonný). V případě solí, v nichž obě části jsou ze slabé komponenty (octan amonný), záleží pak na poměru disociačních konstant – je-li Ka vyšší než Kb reaguje roztok kysele, v opačném případě zásaditě.
Jako příklad si vezmeme roztok soli mravenčanu draselného:
Při rozpouštění ve vodě dojde k disociaci na ionty:
HCOOK HCOO- + K+
Ionty K+ jsou obaleny hydratačním obalem, ionty HCOO- musí zreagovat s vodou podle rovnice:
HCOO- + H2O HCOOH + OH-
aby vyhověly podmínce rovnováhy mezi disociovanou a nedisociovanou formou kyseliny mravenčí danou její disociační konstantou. Tato druhá reakce se označuje jako hydrolýza.
Rovnovážná konstanta pro reakci mravenčanového iontu s vodou za vzniku kyseliny mravenčí a OH- iontů je dána rovnicí (koncentrace molekul vody je zahrnuta do konstanty, protože reakcí malého množství mravenčanových iontů s vodou se koncentrace rozpouštědla v systému nezmění):
Kh = ![]()
a nazývá se konstanta hydrolýzy.
Konstanta
hydrolýzy musí souviset s disociační konstantou, protože se týká téže
rovnováhy. Tuto souvislost snadno odvodíme, když na pravé straně rovnice
vynásobíme čitatele i jmenovatele členem ![]() a přepíšeme-li výraz do tvaru daného vpravo:
a přepíšeme-li výraz do tvaru daného vpravo:
![]() x
x ![]() =
= ![]() x
x ![]()
V pravé části rovnice nyní vidíme, že první člen udává iontový produkt vody, Kv, a druhý člen je převrácená hodnota disociační konstanty, Ka.
Konstantu hydrolýzy můžeme tedy vyjádřit:
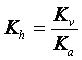
Počet iontů slabé komponenty, které v daném roztoku podlehly hydrolýze, charakterizujeme stupněm hydrolýzy, g
Příklad:
Vypočtěte pH roztoku mravenčanu draselného o koncentraci 0,1 mol/l.
Řešení:
Nejprve musíme rozhodnout, zda se jedná o sůl, která hydrolyzuje.
Protože mravenčanový ion je od slabé kyseliny mravenčí, bude sůl hydrolyzovat.
Dále si musíme najít disociační konstantu kyseliny mravenčí (konstanty hydrolýzy se netabelují, vypočtou se ze vztahu uvedeného výše) – pro kyselinu mravenčí má Ka hodnotu 1,74 x 10-4.
Napíšeme rovnice disociace a následné hydrolýzy a vyjádříme koncentrace jednotlivých komponent pomocí stupně hydrolýzy g a výchozí koncentrace:
disociace:
HCOOK HCOO- + K+
hydrolýza aniontu:
koncentrace
vody se v průběhu
reakce prakticky
nezmění
![]()
![]()
za předpokladu, že stupeň hydrolýzy g << 1 vypočteme g ze zjednodušené rovnice:
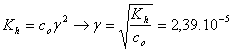
koncentrace
koncentrace H+ iontů je tedy: 1.10-14 : 2,39.10-6 = 4,18.10-9 mol/l pH = 8,38.
Pufry jsou roztoky slabé kyseliny nebo báze a její soli. Mají schopnost odolávat výkyvům pH při přídavcích kyseliny nebo zásady. Máme-li pufr tvořený slabou kyselinou a její solí, udržuje se pH tím, že přídavky H+ iontů reagují s přítomnými anionty od slabé kyseliny, přídavky OH- iontů pak reaguji s vodíkem z nedisociované formy kyseliny na vodu a zůstává anion slabé kyseliny. Přídavek H+ či OH- iontů tedy mění poměr koncentrací aniontu a nedisociované formy, rovnováha daná disociační konstantou musí být zachována.
Pro výpočet pH pufru se používá vztahu, který je odvozen z rovnice disociační konstanty tak, že se vyjádří koncentrace H+, pak se celá rovnice zlogaritmuje a změní znaménko a nakonec se upraví tak, aby všude byla kladná znaménka.
Ukážeme si to na příkladu pufru tvořeného kyselinou octovou a octanem sodným:
Ka
=![]()
![]()
-log ![]() = - log Ka - log
= - log Ka - log ![]()
pH = pKa + log ![]()
Obecně pak, protože koncentrace aniontu (v čitateli) odpovídá koncentraci soli a koncentrace nedisociované formy (ve jmenovateli) odpovídá koncentraci kyseliny v roztoku pufru, můžeme psát:
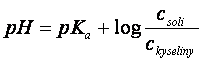
Pufrační kapacita u pufru udává, kolik molů H+ či OH- iontů musíme k danému pufru přidat, aby se pH změnilo o jednotku (v kyselém či zásaditém směru).
Největší pufrační kapacita v obou směrech je u pH = pKa, tedy u pufru, kde je koncentrace soli i kyseliny stejná. Je-li v pufru více kyseliny, je větší pufrační kapacita v zásaditém směru, je-li v pufru více soli, je vyšší pufrační kapacita v kyselém směru.
Příklad:
O kolik
se změní pH ftalátového pufru, jestliže k 500 ml
O kolik se změní pH, když stejné množství HCl přidáme do 500 ml vody?
Řešení:
Vyhledáme pKa kyseliny ftalové. Kyselina ftalová je dvojsytná kyselina, pK1=2,95, pK2= 5,41. Připravený pufr (vzhledem ke svému pH) je připraven z kyseliny ftalové a ftalanu draselného (nikoli z ftalanu draselného a ftalanu didraselného).
Z rovnice pro výpočet pH pufru:
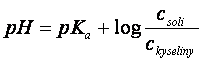
dostaneme po dosazení hodnot z našeho příkladu:
2,95 =
2,95 + log![]()
![]()
![]() = 1
= 1
500 ml
Přídavek
HCl: 1litr
5 ml
Tyto ionty zreagují s aniontem na nedisociovanou formu, jeho množství klesne na 0,02 molu (0,05 původně přítomných – 0,03 reakcí s H+ z přidané HCl spotřebovaných = 0,02).
Množství nedisociované kyseliny vzroste na 0,08 molu (0,05 původně přítomných + 0,03 reakcí s H+ z přidané HCl vzniklých = 0,08).
Tato nová množství dosadíme do rovnice pro výpočet pH pufru a vypočteme novou hodnotu pH po přídavku HCl:
pH = 2,95
+ log ![]() = 2,35
= 2,35
pH se tedy změnilo o 6 desetin jednotky pH.
Kdybychom
toto množství HCl přidali k vodě, dostali bychom roztok, kde jsou 0,03 moly v 500 + 5 ml roztoku,
tedy 0,059 molu H+ v
za předpokladu, že pH vody bylo 7 (nebyl přítomen rozpuštěný CO2), změnilo se přídavkem HCl pH o 5,77 jednotek pH, zatímco v roztoku pufru jen o 6 desetin jednotky pH.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 945
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved