| CATEGORII DOCUMENTE |
| Bulgara | Ceha slovaca | Croata | Engleza | Estona | Finlandeza | Franceza |
| Germana | Italiana | Letona | Lituaniana | Maghiara | Olandeza | Poloneza |
| Sarba | Slovena | Spaniola | Suedeza | Turca | Ucraineana |
DOCUMENTE SIMILARE |
|
TERMENI importanti pentru acest document |
|
Matematická formulace 1. zákona termodynamiky pro statiku plynů vychází z následujících předpokladů :
- Vnější kinetická energie a potenciální energie pracovní látky jsou zanedbatelné
- Neprojevuje se vliv chemické, jaderné, zářivé, magnetické a elektrické energie
Vnitřní energie
Při sdílení tepla dq pro 1 kg plynu se změní jeho teplota o dT a objem o dv
* Změna teploty souvisí se změnou vnitřní kinetické energie molekul - duk ( jedná se o energii translační, vibrační, rotační )
* Při změně objemu dochází ke změně energie související s působením kohézních sil mezi molekulami - označujeme ji vnitřní potenciální energie - dup
Celková změna vnitřní energie plynu :
du = duk + dup
Při změně objemu koná plyn vnější tzv. jednorázovou (absolutní, objemovou) práci da.
V technické termomechanice se píše 1.zákon pro statiku plynů ve tvaru :
dq = du + da
dQ = dU + dA
Poznámka: V technické termodynamice se uvažuje práce vykonaná sledovanou soustavou jako kladná, ačkoliv byla ze soustavy odvedena. Tato zvyklost vyplývá z hlavního zaměření termodynamiky v dob jejího vzniku, kterým byla především snaha o teoretický rozbor podmínek hospodárné přeměny tepelné energie v mechanickou práci. Jindy, např. v chemii se píše ve tvaru :du = dq + da
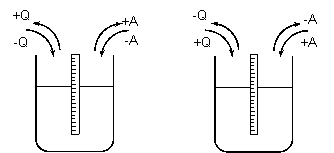
Obr.1-2. Znázornění kladné a záporné energie a) jak ji udává termomechanika, b) chemie
 Jednorázová
práce
Jednorázová
práce
Ve válci nad pístem je stlačená vzdušina. Protože tlak uvnitř válce musí být neustále v rovnováze s vnějšími silami posouvá se píst a stlačená látka nabývá na objemu. Změnou svého objemu vykonává soustava práci. Tuto práci nazýváme jednorázovou, nebo objemovou. Práce vykonaná při posuvu pístu :
dA = F.dl = p.S.dl = p.dv
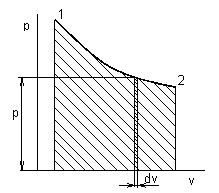
Jednorázová práce vykonaná mezi stavy 1 a 2:
![]() / J /
/ J /
Obr.1-3 Jednorázová práce v p-v diagramu
Vnitřní energie - nezávisí na průběhu termodynamického děje, ale pouze na stavu, při kterém ji určujeme :
Du = u2 - u1 = Du1a2 = Du1b2 = Du1c2
Poznámka :
Vnitřní energie na rozdíl např. od práce má totální diferenciál. Absolutní hodnotu vnitřní energie je obtížné zjistit, v praxi nás však zajímají jen její změny od zvoleného (referenčního ) stavu. Poněvadž je vnitřní energie funkcí stavu, platí obecně :
u = f(p,v,T)
Stav plynu je jednoznačně určen dvěma na sobě nezávislými určujícími stavovými veličinami. Třetí stav.veličina bude určena těmito dvěma veličinami a pracovní látkou. Platí např. u = f(T,v). Z matematiky je známo, že totální diferenciál funkce můžeme vyjádřit jako součet parciálních derivací tété funkce.Potom totální diferenciál vnitřní energie můžeme psát :
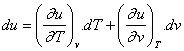
Podobně : u = f(T,p) ; u = f(p,v)
Při přívodu tepla za stálého objemu platí podle 1.zákona termodynamiky :
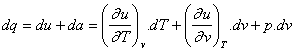
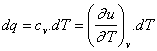
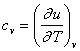
Změna vnitřní energie je dána teplem sděleným při změně za stálého objemu:
du = cv.dT
![]()
První zákon termodynamiky pro statiku plynů můžeme psát ve tvaru:
|
dq = du + da = cv.dT + p.dv |
Vyjadřuje vztah mezi sděleným teplem, entalpií a prací technickou.
Uvedený obrázek vysvětluje princip 2.formulace prvního zákona termodynamiky. Soustava je realizována dvěma zásobníky s různými (konstantními) tlaky p1 > p2 a pracovním válcem. Pracovní válec je naplněn ze 1.zásobníku vzdušinou o tlaku p1 po otevření plnícího ventilu. Energie která je předána pístu odpovídá vnitřní energii vzdušiny a energii dané tlakem a objemem této vzdušiny.
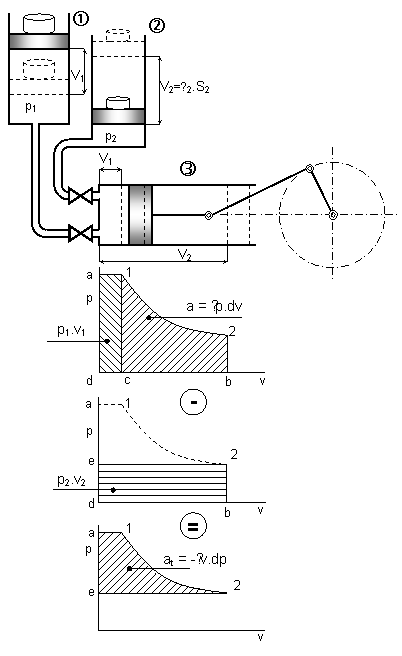
Obr.1-5. Znázornění druhé formulace zákona termodynamiky
Celková energie předaná soustavou 1 pracovnímu válci se nazývá entalpie.
i1 = u1 + p1 .v1
Po uzavření plnícího ventilu nastává expanze, při níž se vykoná absolutní práce. Po expanzi dojde k otevření vypouštěcího ventilu. Pracovní válec-motor odevzdá energii (entalpii i2) 2.zásobníku (následuje výtlak).
Z rozdílu těchto energií se koná v tepelně izolované soustavě práce technická :
![]()
![]() at = u1+
p1.v1 - u2+
p2.v2
at = u1+
p1.v1 - u2+
p2.v2
i1 i2
Jak už bylo uvedeno součet vnitřní energie (tepelné) a mechanické energie (vnější) dané tlakem a objemem pracovní látky se nazývá entalpie. Entalpie nám tedy udává celkovou energii plynu.
Platí : i = u + p.v
di = du + d(p.v) = du + p.dv + v.dp
dosazením výrazu : du = di - p.dv - v.dp
do první formulace 1. zákona termodynamiky obdržíme :
dq = di - p.dv - v.dp + p.dv = di - v.dp
měrná technická práce : +dat = -v.dp , at = - v.dp
Celková technická práce : At = - V.dp
Technická práce
Nazývá se tak proto, že ji můžeme měřit na hřídeli u rotačních strojů (sníženou o účinnost převodů).
Změnu entalpie můžeme vyjádřit pomocí dvou na sobě nezávislých určovacích veličin stavu :
i =
f(T,p) 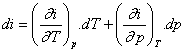
Pro přívod tepla za stálého tlaku platí podle 1.zákona termodynamiky :
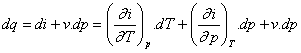
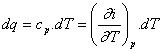
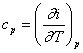
Změna entalpie je dána teplem přivedeným za stálého tlaku :
di = cp .dT ; i2 - i1 = - cp .dT
Druhou formulaci 1.zákona termomechaniky můžeme psát ve tvaru :
|
dq = du + dat = cp.dT - v.dp |
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 669
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved