| CATEGORII DOCUMENTE |
| Bulgara | Ceha slovaca | Croata | Engleza | Estona | Finlandeza | Franceza |
| Germana | Italiana | Letona | Lituaniana | Maghiara | Olandeza | Poloneza |
| Sarba | Slovena | Spaniola | Suedeza | Turca | Ucraineana |
DOCUMENTE SIMILARE |
|
ALKOHOLIAI, FENOLIAI, ETERIAI, TIOLIAI IR SULFIDAI
3.1. Alkoholių ir fenolių klasifikavimas, nomenklatūra, izomerija
Junginiai, turintys vien¹ ar kelias hidroksigrupes, prijungtas prie sp3 hibridizuotų anglies atomų, vadinami alkoholiais.
![]()
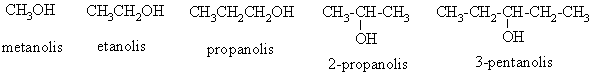
Alkoholiai skirstomi į pirminius, antrinius ir tretinius pagal tai, prie kokio anglies atomo (pirminio, antrinio ar tretinio) prijungta hidroksigrupė.
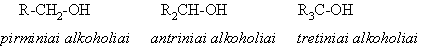
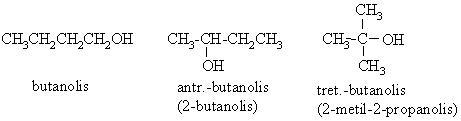
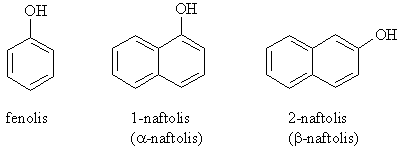
Arenų dariniai, kuriuose hidroksigrupės yra prijungtos prie aromatinio iedo anglies atomų, vadinami fenoliais.
Aromatiniai alkoholiai (hidroksigrupė yra aromatinio iedo oninėje grandinėje):
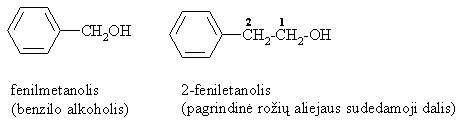
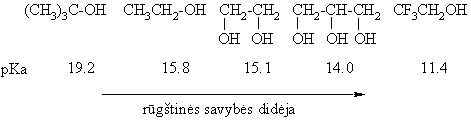
Pagal hidroksigrupių skaičių alkoholiai ir fenoliai skirstomi į mono-, di-, tri- ir polihidroksilinius.
Dihidroksiliniai alkoholiai vadinami dioliais (glikoliais), trihidroksiliniai trioliais (gliceroliais), tetrahidroksiliniai tetraoliais (eritroliais), pentahidroksiliniai pentaoliais (pentitoliais) ir heksahidroksiliniai heksaoliais (heksitoliais).
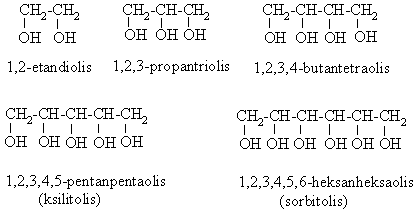
Diabetikai vartoja ksilitolį ir sorbitolį vietoje cukraus (didėjantis hidroksigrupės skaičius saldaus skonio prieastis).
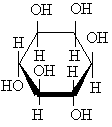
Ciklinės struktūros eiahidroksiliai alkoholiai C6H6(OH)6 vadinami inozitoliais (8 erdviniai izomerai). Reikmingiausias i jų yra mezoinozitolis (vitaminas B8), įeinantis į kai kurių fosfolipidų sudėtį:
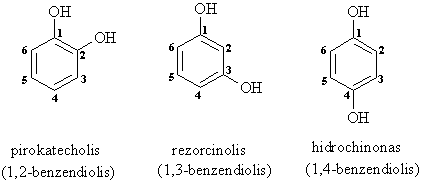
Dihidroksiliniai fenoliai pirokatecholis, rezorcinolis ir hidrochinonas įeina į daugelio gamtinių junginių sudėtį.
3.2. Alkoholių ir fenolių fizikinės savybės
Alkoholiai ir fenoliai poliniai junginiai. Jų sudėtyje yra du poliniai ryiai
![]()
Alkoholiams ir fenoliams būdingi vandeniliniai ryiai, kuriais susiformuoja pakankamai stabilūs tarpmolekuliniai asociatai.

Dėl tarpmolekulinių vandenilinių ryių alkoholiai ir fenoliai pasiymi palyginti auktomis virimo temperatūromis.
Maesnės molekulinės masės alkoholiai (C1-C3) neribotai tirpsta H2O. Ilgėjant anglies atomų grandinei, didėja alkoholio molekulės hidrofobikumas.
Dėl gebėjimo sudaryti vandenilinius ryius alkoholiai ir fenoliai pasiymi antiseptinėmis savybėmis (taikomi biologijoje, medicinoje ir veterinarijoje). Jie suardo baltymų hidratinį sluoksnį. Dėl to įvyksta baltymų denatūravimas natūralios erdvinės struktūros pakitimas ir biologinių funkcijų inykimas. Praskiesti alkoholiai iaukia grįtam¹jį baltymų denatūravim¹, o fenoliai negrįtam¹jį.
Fenolio 1% tirpalas (karbolio rūgtis) taikomas dezinfekcijai. Pastaraisiais metais medicinoje plačiau taikomi antiseptikai: 2,4,6-trichlorfenolis ir lizolis (o-, m-, p-krezolių miinys).
3.3. Alkoholių cheminės savybės
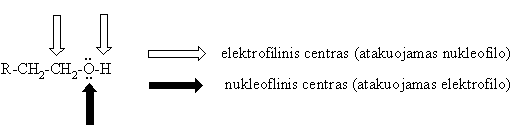
Rūgtinės-bazinės savybės

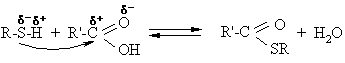
Ryio O-H reakcijos
Rūgtinės savybės
Alkoholiai reaguoja su arminiais metalais.
![]()
Dioliai yra stipresnės rūgtys, todėl arminėje terpėje reaguoja su d-metalais, sudarydami patvarius ciklinius kompleksinius junginius chelatus:
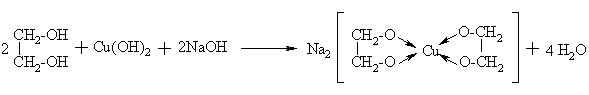
Reakcija taikoma polihidroksiliniams alkoholiams atpainti.
Esterinimo reakcijos
Alkoholių s¹veika su organinėmis rūgtimis

Esterinimo reakcija yra grįtama. Grįtama reakcija vadinama esterių hidrolize (H+ katalizė) arba muilinimu (HO- katalizė).
Organizme (vandens kiekis virija 50%) esterinimo reakcija vyksta substrato-fermento komplekse. Dėka fermento baltymo konformacijų reakcijos centras apsupamas nepolinių fragmentų ir dėl hidrofobinės s¹veikos i reakcijos vietos alinamas H2O. Tokiu būdu susidaro palankios s¹lygos esterinimui.

ie terminai paplitź apraant biocheminius procesus.
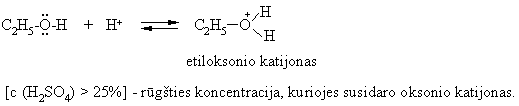
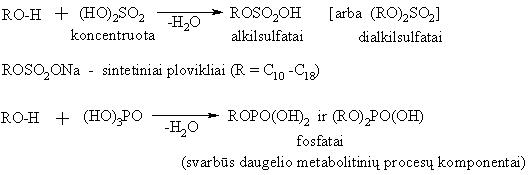
Alkoholių s¹veika su neorganinėmis rūgtimis
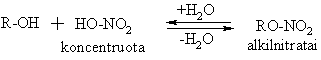
![]()
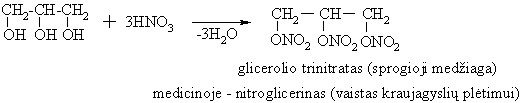
Ryio C-OH reakcijos
Hidroksigrupės nukleofilinis pakeitimas
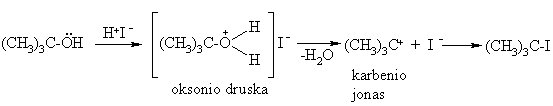
Lengviausiai reaguoja tretiniai alkoholiai, kadangi jie pasiymi didiausiu bazingumu ir i jų susidaro stabiliausi karbenio jonai.
Pirminių alkoholių tarpmolekulinis dehidratavimas (T < 140
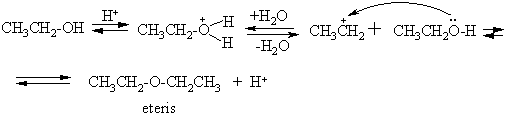
CH3CH2OH - amfolitas (molekulėje pasireikia bazinės ir rūgtinės savybės).
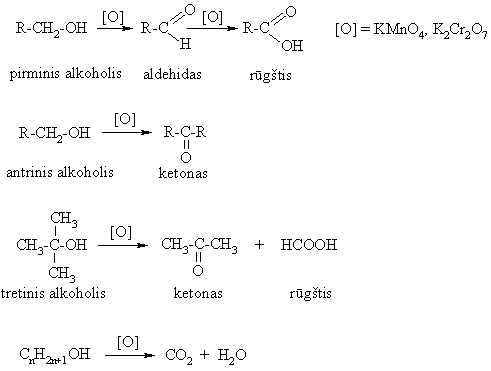
Oksidacijos-redukcijos reakcijos
Vidinis molekulinis dehidratavimas (B)
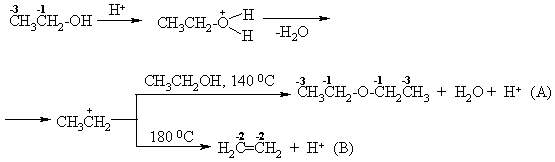
A tarpmolekulinis dehidratavimas.
Lengviausiai dehidratuojasi tretiniai alkoholiai.
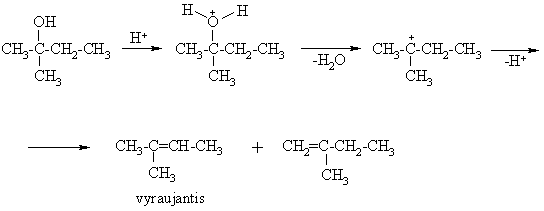
In vivo alkoholių dehidratavimas vyksta substrato-fermento komplekse, kuriame H2O eliminavim¹ skatina fermento baltymo nepolinių fragmentų hidrofobinė s¹veika reakcijos centro srityje. Vykstant hidratavimo reakcijai fermento baltymas keičia konformacij¹ taip, kad reakcijos centre padidėtų polinių fragmentų, gausinančių H2O kiekį ir skatinančių hidratavim¹.
Dehidratavimo ir hidratavimo procesai gyvame organizme vyksta nuolat angliavandenių ir riebalų rūgčių sintezės ir skilimo metu ir vaidina svarbų vaidmenį gyvybinėse organizmo funkcijose.
Dehidrinimas
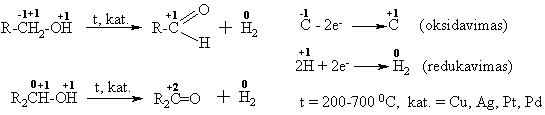
In vivo alkoholiai dehidrinami fermentų dehidrogenazių su atitinkamais kofermentais (čia laisvas H2 neisiskiria).
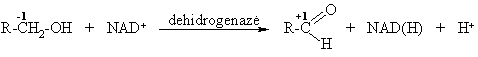
Įvairių biosubstratų dehidrinimo bendra schema:
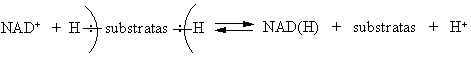
Oksidavimas
3.4. Fenolių cheminės savybės
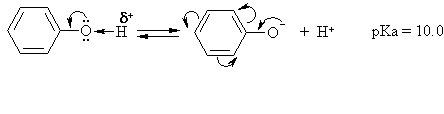
Rūgtinės bazinės savybės
Fenoliai yra stipresnės rūgtys ir silpnesnės bazės negu alkoholiai.
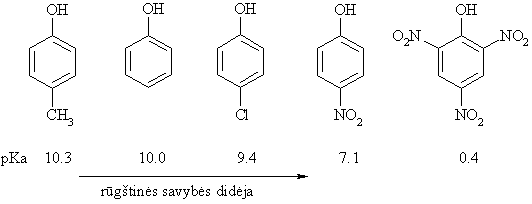
![]()
![]()
O-Acilinimas

O-Alkilinimas
![]()
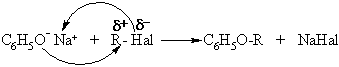
Oksidacijos-redukcijos reakcijos
Fenoliai ir jų anijonai lengvai oksiduojasi. Ypač lengvai oksiduojasi daugiahidroksiliniai fenoliai.
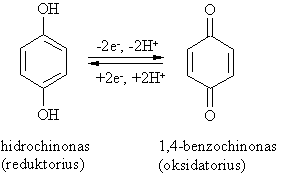
is tarpusavio virsmas svarbus biologinėms sistemoms. Tokių struktūrinių fragmentų yra fermentų oksireduktazių sudėtyje.
Elektrofilinės pakeitimo reakcijos (SE)
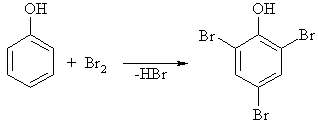
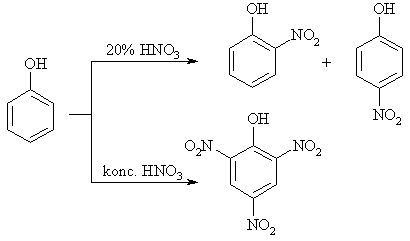
Vertingiausi alkohliai
Alkoholiai fiziologikai aktyvios mediagos, pasiyminčios narkotiniu poveikiu (didiausiu C6 C8, antriniai).
CH3OH nuodas, organizme oksiduojasi iki formaldehido (10 ml apakimas).
C2H5OH nedideli kiekiai suadina CNS, didesni slopina (silpnina smegenų ir raumenų sistemų funkcijas, maina jautrum¹ ir reakcij¹). Ilgesnį laik¹ ir nesaikingai vartojant susergama alkoholizmu. Etanolis lengvai reaguoja su daugeliu svarbių metabolitų, keisdamas jų biologines funkcijas. Svarbi jo kitimo organizme stadija:
![]()
![]() HO-CH2-CH2-OH
antifrizas, nuodingas, kadangi virsta oksalo rūgtimi, o pastaroji
skruzdių rūgtimi.
HO-CH2-CH2-OH
antifrizas, nuodingas, kadangi virsta oksalo rūgtimi, o pastaroji
skruzdių rūgtimi.
HO-CH2-CH(OH)-CH2OH netoksikas, įeina į daugelio lipidų sudėtį. I jo sintetinamas glicerolio trinitratas, kosmetikos preparatai odai minktinti.
3.5. Eterių cheminės savybės
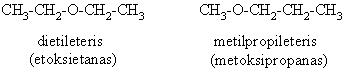
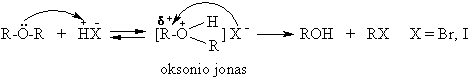
![]()
Eteriai, ypač viesoje, oksiduojasi oro deguonimi sudarydami hidroperoksidus:
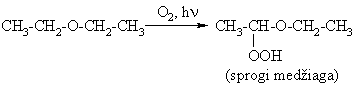
Dietileteris ir kiti eteriai puikūs polinių ir nepolinių organinių junginių tirpikliai, taikomi jiems ekstrahuoti i gamtinių objektų.
Medicinoje dietileteris taikomas bendrajai narkozei (trūkumai dirgina kvėpavimo takus, sprogus).
3.6. Tioliai ir sulfidai
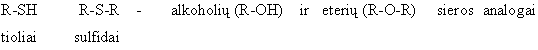

Rūgtinės bazinės savybės
Tioliai 5-6 eilėmis rūgtingesni u atitinkamus alkoholius. Tai apsprendia didesnio S atomo spindulys, didinantis S- poliarizuojamum¹ bei stabilum¹.
![]()
![]()
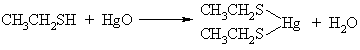
S-Hg ryys stiprus kovalentinis ryys. Tokie ryiai yra patvariuose metaloproteinuose, įskaitant ir metalofermentus, kurie susidaro s¹veikaujant gyvybės metalams su baltymais. Kita vertus, gamtinių tiolių savybė sudaryti patvarias druskas su d-metalais yra tokių metalų kaip Pb, Cd, Hg, As katijonų didelio toksikumo prieastis.
Jie yra labiau poliarizuojami u gyvybės metalus, todėl, patekź į organizm¹, pastaruosius istumia i gamtinių metaloproteinų, sudarydami naujus, patvarius be reikiamų biologinių savybių junginius.
Tioliai yra silpnesnės bazės u alkoholius. Protonas prisijungia prie S tioliams s¹veikaujant su konc. rūgtimis (pvz.: c (H2SO4) > 70%).
![]()
Nukleofilinės elektrofilinės reakcijos
Esterinimo ir peresterinimo reakcijos
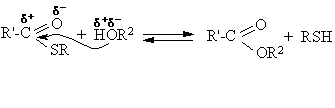
Tokiomis reakcijomis gyvame organizme perneamos acilgrupės. Perneėjas SH grupź turintis kofermentas A (CoA-SH):
![]()

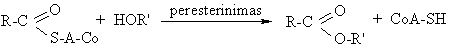
Gyvuose organizmuose daniausiai R = CH3.
Alkilinimo reakcijos
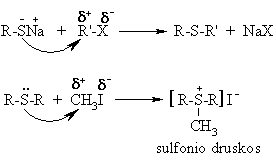
Sulfonio druskos lengvai alkilina nukleofilus.
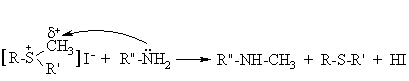
Organizme tokia reakcija vyksta dalyvaujant aminor gčiai metioninui, turinčiai sulfidinź grupź CH3-S-R, kuri s¹veikauja su adenozinu (A) ir sudaro sulfonio drusk¹ S-adenozilmetionin¹. Pastaroji organizme metilina gamtinius azoto nukleofilus: kolamin¹, noradrenalin¹, nikotinamid¹.
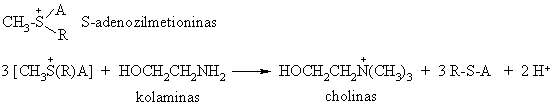
Oksidacijos redukcijos reakcijos
Tioliuose ir sulfiduose S turi maiausi¹ oksidacijos laipsnį (-2), todėl pasiymi stipriomis redukcinėmis savybėmis.
Tiol-disulfidinė pusiausvyra
![]()
jo 0.3) V (redukcinis potencialas)
velnūs oksidatoriai oksiduoja tiolius į disulfidus, o pastaruosius velnūs reduktoriai redukuoja į tiolius:

Susikaupus organizme oksidatorių pertekliui (pvz., laisvaradikalinės reakcijos metu), jie atakuoja baltymus, kurių sudėtyje yra aminorūgtis cisteinas (Cys-SH). Pastaroji oksiduojama į cistin¹ (Cys-S-S-Cys):
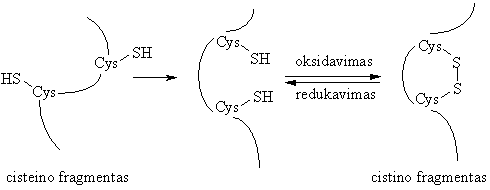
Disulfidiniai tilteliai fiksuoja nauj¹ baltymo konformacij¹, todėl jis praranda biologinź funkcij¹.
Antioksidacinėje buferinėje sistemoje esantys tioliai gaudo oksidatorius ir apsaugo laisv¹sias baltymų SH grupes nuo oksidatorių. Organizme tokį darb¹ atlieka tiol-disulfidinės konjuguotos oksidacinės-redukcinės poros, sudarytos i dipeptido glutationo (G-SH) ir dihidrolipo rūgties:

jo - 0.23 V

jo - 0.29 V
Antioksidacinės buferinės sistemos talpai didinti naudojami preparatai, turintys daugiau negu vien¹ SH grupź: ditioglicerolis HSCH2CH(SH)CH2OH, unitiolis HSCH2CH(SH)CH2SO3H, sukcimeras [- CH(SH)COOH]2. ie preparatai yra taip pat prienuodis toksinių d-metalų katijonams.
Radioaktyvus spinduliavimas labai padidina organizme aktyvaus deguonies O koncentracij¹. Apsisaugoti nuo jo naudojami radioprotektoriai (velninantys radioaktyvaus spinduliavimo pasekmes), pvz.:

Taigi, tiol-disulfidinė pusiausvyra organizme tarnauja apsisaugoti nuo oksidatorių, reduktorių bei laisvųjų radikalų.
Oksidavimas stipriais oksidatoriais
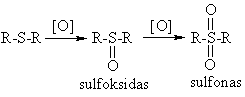
(CH3)2SO (dimetilsulfoksidas) naudojamas medicinoje kaip tirpiklis vaistiniams preparatams per od¹ įvesti.
Imokź į skyrių turite inoti:
alkoholių, fenolių, eterių, tiolių bei sulfidų struktūr¹, klasifikavim¹, izomerij¹ bei nomenklatūr¹;
alkoholių ir fenolių rūgtines-bazines, elektrofilines-nukleofilines bei oksidacines-redukcines savybes; jų antiseptines savybes;
tiolių ir sulfidų rūgtines-bazines, elektrofilines-nukleofilines bei oksidacines-redukcines savybes, tiol-disulfidinź pusiausvyr¹ ir jos vaidmenį gyvame organizme.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 5981
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved