| CATEGORII DOCUMENTE |
| Bulgara | Ceha slovaca | Croata | Engleza | Estona | Finlandeza | Franceza |
| Germana | Italiana | Letona | Lituaniana | Maghiara | Olandeza | Poloneza |
| Sarba | Slovena | Spaniola | Suedeza | Turca | Ucraineana |
DOCUMENTE SIMILARE |
|
AMINORŪGTYS, PEPTIDAI IR BALTYMAI
Aminorūgtimis vadinami karboksirūgčių dariniai, turintys vien¹ arba daugiau aminogrupių. Aminorūgčių struktūroje dar gali būti hidroksi-, merkapto- ir kitų funkcinių grupių. Aminorūgtys labai svarbios gyviems organizmams. Gyvieji organizmai pasiymi nuostabia savybe. Jie geba sujungti aminorūgtis tarpusavyje įvairiausiais dariniais ir sekomis ir sudaryti įvairius poliamidus: peptidus ir baltymus, pasiyminčius gyvybikai svarbiomis savybėmis. Peptidų sudėtyje yra iki 100, o baltymų vir 100 aminorūgčių.
a-Aminorūgčių struktūra, klasifikavimas ir fizikinės savybės
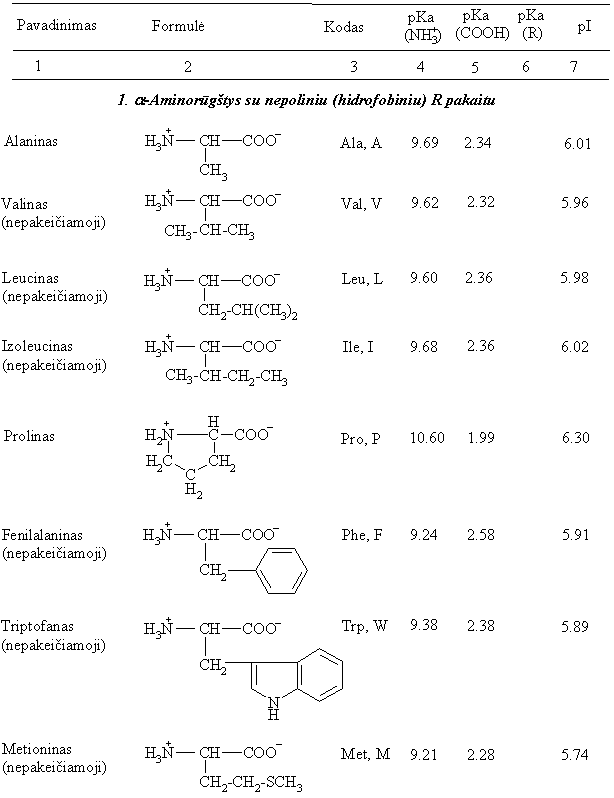
Pagal amino- ir karboksigrupių tarpusavio isidėstym¹ anglies atomų grandinėje aminorūgtys skirstomos į a b g w-aminorūgtis. a-Aminorūgtyse amino- ir karboksigrupės yra prie to paties anglies atomo. Nors i gamtinių objektų yra iskirta vir 300 įvairių aminorūgčių, tačiau į daugumos peptidų ir baltymų sudėtį įeina 20 ypač svarbių aminorūgčių. Visos jos yra a-aminorūgtys:
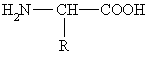
a-Aminorūgčių molekulėse yra rūgtinių ir bazinių grupių, t.y. jos yra amfolitai. Dėl to a-aminorūgčių molekulėse vyksta protono pernaa nuo karboksigrupės į aminogrupź, t.y. joms būdinga prototropinė tautomerija.
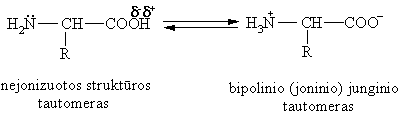
Vandens tirpaluose ir kristaluose vyrauja bipolinio junginio tautomeras, kuris yra elektrikai neutralus.
a-Aminorūgtys pagal jonizacines savybes bei polikum¹ skirstomos į 4 grupes.
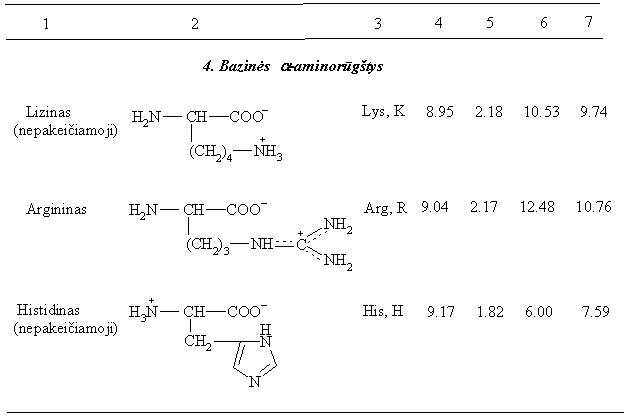
10 lentelė. Baltymų a-aminorūgtys
![]()
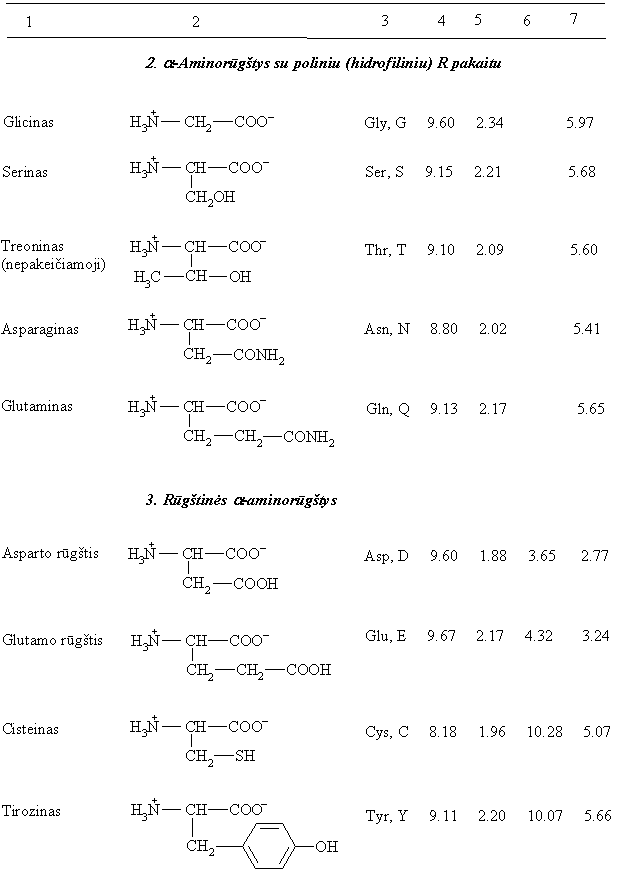
10 lentelės tźsinys
10 lentelės tźsinys
Dipolinio junginio (cviterjono) struktūra apsprendia a-aminorūgčių fizikines savybes. Jos yra bespalvės kristalinės mediagos, pasiyminčios aukta lydymosi temperatūra, nelakios, beveik visos tirpios vandenyje ir praktikai netirpios nepoliniuose tirpikliuose.
a-Aminorūgtys, iskyrus glicin¹, yra chiraliniai junginiai, nes turi asimetrinį a-C-atom¹. Pagrindinės a-aminorūgtys, įeinančios į baltymų sudėtį, yra L-konfigūracijos. R ir S sistemoje visų jų, iskyrus L-cistein¹, asimetrinio a-C-atomo konfigūracija yra S.
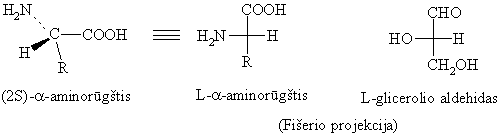
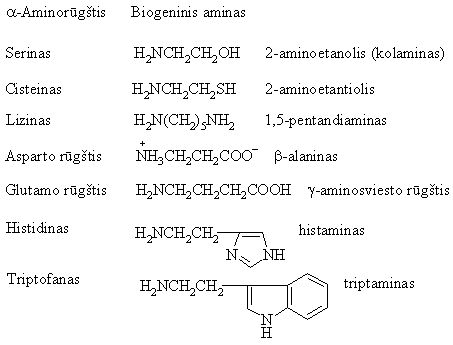
Baltyminis maistas yra gyvųjų organizmų a-aminorūgčių altinis. Daugelį a-aminorūgčių gyvūnų organizmai sintetina, tačiau valino, histidino, leucino, izoleucino, lizino, metionino, treonono, triptofano ir fenilalanino nesintetina. ios 9 a-aminorūgtys turi būti gaunamos su maistu ir vadinamos nepakeičiamosiomis aminorūgtimis.
a-Aminorūgčių cheminės savybės
a-Aminorūgčių cheminių savybių savotikum¹ apsprendia dviejų funkcinių grupių su aikiai prieingomis savybėmis buvimas jų molekulėse.
Rūgtinės-bazinės savybės ir prototropinė tautomerija
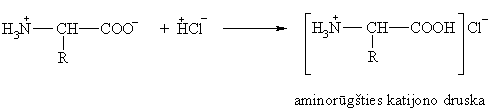
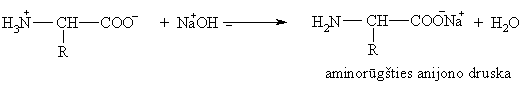
Aminorūgtys reaguoja su rūgtimis ir bazėmis:
Aminorūgčių egzistavimo forma vandens tirpaluose priklauso nuo pH, pvz., alanino:
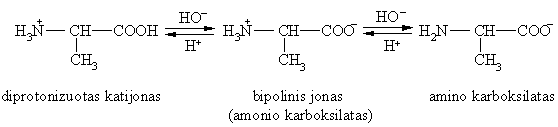
Kiekviena aminorūgtis turi savit¹ pH reikmź, kai susidaro bipolinis junginys. Tai vadinamasis izoelektrinis takas pI, kai tirpale yra vienodas teigiamų ir neigiamų krūvių skaičius ir tirpalas yra nelaidus elektros srovei.
a-Aminorūgčių, turinčių dvi pKa reikmes, pI gali būti apskaičiuojamas tokia formule:
![]()
a-Aminorūgtys, kurios gali egzistuoti tik 3-jose formose molekulė, katijonas ir anijonas vadinamos neutraliomis. I 20 a-aminorūgčių jų yra 13. a-Aminorūgtys, turinčios oninź grandinź su bazine grupe vadinamos bazinėmis (jų yra 3), o turinčios oninź grandinź su rūgtine grupe vadinamos rūgtinėmis (jų yra 4).
Kompleksodara
Visos a-aminorūgtys, atiduodamos proton¹, reaguoja su d-metalų katijonais kaip ligandai ir sudaro ciklinius kompleksus - chelatus:
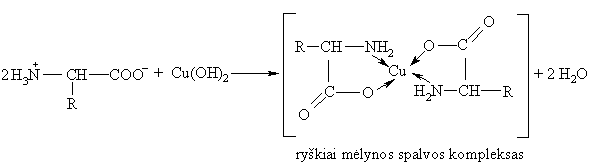
Rūgtinės ir bazinės a-aminorūgtys yra aktyvesni ligandai, negu neutralios a-aminorūgtys. Ypač aktyvūs kompleksodaros reakcijose su biometalais yra cisteinas ir histidinas, turintys lengvai poliarizuojamas merkapto- ir imidazolo grupes. ių a-aminorūgčių aktyvumas kompleksodaros reakcijose ilieka ir jas turinčiuose peptiduose bei baltymuose.
Elektrofilinės-nukleofilinės savybės
Aminorūgtys elektrofilinėse-nukleofilinėse reakcijose karbonilgrupe reaguoja kaip elektrofilai, o aminogrupe kaip nukleofilai.
Acilinimo reakcijos
Aminorūgtys acilina nukleofilus, pvz., alkoholius:
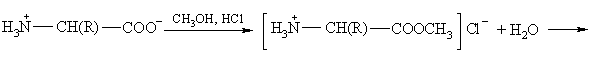
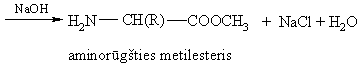
Jų aminogrupė gali būti acilinama, pvz., acilhalogenidu:
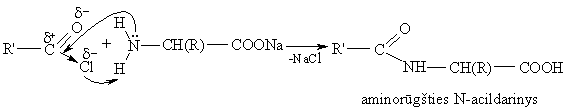
Aminorūgčių karboksigrupė apsaugoma (blokuojama) arminėje terpėje paverčiant jas druskomis (metalų karboksilatais) arba esteriais. Aminorūgčių metalų karboksilatai ir esteriai neturi rūgtinių savybių, bet turi bazinių savybių.
Aminorūgčių aminogrupė blokuojama rūgtinėje terpėje susidarant druskai arba acilinant. Aminorūgčių diprotonizuotas katijonas ir N-acildarinys neturi bazinių savybių, bet turi rūgtinių savybių.
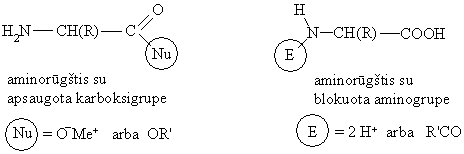
Acilinant aminorūgtis su blokuota karboksigrupe aminorūgtimis su blokuota aminogrupe susidaro dipeptidai.
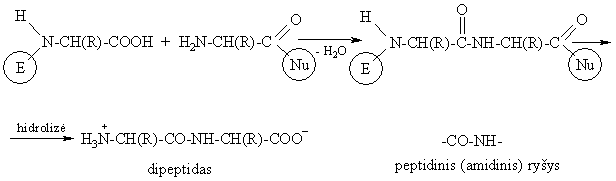
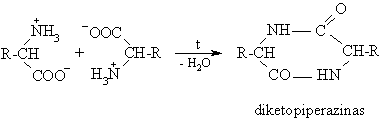
Nesant apsauginių grupių dvi aminorūgčių molekulės reaguoja tarpusavyje acilindamos viena kit¹:
Alkilinimo reakcijos
Aminorūgtys su blokuota karboksigrupe laisva aminogrupe reaguoja su halogenalkanais, pvz., jodmetanu:
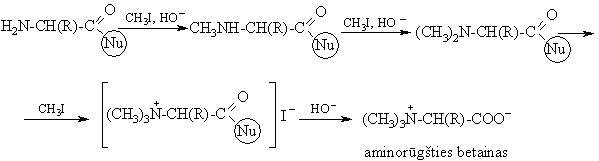
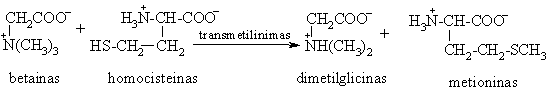
Aminorūgties betainas turi fiksuot¹ dipolinio junginio struktūr¹. Jis yra metilgrupių altinis nukleofilams. Biosistemose betainai dalyvauja transmetilinimo reakcijose:
Alkilinimo reakcijoms priskiriama ir aminorūgčių raekcija su Senderio reagentu:
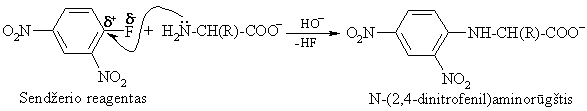
Tokie aminorūgčių dariniai gerai tirpsta organiniuose tirpikliuose ir gali būti efektyviai perskirti chromatografiniais metodais į pavienius aminorūgčių darinius (reakcija naudojama aminorūgčių sekai peptiduose ar baltymuose nustatyti).
S¹veika su formaldehidu
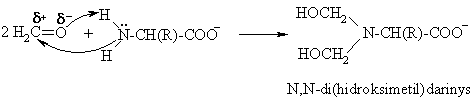
Formaldehidas, reaguodamas su baltymų aminogrupėmis, negrįtamai denatūruoja baltymus. Tuo paaikinamas didelis formaldehido toksikumas ir jo gebėjimas naikinti mikroorganizmus arba jų sporas (sterilizuoti).
Oksidacinės-redukcinės savybės
a-Aminorūgtys dalyvauja įvairiose oksidacijos redukcijos reakcijose, kurių metu kinta anglies atomų oksidacijos laipsnis arba anglies atomų grandinė.
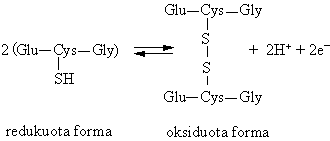
Tiol-disulfidinė pusiausvyra
Cisteinas, kaip ir visi tioliai, yra reduktorius. Jis lengvai oksiduojasi virsdamas disulfidu cistinu, gebančiu lengvai redukuotis.
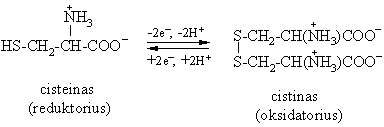
j = - 0.22 V
i konjuguota oksidacinė redukcinė pora pasiymi iek tiek didesniu gebėjimu redukuoti negu oksiduoti. Todėl cisteinas yra efektyvus antioksidatorius, apsaugantis organizm¹ nuo stiprių oksidatorių. Be to, jis buvo pirmasis preparatas spindulinei ligai gydyti.
Dekarboksilinimas
Laboratorinėmis s¹lygomis i reakcija vyksta kaitinant a-aminorūgtis su Ba(OH)2:
![]()
Organizme a-aminorūgčių dekarbksilinimo reakcija vyksta fermento ir kofermento įtakoje:

i reakcija lengvai vyksta gyvūnų ir augalų organizmuose, tačiau ypač lengvai mikroorganizmuose.
a-Aminorūgtims dekarboksilinantis organizme sintetinasi biogeniniai aminai, atliekantys svarbias biologines funkcijas.
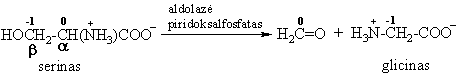
Cb - C a ryio aldolinis skilimas
Reakcija būdinga serinui ir treoninui.
Tiesioginis deamininimas (eliminavimo reakcija)
i reakcija būdinga a-aminorūgtims, turinčioms b-padėtyje OH arba SH grupes.
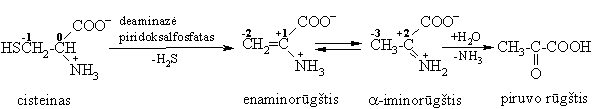
Transamininimas (peramininimas)

ia reakcija reguliuojamas aminorūgčių kiekis organizme.
Oksidacinis deamininimas
is procesas būdingas a-aminorūgtims, kai jos veikiamos oksidatoriais. Reakcija vyksta laboratorinėmis s¹lygomis bei organizme.
Reakcija su HNO2
![]()
Reakcija taikoma aminogrupėms aminorūgtyse ir baltymuose nustatyti.
S¹veika su ninhidrinu
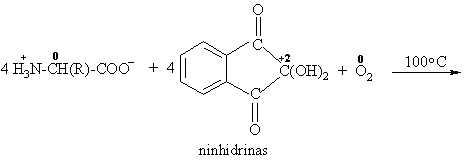
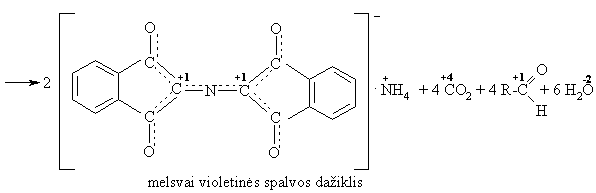
S¹veika su dehidrogenaze
Organizme oksidaciniame deamininime dalyvauja alaninas, asparto ir glutamo rūgtys.
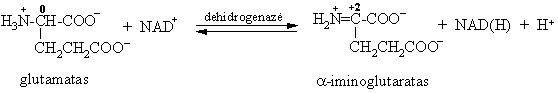
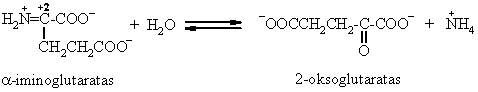
Organizme vyksta ir grįtamoji reakcija redukcinis oksorūgčių amininimas.
Vidinis molekulinis deamininimas
Asparto rūgtis
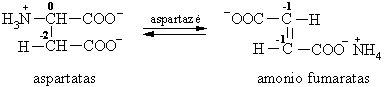
Mikrobiologijos pramonėje grįtam¹ja reakcija i fumaro rūgties sintetinama L-asparto rūgtis.
7.3. Peptidų struktūra ir savybės
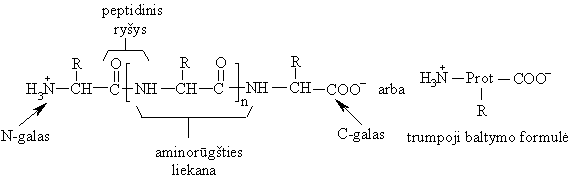
Peptidai biosubstratai, sudaryti i aminorūgčių liekanų. Skirstomi į maamolekulius (oligopeptidus), kurių sudėtyje yra iki 10 aminorūgčių liekanų, ir polipeptidus, kurių sudėtyje yra 11-100 aminorūgčių liekanų.
Peptidai aminorūgčių polikondensacijos produktai:
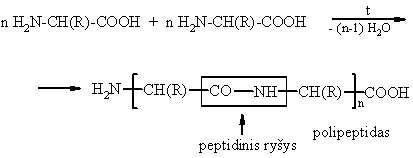
Peptidiniam ryiui būdinga tricentrė p, p- konjuguota sistema. Peptidinė grupė yra planarinės trans-struktūros, kurioje aminorūgčių liekanų R pakaitai isidėstź transoidine konformacija.

Pieiant peptidų struktūrines formules, atomai idėstomi taip, kad laisva aminogrupė liktų kairėje formulės pusėje, o karboksigrupė deinėje.
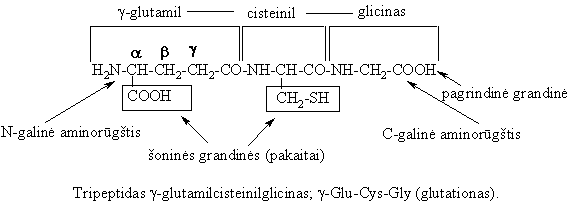
Peptidai, esantys visuose gyvuose organizmuose, atlieka įvairias biologines ir fiziologines funkcijas. Daugelis antibiotikų, hormonų bei toksinų yra peptidai. Cheminiu poiūriu jie gali pasiymėti rūgtinėmis-bazinėmis, jonoforų bei antioksidatorių savybėmis.
Rūgtinės-bazinės savybės
Peptidai, panaiai kaip aminorūgtys, yra amfolitai.
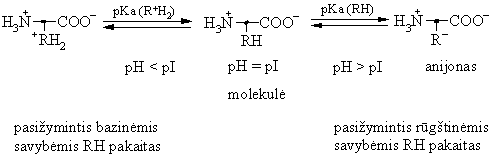
Organizme peptid rūgtinių-bazinių virsmų pagrindu funkcionuoja peptidinės buferinės sistemos.
Kompleksodara
Daugelis peptidų yra ligandai ir sudaro su kompleksodariais nevienodo patvarumo kompleksinius junginius. Peptidai valinomicinas ir gramicidinas S yra ne tik antibiotikai, bet ir jonoforai (padidinantys biomembranos pralaidum¹ jonams), transportuojantys per l¹stelės membran¹ K+ ir Na+ katijonus.
Valinomicino ciklinė molekulė panai į riestainį, kurio iorinis pavirius yra hidrofobinis, o vidinis polinis; ertmė atitinka K+ matmenis.
Gramicidino S molekulė panai į vamzdelį, kurio iorinis pavirius hidrofobinis, o vidinis polinis. Juo perneami vienvalenčiai katijonai: Na+, K+ ir kt., tačiau daniausiai Na+ katijonai.
Oksidacinės-redukcinės savybės
Gyvūnų, augalų ir bakterijų l¹stelėse yra tripeptido glutationo (GSH), kuris aktyviai dalyvauja oksidacijos-redukcijos reakcijose, i redukuotos formos (GSH) pereidamas į oksiduot¹ (GS-SG) ir atvirkčiai:
j - 0.23 V.
Redukuota glutationo forma yra antioksidatorius, neutralizuojantis l¹stelėse aktyvi¹sias deguonies formas. Oksiduota glutationo forma saugo biosubstratus nuo laisvųjų radikalų reduktorių.
Biologinės ir fiziologinės funkcijos
Daugelis peptidų yra hormonai, reguliuojantys organizme vykstančius procesus. Pvz., insulinas, sintetinamas kasos liaukoje, yra sudarytas i 51 aminorūgties liekanų ir dviejų grandinių, sujungtų disulfidiniais tilteliais, palaiko normos ribose cukraus kiekį kraujuje. Apie 150 peptidų, vadinamų neuropeptidais, yra mogaus galvos smegenyse, kur jie atlieka įvairias biologines ir fiziologines funkcijas. Peptidų cheminės savybės, o ypač biologinės ir fiziologinės funkcijos, priklauso ne tik nuo aminorūgčių skaičiaus ir jų sekos grandinėje, bet ir nuo grandinės konformacijos. Tuo jie panaūs į baltymus.
7.4. Baltymų struktūra ir savybės
Baltymai svarbiausia gamtinių junginių klasė, atliekanti įvairius vaidmenis funkcionuojant gyvybei. Cheminiu poiūriu baltymai yra biopolimerai, sudaryti i a-aminorūgčių. Baltymų molekulės yra linijinės, neakotos.
Daugeliui gamtinių polimerų (pvz., polisacharidams) būdingas polidispersikumas. Jų molekulės būna įvairaus ilgio. Baltymai visika prieingybė. Visos to paties baltymo molekulės yra identikos, turi t¹ patį polipeptidinės grandinės ilgį ir t¹ pači¹ cheminź struktūr¹.
Baltymų peptidinis ryys yra patvarus neutralioje terpėje 37 C temperatūroje, tačiau rūgtinėje arba bazinėje terpėje gali hidrolizintis. Organizme baltymų hidrolizź vykdo fermentai peptidazės.
Gamtinių baltymų molekulės netgi tirpaluose gali egzistuoti įvairiose konformacijose.
Baltymų makromolekulės konformacija tirpale įvairios jos erdvinės formos, susidarančios sukantis molekulės fragmentams apie viengubuosius ryius ir besistabilizuojančios tarpmolekuliniais ryiais, atsirandančiais s¹veikaujant atskiroms baltymų makromolekulės grupėms tarpusavyje arba su baltymus supančiame vandens tirpale esančių mediagų molekulėmis.
Konformacijų tarpusavio virsmai daugumoje atvejų vyksta neskylant baltymų makromolekulėje kovalentiniams ryiams. Baltymų sudėčiai ir konformacijoms apibūdinti vartojamos pirminės, antrinės, tretinės ir ketvirtinės struktūros s¹vokos.
Pirminė baltymų struktūra
Aminorūgčių seka baltymo polipeptidinėje grandinėje yra vadinama pirmine baltymų struktūra.
Pirminės baltymų struktūros tyrimai svarbūs medicinai. inoma nemaai įgimtų ligų, kurių prieastis vienos ar kelių aminorūgčių pakeitimas konkretaus baltymo polipeptidinėje grandinėje. Tokių ligų atskleidimu ir diagnoze usiima palyginti jauna medicinos aka molekulinė patologija.
Labai svarbų vaidmenį baltymų pirminės struktūros tyrimuose turėjo ir dabar turi N-galinių aminorūgčių liekanų idetifikavimas. F. Senderis pasiūlė iam tikslui N-galinių aminorūgčių cheminio ymėjimo metod¹.
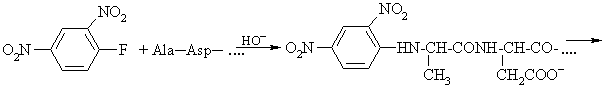
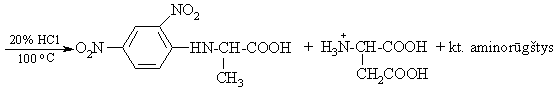
Ekstrahuojant hidrolizės miinį organiniais tirpikliais isiekstrahuoja tik paymėtoji N-galinė aminorūgtis; visos kitos lieka vandens sluoksnyje.
iuo metu pats svarbiausias N-galinių aminorūgčių identifikavimo metodas yra vadinamasis Edmano degradavimas.

Sutrumpint¹ polipeptid¹ galima vėl veikti fenilizotiocianatu ir identifikuoti antr¹j¹ N-galo aminorūgtį ir t.t.
Grietai linijinė polipeptidinė grandinė energetikai nenaudinga, kadangi ji eliminuoja įvairių pakaitų, esančių aminorūgčių liekanose, tarpusavio s¹veik¹. Dėl tokios s¹veikos atsiranda papildomi ryiai, stabilizuojantys vienoki¹ ar kitoki¹ baltymo konformacij¹.
![]()
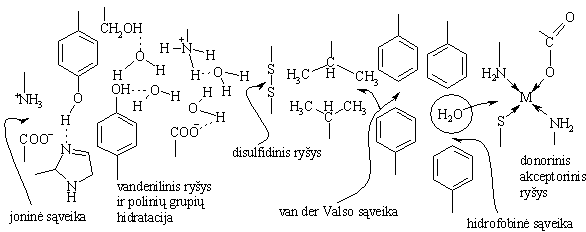
Daniausiai pasitaikančios s¹veikos yra ios: joninė, vandenilinis ryys, polinių grupių hidratavimas, disulfidinis ryys, nepolinių pakaitų van der Valso s¹veika, hidrofobinė s¹veika (istumiamas H2O i nepolinių pakaitų zonos), donorinė-akceptorinė s¹veika tarp kompleksadario jono ir baltymo ligandinių grupių.
Antrinė baltymų struktūra
Gamtinėmis s¹lygomis (vandens terpė, neaukta temperatūra) baltymų makromolekulės susilanksto į kompaktik¹, artim¹ rutulio formai, kamuolėlį, vadinam¹ globule. Baltymų globulės sudarytos i a-spiralių ir b-klostinių fragmentų. Santykinis a-spiralių ir b-klostinių kiekis baltymų globulėse gali būti įvairus. Paprasčiausi erdvinės struktūros elementai (a-spiralės, b-struktūros, vingiai) vadinami antrine baltymų struktūra. J¹ fiksuoja palyginti silpni vandeniliniai ryiai >C=O HN< .Todėl antrinź baltymų struktūr¹ lengvai transformuoja ioriniai veiksniai: temperatūra, tirpalo sudėtis arba pH, mechaninis poveikis. Dėl to keičiasi baltymo natūralios savybės, reikia ir biologinės bei fiziologinės funkcijos
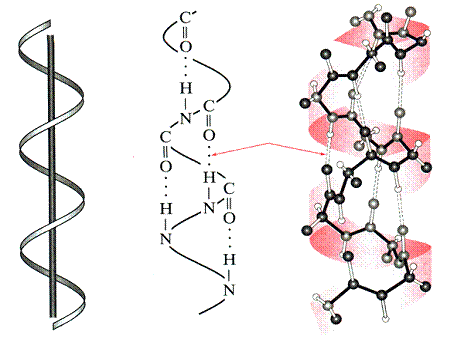
baltymo a-spiralė
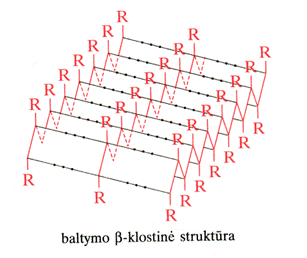
Tretinės ir ketvirtinės baltymų struktūros samprata
Visos peptidinės grandinės ir oninių grandinių isidėstymas erdvėje vadinamas tretine baltymų struktūra.
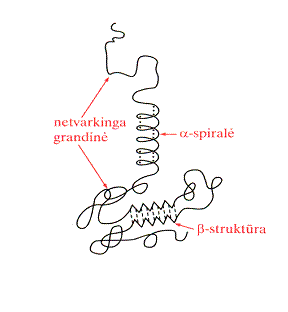
Didiausi¹ įtak¹ jos formavimuisi turi oniniai pakaitai ir jų tarpusavio s¹veika (joninė, vandenilinių ryių, hidrofobinė, disulfidiniai ryiai). Daugelio baltymų pavyzdiu parodyta, kad jiems būdinga tretinė struktūra susidaro savaime, kadangi ji yra termodinamikai stabiliausias baltymo konformeras.
Tretinė struktūra yra lengviau paeidiama u antrinź. Tada polipeptido grandinė tarsi isivynioja. į proces¹ skatina temperatūra, pH pokytis, vitinimas, mechaniniai faktoriai (pvz., maiymas). Daugelio baltymų globulės linkusios jungtis į stambesnius asociatus, sudarytus i dviejų ir daugiau narių. Tokie asociatai vadinami ketvirtine baltymų struktūra, o įeinančios į jų sudėtį baltymo globulės subvienetais.
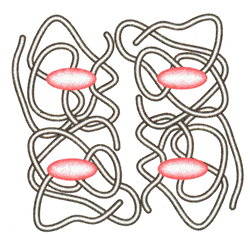
Ketvirtinė struktūra gali būti sudaryta i vienodų arba skirtingų subvienetų. Molekulė asociatas atlieka biologines funkcijas, kurios nebūdingos atskiriems vienetams. Pvz., hemoglobino molekulė sudaryta i keturių subvienetų, o jos kompleksui su deguonimi būdingas didesnis labilumas negu atskirų subvienetų.
Ketvirtinė baltymų struktūra daniausiai yra labai labili, kadangi subvienetų neria kovalentiniai ryiai, o ria tik van der Valso tarpmolekulinės s¹veikos jėgos, rečiau vandeniliniai ryiai. Todėl j¹ gali paeisti net nedidelė denatūruojančių veiksnių įtaka.
Baltymų molekulių forma
Pagal molekulių form¹ baltymai yra skirstomi į fibrilinius ir globulinius. Fibrilinių baltymų molekulės paprastai turi antrinź b-struktūr¹ ir plauelių sandar¹, jos netirpsta H2O, kadangi paviriuje yra daug hidrofobinių grupių. Fibrilinis baltymas yra sausgyslių ir kaulų audinio kolagenas.
Globulinių baltymų molekulės turi cilindrinź arba sferinź form¹. Jie paprastai tirpsta H2O, kadangi paviriuje turi polinių grupių. Albuminas (kiauinio baltymas) yra globulinis baltymas.
Denatūravimas
Erdvinź baltymų struktūr¹ gali suardyti daugelis veiksnių: temperatūros pakėlimas, pH pasikeitimas, UV arba rentgeno spinduliuotė, mediagos, dehidratuojančios baltymus (etanolis, acetonas ir kt.) arba reaguojančios su oninėmis grandinėmis (oksidatoriai, reduktoriai, formaldehidas, fenolis) ir net stiprus mechaninis maiymas.
Natūralios baltymų makromolekulės konformacijos pasikeitimas iorinių veiksnių įtakoje vadinamas baltymų denatūracija. Jos metu suyra ketvirtinė, tretinė ir antrinė baltymų struktūra, o pirminė ilieka nepakitusi. Denatūracija gali būti grįtamojo ir nerįtamojo pobūdio. Jeigu denatūracija yra grįtamoji, tai grįtamasis procesas vadinamas renatūracija.
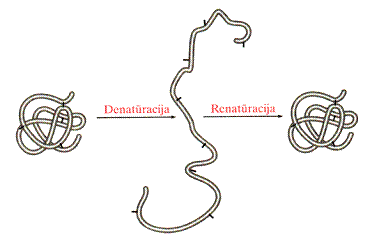
Pavirinės baltymų savybės. Lipoproteinai
Dauguma baltymų yra pavirinio aktyvumo mediagos. Jie emulguoja riebalus ir cholesterolį, yra aktyvūs biomembranų komponentai.
Kai kurie baltymai sudaro liofilines miceles su lipidais, vadinamas lipoproteinais. Tarp baltymų ir lipidų molekulių lipoproteinuose egzistuoja dispersinė s¹veika (van der Valso). Lipoproteinai dalyvauja riebalų transporto ir hidrolizės (kartu su fermentu lipoproteinlipaze) procesuose. b-Lipoproteinai (mao tankio) transportuoja cholesterolį į l¹steles, o a-lipoproteinai (didelio tankio) alina cholesterolio perteklių i l¹stelės.
Baltymų pavirinės savybės, charakterizuojančios jų gebėjim¹ tarpmolekulinėms s¹veikoms, yra fermento s¹veikos su substratu pagrindas (rakto ir spynos teorija).
Informacinės savybės
Baltymų molekulės arba jų atskiri fragmentai laikomi biologinės informacijos, kurios abėcėlės raidės 20 aminorūgčių, neėjai. ios informacijos perdavimo pagrindas yra įvairios tarpmolekulinės s¹veikos rūys ir sistemos siekimas efektyviai jas inaudoti. Aminorūgčių kalba, sudaryta i 20 vienetų, tai optimalus ir patikimas svarbios informacijos apie biosistemų gyvybines funkcijas, įskaitant atskirų organų ir viso organizmo form¹, kodavimo būdas.
Rūgtinės-bazinės savybės
Baltymai, kaip ir a-aminorūgtys, yra poliamfolitai. Jų rūgtines savybes apsprendia COOH, NH3, SH ir 4 HOC6H4-grupės. Baltymų bazines savybes apsprendia COO-, NH2 grupės bei imidazolo ( C3H3N2) ir guanidino ( CH5N3) pakaitai.
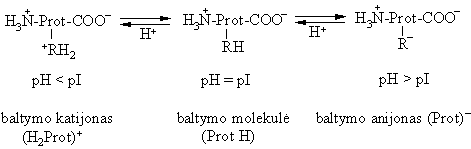
Stipriai rūgtinėje aplinkoje protonizuojamas baltymo galinis karboksilatanijonas, o stipriai arminėje deprotonizuojamas galinis amonio katijonas. Tačiau biologinėse sistemose tokie virsmai nevyksta, kadangi joms nebūdingos tokios kratutinės pH reikmės. Dėl rūgtinių-bazinių baltymų virsmų kinta jų konformacija, todėl skiriasi baltymų molekulės, katijono ir anijono biologinės bei fiziologinės funkcijos. Kai pH pI baltymo tirpumas yra minimalus, jis linkźs koaguliuoti sudaryti nuosėdas.
Kompleksodara
Baltymai aktyvūs polidentatiniai ligandai, ypač tie, kurie turi lengvai poliarizuojamas funkcines grupes (-SH, imidazolo ied¹, guanidino ir aminogrupes). Jie sudaro įvairaus patvarumo kompleksinius junginius, priklausomai nuo kompleksadario jono poliarizuojamumo. Su arminiais metalų katijonais baltymai sudaro nepatvarius kompleksus, kurie atlieka jonoforų funkcij¹, su emės arminiais metalais (Mg2+, Ca2+) jau pakankamai patvarius. Dar patvaresnius kompleksus baltymai sudaro su d-metalais (gyvybės metalais: Fe, Cu, Mn, Zn, Co, Mo) ir ypač patvarius su toksiniais metalais (Pb, Cd, Hg). Patvarūs baltymų kompleksai su metalų katijonais danai vadinami metaloproteinais.
Daugelis fermentų tai baltymų cikliniai kompleksai su gyvybės metalais. Katijonas fermento aktyvusis centras, o baltymas substrato atpaintojas ir aktyvintojas.
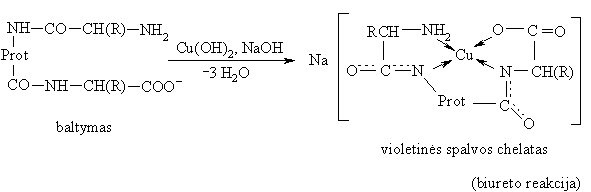
Elektrofilinės-nukleofilinės reakcijos
Hidrolizė
Baltymų hidrolizė pagrindinis jų katabolizmo (skilimo) organizme būdas.

Baltymų amidinimas
Baltymai, turintys asparto ar glutamo rūgtis, organizme gali būti amoniako akceptoriais:

i reakcija susijusi su ATP hidrolizės reakcija.
Reakcija su formaldehidu
Objektų sterilizacijai (visikam mikroorganizmų sunaikinimui) naudojamas formaldehidas:
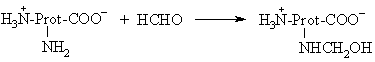
Reakcijos metu įvyksta negrįtamoji baltymų denatūracija.
Reakcijos su 2,4-dinitrofluorbenzenu ir fenilizotiocianatu
Aktyvūs elektrofiliniai reagentai (Ed Xd ): 2,4-dinitrofluorbenzenas ir fenilizotio-cianatas naudojami baltymų (ir peptidų ) pirminei struktūrai nustatyti.
![]()
Oksidacinės-redukcinės savybės
Baltymai yra atsparūs velniems oksidatoriams, iskyrus tuos, kurie turi aminorūgtį cistein¹.
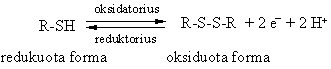
Tokių virsmų metu kinta baltymo konformacija.
Grietesnėmis s¹lygomis baltymų merkaptogrupė oksiduojama iki sulfogrupės:
![]()
Organizme vyksta ir tokia baltymų oksidavimo reakcija:
![]()
ia reakcija organizmas alina nereikalingus baltymus ir papildo savo energetinius resursus.
Baltymams atpainti taikoma ksantoproteino reakcija (s¹veika su HNO3) ir ninhidrino reakcija (s¹veika su ninhidrinu, iūr. 121 psl.).
Imokź į skyrių turite inoti:
a-aminorūgčių struktūr¹, prototropinź tautomeij¹, klasifikavim¹;
a-aminorūgčių rūgtines-bazines, kompleksodarines, elktrofilines-nukleofilines, oksidacines-redukcines savybes;
peptidų struktūr¹ ir savybes;
baltymų struktūr¹ ir savybes.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 7013
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved