| CATEGORII DOCUMENTE |
| Bulgara | Ceha slovaca | Croata | Engleza | Estona | Finlandeza | Franceza |
| Germana | Italiana | Letona | Lituaniana | Maghiara | Olandeza | Poloneza |
| Sarba | Slovena | Spaniola | Suedeza | Turca | Ucraineana |
DOCUMENTE SIMILARE |
|
Atomo sudėtis, cheminės jungtys, kompleksiniai junginiai
Atomas pati maiausia cheminio elemento dalelė įeinanti į vieninių ir sudėtinių mediagų molekulių sudėtį.
Atomo sandara sudėtinga. Paprasčiausiai sudarytas vandenilio atomas. Jo centre branduolys, o aplink jį juda elektronas. Brandulį sudaro dviejų rūių elementariosios dalelės protonai ir neutronai.
S¹veikaudami tarpusavyje, atomai gali perduoti vienas kitam savo elektronus. Protonų skaičius elemento atomo branduolyje ymimas raide Z ir vadinamas atominiu skaičiumi. Visi to paties elemento atomai savo branduoliuose turi vienoda protonų skaičių. Bet gali skirtis neutronų skaičius. Neutronų skaičius branduolyje ymimas raide N. Protonų ir neutronų skaičiau suma vadinama masės skaičiumi ir ymima A=Z+N.
Elementų atomų atmainos besiskiriančios netronų skaičiumi vadinamos izotopais. Neutraliame atome yra vienodas elektronų ir protonų skaičius (protonų ir elektronų krūviai kompensuoja vienas kit¹).
Cheminės jungtys atsiranda s¹veikaujant emektroniniams laukams, kuriuos sukuria besijungiančių atomų elektronai ir branduoliai. Cheminės jungties stiprum¹ apibūdina jungties energija, kuri parodo energijos kiekį, reikaling¹ jungčiai suardyti. Cheminės jungtys skirstomos į:
Kovalentines
Jonines
Metalik¹sias
Vandenilines
Koordinacines
Cheminė jungtis atsirandanti susidarant bendroms elektronų poroms, vadinama kovalentine jungtimi:
![]() arba
arba ![]()
![]() arba
arba ![]()
Jei abiejų atomų
elektronų neigamumai yra vienodi, abu atomai galės visikai
lygiaverčiai sudaryti bendr¹ elektronų por¹. Tokia jungtis vadinama
kovalentine nepoline (![]() ir
t.t.).
ir
t.t.).
Prie elektronikai
neigiamesnio atomo kaupiasi neigiamesnis krūvis, o prie kito
teigiamesnis. Tokia jungtis vadinama kovalentine poline (![]() ).
).
Valentinių jungčių metodas
Atomams suartėjus taip, kad tarp jų galėtų atsirasti jungtis, atomų orbitalės susineria. S¹naros vietoje yra didiausia elektronų poros buvimo tikimybė. Pagal atomų s¹naros būd¹ jungtys skirstomos į p ir s jungtis. Kuo daugiau orbitalės susineria, tuo daugiau isiskiria energijos ir tuo stipresnė susidaro kovalentinė jungtis. Susidarant s jungčiai, orbitalės susineria daugiau, negu susidarant p jungčiai, todėl s jungtys yra stipresnės.
Elektronų orbitalių hibridizacija
Junginiuose hibridizacija esti tokia: sp, ![]() ir
ir
![]() .
Kompleksiniuose junginiuose hibridizuojasi s, p ir d orbitalės.
.
Kompleksiniuose junginiuose hibridizuojasi s, p ir d orbitalės.
sp hibridizacija galima tuomet, kai molekulės centrinio elemento atomas turi 2 pavienius elektronus s ir p orbitalėse.
![]() hibridizacija galima tuomet, kai
molekulės centrinio elemento atome yra 3 pavieniai elektronai s ir p
orbitalėse.
hibridizacija galima tuomet, kai
molekulės centrinio elemento atome yra 3 pavieniai elektronai s ir p
orbitalėse.
Nesotiem anglevandeniliams būdinga ![]() ir
sp hibridizacija.
ir
sp hibridizacija.
![]() hibridizacija vyksta tik tuo atveju, kai
molekulės centrinio atomo iorinio atomo ioriniame sluoksnyje dalis
orbitalių upildytos elektronų poromis, o kitos pavieniais
elektronais ir sudaro jungtis.
hibridizacija vyksta tik tuo atveju, kai
molekulės centrinio atomo iorinio atomo ioriniame sluoksnyje dalis
orbitalių upildytos elektronų poromis, o kitos pavieniais
elektronais ir sudaro jungtis.
Joninė jungtis susidaro dėl elektrostatinės tarpusavio traukos. Tai viena i paprasčiausių cheminių jungčių.
Pavizdiui reaguojant NaCl, Na atomas atiduoda
elektron¹ i 3s orbitalės ir virsta teigiamu jonu: ![]() ;
Cl atomas į elektron¹ prisijungia į 3p orbitalź ir virsta neigiamu
jonu
;
Cl atomas į elektron¹ prisijungia į 3p orbitalź ir virsta neigiamu
jonu ![]() .
Beveik visi joniniai junginiai yra kristalinės mediagos.
.
Beveik visi joniniai junginiai yra kristalinės mediagos.
Metalikoji jungtis susidaro dėl to, kad metalai gali atiduoti savo valentinius elektronus. Metalų kristalai dėl metalikojo ryio lengvai deformuojami.
Cheminė jungtis, kuri susidaro tarp į molekulź sujungto vandenilio atomo ir kito elemento vadinama vandeniline.
Vandervalinės jėgos
Nors molekulės yra neutralios ir negali sudaryti valentinių jungčių, tačiau jos taip pat viena kit¹ veikia. Tarp molekulių veikiančios jėgos vadinamos vandervalinėmis jėgomis ir skirstomos į 3 rgupes: dipolines, indukcines ir dispersines.
dipolinės jėgos veikia tarp dviejų polinių molekulių. Kylant temperatūrai, dipolinė s¹veika silpnėja
indukcinis ryys tarp molekulių susidaro tada, kai suartėja polinė ir nepolinė molekulė. Indukcinės jėgos nepriklauso nuo temperatūros.
tarpusavyje s¹veikauja ir nepolinės molekulės. is reikinys aikinamas tuo, kad sukantis elektronams ir svyruojant atomų branduoliams atome labai trumpam susikuria dipoliai, dėl kurių tarp molekulių atsiranda dispersinė s¹veika. Ji būdinga tiek ir nepolinėms molekulėms.
Koordinacinė jungtis tai viena i kovalentinės jungties atmainų. Jai susidaryti padeda elektronų pora, priklausanti viem i reakcijoje dalyvaujančių atomų.
Atomas arba jonas, turintis ioriniame energetiniame lygmenyje laisv¹ elektroninź por¹, sudaranči¹ koordinacinź jungtį, vadinamas donoru, o atomas arba jonas, priimantis į savo iorinį energetinį lygmenį i¹ por¹, vadinamas akuptoriumi. Todėl koordinacinė jungtis dar vadinama donoriseakaptorine.
Cheminems junginems turintiems koordinacinź
jungtį, priklauso kompleksiniai junginiai. Jie yra neutralūs: ![]() ir joniniai: katijonai -
ir joniniai: katijonai - ![]() anijonai -
anijonai - ![]() ir kiti.
ir kiti.
Kompleksiniai junginiai būna:
Rūgtys ![]()
Bazės ![]()
Neelektrolitai ![]()
Jonas prisijungźs prieingo enklo jonus arba
neutralias molekules vadinamas kompleksadariu. Pvz: ![]() kompleksadaris yra
kompleksadaris yra ![]() jonai ir molekulės petarpikai sujungti
su kompleksadariu vadinami adendais arba ligandais. Isidesčiusių aplink kompleksadarį
adendų skaičius vadinamas koordinaciniu skaičiumi. Jis gali būti nuo 2 iki 8.
jonai ir molekulės petarpikai sujungti
su kompleksadariu vadinami adendais arba ligandais. Isidesčiusių aplink kompleksadarį
adendų skaičius vadinamas koordinaciniu skaičiumi. Jis gali būti nuo 2 iki 8.
Kai kurių ceminių elementų koordinaciniai skaičiai:
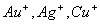
![]()
![]()
![]()
Adendai būna: Monodentatiniai (jonai)
Bidentatiniai
![]()
Tetradentatiniai
![]()
Sudarant kompleksinio junginio pavadinim¹
pirmiausia raomas teigiamo po to neigiamo jono pavadinimas. Ligandų skaičiui
nurodyti vartojami graikiki priedėliai mono, di, tera ir t.t.
kompleksinio anijono, pvz. ![]() pavadinimas sudaromas taip: prie
kompleksadario (
pavadinimas sudaromas taip: prie
kompleksadario (![]() )
lotyniko pavadinimo ferum kamino pridedama galūnė atas.
Kompleksadario valentingumas ymimas pavadinimo gale romėniku skaitmeniu:
)
lotyniko pavadinimo ferum kamino pridedama galūnė atas.
Kompleksadario valentingumas ymimas pavadinimo gale romėniku skaitmeniu:
![]() -
kalio heksacionoferatas (II)
-
kalio heksacionoferatas (II)
![]() -
kalio heksacionoferatas (III)
-
kalio heksacionoferatas (III)
![]() -
natrio heksahidroksoaliuminatas (III)
-
natrio heksahidroksoaliuminatas (III)
Branduolinės reakcijos
Reakcijos kurių metu pakinta elemento atomo
branduolio sudėtis ir jis virsta kitu elementu vadinamos branduolinėmis.
Ispindulevźs a dalelź ![]() ,
radioaktyvaus elemento atomas virsta nauju elementu, kurio masės skaičius
maesnis keturiais vienetais, krūvio skaičius dviem. Radis ispindulevźs
a dalelź, tampa radonu.
,
radioaktyvaus elemento atomas virsta nauju elementu, kurio masės skaičius
maesnis keturiais vienetais, krūvio skaičius dviem. Radis ispindulevźs
a dalelź, tampa radonu.
![]()
Radioaktyviam elementui ispindulevus b dalelź (elektron¹ ![]() ),
atsiradusio elemento branduolio masės skaičius lieka tas pats, o
krūvio skaičius padidėja vienetu, nes elektronas atskyla i neutrono,
o jis virsta protonu:
),
atsiradusio elemento branduolio masės skaičius lieka tas pats, o
krūvio skaičius padidėja vienetu, nes elektronas atskyla i neutrono,
o jis virsta protonu: ![]() .
Pvz. toris ispindulevźs b dalelź, virsta protaktiniu.
.
Pvz. toris ispindulevźs b dalelź, virsta protaktiniu.
![]()
![]()
Radioaktyvieji elementai vienų spindulių neskleidia, - juos imeta kartu su a ir b spinduliais. Skylant radioaktyviems
elementams, susidaro nauji elementai. Pavyzdiui skylant ![]() , susidaro 15 naujų radioaktyvių
elementų, ir tik paskutinis i jų
, susidaro 15 naujų radioaktyvių
elementų, ir tik paskutinis i jų ![]() ,
yra neradioaktyvus. Visi ie elementai sudaro urano radioaktyvi¹j¹ eim¹.
,
yra neradioaktyvus. Visi ie elementai sudaro urano radioaktyvi¹j¹ eim¹. ![]()
Cheminių bei fizikinių procesų energetinius pokyčius,
jų kryptį bei vyksmo s¹lygas nagrinėja cheminė
termodinamika. Pirmasis pagrindinis termodinamikos dėsnis, nurodo, kad
sistemoje energija nesigamina ir neinyksta, bet tik vienor rūies
energija tiksliai ekvivalentiniu santykiu virsta kitos rūies energija.
Sistemos vidinė ir iorinė energija kartu sudaro pilnutinź energij¹,
vadinam¹ entalpija H. Taigi iluma yra entalpijos pokytis, (jei ji gaunama i
iorės, sistemos energija padidėja, jei isiskiria sumaėja).![]()
Ceminiai procesai
daniausiai yra izobariniai (izobarinis procesas jei nesikeičia sistemos
slėgis (p=constanta)), todėl jų iluminis efektas reikiamas
entalpijos pokyčiu ![]() .
Cheminių reakcijų lygtys, kuriose nurodyta reakcijos iluma,
vadinamos termocheminėmis lygtimis, o isiskirianti arba sunaudojama
iluma reakcijos iluminiu efektu. Reakcijos iluminis efektas priklauso nuo
reaguojančių mediagų ir reakcijos produktų agregatinės
būsenos, temperatūros, slėgio ir koncentracijos.
.
Cheminių reakcijų lygtys, kuriose nurodyta reakcijos iluma,
vadinamos termocheminėmis lygtimis, o isiskirianti arba sunaudojama
iluma reakcijos iluminiu efektu. Reakcijos iluminis efektas priklauso nuo
reaguojančių mediagų ir reakcijos produktų agregatinės
būsenos, temperatūros, slėgio ir koncentracijos.
Termochemijos dėsniai:
Lavuazjė ir Laplaso dėsnis teigia, kad junginio susidarymo iluma lygi jo skilimo į vienines mediagas, i kurių tas junginys sudarytas, ilumai, bet yra prieingo enklo. Vieninių junginių (pvz: CO , H2O) susidarymo ilum¹ galima rasti kalorimetru imatavus reakcujų ilum¹, pvz.:
![]() IR
IR ![]()
Heso dėsnis: reakcijos iluma priklauso tik nuo reaguojančių mediagų ir reakcijos produktų rūies, būsenos, net nepriklauso nuo reakcijos produktų susidarymo būdo. Pvz: degdama anglis gali i karto virsti anglies (IV) oksidu arba pirmiausiai virsti anglies (II) oksidu ir toliau anglies (IV) oksidu. Abiem atvejais reakcijos iluma vienoda.
![]()
![]() kj/mol
kj/mol
![]()
![]() kj/mol
kj/mol
![]()
![]()
čia: ![]() -
junginių entalpijos pokytis
-
junginių entalpijos pokytis
Antr¹jį termodinamikos dėsnį suformulavo Klauzijus: jokiais savaiminiais prcesais negalima alto kūno ilumos perduti iltesniam. Antras termodinamikos dėsnis nusako proceso kryptį t.y., nurodo iki kokios ribos procesas gali vykti savaime, nagaudamas energijos i aplinkos, ir kaip pasislinko sistemos pusiausvyra pakitus termodinaminėms s¹lygoms.
Entropija
Apie reakcijos
savaimingum¹ sprźsti i iluminio efekto (entalpijos pokyčio ![]() )
nagalime, nes savaime gali vykti tiek egzoterminės, tiek endoterminės
reakcijos. Reakcijų savaimingum¹ nusako antrasis termodinamokos
dėsnis.
)
nagalime, nes savaime gali vykti tiek egzoterminės, tiek endoterminės
reakcijos. Reakcijų savaimingum¹ nusako antrasis termodinamokos
dėsnis.
Mediagų
dalelėms būdinga kuo dugiau judėti, skaidytis, virsti
paprastesnėmis. Sistemos netvarkingumos matas yra entropija. Mediagų
entropija nustatoma eksperimentikai. Tai absoliutus dydis reikiamas
J/(mol*k). Mediagų entropija priklauso nuo temperatūros,
agregatinės būsenos. Kaitinamų mediagų entropija
didėja: kietų entropija didėja maiausiai, skystų
daugiau, dujinių daugiausiai. Entropija labai padidėja pereinant
mediagoms i kietos būsenos į skyst¹ ir ypač i skystos į
dujinź būsen¹. Prieingais atvejais mediagai autant, garams
kondencuojantis entropija maėja. Norint apskaičiuoti entropijos proceso
pokytį ![]() ,
i reakcijų produktų entropijų sumos atimama reaguojančių
mediagų entropijų suma:
,
i reakcijų produktų entropijų sumos atimama reaguojančių
mediagų entropijų suma:
![]()
apie ceminių mediagų entropijų pokytį (padidėja ar sumaėja) galima sprźsti i reakcijų tūrio pokyčio. Pvz:
![]()
![]()
![]()
Vykstant pirm¹jai tūris ir entropija padidėja (![]() teigiamas).
teigiamas).
Vykstant antr¹jai sumaėja (![]() neigiamas).
neigiamas).
Vykstant treči¹jai reakcijos tūris nekinta.
I entropijos pokyčio galima sprźsti apie savaiminio proceso kryptį.
Gibso energija
Procesuose pasireikia du
prieingi veiksmai: entalpinis ir entropinis; proceso kryptis priklauso nuo to,
kuris i ių veiksnių stipresnis. Pirmasis entalpinis, veiksnys
priverčia sistem¹ pereiti į būsen¹, kurioje jo vidinė energija
būtų maiausia. Kietų, kristalinių ir sudėtinių
mediagų molekulių vidinė energija meesnė nei itirpusių.
io veiksnio įtak¹ rodo entalpijos pokytis ![]() .
Antrasis entropinis veiksnys verčia sistemos mediagas labiau sklaidytis,
tapti paprastesnėmis (Pvz:
.
Antrasis entropinis veiksnys verčia sistemos mediagas labiau sklaidytis,
tapti paprastesnėmis (Pvz: ![]() ,
reakcija yra egzoterminė). Entalpinis veiksnys verčia susidaryti amoniak¹,
nes isiskiria energija ir reakcijos produkto amoniako, vidinė energija
maesnė negu reaguojančių mediagų (N2, H2).
,
reakcija yra egzoterminė). Entalpinis veiksnys verčia susidaryti amoniak¹,
nes isiskiria energija ir reakcijos produkto amoniako, vidinė energija
maesnė negu reaguojančių mediagų (N2, H2).
Izoliuotos sistemos vidinė energija susideda i pastovioje temperatūroje darbu paverčiamos leisvosios energijos ir pastovioje temperatūroje darbu paverčiamos suritosios energijos. Suritoji energija yra temperatūros ir entropijos sandauga (TS). Cheminiuose procesuose nustatomas tik izobarinio potencialo, arba Gibso energijos pokytis DG.
DG=DH-TDS
i lygtis ireikia bendr¹ entropijos ir entalpijos pokyčio įtak¹
cheminio proceso krypčiai. Jei DG<0, procesas gali vykti savaime, jei ![]() daugiau u 0, procesas savaime nevyksta. Jei
procese entropije didėja, tai TDS narys didėja, ir DG tampa vis labiau neigiamesnis. Auktoje temperatūroje gali vykti ir
endoterminiai procesai Pvz. vandens dujos susidaro reaguojant įkaitinant
angliai su vandens garais.
daugiau u 0, procesas savaime nevyksta. Jei
procese entropije didėja, tai TDS narys didėja, ir DG tampa vis labiau neigiamesnis. Auktoje temperatūroje gali vykti ir
endoterminiai procesai Pvz. vandens dujos susidaro reaguojant įkaitinant
angliai su vandens garais.
![]()
Kambario temperatūroje ios reakcijos entalpijos pokytis yra teigiamas (reakcija endoterminė).
DG gali būti ir neigiamas. Neigiama
reikmė rodo tik tai, kad procesas gali nevykti. Procesas gali nevykti,
nes reakcijos greitis tuomet yra labai maas. Reakcijai paspartinti naudojamas
katalizatorius. Apytiksliai apie proceso savaimingum¹ galima sprźsti i
standartinės Gibso energijos pokyčio ![]() ,
kuris apskaičiuojamas taip:
,
kuris apskaičiuojamas taip: ![]() .
Kai
.
Kai ![]() ,
procesas vyksta savaime ne tik standartinėmis, bet ir kitomis s¹lygomis.
Jei
,
procesas vyksta savaime ne tik standartinėmis, bet ir kitomis s¹lygomis.
Jei ![]() daugiau
nei 40 Kj/mol, procesas
nevyksta jokiomis s¹lygomis.
daugiau
nei 40 Kj/mol, procesas
nevyksta jokiomis s¹lygomis.
Svarbiausia metalų savybė yra ta, kad jie lengai oksiduojasi, ir virsta paprastais teigiamais jonais. I inomų 104 elementų 82 yra metalai. Technikoje metalais vadinamos mediagos, pasiyminčios laidumu elektrai, ilumai, kalumui ir kt. savybėmis.
Atsivelgiant į metalų tankį technikoje jie skirstomi į:
Lengvuosius (jei jų tankis maesnis nei 5000 kg. į kūbinį metr¹.) tai arminiai, emės arminiai metalai, berilis, aliuminis, titanas
Sunkiuosius (jei jū tankis didesnis nei 5000 kg. į kūbinį metra), sunkiausias
osmis 22700kg/m
Metalai skistomi į juoduosius (geleis bei jos lydiniai) ir spalvotuosius (varis bei jo lydiniai, bei kitus).
Visi metalai iskyrus gyvsidabrį kambario temeratūroje yra kietos kristalinės mediagos.
Metalams būdingos fizikinės savybės yra: laidumas elektrai, ilumai, blizgesys ir plastikumas. ios savybės aikinamos kristalo gardelės ir metalinės jungties ypatumais. Metalai laidūs elektrai, nes turi laisvų elektronų, kurie lengvai pereina i vieno atomo į kit¹. Todėl veikiami net ir nedidelės elektrovaros jėgos, elektronai teka prie teigiamo poliaus. Kylant temperatūrai, metalų laidumas elektrai maėja, nes kristalo gardelės mazguose metalo atomai, veikiami ilumos, pradeda stipriau vytuoti ir trugdo judėti elektronams. Mainant temperatūra metalų laidumas elektrai didėja. Esant artimai 0K temperatūrai, daugelio metalų vara visai inyksta. is reikinys vadinamas superlaidumu. Metalai yra pirmos rūies laidininkai, nes juose elektros srovź pernea elektronai.
Metalų iluminės savybės vertinamos jū specifine ir
sublimacijos iluma. Specifinė iluma - tai ilumos kiekis, kurį reikia
suteikti mediagai, norint jos masės vieneto temperatūr¹ pakelti
vienu laipsniu. Metalų specifinė iluma nedidelė meesnė
u ![]()
![]()
![]() ir įvairių metalų maai
tesiskiria. Metalų sublimacijos iluma ilumos kiekis,
reikalingas vieno molio metalo masei paversti dujomis, ji yra labai įvairi
pvz. francio sublimacijos iluma yra 72,8 kJ/mol. O volframo 836,8 kJ/mol. Metalų sublimacijos iluma
priklauso nuo kristalo gardelės patvarumo.
ir įvairių metalų maai
tesiskiria. Metalų sublimacijos iluma ilumos kiekis,
reikalingas vieno molio metalo masei paversti dujomis, ji yra labai įvairi
pvz. francio sublimacijos iluma yra 72,8 kJ/mol. O volframo 836,8 kJ/mol. Metalų sublimacijos iluma
priklauso nuo kristalo gardelės patvarumo.
Metalų magnetinės savybės yra nevienodos. Stipriai ysimagnetinantys (feromagnetiniai) metalai yra geleis, kobaltas, nikelis. Kiti metalai yra diamagnetiniai arba paramagnetiniai. Jū magnetinės savybės inyksta, nustojus veikti iorės magnetiniam laukui.
iorės magnetiniam laukui.
Geleis:
Geleis plastikas, sidabrikai baltas metalas. Gryna geleis ore
pakankamai pastovi, nes j¹ apsaugo oksidacinė plėvelė,
susidaranti i geleies (II ir III) oksido ![]() .
Įkaitinta Fe ore lengvai oksiduojasi.
.
Įkaitinta Fe ore lengvai oksiduojasi.
![]()
![]()
Auktoje temperatūroje geleį oksiduoja vandens garai, tuo metu isiskiria H2
![]()
Kambario temperatūroje geleies paviriuje susidaro rūdys. Su druskos ir sieros rūgtimis geleis lengvai oksiduojasi.
![]()
Koncentruotoje azoto rūgtyje geleis pasidaro pasyvi nes jos paviriuje susidaro Fe3O4 apsauginė plėvelė. Geleies (II) hidroksidas gaunamas, veikiant Fe (II) druskų tirpalus armais:
![]()
Geleies (II) hidroksidas gaunamas, kai nėra tirpale deguonies pėdsakų. Tai balta mediaga. Supilant tirpalus kuriuose yra itirpusio deguonies, gaunamas alias hidroksidas. Jis pasiymi bazinėmis savybėmis ir tirpsta rūgtyje, sudarydamas Fe(II) druskas. Fe (III) hidroksidas gaunamas veikiant (III) druskų tirpalų armais. Jis rudos spalvos ir vandenyje netirpsta.
![]()
dvivalentis Fe druskos gaunamas tirpinant Fe rūgtyje be oksidatorių
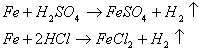
taip pat ir laikant Fe (III) druskų tirpstant su metaline geleimi
![]()
geleies (III) druskos gaunamos:
1. tirpstant Fe(OH3) rūgtyje.
![]()
2. Fe(II) druskas oksiduojant oksidatoriumi
![]()
bevandeniai Fe halogenidai gaunami metaline geleį halogeno atmosferoje
naudojimas:
gryna geleis minktas metalas todėl pramonėje nenaudoja, daniau naudojamas Fe lydiniai kuriuose yra ketaus i plieno. I ketaus liejami įvairūs liejiniai. I kietųjų plienų gaminami įrankiai, spyruoklės ir detalės, kurios turi būti kietos ir atsparios sudidėvėjimui.
Plienas su specialiais metalais vadinamas legiruotu. Legiruoto plieno gamyba mūsų alyje nuolat plečiama, nes i jų pagamintos konstrukcijos ir mainos esti tvirtos ir ilgai nenusidėvi.
Tai lengvas, sidabrikai baltos spalvos metalas. Vykstant cheminėms reakcijoms kalcio valentiniai elektronai pereina į kitų elementų atomus. Tada susidaro du krūvius turintys jonai Ca labai aktyviai reaguoja su metalais, ypač su deguonimi. Ore jis lečiau oksiduojasi, negu arminiai metalai nes jų oksidų plėvelė maiau praleidia deguionį. Kaitinamas kalcis sudega ir isisikiria milinikas ilumos kiekis.
![]()
cia reaguoja su vandeniu isstumdamas
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2405
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved