| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Componentele catenei respiratorii bacteriene
Catena respiratorie bacteriana este alcatuita din componente transportoare de e-, asociate membranei si diverticulilor ei. Catena indeplineste doua functii :
accepta e- de la un donor si-i transfera la un acceptor
conserva o parte a E eliberate in timpul transferului de e-, pentru sinteza ATP. Cantitatea mare de energie produsa in respiratie rezulta din transportul e- din catena, de la un component cu un nivel energetic inalt, la unul cu nivel energetic mai scazut. Energia este captata in legaturi macroergice prin combinarea P anorganic cu ADP, cu formarea ATP. Procesul se numeste fosforilare oxidativa
Componentele catenei sunt reduse de forma redusa a purtatorului anterior si sunt oxidate de forma oxidata a componentului urmator.
Catena poate fi impartita in trei segmente functionale, al caror potential redox creste de la flavoproteine, pana la citocrom-oxidaza terminala.
Intrarea protonilor (H+) in catena respiratorie are loc la nivelul primului segment functional format din urmatoarele componente:
dehidrogenazele cu nucleu piridinic (NAD sau NADP) sunt asociate fetei interne a membranei celulare. NAD functioneaza ca purtator de e- in reactiile catabolice, iar NADP functioneaza in reactiile de biosinteza fixatoare ale CO2. Ele accepta atomi de H generati in diferite reactii celulare si ii transfera la flavoproteine. Coenzima redusa (NADH), formata prin oxidarea glucozei, este reoxidata si H+ este transferat la grupul prostetic al flavoproteinelor (FMN);
dehidrogenazele cu nucleu flavinic(un derivat al riboflavinei), FAD si FMN.
Flavoproteinele sunt proteine care contin un derivat al riboflavinei(vitamina B2). Portiunea flavinica, legata de o proteina, este grupul prostetic care accepta atomi de H si se reduce sau doneaza e- si se oxideaza. {n celule se gasesc 2 flavine: FMN si FAD.
proteine nehemice cu Fe-S. S-au identificat la Cl. pasteurianum si functioneaza ca transportori de e- pentru ca sufera tranzitii reversibile Fe2+- Fe3+. Sunt foarte electronegative (-0,49 V) si contin o grupare prostetica alcatuita din Fe nehemic si S acidolabil, care formeaza aglomerari dimerice (Fe-S)2 sau mai frecvent, tetramerice (Fe-S)4, legate de resturile de cisteina ale proteinei. Potentialul redox al proteinelor Fe- S variaza mult in functie de numarul atomilor de Fe si S si de modul de legare de proteine. De aceea, proteinele Fe-S pot functiona in diferite puncte ale catenei transportoare de e-. Ca si citocromii, proteinele Fe-S transporta numai e-.
Al II-lea segment functional este constituit dintr-o familie de molecule chinonice liposolubile, denumite lipoquinone sau coenzime Q.
Quinonele (ubiquinona = CoQ) sunt molecule foarte hidrofobe, solubile in lipide si au rol in transportul e-. Unele sunt inrudite cu vitamina K (un factor de crestere al animalelor superioare). Ca si flavoproteinele, quinonele functioneaza ca acceptori de H+ si ca donori de e-. Quinonele difuzeaza liber prin membrane si transporta e- de la proteinele cu Fe-S, la citocromi. Coenzimele Q sunt adevaratele navete transportoare de e- , intre flavoproteinele reduse (FMNH) si citocromii oxidati.
Al III-lea segment functional al lantului respirator este format din citocromi.
![]() Citocromii sunt proteine de care se
ataseaza inelul porfirinic cu Fe - hemul, ca grup prostetic. {n
centrul grupului prostetic se
gaseste un atom de Fe. Gruparea prostetica se numeste hem, daca Fe este in stare
redusa (Fe2+) sau hemina,
daca Fe este oxidat (Fe3+). Functia redox este intim
legata de schimbarea valentei Fe hemic (citocrom-Fe2+ citocrom-Fe3+ + e-).
Citocromii transporta numai e- si se
gasesc numai in celulele aerobe.
Citocromii bacterieni functioneaza in transportul fotosintetic al e-
si in respiratia aeroba, cuplata cu oxidarea substratului
redus (substante organice, H2, S redus sau metale). Citocromii
au rolul de a transporta e- la alt citocrom cu potential redox
mai pozitiv, pana la acceptorul
final. Diferitii citocromi sunt desemnati prin litere: a, b, c. Citocromul terminal al catenei
de respiratie - a 3 (citocrom-oxidaza)
contine Cu. Citocromii unui organism pot sa difere de ai altora
si variantele sunt desemnate a1, a2, aa3
etc.
Citocromii sunt proteine de care se
ataseaza inelul porfirinic cu Fe - hemul, ca grup prostetic. {n
centrul grupului prostetic se
gaseste un atom de Fe. Gruparea prostetica se numeste hem, daca Fe este in stare
redusa (Fe2+) sau hemina,
daca Fe este oxidat (Fe3+). Functia redox este intim
legata de schimbarea valentei Fe hemic (citocrom-Fe2+ citocrom-Fe3+ + e-).
Citocromii transporta numai e- si se
gasesc numai in celulele aerobe.
Citocromii bacterieni functioneaza in transportul fotosintetic al e-
si in respiratia aeroba, cuplata cu oxidarea substratului
redus (substante organice, H2, S redus sau metale). Citocromii
au rolul de a transporta e- la alt citocrom cu potential redox
mai pozitiv, pana la acceptorul
final. Diferitii citocromi sunt desemnati prin litere: a, b, c. Citocromul terminal al catenei
de respiratie - a 3 (citocrom-oxidaza)
contine Cu. Citocromii unui organism pot sa difere de ai altora
si variantele sunt desemnate a1, a2, aa3
etc.
Deoarece respiratia are loc in membrana citoplasmatica, citocromii sunt adeseori localizati in acest compartiment, dar se gasesc si in spatiul periplasmic, unde functia lor de transfer al e- este legata cu a citocromilor membranari. Citocromii diferitelor organisme pot sa difere intre ei si sunt desemnati a1, a2, aa3 etc.
Proteinele componente ale citocromilor sunt desemnate prin litere, urmate de un indice sau prin cifre, care indica lungimea de unda a spectrului lor maxim de absorbtie.
NADH si coenzimele Q transporta e- sub forma atomilor de H, iar citocromii transporta e- ca atare. Nu transporta protoni (H+). La trecerea in citocromi, H+ trece in citosol si va fi extras in treapta finala reducerii O2, cu formarea apei.
Citocromul terminal, care are rolul unei enzime finale acceptoare de e- se numeste citocrom-oxidaza. Este singura proteina capabila sa transfere e- la O2 molecular, dupa reactia:
![]()
Toate proteinele catenei sunt situate in membrana citoplasmatica a celulei bacteriene. Unele sunt agregate in grupari functionale complexe.
Reducerea unei molecule de O2 la H2O necesita 4 e-. Reducerea O2 cu un singur e- produce O2- (radicalul superoxid), iar reducerea cu 2 e- produce H2O2, ambii avand efecte distructive.
Catena de respiratie celulara este formata din proteine transmembranare, incluse in stratul lipidic si expun domenii pe ambele fete ale membranei. Transportorii de e- sunt astfel orientati in membrana incat, in timpul transportului realizeaza o separare a protonilor de e-.
Curgerea e- prin sistemul de transport poate fi considerata ca o cascada cu mai multe trepte. La fiecare treapta, energia electronilor este captata enzimatic si folosita pentru a forma molecula de ATP din ADP + Pi. In cele mai multe transferuri de energie se elibereaza cantitati mici, dar trei dintre ele elibereaza catitati mari de energie utilizata pentru sinteza ATP.
Atomii de H, la nivelul transportorilor specifici (NADH, NADPH), pe fata interna a membranei, sunt disociati in protoni (H+) si e-. Electronii se intorc pe fata citoplasmatica a membranei prin transportorii specifici (citocromii), iar protonii sunt eliminati la exteriorul celulei Gram pozitive si produc o usoara acidificare a mediului extern sau in spatiul periplasmic al bacteriilor Gram negative.
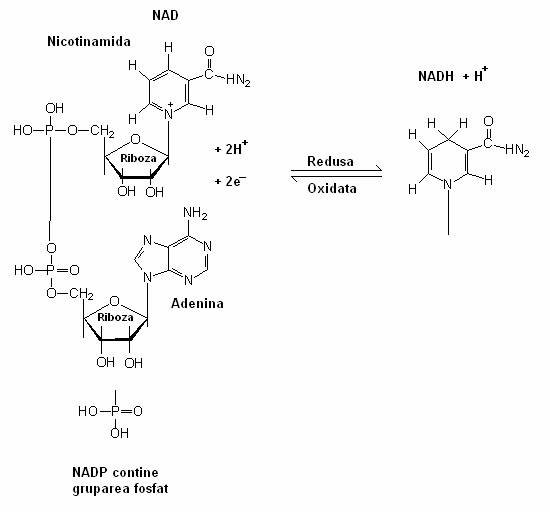
Fig. 53. Structura coenzimei NAD+ si NADP+.
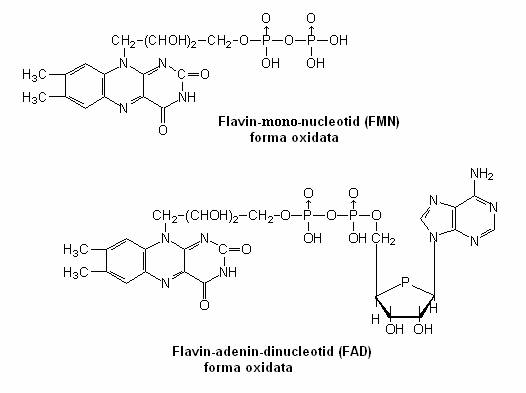
Structura FMN si FAD.
La capatul catenei de
respiratie celulara, e- reduc acceptorul final (O2).
O2 redus necesita H+ din citoplasma pentru
formarea apei. H+ citosolic provine din disocierea apei in H+ si
Excesul de H+ pe fata externa confera
membranei o sarcina neta
pozitiva in raport cu fata
interna. Rezultatul net al
distributiei asimetrice a acestor ioni este generarea unui gradient de pH
si a unui potential electric de membrana (potential
electrochimic). Fata interna a
membranei are sarcina negativa si este alcalina,
datorita ionilor
Transportul e- la O2, aparent produce H2O, dar de fapt, prin disocierea H2O, produce H+ si OH-, care se concentreaza pe cele doua fete ale membranei.
Diferenta de pH si de potential electrochimic de pe cele doua fete determina o stare energizata a membranei, asemenea unei baterii, care se masoara in volti si se exprima ca forta proton motrice.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2058
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved