| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
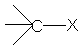
Compusi halogenati
Definitie: Compusii halogenati sunt compusi organici in care atomul de halogen este legat covalent de atomul de carbon
Formula generala este: R - X sau Ar - X
Clasificare:
a) dupa natura radicalului hidrocarbonat: b) dupa natura atomului de carbon:
- saturati CH3-Cl; - primari R-CH2-X;
-
nesaturati ![]() -
secundari R2CH-X;
-
secundari R2CH-X;
- aromatici C6H5-Cl - tertiari R3C-X;
c) dupa numarului atomilor de X: - mono CH3Cl;
- poli CCl4.
La derivatii halogenati aromatici si nesaturati apar pozitii deosebite de care trebuie sa tinem cont:
R-CH=CH-CH2-X CH2=CH-X C6H5-X C6H5-CH2-X
halogen alilic halogen vinilic halogen aromatic halogen benzilic
Nomenclatura:
Regula: Numele compusilor halogenati se formeaza prin adaugarea numelui halogen, ca prefix la numele hidrocarburii. Se utilizeaza si o alta nomenclatura in care molecula compusului halogen este considerata ca o halogenura a restului hidrocarbonat.
* La derivatii halogenati nesaturati este prioritara dubla legatura si nu halogenul.
|
clormetan clorura de metil |
|
3-clorpropena clorura de alil |
CH3-Cl ![]()
|
1,1-dicloretan gem-dicloretan |
|
1,2-dicloretan vic-dicloretan (derivat vicinal) |
![]()
![]()
*gem - geminali la acelasi atom de carbon
1,3-brom clor propan
(citire in ordine alfabetica)
![]() 1-brom-3-clorpropan
1-brom-3-clorpropan
Structura. Proprietati caracteristice.
 Legatura C-X se formeaza prin
intrepatrunderea unui orbital p al atomului de halogen cu un orbital de
legatura sp3, sp2 al unui atom de carbon.
Legatura C-X se formeaza prin
intrepatrunderea unui orbital p al atomului de halogen cu un orbital de
legatura sp3, sp2 al unui atom de carbon.
Legaturile sunt de tip s C-X sp3(sp2, sp) - pz. Sunt legaturi polare
Principalele caracteristici ale legaturii covalente C-X variaza astfel:
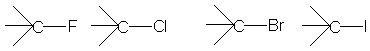
lungimea ![]()
energia ![]()
reactivitatea ![]()
polaritatea ![]()
polarizabilitatea ![]()
Dupa hidrocarburi, derivatii halogenati sunt cei mai importanti compusi organici datorita reactivitatii lor ridicate si participarii la numeroase reactii chimice sau transformari chimice.
Reactivitatea depinde, pe langa natura atomului de halogen, si de pozitia atomului de halogen in catena (vezi proprietati chimice).
Proprietati fizice
Stare de agregare: Derivatii halogenati alchilici sunt gazosi, lichizi sau solizi. Cei aromatici monohalogenati sunt lichizi, iar cei polihalogenati sunt solizi. Sunt toxici, iar cei benzilici sunt lacrimogeni.
Sunt insolubili in apa si solubili in solventi organici, fiind la randul lor buni solventi. Au densitatea mai mare decat 1 g/cm3.
Proprietati chimice
Reactivitatea derivatilor halogenati depinde de:
- natura halogenului (I>Br>Cl>F)
- pozitia atomului de halogen in catena:
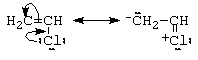
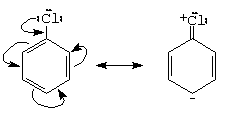
a.- halogenul vinilic si arilic au reactivitate scazuta (se realizeaza o legatura cu un partial caracter de legatura dubla)
b.- halogenul legat la un atom de carbon hibridizat sp3 prezinta reactivitate normala
c.- halogenul alilic si cel benzilic au reactivitate marita (se realizeaza intermediari stabilizati prin conjugare)
|
|
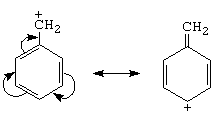
A. Reactii comune tuturor derivatilor halogenati
a.- reactia de reducere
![]()
Are loc in medii reducatoare (H2 in prezenta de metale, LiAlH4 sau Na in alcool etilic).
b.- reactia cu metale
![]()
![]()
B. Reactii specifice derivatilor halogenati cu reactivitate marita si normala (vezi reactivitatea)
|
R-X + |
Nucleofil |
Produsi de reactie |
|
X'- |
derivat halogenat (schimb de halogen) |
|
|
H2O (-OH) |
alcooli (aldehide, cetone, acizi) |
|
|
ROH (-OR) |
eteri |
|
|
H2S (HS-) |
tioli |
|
|
RSH (-SR) |
tioeteri |
|
|
NH3 |
amine primare |
|
|
RNH2 |
amine secundare |
|
|
R2NH |
amine tertiare |
|
|
R3N |
saruri cuaternare de amoniu |
|
|
CN |
cianuri |
|
|
CsCH |
alchine |
|
|
HC(COOR)2 |
ester alchil-malonic |
|
|
|
ester alchil-acetil-acetic |
|
|
NO2 |
R-NO2 (SN1) nitroderivat |
|
|
R-O-NO (SN2) nitrit de alchil |
Reprezentanti.
CH3-Cl - bun agent frigorific;
CH2Cl2 - bun solvent;
CHCl3 - anestezic in medicina;
CCl4 - solvent si stingator de incendii;
CHI3 - dezinfectant in medicina;
CH3-CH2-Cl - agent de etilare si anestezic in medicina
CH2Cl-CH2Cl - foarte bun solvent, si este folosit la prepararea clorurii de vinil
C6H5-Cl - folosit in industria de medicamente, coloranti si la prepararea D.D.T.-ului
(diclordifeniltricloretan);
C6H6Cl6 izomerul g - insecticid (lindan sau gamexan);
CF2Cl2 (freon) - agent frigorific;
CF2=CF2 - folosit la sinteza teflonului;
CH2=CH-Cl - folosit la sinteza P.V.C. (policlorura de vinil)
CH2=CCl-CH=CH2 - folosit la obtinerea cauciucului cloroprenic.
Compusi hidroxilici
Compusii hidroxilici sunt compusii organici care contin gruparea OH (combinatii olice). Dupa tipul de hibridizare a atomului de carbon la care este grefata gruparea OH, compusii hidroxilici se clasifica in:
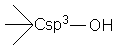
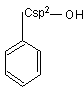
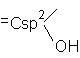 Alcooli Fenoli Enoli
Alcooli Fenoli Enoli
Alcooli
Definitie Sunt compusi hidroxilici la care gruparea OH este legata de un Csp3 apartinand unui rest hidrocarbonat saturat, nesaturat sau unei catene laterale a unei arene.
Clasificare:
- saturati CH3-OH;
Dupa natura radacinii hidrocarbonat: - nesaturati CH2=CH-CH2OH;
- aromatici C6H5-CH2OH
- primari R-CH2-OH;
Dupa natura atomului de carbon: - secundari R2CH-OH;
- tertiari R3C-OH.
Dupa numarul gruparilor OH: - alcool monohidroxilici CH3-OH
- alcool polihidroxilici CH2 - CH2
| |
OH OH
Regula: Numele alcoolilor se formeaza prin adaugarea sufixului ol sau al prefixului hidroxi la numele hidrocarburii de baza.
![]()
![]() Pentru unii compusi simpli se
utilizeaza si o nomenclatura mai veche, in care cuvantul alcool
este urmat de numele radicalului hidrocarburii la care s-a adaugat sufixul
ic.
Pentru unii compusi simpli se
utilizeaza si o nomenclatura mai veche, in care cuvantul alcool
este urmat de numele radicalului hidrocarburii la care s-a adaugat sufixul
ic.
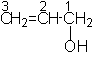
CH3OH metanol 2-propen 1-ol
hidroximetan alcool alilic
alcool metilic (carbinol)
* OH-ul este prioritar fata de dubla legatura.
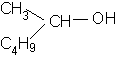 Unii alcooli cu structura mai
complexa se considera ca produsi de substitutie ai
metanolului (carbinolului).
Unii alcooli cu structura mai
complexa se considera ca produsi de substitutie ai
metanolului (carbinolului).
butil metil carbinol
butil metil metanol
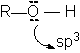 Structura.
Proprietati caracteristice.
Structura.
Proprietati caracteristice.
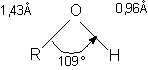
In alcooli, ca si in apa, atomul de oxigen hibridizat sp3 formeaza covalentele:
leg sO-R sp3 - sp3
leg sO-H sp3 - s
Legaturile sunt orientate dupa colturile unui tetraedru regulat. Ambele covalente sunt polare, atomul de oxigen mai electronegativ are polaritate negativa.
Proprietati caracteristice
1. Polarizarea covalentei O-H face ca intre moleculele de alcool sa se stabileasca legaturi de hidrogen, punti de hidrogen, realizandu-se asociatii moleculare de tipul (R-OH)n. Valoarea n depinde de structura alcoolului ( n - numarul de molecule asociate) si variaza astfel:
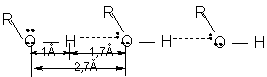
![]()
legatura covalenta legatura H legatura van der Waals
Energie (kcal/mol) 50 100 5 0,05 - 0,5
Legaturile de hidrogen nu modifica proprietatile chimice ale substantei, Ele se manifesta asupra anumitor proprietati fizice, de exemplu: punctele de fierbere ale alcoolilor sunt anormal de ridicate.
2. Polarizarea covalenta O-H imprima alcoolilor un caracter slab acid (cedare de H+ in prezenta metalelor reactive).
Ka = 10-16 10-18 pKa = 16 18
KaR OH < KaH-OH
+Is Is = 0
re- creste; aciditatea scade; re- - densitatea electronica pe gruparea OH.
3. Prezenta dubletului electronic neparticipant la atomul de oxigen imprima alcoolului caracter bazic:
![]()
KbR OH > KbH-OH
densitatea electronica creste; bazicitatea creste
Alcoolul are un caracter amfoter (este un amfolit ca apa).
I. Alcooli monohidroxilici
Proprietati fizice
Alcoolii inferiori sunt lichizi, iar cei superiori sunt solizi.
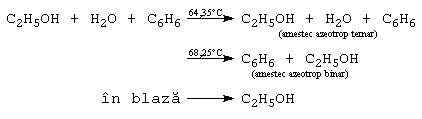
Alcoolii inferiori sunt solubili in apa, solubilitatea scazand cu cresterea catenei. Cei superiori sunt solubili in solventi organici. Au puncte de fierbere anormal de ridicate, datorita puntilor de hidrogen dintre molecule. Alcoolii inferiori formeaza amestecuri azeotrope cu apa (ex: etanolul formeaza un azeotrop cu 96% etanol si 4% apa, cu punctul de fierbere de 78,1C). Anhidrizarea etanolului se poate face folosind substante reactive, avide de apa, ca de exemplu CaO sau CaC2, sau utilizand o componenta ternara (benzen).
Proprietati chimice
Se
disting doua tipuri de reactii in care se scindeaza
legatura: ![]() .
.
Reactii cu scindari de covalente O-H
A. Formarea alcoxizilor. Caracterul slab acid.
Din cauza polarizarii covalentei O-H, alcoolii au un slab caracter acid. Solutiile apoase au pH = 7 si nu vireaza indicatorii. Hidrogenul este substituit in reactii cu metale reactive sau cu hidruri: Na, Li, K, NaH, LiH, KH.
![]()
![]()
Aceste reactii sunt mai putin violente decat cele cu apa. Aciditatea scade in serie. Protonul mai poate fi cedat si in alte reactii:
![]()
![]()
Alcoxizii sunt substante ionice care regenereaza alcoolul in reactia cu apa.
![]()
B. Oxidarea alcoolilor
![]()
![]()
![]()
In laborator, reactia se realizeaza cu K2Cr2O7 sau KMnO4 in mediu acid sau CrO3 in mediu de piridina (Py) sau CH3COOH. In industrie se foloseste cataliza eterogena, care se obtine in prezenta de Cu sau CuO, la temperatura de 300C.
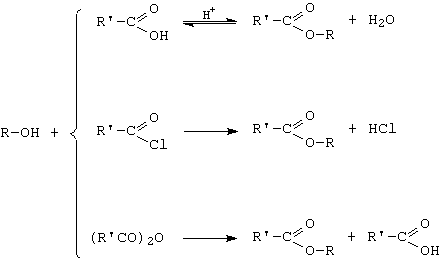
C. Esterificarea
Reactii cu scindarea covalentei R-OH
A. Reactia de substitutie a grupei OH cu hidracizi sau halogenuri anorganice
![]()
Afinitatea halogenilor si a alcoolilor creste in sensul Cl < Br < I, respectiv alcool primar < secundar < tertiar.
![]()
![]()
![]()
B. Reactia de deshidratare
a.- deshidratare intramoleculara conduce la alchene.
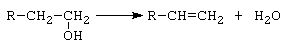
Reactia are loc in cataliza omogena (H2SO4 la temperaturi peste 150C), dar in industrie se foloseste pentru cataliza Al2O3 la 300 - 400C.
b.- deshidratarea intermoleculara conduce la eteri
![]()
Reactia se realizeaza in prezenta de H2SO4, la temperaturi sub 150C, iar in industrie, Al2O3 la 200 - 300C. Mecanismul reactiei este SN1 sau SN2, in functie de alcool.
Reprezentanti
a) prin distilarea uscata a lemnului. Produsii distilarii sunt:
- gaz combustibil (CO2, CO, CH4, C2H4);
- acid pirolignos cu 1-2% metanol care se separa prin distilare fractionata
- mangal "otet de lemn", "carbune de lemn".
b) prin sinteza din gazul de sinteza
![]() CO + 2H2 CH3OH conditii: ZnO + Cr2O3;
350C; 250 atm
CO + 2H2 CH3OH conditii: ZnO + Cr2O3;
350C; 250 atm
Este un lichid incolor, p.f. = 65C, putere calorica 7500 kcal/kg; este foarte toxic!!!, in cantitati
mici provoaca orbirea; 0,15 g/kg - doza letala.
Intrebuintari se foloseste:
- ca solvent
- ca materie prima la prepararea formaldehidei, clorurii de metil, a sulfatului de metil, a esterilor;
- ca intermediar in industria colorantilor
- la denaturarea alcoolului etilic.
Etanolul: CH3-CH2-OH se obtine:
a) prin fermentatia glucidelor sub actiunea ciupercilor microscopice din drojdia de bere: Saccharomyces cerevisiae
![]() C6H12O6 2C2H5OH + 2CO2
C6H12O6 2C2H5OH + 2CO2
- se obtine un lichid apos care contine 12-18% etanol care prin distilare conduce la alcool de 96%.
b) prin hidratarea etenei:
![]() CH2 = CH2 +
HOH CH3-CH2-OH conditii H3PO4/Al2O3;
250-300C; 70-80 atm.
CH2 = CH2 +
HOH CH3-CH2-OH conditii H3PO4/Al2O3;
250-300C; 70-80 atm.
c) prin reducerea aldehidei acetice obtinuta din reactia Kucerov
![]()
![]() CH s CH + H2O CH3-CH=O CH3-CH2-OH
CH s CH + H2O CH3-CH=O CH3-CH2-OH
Este
un lichid incolor, cu gust arzator, miros caracteristic, p.f. = 78C; ![]() .
.
Intrebuintari:
- ca solvent pentru lacuri, vopsele, compusi macromoleculari, I, P, hidroxizi alcalini, la precipitarea proteinelor;
- in industria chimica pentru sinteza clorurii de etil, esterilor, eterilor, a butadienei, in industria colorantilor, a medicamentelor,
- la prepararea bauturilor alcoolice.
In cantitati mici este stupefiant provocand euforie; in cantitati mai mari este toxic.
1-Propanol (alcool propilic) - se gaseste in reziduri de la distilarea etanolului si se foloseste ca solvent.
Alcool izopropilic (2 propanol) - se obtine prin hidratarea propenei si se foloseste la sinteza acetonei si ca solvent.
Alcoolul benzilic C6H5-CH2OH, p.f. = 206C se gaseste in uleiul de iasomie.
2-Feniletanolul C6H5-CH2-CH2OH, p.f. = 219C, componenta a uleiului de trandafir se foloseste in parfumerie.
II. Alcooli polihidroxilici
Proprietati fizice: marirea numarului gruparilor OH duce la cresterea solubilitatii, alcoolii transformandu-se in lichide vascoase, cu gust dulce. Dispare de asemenea mirosul caracteristic.
Proprietati chimice
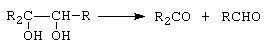
Alcoolii polihidroxilici prezinta toate reactiile alcoolilor monohidroxilici. Aciditatea este mai mare, putand reactiona cu hidroxizi de Pb si Ca, formand saruri insolubile. Covalenta HO-C-C-OH este labila, putandu-se scinda usor in reactiile de oxidare.
|
Conditii: Pb(OAc)4, HIO4. |
Reprezentanti
Etandiolul (glicolul) este obtinut prin hidratarea oxidului de etena
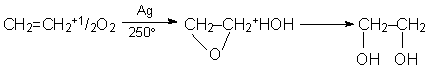
Este un lichid vascos, cu gust dulceag, utilizat ca antigel si in industria componentelor macromoleculare la sinteza polietilentereftalatului (tergal).
Glicerina (1,2,3-propantriol) - se obtine din propena sau din saponificarea grasimilor;
Este un lichid vascos, cu gust dulce, utilizat in: farmacie si cosmetica, in industria pielariei si textila, la sinteza explozibililor, in industria compusilor macromoleculari (gliptali folositi la obtinerea rasinilor utilizate la fabricarea lacurilor si vopselelor).
Tetrolii, pentolii si hexitolii obtinuti prin reducerea glucidelor sunt solizi, cristalini, cu gust dulce.
Fenoli. Hidroxiarene
Definitie: Compusii hidroxilici in care gruparea OH este grefata pe un nucleu aromatic.
Clasificare si nomenclatura:
Dupa numarul gruparilor OH grefate la nucleu, fenolii se clasifica in:
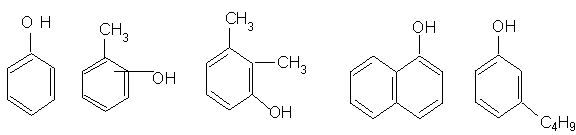 a) monohidroxilici
a) monohidroxilici
fenol o, m, p-crezoli 1,2,3 xilenol a - naftol m-butil fenol
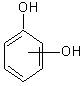
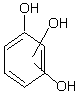
b) polihidroxilici
1,2-pirocatechina 1,2,3-pirogalol
1,3-rezorcina 1,2,4-hidroxihidrochinona
1,4-hidrochinona 1,3,5-floroglucina
Structura. Proprietati caracteristice:
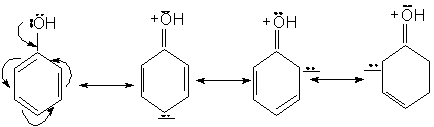
Fenolul poate fi reprezentat prin urmatoarele structuri limita. Intre e- neparticipanti ai oxigenului si e-p ai nucleului are loc o conjugare in urma careia atomul de oxigen se pozitiveaza, iar nucleul se imbogateste in electroni.
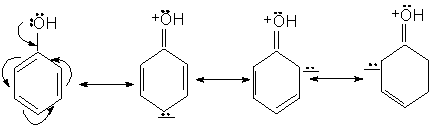
Consecinte:
Densitatea electronica la gruparea OH scade, deci aciditatea grupei creste.
Densitatea electronica la nucleu creste, deci reactivitatea nucleului in S.E. creste si orientarea are loc in pozitiile orto si para.
Proprietati caracteristice:
a) Aciditatea pKa = 10 (aciditatea marita fata de alcooli)
![]() Ka R OH < Ka
Ka R OH < Ka
(Ka = 10-16) (Ka = 10-10)
ArOH + H2O ArO- + H3O+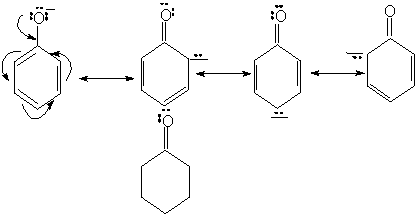
Aciditatea marita a
fenolului se explica si prin faptul ca ionizarea genereaza
un anion fenoxid stabilizat prin conjugare, echilibrul reactiei de
ionizare fiind deplasat mai spre dreapta comparativ cu alcoolii.
![]()
Aciditatea fenolului este influentata si de natura substituentilor grefati la nucleu. Gruparile puternic atragatoare de electroni maresc aciditatea (sarcina pozitiva a gruparii OH este mai mare si anionul realizat este mai stabilizat). De exemplu: 2,4,6-trinitrofenol (acid picric) pKa = 0,25
b) Reactivitatea in substitutia electrofila, S.E. mai mare ca a benzenului, din cauza densitatii electronice marite a nucleului si orientarea are loc in pozitiile orto si para.
Proprietati fizice:
Sunt substante solide. Comparativ cu alcoolii, solubilitatea in apa este mai scazuta (7,6% fenolul, 2% crezolul). Fenolii polihidroxilici sunt mai solubili. Toti fenolii sunt solubili in solventi organici.
|
|
|
pf.o-nitrofenol pf. p-nitrofenol = 295 |
Punctele de fierbere sunt mari din cauza puntilor de hidrogen mai puternice decat ale alcoolilor (ex: ciclohexanolul are punctul de fierbere de 161C, iar fenolul de 182C).
Fenolul se gaseste sub forma de cristale incolore caustice, higroscopice (se transforma intr-o solutie cu continut de 8% H2O), capabile de autooxidare.
Anumiti fenoli pot forma legaturi chelatice, care duc la modificarea valorii punctului de fierbere.
Proprietati chimice
I. Reactii specifice grupei OH
A. Formarea fenoxizilor. Aciditatea fenolilor
![]()
Anionul fenoxid este o baza mai slaba decat anionul HO- si refacerea fenolului din fenoxizi are loc cu acizi mai tari decat fenolul.
![]()
B. Formarea eterilor
![]()
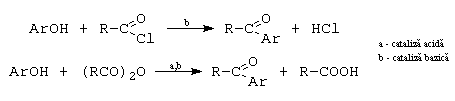
C. Formarea esterilor. Acilarea fenolilor.
Acilarea se face doar cu cloruri acide si anhidride acide. Reactia decurge mai usor daca se
folosesc fenoxizi.
II. Reactii specifice nucleului aromatic (S.E.). Reactiile decurg mai usor decat la benzen, cu orientare orto, para.
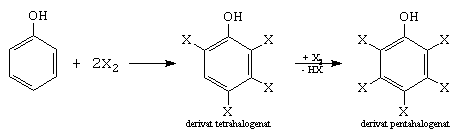
A. Halogenarea
a.- Reactia decurge astfel in solventi nepolari si la rece (X=Cl, Br).

b.- Reactia se realizeaza in prezenta de AlCl3
c.- Reactia cu solutie apoasa de brom.
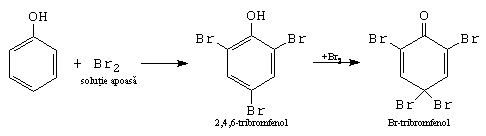
Este o reactie cantitativa, folosita la dozarea fenolului.
B. Sulfonarea
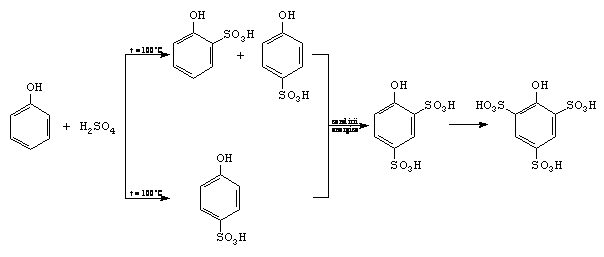
Atunci cand temperatura mediului de reactie este sub 100C, se realizeaza un control cinetic, iar cand temperatura depaseste 100C se realizeaza un control termodinamic.
C. Nitrozarea.
Se face cu acid azotos, in mediu de acid mineral, reactantul fiind ionul nitrozoniu care este un electrofil slab care nu ataca nucleul benzenului (vezi 5.6.4).
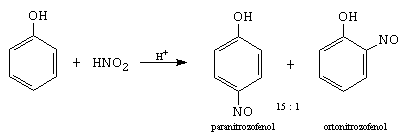
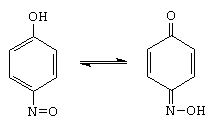
verde benzenchinonoxima (galbena)
D. Nitrarea
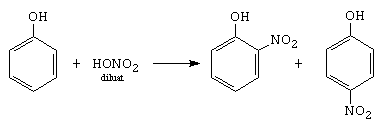
o-nitrofenol p-nitrofenol
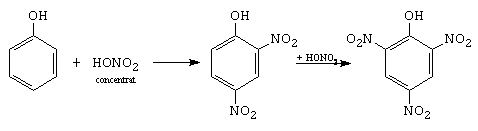
2,4-dinitrofenol 2,4,6-trinitrofenol
Mecanismul este diferit fata de nitrarea benzenului. In HNO3 exista acidul azotos, care nitrozeaza fenolul, formand un nitrozoderivat, care in prezenta acidului azotic se oxideaza la nitroderivat.
E. Alchilarea fenolului
Reactia se poate realiza cu alchene, alcooli sau derivati halogenati.
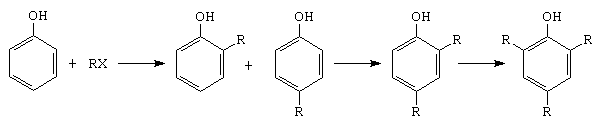
F. Azocuplarea
Fenolul, in prezenta ionului de diazoniu, genereaza, prin reactia de cuplare, coloranti azoici (vezi 5.6.2).
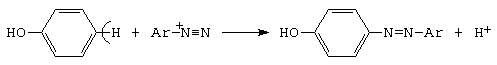
![]()
III. Alte reactii
A. Reactii de aditie. Hidrogenarea
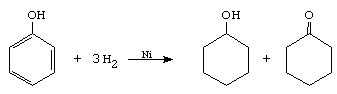
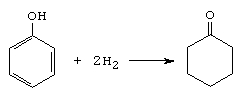
La reactia de hidrogenare totala a fenolului, in prezenta de Ni la 180 , se obtin doar cantitati mici de ciclohexanona, produsul principal de reactie fiind ciclohexanolul.
B. Reactii de culoare. Reactia cu solutie apoasa de FeCl3
Fenolii dau coloratii diferite cu solutie apoasa de FeCl3, datorita formarii unui cation colorat.
![]()
Cationul colorat in acest exemplu este C6H5-OFe2+. Fenolul da o coloratie rosie-violeta, crezolii albastra, pirocatechina verde.
Reprezentanti:
Fenolul - substanta solida, cristalina, autooxidabila (cristalele incolore se inrosesc in aer), higroscopica. Este solubil in alcool, glicerina, eter si benzen, in orice proportie. Este toxic si caustic. Se foloseste in industria colorantilor si industria fenoplastelor si are actiune antiseptica.
Pirocotechina se foloseste in industria farmaceutica, are actiune antiseptica.
Crezolii au actiune antiseptica, se folosesc sub forma de emulsie cu o solutie de sapun in apa.
Pirogalolul are caracter reducator puternic si este folosit la dozarea oxigenului.
Hidrochinona este folosita ca revelator foto.
O-fenil fenolul este folosit ca si conservant al citricelor.
Timolul si carvacrolul sunt componente ale uleiului de cimbru, folosit in lambriaza. Carvacrolul se gaseste si in uleiul de chimion.
Naftolii sunt folositi in industria colorantilor.
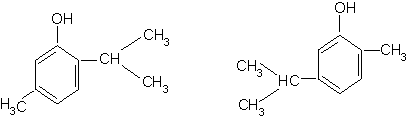
Timol Carvacrol
Derivati functionali ai compusilor hidroxilici
Eterii
Definitie: Eterii provin prin eliminarea reala sau formala a unei molecule de apa intre doi compusi hidroxilici. Pot fi considerati ca derivati ai apei in care cei doi atomi de hidrogen sunt inlocuiti (formal) cu radicali organici.
![]() Clasificare:
Clasificare:
Eteri: - aciclici: R - O - R - ciclici:
Eterii aciclici
Nomenclatura: Se folosesc denumiri
- stiintifice considerandu-i ca hidrocarburi substituite cu radicali ORsau OAr
- uzuale: radicali alchili + eter;
- comune.
CH3-O-CH3 - metoximetan, dimetil eter, eter metilic;
CH2=CH-O-CH3 - metoxietena, metil vinil eter;
C6H5-O-CH3 - metoxibenzen, fenil metil eter, anisol;
C6H5-OC2H5 - etoxibenzen, fenetol.
Eterii naftalinei se numesc neroline.
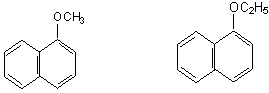
nerolina noua nerolina
Structura. Proprietati caracteristice.
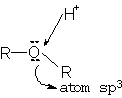
Radicalii
organici sunt legati de atomul de oxigen hibridizat sp3 prin
legaturi s care formeaza intre ele unghiuri de 110 -
112. Eterii au momentul electric diferit de zero:![]() .
.
|
Prezenta dubletului electronic neparticipant la atomul de oxigen imprima eterului caracter bazic mai accentuat ca al alcoolului.
|
Proprietati fizice:
stare de agregare eterul metilic (primul termen gaz; p.f. = -24), restul lichizi;
punctele de fierbere ale eterilor sunt mai mici
decat ale alcoolilor (nu au punti de hidrogen); substante usor
volatile; ![]() 35C;
35C;
solubilitate: insolubile in apa, solubile in solventi organici; eterul etilic are 10% solubilitate in H2O; sunt solventi buni;
au miros placut eterat;
sunt autooxidabili in aer (eterul etilic absolut se pastreaza pe sarma de sodiu).
Reprezentanti:
Eterul etilic: - p.f. = 35C, miros eterat;
- folosit ca solvent, mediu de reactie si narcotic.
Anisol si fenetol: - folositi in industria de medicamente si coloranti;
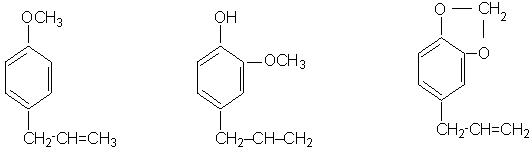 In natura, in
uleiurile vegetale, in uleiurile eterice se gasesc mai multi eteri
fenolici, de obicei metili eteri, cu miros placut de flori si sunt
utilizati in parfumerie.
In natura, in
uleiurile vegetale, in uleiurile eterice se gasesc mai multi eteri
fenolici, de obicei metili eteri, cu miros placut de flori si sunt
utilizati in parfumerie.
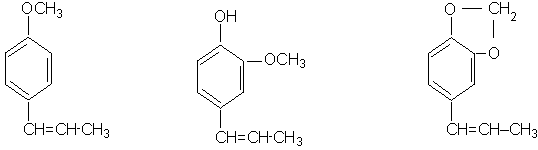 estragol eugenol safrol
estragol eugenol safrol
anetol izoeugenol izosafrol
Nerolina si noua nerolina se folosesc in parfumerie datorita mirosului de flori de portocal si salcam.
Un eter fenolic cu structura complicata este lignina, componenta care insoteste celuloza in lemn.


 Eterii ciclici:
Eterii ciclici:
etilenoxid THF oxan dioxan
(epoxi etan) (tetrahidrofuran) THP
oxid de etena tetrametilenoxid tetrahidropiran
oxolan pentametilenoxid
Primul termen este gazos, ceilalti lichizi.
THF si THP sunt solubili in apa, alcooli, eter, in orice proportie, iar dioxanul si in benzen. Se folosesc ca solventi si ca medii de reactie avand inertie chimica.
Etilenoxidul
are o reactivitate foarte ridicata, dand reactii de aditie, cu
deschideri de ciclu, reactii de etoxilare (aceasta comportare este
caracteristica tuturor epoxizilor, care au tensiune ridicata in ciclu
de trei atomi).
Compusi carbonilici
Compusii carbonilici sunt compusi organici ce contin gruparea functionala bivalenta carbonil,
Gruparea carbonil
genereaza doua functiuni organice:![]()
![]()
si
![]()
aldehida cetona
Nomenclatura:
Regula: Numele aldehidelor se formeaza prin adaugarea sufixului al la numele hidrocarburii cu acelasi schelet, prin adaugarea cuvantului aldehida inaintea numelui acidului cu aceeasi structura sau prin adaugarea sufixului aldehida la radacina numelui acidului. Numele cetonelor se formeaza prin adaugarea sufixului ona la numele hidrocarburii cu acelasi schelet sau din numele celor doi radicali legati de grupa carbonil urmat de cuvantul cetona.
![]()
![]()
![]()
![]()
![]() metanal
fenil metanol propanona
metanal
fenil metanol propanona
![]() aldehida
formica aldehida benzoica acetona
aldehida
formica aldehida benzoica acetona
formaldehida benzaldehida dimetil cetona
![]()
![]()
![]()
![]()
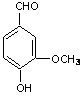
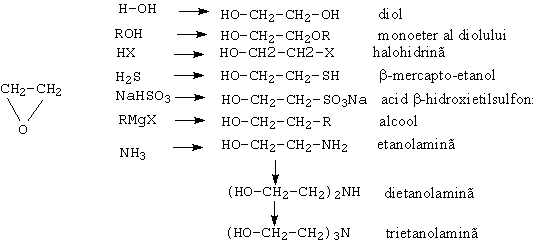
![]()
fenil metil cetona difenil cetona 4 hidroxi 3 metoxi
acetofenona benzofenona benzaldehida
(vanilina)
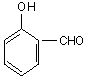
![]()
ortohidroxibenzaldehida
aldehida salicilica
Clasificare:
1. Compusi monocarbonilici saturati;
2. Compusi dicarbonilici saturati;
3. Compusi carbonilici nesaturati.
Compusi monocarbonilici saturati
Structura. Proprietati caracteristice:
Grupa carbonil contine o legatura dubla intre un atom de carbon hibridizat sp2 si un atom de oxigen nehibridizat.
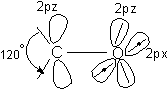
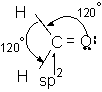
leg sC-O sp2 - 2py
nehibridizat leg pC-O 2pz - 2pz
Gruparea carbonil este o grupare divalenta plana cu unghiul 120 intre covalente. Distanta C = O este 1,21A. Energia legaturii duble C = O este de 176 - 179 kcal.mol-1 mai mare decat dublu legaturii C-O (12x85,5), deci legatura C = O este o legatura puternica.
Proprietati caracteristice:
![]() 1. Polaritate: Gruparea carbonil este formata din 2 atomi cu
electronegativitati diferite ceea ce duce la un dezechilibru electric
al sarcinilor si la formarea unui dipol.
1. Polaritate: Gruparea carbonil este formata din 2 atomi cu
electronegativitati diferite ceea ce duce la un dezechilibru electric
al sarcinilor si la formarea unui dipol.
![]()
![]()
structura fundamentala
xO > xC
mC=O = 2,8D are valoare mai mare decat mC-O = 1,3D.
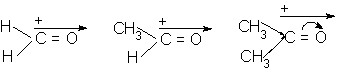 Momentul de dipol depinde de natura
radicalilor grefati la grupare.
Momentul de dipol depinde de natura
radicalilor grefati la grupare.
m = 2,29D m = 2,69D m = 2,97D
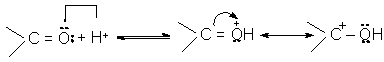 2. Bazicitatea. Datorita polaritatii sale negative
si a prezentei electronilor neparticipanti, atomul de oxigen al
grupei C=O are caracter slab bazic. Bazicitatea gruparii carbonil se
manifesta in reactiile catalizate de acid.
2. Bazicitatea. Datorita polaritatii sale negative
si a prezentei electronilor neparticipanti, atomul de oxigen al
grupei C=O are caracter slab bazic. Bazicitatea gruparii carbonil se
manifesta in reactiile catalizate de acid.
ion oxoniu ion hidroxicarboniu
3. Acidifierea hidrogenului din pozitia a fata de gruparea carbonil
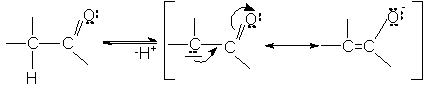 Atomii de hidrogen din pozitia a invecinata cu
grupa carbonil, au caracter slab acid. Gruparea carbonil are un efect
acidifiant asupra acestor protoni. Explicatia: se realizeaza un anion
enolat stabilizat prin conjugare.
Atomii de hidrogen din pozitia a invecinata cu
grupa carbonil, au caracter slab acid. Gruparea carbonil are un efect
acidifiant asupra acestor protoni. Explicatia: se realizeaza un anion
enolat stabilizat prin conjugare.
pKa = 19.
4. Grupare nesaturata care participa la reactii de aditie nucleofila, A.N. Acestea pot sa decurga in doua moduri:
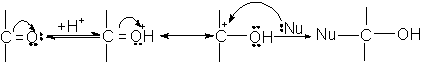
Reactivitatea compusilor carbonilici in A.N. depinde de structura lor.
Proprietati fizice:
Starea de agregare: aldehida formica este gaz, ceilalti termeni sunt lichizi sau solizi.
Punctele de fierbere sunt mai mici ca ale alcoolilor cu acelasi numar de atomi de carbon (nu sunt punti de hidrogen).
Solubilitatea termenilor inferiori este mare in apa; solubilitatea scade cu cresterea catenei.
|
|
Formaldehida si acetaldehida au miros dezagreabil. Multe aldehide si cetone au mirosuri placute, caracteristice, fiind utilizate in parfumerie.
Proprietati chimice:
Compusii
carbonilici pot participa la urmatoarele tipuri de reactii
I. Reactii de aditie
Compusii carbonilici participa la reactii de aditie nucleofila, reactii reversibile cu formare de derivati functionali ai compusilor carbonilici si de compusi cu importanta practica.
|
Reactant |
Tipul reactiei |
Produs de reactie |
|
H2O (H-OH) |
|
|
|
R-OH |
|
|
|
HSH |
|
|
|
HX |
|
|
|
CH3-COOH |
|
|
|
HCN |
|
|
|
NaHSO3 |
|
|
|
R-MgX |
|
|
II. Reactii de condensare
Condensarile sunt reactii intre o componenta carbonilica (ce participa cu gruparea carbonil) si o componenta metilenica, care participa cu gruparea metil, metilen sau metin din pozitia a fata de o grupare puternic acidifianta, care exercita efecte atragatoare de electroni (-CO, -COOH, -COOR, -NO2, -CN).
Condensarile decurg dupa trei scheme:
A. Condensarea aldolica: - reprezinta aditia componentei metilenice la componenta carbonilica, cu formarea unei functiuni mixte (aldol sau cetol).
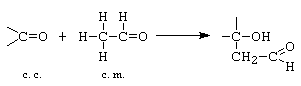
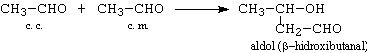
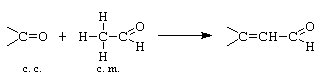
B. Condensarea crotonica: - decurge cu eliminare de apa intre componenta carbonilica si cea metilenica, cu formarea unui compus carbonilic a b - nesaturat. Crotonizarea decurge prin deshidratarea intramoleculara a aldolului sau cetolului format.
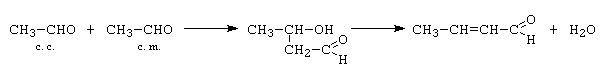
C. Condensarea trimoleculara: - se realizeaza cu participarea a trei componente (1 c. c. + 2 c. m. sau 2 c. c. + 1 c. m.)
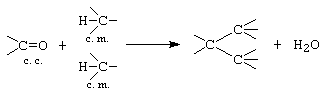
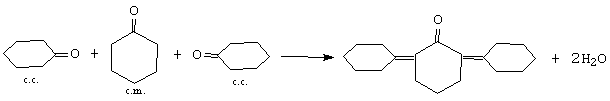
Din condensarea trimoleculara a ciclohexanonei se formeaza 2,6 diciclohexilenciclohexanona.
Condensarile aldolice si crotonice pot decurge in cataliza acida sau bazica
Tipuri de condensari:
A. Condensarea compusilor carbonilici intre ei
a.- aldehida + aldehida - este o reactie fara importanta practica, deoarece produsii de reactie sunt amestecuri de aldoli. Reactia devine practica atunci cand una din aldehide poate functiona doar ca si componenta carbonilica. De exemplu:
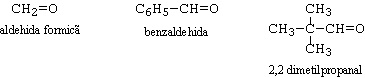
b.- aldehida + cetona. Reactia decurge in conditii mai drastice decat cele de la cazul a.-, si de obicei se obtin crotonii (produsii de crotonizare). Aldehida functioneaza ca si componenta carbonilica, iar cetona ca si componenta metilenica.
c.- cetona + cetona. In urma acestei reactii se obtin doar produsii de crotonizare, deoarece conditiile de reactie sunt energice.
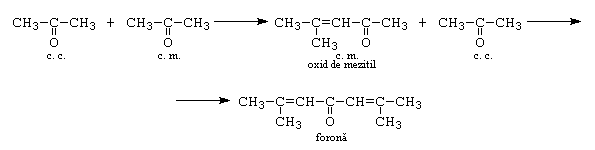
B. Condensarea cu derivati functionali ai acizilor carboxilici:
a.- condensarea Perkin: este condensarea cu anhidrida acetica (la reactie participa doar aldehide aromatice si aldehide alifatice neenolizabile).
![]()
b.- condensarea Claisen: se realizeaza cu esteri
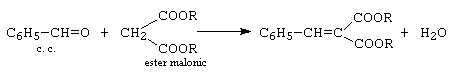
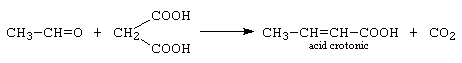
c.- condensarea Knoevenagel: reprezinta condensarea decarboxilanta cu acid malonic si o dau aldehidele alifatice enolizabile.
E. Condensari cu fenoli. Pot decurge in cataliza bazica, cand fenolul se transforma in fenoxid (reactant nucleofil) si aditioneaza la compusul carbonilic, sau in cataliza acida, cand compusul carbonilic se transforma in reactant electrofil care ataca fenolul, dand produsi de substitutie electrofila. Compusii intermediari formati dau prin policondensare fenoplaste, compusi cu rezistenta mecanica mare si proprietati izoelectrice.
De exemplu: 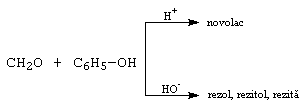
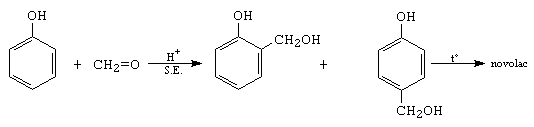
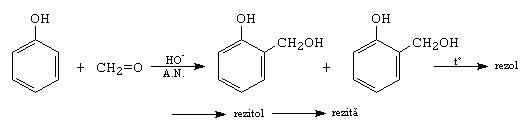
F. Condensarea cu compusi cu azot. Compusii de forma NH2-X, reactanti bazici, aditioneaza nucleofil la compusii carbonilici in cataliza acida.
|
Reactanti |
Produsi de reactie |
|
H2N-H (amoniac) |
>C=N-H (imina) |
|
H2N-R (amina) |
>C=N-R (baza Schiff, imina substituita) |
|
H2N-OH (hidroxilamina) |
>C=N-OH (oxima) |
|
H2N-NH2 (hidrazina) |
>C=N-NH2 (hidrazona) |
|
H2N-NH-C6H5 (fenilhidrazina) |
>C=N-NH-C6H5 (fenilhidrazona) |
|
H2N-NH-CO-NH2 (semicarbazida) |
>C=N-NH-CO-NH2 (semicarbazona) |
Cateva din condensarile prezentate sunt utilizate pentru identificarea compusilor carbonilici, obtinandu-se derivati cu proprietati caracteristice.
III. Reactii de oxidare
A. Oxidarea aldehidelor
a.- oxidarea cu sisteme oxidante. Se realizeaza cu diferite sisteme oxidante, ca de exemplu: K2Cr2O7/H+, KMnO4/H+, Ag+ (reactiv Tollens), Cu2+ (reactiv Fehling). Este o reactie de identificare a aldehidelor.
![]()
b.- autooxidarea aldehidelor. Aldehidele, sub actiunea oxigenului din aer si a energiei luminoase sau a promotorilor, genereaza printr-o reactie homolitica acizii cu acelasi numar de atomi de carbon. Reactia este utilizata industrial.
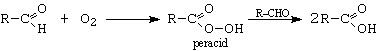
B. Oxidarea cetonelor
a.- cetonele se oxideaza degradativ la acizi cu numar mai mic de atomi de carbon (vezi oxidarea alcoolilor secundari).
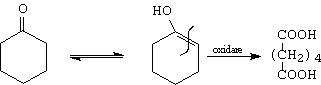
b.- cetonele enolizabile se oxideaza la acizi cu acelasi numar de atomi de carbon. Industrial, se foloseste oxidarea ciclohexanonei la acid adipic.
c.- a-metil-cetonele dau in mediu bazic, in prezenta de hipoclorit de sodiu (NaOCl), o reactie haloforma.
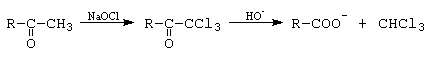
IV. Reactii de reducere
A. Aldehidele si cetonele se reduc la alcoolii primari sau secundari corespunzatori, cu hidrogen molecular in prezenta de Ni, cu hidrogen atomic din sistemul reducator Na/C2H5OH sau cu LiAlH4.
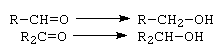
B. In prezenta sistemului reducator Zn/HCl, cetonele se reduc la hidrocarburile corespunzatoare.
![]()
Reprezentanti:
Aldehida formica se obtine din oxidarea metanolului; este un gaz solubil in apa. Solutia apoasa 40%, formol, este folosita la conservarea preparatelor anatomice. Are proprietati toxice puternice pentru microorganisme si de aceea se foloseste ca dezinfectant. Se foloseste in sinteze chimice la obtinerea de fenoplaste (condenseaza cu fenol), ureoplaste (condenseaza cu uree), in industria colorantilor si a medicamentelor (de exemplu urotropina).
Aldehida acetica se obtine prin reactia Kucerov (hidratarea acetilenei); este un lichid cu miros de mere verzi p.f. = 21C. Se foloseste la sinteza alcoolului etilic prin reducere, a acidului acetic prin oxidare, la sinteza butanolului.
Acetona se obtine prin oxidarea cumenului sau a alcoolului izopropilic. Este un lichid cu p.f. = 56C; miscibil cu apa in orice proportie; este un solvent foarte bun (pentru acetilena, pentru nitratii si acetatii de celuloza). Se foloseste in sinteze chimice (cloroform, sticla plexi, cetena).
Aldehida benzoica se obtine prin hidroliza clorurii de benziliden. Este lichid incolor, uleios, p.f. = 180C. Se gaseste in samburii de migdale amare (are miros de migdale amare) fiind folosita in parfumerie. Se mai foloseste in sinteze (acid cinamic) si la obtinerea unor coloranti. Aldehidele cu C8-10 se gasesc in uleiurile eterice de lamaie, de trandafir si sunt folosite in parfumerie.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 11269
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved