| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Compusi hidroxilici
Compusii hidroxilici sunt compusii organici care contin gruparea OH (combinatii olice). Dupa tipul de hibridizare a atomului de carbon la care este grefata gruparea OH, compusii hidroxilici se clasifica in:
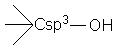
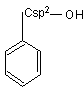
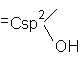 Alcooli Fenoli Enoli
Alcooli Fenoli Enoli
Alcooli
Definitie Sunt compusi hidroxilici la care gruparea OH este legata de un Csp3 apartinand unui rest hidrocarbonat saturat, nesaturat sau unei catene laterale a unei arene.
Clasificare:
- saturati CH3-OH;
Dupa natura radacinii hidrocarbonat: - nesaturati CH2=CH-CH2OH;
- aromatici C6H5-CH2OH
- primari R-CH2-OH;
Dupa natura atomului de carbon: - secundari R2CH-OH;
- tertiari R3C-OH.
Dupa numarul gruparilor OH: - alcool monohidroxilici CH3-OH
- alcool polihidroxilici CH2 - CH2
| |
OH OH
Regula: Numele alcoolilor se formeaza prin adaugarea sufixului ol sau al prefixului hidroxi la numele hidrocarburii de baza.
![]()
![]() Pentru unii compusi simpli se
utilizeaza si o nomenclatura mai veche, in care cuvantul alcool este urmat de
numele radicalului hidrocarburii la care s-a adaugat sufixul ic.
Pentru unii compusi simpli se
utilizeaza si o nomenclatura mai veche, in care cuvantul alcool este urmat de
numele radicalului hidrocarburii la care s-a adaugat sufixul ic.
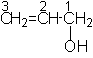
CH3OH metanol 2-propen 1-ol
hidroximetan alcool alilic
alcool metilic (carbinol)
* OH-ul este prioritar fata de dubla legatura.
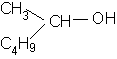 Unii alcooli cu structura mai
complexa se considera ca produsi de substitutie ai metanolului (carbinolului).
Unii alcooli cu structura mai
complexa se considera ca produsi de substitutie ai metanolului (carbinolului).
butil metil carbinol
butil metil metanol
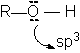 Structura.
Proprietati caracteristice.
Structura.
Proprietati caracteristice.
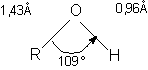
In alcooli, ca si in apa, atomul de oxigen hibridizat sp3 formeaza covalentele:
leg sO-R sp3 - sp3
leg sO-H sp3 - s
Legaturile sunt orientate dupa colturile unui tetraedru regulat. Ambele covalente sunt polare, atomul de oxigen mai electronegativ are polaritate negativa.
Proprietati caracteristice
1. Polarizarea covalentei O-H face ca intre moleculele de alcool sa se stabileasca legaturi de hidrogen, punti de hidrogen, realizandu-se asociatii moleculare de tipul (R-OH)n. Valoarea n depinde de structura alcoolului ( n - numarul de molecule asociate) si variaza astfel:
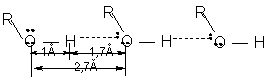
![]()
legatura covalenta legatura H legatura van der Waals
Energie (kcal/mol) 50 100 5 0,05 - 0,5
Legaturile de hidrogen nu modifica proprietatile chimice ale substantei, Ele se manifesta asupra anumitor proprietati fizice, de exemplu: punctele de fierbere ale alcoolilor sunt anormal de ridicate.
2. Polarizarea covalenta O-H imprima alcoolilor un caracter slab acid (cedare de H+ in prezenta metalelor reactive).
Ka = 10-16 10-18 pKa = 16 18
KaRàOH < KaH-OH
+Is Is = 0
re- creste; aciditatea scade; re- - densitatea electronica pe gruparea OH.
3. Prezenta dubletului electronic neparticipant la atomul de oxigen imprima alcoolului caracter bazic:
![]()
KbRà OH > KbH-OH
densitatea electronica creste; bazicitatea creste
Alcoolul are un caracter amfoter (este un amfolit ca apa).
I. Alcooli monohidroxilici
Proprietati fizice
Alcoolii inferiori sunt lichizi, iar cei superiori sunt solizi.
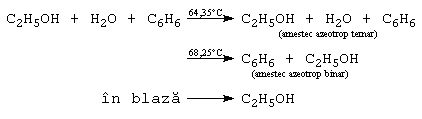
Alcoolii inferiori sunt solubili in apa, solubilitatea scazand cu cresterea catenei. Cei superiori sunt solubili in solventi organici. Au puncte de fierbere anormal de ridicate, datorita puntilor de hidrogen dintre molecule. Alcoolii inferiori formeaza amestecuri azeotrope cu apa (ex: etanolul formeaza un azeotrop cu 96% etanol si 4% apa, cu punctul de fierbere de 78,1C). Anhidrizarea etanolului se poate face folosind substante reactive, avide de apa, ca de exemplu CaO sau CaC2, sau utilizand o componenta ternara (benzen).
Proprietati chimice
Se
disting doua tipuri de reactii in care se scindeaza legatura: ![]() .
.
Reactii cu scindari de covalente O-H
A. Formarea alcoxizilor. Caracterul slab acid.
Din cauza polarizarii covalentei O-H, alcoolii au un slab caracter acid. Solutiile apoase au pH = 7 si nu vireaza indicatorii. Hidrogenul este substituit in reactii cu metale reactive sau cu hidruri: Na, Li, K, NaH, LiH, KH.
![]()
![]()
Aceste reactii sunt mai putin violente decat cele cu apa. Aciditatea scade in serie. Protonul mai poate fi cedat si in alte reactii:
![]()
![]()
Alcoxizii sunt substante ionice care regenereaza alcoolul in reactia cu apa.
![]()
B. Oxidarea alcoolilor
![]()
![]()
![]()
In laborator, reactia se realizeaza cu K2Cr2O7 sau KMnO4 in mediu acid sau CrO3 in mediu de piridina (Py) sau CH3COOH. In industrie se foloseste cataliza eterogena, care se obtine in prezenta de Cu sau CuO, la temperatura de 300C.
C. Esterificarea
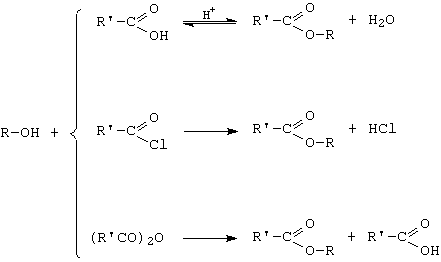
Reactii cu scindarea covalentei R-OH
A. Reactia de substitutie a grupei OH cu hidracizi sau halogenuri anorganice
![]()
Afinitatea halogenilor si a alcoolilor creste in sensul Cl < Br < I, respectiv alcool primar < secundar < tertiar.
![]()
![]()
![]()
B. Reactia de deshidratare
a.- deshidratare intramoleculara conduce la alchene.
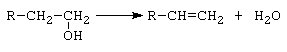
Reactia are loc in cataliza omogena (H2SO4 la temperaturi peste 150C), dar in industrie se foloseste pentru cataliza Al2O3 la 300 - 400C.
b.- deshidratarea intermoleculara conduce la eteri
![]()
Reactia se realizeaza in prezenta de H2SO4, la temperaturi sub 150C, iar in industrie, Al2O3 la 200 - 300C. Mecanismul reactiei este SN1 sau SN2, in functie de alcool.
Reprezentanti
a) prin distilarea uscata a lemnului. Produsii distilarii sunt:
- gaz combustibil (CO2, CO, CH4, C2H4);
- acid pirolignos cu 1-2% metanol care se separa prin distilare fractionata
- mangal "otet de lemn", "carbune de lemn".
b) prin sinteza din gazul de sinteza
![]() CO + 2H2 CH3OH conditii: ZnO + Cr2O3;
350C; 250 atm
CO + 2H2 CH3OH conditii: ZnO + Cr2O3;
350C; 250 atm
Este un lichid incolor, p.f. = 65C, putere calorica 7500 kcal/kg; este foarte toxic!!!, in cantitati
mici provoaca orbirea; 0,15 g/kg - doza letala.
Intrebuintari se foloseste:
- ca solvent
- ca materie prima la prepararea formaldehidei, clorurii de metil, a sulfatului de metil, a esterilor;
- ca intermediar in industria colorantilor
- la denaturarea alcoolului etilic.
Etanolul: CH3-CH2-OH se obtine:
a) prin fermentatia glucidelor sub actiunea ciupercilor microscopice din drojdia de bere: Saccharomyces cerevisiae
![]() C6H12O6 2C2H5OH + 2CO2
C6H12O6 2C2H5OH + 2CO2
- se obtine un lichid apos care contine 12-18% etanol care prin distilare conduce la alcool de 96%.
b) prin hidratarea etenei:
![]() CH2 = CH2 +
HOH CH3-CH2-OH conditii H3PO4/Al2O3;
250-300C; 70-80 atm.
CH2 = CH2 +
HOH CH3-CH2-OH conditii H3PO4/Al2O3;
250-300C; 70-80 atm.
c) prin reducerea aldehidei acetice obtinuta din reactia Kucerov
![]()
![]() CH º CH + H2O CH3-CH=O CH3-CH2-OH
CH º CH + H2O CH3-CH=O CH3-CH2-OH
Este
un lichid incolor, cu gust arzator, miros caracteristic, p.f. = 78C; ![]() .
.
Intrebuintari:
- ca solvent pentru lacuri, vopsele, compusi macromoleculari, I, P, hidroxizi alcalini, la precipitarea proteinelor;
- in industria chimica pentru sinteza clorurii de etil, esterilor, eterilor, a butadienei, in industria colorantilor, a medicamentelor,
- la prepararea bauturilor alcoolice.
In cantitati mici este stupefiant provocand euforie; in cantitati mai mari este toxic.
1-Propanol (alcool propilic) - se gaseste in reziduri de la distilarea etanolului si se foloseste ca solvent.
Alcool izopropilic (2 propanol) - se obtine prin hidratarea propenei si se foloseste la sinteza acetonei si ca solvent.
Alcoolul benzilic C6H5-CH2OH, p.f. = 206C se gaseste in uleiul de iasomie.
2-Feniletanolul C6H5-CH2-CH2OH, p.f. = 219C, componenta a uleiului de trandafir se foloseste in parfumerie.
II. Alcooli polihidroxilici
Proprietati fizice: marirea numarului gruparilor OH duce la cresterea solubilitatii, alcoolii transformandu-se in lichide vascoase, cu gust dulce. Dispare de asemenea mirosul caracteristic.
Proprietati chimice
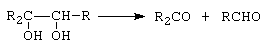
Alcoolii polihidroxilici prezinta toate reactiile alcoolilor monohidroxilici. Aciditatea este mai mare, putand reactiona cu hidroxizi de Pb si Ca, formand saruri insolubile. Covalenta HO-C-C-OH este labila, putandu-se scinda usor in reactiile de oxidare.
|
Conditii: Pb(OAc)4, HIO4. |
Reprezentanti
Etandiolul (glicolul) este obtinut prin hidratarea oxidului de etena
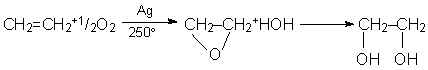
Este un lichid vascos, cu gust dulceag, utilizat ca antigel si in industria componentelor macromoleculare la sinteza polietilentereftalatului (tergal).
Glicerina (1,2,3-propantriol) - se obtine din propena sau din saponificarea grasimilor;
Este un lichid vascos, cu gust dulce, utilizat in: farmacie si cosmetica, in industria pielariei si textila, la sinteza explozibililor, in industria compusilor macromoleculari (gliptali folositi la obtinerea rasinilor utilizate la fabricarea lacurilor si vopselelor).
Tetrolii, pentolii si hexitolii obtinuti prin reducerea glucidelor sunt solizi, cristalini, cu gust dulce.
Fenoli. Hidroxiarene
Definitie: Compusii hidroxilici in care gruparea OH este grefata pe un nucleu aromatic.
Clasificare si nomenclatura:
Dupa numarul gruparilor OH grefate la nucleu, fenolii se clasifica in:
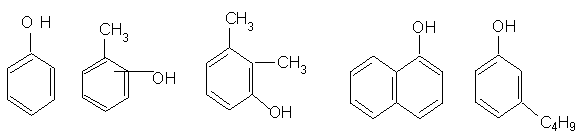 a) monohidroxilici
a) monohidroxilici
fenol o, m, p-crezoli 1,2,3 xilenol a - naftol m-butil fenol
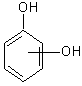
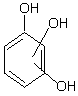
b) polihidroxilici
1,2-pirocatechina 1,2,3-pirogalol
1,3-rezorcina 1,2,4-hidroxihidrochinona
1,4-hidrochinona 1,3,5-floroglucina
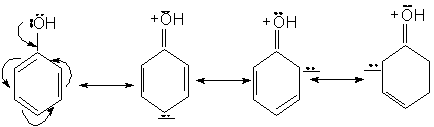
Structura. Proprietati caracteristice:
Fenolul poate fi reprezentat prin urmatoarele structuri limita. Intre e- neparticipanti ai oxigenului si e-p ai nucleului are loc o conjugare in urma careia atomul de oxigen se pozitiveaza, iar nucleul se imbogateste in electroni.
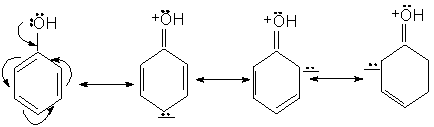
Consecinte:
Densitatea electronica la gruparea OH scade, deci aciditatea grupei creste.
Densitatea electronica la nucleu creste, deci reactivitatea nucleului in S.E. creste si orientarea are loc in pozitiile orto si para.
Proprietati caracteristice:
a) Aciditatea pKa = 10 (aciditatea marita fata de alcooli)
![]() Ka R à OH < Ka
Ka R à OH < Ka
(Ka = 10-16) (Ka = 10-10)
ArOH + H2O ArO- + H3O+
Aciditatea marita a fenolului se
explica si prin faptul ca ionizarea genereaza un anion fenoxid stabilizat prin
conjugare, echilibrul reactiei de ionizare fiind deplasat mai spre dreapta
comparativ cu alcoolii.
![]()
Aciditatea fenolului este influentata si de natura substituentilor grefati la nucleu. Gruparile puternic atragatoare de electroni maresc aciditatea (sarcina pozitiva a gruparii OH este mai mare si anionul realizat este mai stabilizat). De exemplu: 2,4,6-trinitrofenol (acid picric) pKa = 0,25
b) Reactivitatea in substitutia electrofila, S.E. mai mare ca a benzenului, din cauza densitatii electronice marite a nucleului si orientarea are loc in pozitiile orto si para.
Proprietati fizice:
Sunt substante solide. Comparativ cu alcoolii, solubilitatea in apa este mai scazuta (7,6% fenolul, 2% crezolul). Fenolii polihidroxilici sunt mai solubili. Toti fenolii sunt solubili in solventi organici.
|
|
|
pf.o-nitrofenol pf. p-nitrofenol = 295 |
Punctele de fierbere sunt mari din cauza puntilor de hidrogen mai puternice decat ale alcoolilor (ex: ciclohexanolul are punctul de fierbere de 161C, iar fenolul de 182C).
Fenolul se gaseste sub forma de cristale incolore caustice, higroscopice (se transforma intr-o solutie cu continut de 8% H2O), capabile de autooxidare.
Anumiti fenoli pot forma legaturi chelatice, care duc la modificarea valorii punctului de fierbere.
Proprietati chimice
I. Reactii specifice grupei OH
A. Formarea fenoxizilor. Aciditatea fenolilor
![]()
Anionul fenoxid este o baza mai slaba decat anionul HO- si refacerea fenolului din fenoxizi are loc cu acizi mai tari decat fenolul.
![]()
B. Formarea eterilor
![]()
C. Formarea esterilor. Acilarea fenolilor.
Acilarea se face doar cu cloruri acide si anhidride acide. Reactia decurge mai usor daca se
folosesc fenoxizi.
II. Reactii specifice nucleului aromatic (S.E.). Reactiile decurg mai usor decat la benzen, cu orientare orto, para.
A. Halogenarea
a.- Reactia decurge astfel in solventi nepolari si la rece (X=Cl, Br).

b.- Reactia se realizeaza in prezenta de AlCl3
c.- Reactia cu solutie apoasa de brom.
Este o reactie cantitativa, folosita la dozarea fenolului.
B. Sulfonarea
Atunci cand temperatura mediului de reactie este sub 100C, se realizeaza un control cinetic, iar cand temperatura depaseste 100C se realizeaza un control termodinamic.
C. Nitrozarea.
Se face cu acid azotos, in mediu de acid mineral, reactantul fiind ionul nitrozoniu care este un electrofil slab care nu ataca nucleul benzenului (vezi 5.6.4).
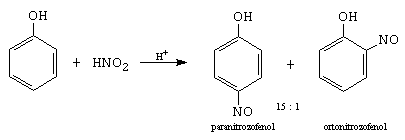
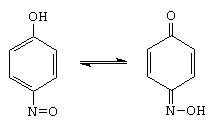
verde benzenchinonoxima (galbena)
D. Nitrarea
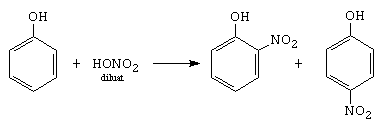
o-nitrofenol p-nitrofenol
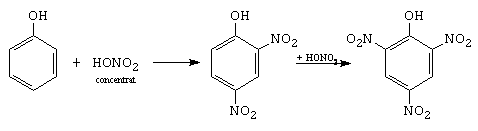
2,4-dinitrofenol 2,4,6-trinitrofenol
Mecanismul este diferit fata de nitrarea benzenului. In HNO3 exista acidul azotos, care nitrozeaza fenolul, formand un nitrozoderivat, care in prezenta acidului azotic se oxideaza la nitroderivat.
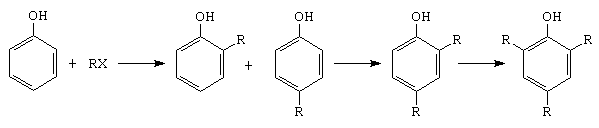
E. Alchilarea fenolului
Reactia se poate realiza cu alchene, alcooli sau derivati halogenati.
F. Azocuplarea
Fenolul, in prezenta ionului de diazoniu, genereaza, prin reactia de cuplare, coloranti azoici (vezi 5.6.2).
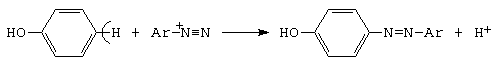
![]()
III. Alte reactii
A. Reactii de aditie. Hidrogenarea
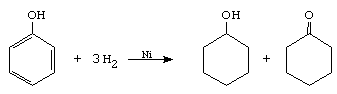
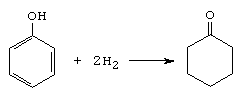
La reactia de hidrogenare totala a fenolului, in prezenta de Ni la 180 , se obtin doar cantitati mici de ciclohexanona, produsul principal de reactie fiind ciclohexanolul.
B. Reactii de culoare. Reactia cu solutie apoasa de FeCl3
Fenolii dau coloratii diferite cu solutie apoasa de FeCl3, datorita formarii unui cation colorat.
![]()
Cationul colorat in acest exemplu este C6H5-OFe2+. Fenolul da o coloratie rosie-violeta, crezolii albastra, pirocatechina verde.
Reprezentanti:
Fenolul - substanta solida, cristalina, autooxidabila (cristalele incolore se inrosesc in aer), higroscopica. Este solubil in alcool, glicerina, eter si benzen, in orice proportie. Este toxic si caustic. Se foloseste in industria colorantilor si industria fenoplastelor si are actiune antiseptica.
Pirocotechina se foloseste in industria farmaceutica, are actiune antiseptica.
Crezolii au actiune antiseptica, se folosesc sub forma de emulsie cu o solutie de sapun in apa.
Pirogalolul are caracter reducator puternic si este folosit la dozarea oxigenului.
Hidrochinona este folosita ca revelator foto.
O-fenil fenolul este folosit ca si conservant al citricelor.
Timolul si carvacrolul sunt componente ale uleiului de cimbru, folosit in lambriaza. Carvacrolul se gaseste si in uleiul de chimion.
Naftolii sunt folositi in industria colorantilor.
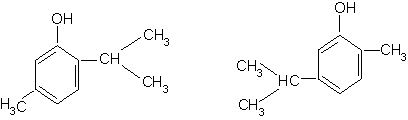
Timol Carvacrol
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 12777
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved