| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Introducere in electrochimie
Transformarile chimice insotite de trecerea unui curent electric prin sistem au fost numite reactii electrochimice. Cuplarea celor doua fenomene - reactia chimica si trecerea curentului electric - se poate realiza in doua moduri distincte: generarea curentului electric ca rezultat al producerii unor reactii chimice (pile electrochimice) si respectiv producerea unor reactii chimice ca rezultat al trecerii curentului electric (electroliza).
Multe reactii chimice au loc prin transferul unor sarcini electrice, cum ar fi de exemplu reactiile cu transfer de proton dintre un acid (AH sau BH+) si solventul SH, sau dintre o baza (B sau A-) si solvent :
AH + SH = A + SH2+ A- + SH = AH + SB+
SH = S + BH+ BH+ + SH = B + SH2+
sau reactiile cu transfer de electron:
Fe2+(aq) + Ce4+(aq) = Fe3+(aq) + Ce3+(aq)
2Fe3+(aq) + Sn2+(aq) = 2Fe2+(aq) + Sn4+(aq)
2Cu2+(aq) + 2I-(aq) = 2Cu+(aq) +I2(aq)
In aceste reactii, deplasarea (transferul) sarcinilor electrice nu conduce la aparitia unui curent electric, datorita miscarilor aleatoare (dezordonate) ale particulelor implicate. Curentul electric reprezinta deplasarea sarcinilor electrice intr-o anumita directie in prezenta unui camp electric. Transportul ordonat al sarcinilor este asigurat de purtatorii de sarcina: electronii in metale sau aliaje si ionii in solutii sau topituri de electroliti.
Electrochimia este ramura chimiei fizice care studiaza factorii care conduc la aparitia acestor fenomene si posibilitatea de a le aplica in scopuri practice.
Reactiile electrochimice au loc in sisteme eterogene, la suprafata de separare dintre doua faze, si sunt puternic dependente de stabilitatile relative ale componentilor reactiei in cele doua faze.
Cele mai studiate sisteme sunt cele metal / solutie de electroliti. In metal purtatorii de sarcina sunt electronii. Cel mai simplu model al structurii metalice se bazeaza pe ideea punerii in comun a electronilor de valenta proveniti de la atomii componenti ai retelei cristaline. Atomii isi pierd electronii de valenta devenind ioni pozitivi localizati in nodurile retelei cristaline. Electronii eliberati sunt asimilati cu un "gaz electronic" intr-o stare de permanenta miscare dezordonata. Fluxul orientat de electroni datorat aplicarii unei diferente de potential intre doua puncte asigura transportul de sarcini electrice. In prezent exista si modele mai realiste, capabile de a explica proprietatile metalelor.
In faza lichida (solutie sau topitura) componentii reactanti sunt de regula sub forma ionica, dar pot fi si molecule neutre. Un rol important in procesele electrochimice il are starea speciilor ionice din faza lichida (de exemplu din solutie). Ca particule
incarcate electric, ele interactioneaza puternic atat cu solventul (interactie numita solvatare) cat si cu celelalte particule ionice (care constituie atmosfera ionica). Trecerea lor in alte forme, in urma reactiilor electrochimice, este dependenta de valoarea energiei libere a procesului. Atat procesul de solvatare (interactiunile ion - molecula), cat si cel de interactie cu atmosfera ionica (interactiunile ion - ion), prezinta mari dificultati de abordare cantitativa la nivel microscopic. Doua modele simple sugereaza factorii cei mai importanti in aceste interactiuni. Primul este modelul lui Max Born de solvatare a unui ion de catre un solvent, iar cel de al doilea este modelul lui Debye si Hckel de interactie a unui ion cu atmosfera ionica, in cazul solutiilor diluate de electroliti.
Modelul lui Born pleaca de la asimilarea unui ion cu o sfera conductoare de raza rj si cu o sarcina electrica zje0 (unde zj este valenta iar e este sarcina elementara). Lucrul electric de incarcare a unui astfel de ion in vid, cu constanta dielectrica absoluta e , este dat de:
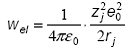
iar intr-un solvent cu constanta dielectrica eD e , unde eD este constanta dielectrica relativa:
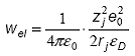
Energia libera molara standard (pentru ![]() particule) de transfer
din vid in solventul considerat (egala cu energia libera de solvatare) este
data de diferenta:
particule) de transfer
din vid in solventul considerat (egala cu energia libera de solvatare) este
data de diferenta:
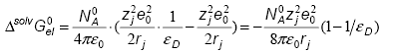
Tinand cont de faptul ca eD > pentru
orice solvent, rezulta ca ![]() , ceea ce inseamna ca
procesul de solvatare conduce la stabilizarea ionilor. Solvatarea este cu atat
mai puternica cu cat raza ionului este mai mica, iar constanta dielectrica a
solventului este mai mare. [e F m-1 e0 = 1,602 10-19C]
, ceea ce inseamna ca
procesul de solvatare conduce la stabilizarea ionilor. Solvatarea este cu atat
mai puternica cu cat raza ionului este mai mica, iar constanta dielectrica a
solventului este mai mare. [e F m-1 e0 = 1,602 10-19C]
Coeficientul de activitate dj , care tine cont de interactia solvit - solvent, este
corelat cu ![]() prin:
prin:
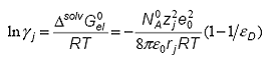
In mod similar se pot obtine energiile libere standard de solvatare si coeficientii de activitate corespunzatori alegand si alta stare de referinta in locul vidului. (starea standard este considerata aici solutia ideala de concentratie 1M).
Modelul Debye - Hckel ia in calcul interactiile ionilor din solutie cu "atmosfera ionica" inconjuratoare si calculeaza coeficientii de activitate fj corespunzatori, luand ca stare de referinta starea de dilutie ionica infinita. Gradul in care proprietatile unei solutii de electroliti se abat de la proprietatile unei solutii ideale depinde de intensitatea campului electric rezultat din prezenta tuturor celorlalti ioni. In modelul Debye - Hckel se ajunge la concluzia ca intensitatea acestui camp poate fi redata cu ajutorul unei proprietati caracteristice numita tarie ionica si definita prin:
![]() (4)
(4)
unde Cj sunt concentratiile molare ale ionilor componenti. Din conditia de electroneutralitate a solutiei rezulta ca sarcina oricarui ion trebuie sa fie neutralizata de o sarcina spatiala egala si de semn contrar, dispersata in restul solutiei. Deoarece la distante mari potentialul electric al ionului este neglijabil, sarcina spatiala care neutralizeaza sarcina ionului central este localizata intr-o zona limitata de forma sferica, numita atmosfera ionica sau nor ionic. Pe baza legilor generale de conservare, Debye si Hckel au obtinut urmatoarea forma a ecuatiei care permite evaluarea coeficientului de activitate fj
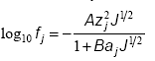 (5)
(5)
unde A si B sunt parametri dependenti de proprietatile solventului si de temperatura, iar aj reprezinta distanta cea mai mica la care ionii se pot apropia de ionul central. Pentru tarii ionice mici, cel de al doilea termen de la numitor devine neglijabil si se obtine legea
limita Debye - Hckel. Legea arata, prin semnul negativ, ca atmosfera ionica stabilizeaza ionii in solutie.
In modelele prezentate s-a utilizat notiunea de coeficient ionic individual de activitate. Astfel de coeficienti nu pot fi masurati experimental, deoarece nu exista solutii care sa contina un singur fel de ioni (pozitivi sau negativi). Din aceste motive a fost introdusa notiunea de coeficient mediu de activitate. Pentru o solutie de NaCl, acesta se defineste ca media geometrica a celor doi ioni individuali:
![]() (
(
iar potentialul chimic al NaCl pe scara concentratiei molale este:
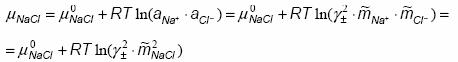
Pentru o sare de tipul MexAy, coeficientul mediu de activitate este:
![]()
Reactiile electrochimice sunt dependente atat de procesele care au loc la suprafata de separatie dintre faze, cat si de transportul sarcinilor electrice in cele doua faze.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1801
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved