| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Legatura chimica
Tendinta crearii unor structuri electronice stabile a elementelor chimice(exceptie unele gaze rare:He,Ne) conduce la formarea unor edificii moleculare sau retele cristaline prin modificarea stratului exterior, denumit si strat de valenta (de legatura).
Principalele tipuri de legaturi chimice sunt:electrovalenta (legatura ionica),covalente ,legatura metalica ,legatura de tip complex, legatura Van der Waals si legatura de hidrogen(puntile de H).
a)Legatura ionica
Elementele chimice apropiate structural de un gaz rar sunt cele mai instabile acceptand sau cedand cu usorinta electroni si formand anioni respective cationic, cu configuratii de gaz rar urmator sau anterior in sistemul periodic:
Na + ![]() Cl
Cl![]() = NaCl
= NaCl ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ceea
ce nu corespunde reactiei de formare a NaCl din elemente.
ceea
ce nu corespunde reactiei de formare a NaCl din elemente.
De aceea Kossel ia in consideratie interactiunile electrostatice ale ionilor din reteaua cristalina a NaCl si a norilor electronici ai ionilor acestora.
Calculeaza energia de retea ![]() in care
:
in care
:
![]() ;
; ![]()
Za,Zc sarcinile anionilor si cationilor ; n=5,6,9,10,12
Valoarea U=-774Kj![]() calculata si identica cu cea din datele termodinamice,
acopera cu mult deficitul energetic calculat in baza transferului de electroni
si deci formarea cloruri de sodiu este posibila
decurgand printr-o reactie exoterma
calculata si identica cu cea din datele termodinamice,
acopera cu mult deficitul energetic calculat in baza transferului de electroni
si deci formarea cloruri de sodiu este posibila
decurgand printr-o reactie exoterma ![]()
![]()
b)Legatura covalenta
Aceasta se realizeaza prin punerea in comun a electronilor neimperecheati ai atomilor si conduc la formarea de molecule sau retele atomice (diamant,grafit).
![]()
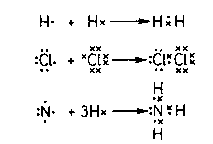
Functie de natura atomilor participanti la legatura covalenta este:
![]() nepolara,stabilita intre atomi de
acelasi fel;
nepolara,stabilita intre atomi de
acelasi fel;
![]() polara,stabilita intre atomi
diferiti:
polara,stabilita intre atomi
diferiti:
![]()
In cazul atomilor cu un numar mare de electroni neimperechiati se pot stabili legaturi multiple(duble,triple):
![]()
Un alt tip de covalenta ce se mai poate forma este covalenta coordinativa, in care unul din atomi poseda o pereche de electroni neparticipanti pe care o pune in comun cu un alt atom, din alta molecula sau din aceeasi, deficitar in electroni:
![]()
Dezvoltarea teoretica a legaturii
covalente s-a realizat prin aplicarea principiilor mecanicii cuantice la
calculul functiei de unda a orbitalului molecular care ia nastere prin cuplarea
electronilor neimperecheati din atomi.Calculele sunt destul de complicate si
s-au efectuat initial pentru molecule simple(![]() )recurgandu-se la unele simplificari (metoda aproximarilor).
)recurgandu-se la unele simplificari (metoda aproximarilor).
Doua metode de aproximare au capatat o aplicabilitate mai larga(MLV=metoda legaturii de valenta) si (MOM=metoda orbitalilor moleculari).
Ambele metode se bazeaza pe
combinarea liniara a functiilor de unda a orbitalilor atomici
:![]() , in care:
, in care:
-![]() sunt coeficienti de contributie a orbitalilor atomici
sunt coeficienti de contributie a orbitalilor atomici
-![]() sunt functiile de unda a orbitalilor atomici
sunt functiile de unda a orbitalilor atomici
Cele doua metode difera prin valoarea pe care o atribuie coeficientilor de contributie si modul de interpretare a rezultatelor.
In MLV ,legatura covalenta se considera drept un rezultat al suprapunerii orbitalilor atomici nedeformati iar in MOM, formarea covalentei se produce in urma contopirii orbitalilor atomici in orbitali moleculari ,ca numar egali, dar jumatate de legatura (de energie joasa) si jumatate de antilegatura (de energie inalta).
Exemplu pentru molecula de H2 de formare prin cele doua metode:
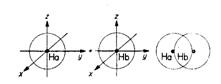
Fig. nr. 2.1. Formarea moleculei de hidrogen in M.L.V.
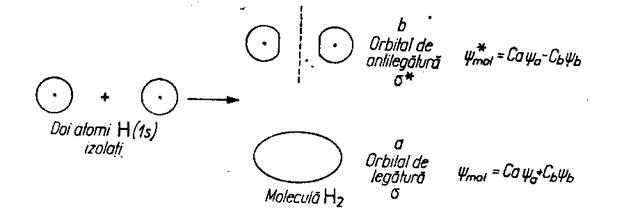
Fig.nr.2.2. Formarea moleculei de hidrogen in M.O.M.
c)Legaturi Van der Waals
Abaterea gazelor reale de la legile
gazelor ideale [(p+![]() V-VM)=RT] efectul
Joule-Thomson (racirea unui gaz puternic comprimat prin curgerea lui printr-un
orificiu ingust provoaca in majoritatea cazurilor o racire a gazului),
lichefierea si solidificarea gazelor (
V-VM)=RT] efectul
Joule-Thomson (racirea unui gaz puternic comprimat prin curgerea lui printr-un
orificiu ingust provoaca in majoritatea cazurilor o racire a gazului),
lichefierea si solidificarea gazelor (![]() si altele),au impus faptul ca intre acestea se stabilesc
legaturi Van der Waals.
si altele),au impus faptul ca intre acestea se stabilesc
legaturi Van der Waals.
Sunt forte cu "bataie" scurta ![]() :
:
Forte London , de "dispersie",actioneaza la toate tipurile de molecule ,deoarece apar in urma oscilatiei nucleu-nor electronic:
![]()
Forte Keesom, de orientare , apar intre molecule polare, fiind forte atractive de tip dipol-dipol.
![]()
Forte Debye, de inductie, apar intre molecule polare si nepolare.
![]()
Ponderea celor trei tipuri de forte
depinde de doua proprietati distincte ale moleculelor:polarizabilitate![]() si polaritate
si polaritate![]() .
.
Forte repulsive , atractia intre molecule este
limitata de aparitia acestor repulsii datorate invelisurilor electronice.Sunt
forte cu o "bataie" si mai scurta: ![]()
d)Legatura de hidrogen(puntile de H)
Este tot o legatura intermoleculara
si se realizeaza intre protonul unei molecule legat de un atom puternic electronegativ(![]() dupa Pauling A=F,O,N,Cl) si atomul electronegativ al unei
alte molecule vecine.
dupa Pauling A=F,O,N,Cl) si atomul electronegativ al unei
alte molecule vecine.
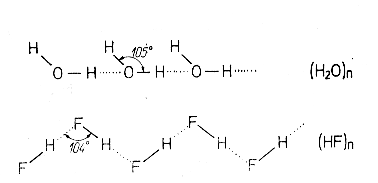
Fig. nr. 2.3.
Legaturile de hidrogen dintre moleculele de ![]() si
si ![]()
Manifestarea unor proprietati specifice,sugereaza existenta in metale a unei legaturi chimice diferita de cele intalnite la nemetale,numita legatura metalica.
Natura legaturii nu este de tip Van der Waals,deoarece este puternica ,existenta unei legaturi tip ionica nu este posibila intre specii de acelasi fel iar in metal ca retea, acesta fiind inconjurat de un numar mare de atomi identici (6,8,12 etc.)nu poate forma legaturi covalente localizate intre toti acestia.
Asupra naturii chimice s-au emis diferite teorii.
e.1.)Teoria gazului electronic(Drude-Lorentz)
Acesta considera ca electronii de valenta ai atomilor de metal formeaza un "gaz" mobil - un "gaz" de electroni care difuzeaza prin reteaua cristalina a metalului ,ale carei noduri sunt formate din "resturile" de atomi , respectiv de ioni pozitivi.Interactiunea dintre ionii pozitivi si gazul electronic ar constitui legatura metalica.
Existenta electronilor mobili in metale poate explica conductibilitatea termica si electrica foarte mare a acestora , legea Wiedemann-Franz si anume raportul acestor conductivitati este constant pentru toate metalele.
Modelul gazului electronic este ,insa, in contradictie cu unele observatii experimentale, in special nu poate explica caldura specifica a metalelor.
Prin aceasta teorie metalul compact poate fi considerat drept o molecula uriasa formata din atomi identici.Exista astfel posibilitatea formarii unor orbitali moleculari din orbitali atomici de acelasi tip,echivalenti.
Considerand un mol de atomi ![]() ,avem N orbitali atomici de acelasi tip care in reteaua
metalica formeaza N orbitali moleculari ,din care jumatate (N/2) sunt de mai
joasa energie (orbitali moleculari de legatura) si cealalta jumatate (N/2) sunt
de energie inalta (orbitali moleculari de antilegatura).Totalitatea nivelelor
de energie care se gasesc intr-o succesiune foarte stransa formeaza o zona sau
banda de energie.
,avem N orbitali atomici de acelasi tip care in reteaua
metalica formeaza N orbitali moleculari ,din care jumatate (N/2) sunt de mai
joasa energie (orbitali moleculari de legatura) si cealalta jumatate (N/2) sunt
de energie inalta (orbitali moleculari de antilegatura).Totalitatea nivelelor
de energie care se gasesc intr-o succesiune foarte stransa formeaza o zona sau
banda de energie.
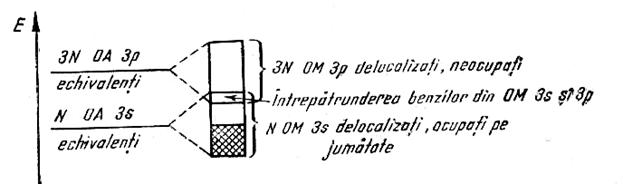
Litiul de exemplu are structura
atomica![]()
![]()
Un mol are deci N(2s)+3N(2p) orbitali atomici care formeaza 4N orbitali moleculari delocalizati.Cu electroni se vor ocupa N orbitali delocalizati formand asa numita banda ocupata (BO).Ramane astfel din banda energetica a orbitalilor moleculari un numar mare care formeaza banda de conductie (B.C.).Electronii in camp electric pot "migra" din B.O. in B.C. explicandu-se astfel conductibilitatea electrica si termica a metalelor:
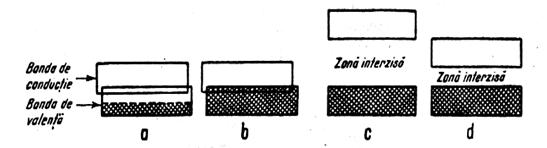
Spre deosebire de metale, in materiale semiconductoare si izolatoare
cele doua benzi B.O. si B.C. nu mai sunt alaturate.Exista intre ele o diferenta
de energie ,(apare B.I.=banda interzisa)care creste in
mod semnificativ la izolatori ![]() .
.
Numarul mic de electroni din stratul de valenta a impus ca teorie in explicarea legaturii puternice din metal, covalenta delocalizata .De exemplu, in potasiu(Kaliu) metalic, fiecare atom avand un singur electron poate forma o singura covalenta simpla cu un alt atom vecin.Cum in reteaua metalica in proxima apropiere sunt opt atomi rezulta o structura de rezonanta in diferite pozitii.De exemplu pentru patru atomi de potasiu exista:
K K K K
K K K K
I II
K K K K K __K K __K-
K K K K K K K K
III IV V VI
Fig.nr.2.4. Structuri sincrone(I,II) si asincrone(III,IV,V,VI)
Structurile de rezonanta nesincronizate explica conductibilitatea electrica la metale in stare topita prin purtatorii de sarcina de ordinul doi (ionici).
Modul in care intervin aceste in
conductia electrica poate fi astfel reprezentat:![]()
Catod(-)] K![]() K-K K-K K-K K-K K-K-K
K-K K-K K-K K-K K-K-K![]() [(+)Anod
[(+)Anod
Deci,la trecerea unui curent electric, va avea loc o schimbare a legaturilor astfel incat sa se produca o deplasare a sarcinii positive spre catod si a sarcinii negative spre anod.
Conductibilitatea este mai ridicata la temperaturi joase;la cresterea temperaturii agitatia termica perturba aranjamentul atomilor in reteaua metalica si conductibilitatea scade.
Structura electronica a metalelor da explicatia schimbarilor observate la proprietatile fizice ale metalelor .
Astfel daca se considera primele metale din perioada a patra (n=4),adica K,Ca,Sc,Ti,V,Cr, se poate constata o crestere a densitatii,duritatii,punctului de topire, punctului de fierbere etc.Aceste observatii, pot fi explicate prin aria legaturilor interatomice in metal.Cu cat atomii metalelor au mai multi electroni in stratul de valenta ,cu atat numarul legaturilor pe care le pot forma cu atomii invecinati este mai mare.
Atomul de potasiu are un singur electron in stratul de valenta si poate forma o singura legatura covalenta cu un atom de potasiu vecin.In cristal l este inconjurat de opt atomi de potasiu vecini, cu care poate forma cate o legatura covalenta, rezultand structuri de rezonanta (MLV).
De aceea potasiul este un metal moale,usor,cu punct de topire scazut.
In calciul metalic,fiecare atom are doi electroni de valenta si deci poate forma cu atomii vecini doua legaturi.Aceste doua legaturi formeaza structuri de rezonanta intre diferite pozitii ale legaturilor Ca-Ca si legatura este de doua ori mai puternica decat la potasiu.
Scandiul cu trei electroni de valenta formeaza legaturi de trei ori mai puternice.Corelatia intre valenta metalica si proprietati continua sa se observe pana la crom.
Explicatia o reprezinta faptul ca legatura chimica se realizeaza la metalele tranzitionale tip d si prin electroni dintr-o orbitala interioara.Modul in care acestia participa la legatura chimica este diferit si poarta numele de valenta secundara.Aceasta nu poate depasi valoarea 6 si se intalneste la tranzitionalele d din mijlocul fiecarei serii.De aceea acestea au proprietati fizice si chimice remarcabile.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2894
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved