| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
METODA DE IDENTIFICARE SI DETERMINARE CANTITATIVA PENTRU ACIDUL BENZOIC, ACIDUL 4 HIDROXIBENZOIC, ACIDUL SORBIC, ACIDUL SALICILIC SI ACIDUL PROPIONIC
SCOP SI DOMENIU DE APLICARE
Metoda reglementeaza identificarea si determinarea acidului benzoic, acidului 4-hidroxibenzoic, acidului sorbic, acidului salicilic si a acidului propionic in produsele cosmetice. In sectiuni separate sunt prezentate:
A.identificarea acestor conservanti;
B.determinarea acidului 4-hidroxibenzoic, acidului salicilic, acidului sorbic si acidului benzoic;
C.determinarea acidului propionic.
DEFINITIE
Cantitatile de acid benzoic, acid 4-hidroxibenzoic, acid sorbic, acid salicilic si
acid propionic determinate prin aceasta metoda sunt exprimate ca procente masice de acizi liberi.
PRINCIPIU
Dupa extractia acid/baza a conservantilor, extractul este analizat prin
cromatografie in strat subtire (CCS) implicand derivatizarea probei "pe loc".
In functie de rezultate, identificarea este confirmata prin cromatografie de
lichid de inalta performanta (HPLC) sau in cazul acidului propionic prin
cromatografie de gaze (CG).
REACTIVI
Generalitati
Toti reactivii trebuie sa fie de puritate analitica. Apa folosita trebuie sa fie apa distilata, sau apa de puritate cel putin echivalenta.
Acetona
Dietileter
Acetonitril
Toluen
n-Hexan
parafina, lichida
Acid clorhidric, 4M
solutie hidroxid de potasiu, 4M
Clorura de calciu, CaCl2 . 2H2O
Carbonat de litiu, Li2CO3
2-bromo-2'-acetonaftona
Acid 4-hidroxibenzoic
Acid salicilic
Acid benzoic
Acid sorbic
Acid propionic
Solutii de referinta
Se prepara solutii 0,1% (m/v) (100mg/100ml) din fiecare dintre cei cinci
conservanti (2.13 2.17) in dietileter.
Reactiv de derivatizare
solutie de 2-bromo-2'-acetonaftona (2.12) 0,5% (m/v) in acetonitril (2.4)
(50mg/10ml). Aceasta solutie trebuie preparata saptamanal si depozitata in
frigider.
Solutie catalitica
solutie de carbonat de litiu (2.11) 0,3% (m/v) in apa (300mg/100ml). Aceasta solutie trebuie sa fie proaspat preparata.
Solvent de developare
Toluen (2.5) / acetona (2.2) (20 : 0,5, v/v)
Parafina lichida (2.7) / n-hexan (2.6) (1 : 2, v/v).
APARATURA
Echipament obisnuit de laborator.
Baie de apa, capabila sa mentina temperatura la 60C
Tanc de developare
Sursa de lumina UV, 254 si 366nm
Placi pentru cromatografie in strat subtire CSS, Kieselgel 60, fara indicator de fluorescenta, 20 x 20 cm, grosime strat 0,25 mm cu zona de concentrare 2,5 x 20cm (Merck 11845, sau echivalent).
Microseringa, 10ml
Microseringa, 25ml
Etuva, capabila sa mentina tempetaturi pana la 105C.
Vase de sticla cu dop filetat, 50ml
Hirtie de filtru, diametru 90 mm, Schleicher & Schull, Weissband No. 5892 sau echivalent
Hartie indicatoare de pH universala, pH 1-11
Fiole de probe, din sticla, 5 ml
Evaporator cu film rotativ (Rotavapor sau echivalent)
Plita electrica.
PROCEDEU
Preparare proba
intr- un vas de sticla cu dop filetat se cintareste circa 1g proba (3.8). Se adauga patru picaturi acid clorhidric 4M (2.8) si 40ml acetona (2.2). pentru produsi puternic bazici cum ar fi sapunul de toaleta, trebuie adaugate 20 picaturi acid clorhidric 4M (2.8). Se verifica ca pH-ul sa fie aproximativ doi, folosind hartie indicatoare (3.10). Se inchide eprubeta si se agita puternic timp de un minut.
Daca este necesara facilitarea extractiei conservantilor in faza de acetona, se
incalzeste usor amestecul la circa 60C pentru topirea fazei grase.
Se raceste solutia la temperatura camerei si se filtreaza prin hirtie de filtru (3.10) intr-un flacon conic.
Se transfera 20ml de filtrat intr-un flacon conic de 200ml, se adauga 20ml apa si se amesteca. se ajusteaza pH-ul amestecului la circa 10 cu hidroxid de potasiu 4M (2.9), folosind hartie indicatoare (3.10) pentru masurarea acestuia.
Se adauga 1g clorura de calciu (2.10) si se agita puternic. Se filtreaza prin hartie de filtru (3.9) intr-o palnie de separare de 250ml continand 75ml dietil eter (2.3) si se agita puternic timp de un minut. Se lasa sa se separe si se colecteaza stratul apos intr-un flacon conic de 250ml. Se indeparteaza stratul de eter. Folosind hirtie indicatoare (3.10) se ajusteaza pH-ul solutiei apoase la circa doi cu ajutorul acidului clorhidric 4M (2.8). Se adauga 10ml dietileter (2.3) ,se astupa flaconul si se agita puternic continutul timp de un minut. se lasa sa se separe si se transfera stratul eteric intr-un evaporatorul cu film rotativ (3.12). Se indeparteaza stratul apos.
Se evapora stratul de eter pana aproape de uscare si se redizolva reziduul in 1 ml dietileter (2.3). Se transfera solutia intr-o fiola de proba (3.11).
Cromatografiere in strat subtire.
Pentru fiecare dintre referintele si probele ce vor fi cromatografiate. Se pun cu
o siringa (3.5) circa 3 ml solutie carbonat de litiu (2.2) la distante egale fata de
linia de start in zona de concentrare a placii C.S.S. (3.4) si se usuca intr-un
curent de aer rece.
Se transfera placa C.S.S. pe o plita electrica (3.13), incalzita la 40C, pentru a
mentine spoturile cat mai mici cu putinta. Se pun cu o siringa 10ml din fiecare
dintre solutiile de referinta (2.18) si solutia proba (4.1) pe linia de start a
placii, exact pe punctele unde a fost aplicata solutia de carbonat de litiu.
Se pun cu o siringa circa 15ml reactiv de derivatizare (2.19) (solutie 2-bromo-
2'-acetonaftona), din nou exact pe punctele unde au fost aplicate solutiile de
referinta/proba si solutia de carbonat de litiu.
Se incalzeste placa cromatografica intr-o etuva (3.7) la 800C timp de 45
minute. Dupa racire, se elueaza placa intr-un tanc (3.2) care a fost echilibrat
timp de 15 minute (fara a fi fost captusit cu hartie de filtru), folosind ca eluent
amestecul de solventi 2.21 (toluen/acetona), pana ce frontul solventului a migrat pe
o distanta de 15cm (poate dura 80 minute).
Se usuca placa intr-un curent de aer rece si se examineaza spoturile obtinute in lumina UV (3.3). Pentru a imbunatatii fluorescenta spoturilor slabe, placa C.S.S. poate fi cufundata in amestec parafina lichida / n-hexan (2.22).
IDENTIFICARE.
Se calcueaza Rf pentru fiecare spot.
Se compara Rf si comportarea la radiatie UV obtinuta pentru proba cu cea obtinuta pentru solutiile de referinta.
Se trage o concluzie preliminara privind prezenta si identitatea conservantilor prezenti. Se realizeaza cromatografia de lichide de inalta performanta (HPLC) descrisa in capitolul B, sau, cand este prezent acidul propionic, cromatografia de gaze (CG) descrisa in capitolul C. Se compara timpii de retentie obtinuti cu cei ai solutiilor de referinta.
Se combina rezultatele din CSS si HPLC sau CG si se face identificarea finala
a conservantilor prezenti in proba pe baza rezultatelor combinate.
B. DETERMINAREA CANTITATIVA A ACIDULUI BENZOIC, ACIDULUI 4--HIDROXIBENZOIC, ACIDULUI SORBIC SI ACIDULUI SALICILIC
PRINCIPIU
Dupa acidifiere, proba este extrasa cu un amestec de etanol si apa. dupa filtrare, conservantii sunt determinati prin cromatografie de lichide de inalta performanta (HPLC).
REACTIVI
Toti reactivii trebuie sa fie de puritate analitica, si adecvati HPLC. Apa folosita trebuie sa fie apa distilata, sau apa de cel putin puritate echivalenta.
Etanol, absolut
Acid 4-hidroxibenzoic
Acid salicilic
Acid benzoic
Acid sorbic
Acetat de sodiu (CH3COONa . 3H2O)
Acid acetic, d420 =1,05 g/ml
Acetonitril
Acid sulfuric, 2M
solutie hidroxid de potasiu, 0,2M
Acid 2-metoxibenzoic
amestec etanol / apa
Se amesteca noua volume de etanol (2.2) si un volum de apa (2 : 1)
Solutie standard intern
Se prepara o solutie continand circa 1g acid 2 metoxibenzoic (2.12) in 500ml
amestec etanol / apa (2.13)
Faza mobila pentru HPLC
tampon acetat: la 1l apa se adauga 6,35 g acetat de sodiu (2.7) si
20 ml acid acetic (2.8) si se amesteca.
Se prepara faza mobila prin amestecarea a noua volume de tampon acetat (2.15.1) si un volum de acetonitril (2.9).
Solutie stoc de conservant
intr-un balon cotat de 50ml se cintaresc cu precizie circa 0,05g acid 4-hidroxibenzoic (2.3), 0,2g acid salicilic (2.4), 0,2g acid benzoic (2.5) si 0,05g acid sorbic si se aduce la semn cu amestec etanol / apa (2.13). Aceasta solutie se depoziteaza in frigider. Solutia este stabila pentru o saptamana.
Solutii de conservanti standard
intr-o serie de baloane cotate de 20ml se transfera 8,00, 4,00, 2,00, 1,00 si respectiv 0,5ml solutie stoc (2.16). In fiecare balon cotat se adauga 10,0ml solutie standard intern (2.14) si 0,5ml acid sulfuric 2M (2.10). Se aduce la semn cu amestec etanol / apa (2.13). Aceste solutii trebuie sa fie proaspat preparate.
APARATURA
Echipament uzual de laborator, si:
Baie de apa, setata la 60C
Cromatograf de lichide de inalta performanta HPLC cu detector UV cu lungime de unda variabila si ciclu de injectie de 10ml.
Coloana analitica de otel inoxidabil, lungime 12,5 pana la 25cm, diametru interior 4,6mm, umpluta cu Nucleosil 5C18, sau echivalent
Hartie de filtru, diametru: 90 mm, Schleicher si Schull, Weissband No 5892, sau echivalent.
Vase de sticla cu dop (filetat) 50ml.
Fiole de proba, din sticla, 5ml
Granule de portelan pentru fierbere, carborund, dimensiuni de la 2 la 4 mm, sau echivalent.
PROCEDEU
Preparare proba
4.1.1. Preparare proba fara adaos de standard intern
Intr-un vas de sticla de 50 ml cu dop filetat (3.5) se cantareste 1g proba. cu pipeta se pun in eprubeta 1,00 ml acid sulfuric 2M (2.10) si 40,0 ml amestec etanol/apa (2.13). Se adauga circa 1 g granule de portelan pentru fierbere (3.7), se inchide eprubeta si se agita puternic pentru cel putin un minut pana la obtinerea unei suspensii omogene. Pentru a facilita extractia conservantilor in faza de etanol, se pune eprubeta pentru exact cinci minute intr-o baie de apa (3.1) mentinuta la 60C.
Se raceste imediat eprubeta intr-un curent de apa rece si se pastreaza
extractul la 5C pentru o ora.
se filtreaza extractul prin hartie de filtru (3.4). Se transfera circa 2 ml extract intr-o fiola de proba (3.6). Se pastreaza extractul la 5C si se realizeaza determinarea HPLC intr-un interval de 24 de ore de la preparare.
Prepararea probei cu adaos de standard intern
Intr-un vas de sticla de 50 ml cu dop filetat (3.5) se cintareste cu precizie la a treia zecimala 1 0,1 g ( "a" grame) de proba.
Se adauga cu pipeta 1,00 ml acid sulfuric 2M (2.10) si 30,0 ml amestec etanol/
apa (2.13). Se adauga circa 1 g bucatele de portelan pentru fierbere (3.7) si
10,00ml solutie standard intern (2.14). Se inchide eprubeta si se agita puternic
cel putin un minut pana la obtinerea unei suspensii omogene. Pentru a facilita
extractia conservantilor in faza de etanol, se pune eprubeta pentru exact cinci
minute intr-o baie de apa (3.1) mentinuta la 60C.
Se raceste imediat eprubeta intr-un curent de apa rece si se tine extractul la
5C pentru o ora.
se filtreaza extractul prin hartie de filtru (3.4). Se transfera circa 2ml extract intr-o fiola de proba (3.6). Se depoziteaza extractul la 5C si se realizeaza determinarea HPLC intr-un interval de 24 de ore de la preparare.
Cromatografiere de lichide de inalta performanta (HPLC)
faza mobila: acetonitril/ tampon acetat (2.15)
Se regleaza debitul fazei mobile prin coloana la 2,0 ml/ min. se seteaza lungimea de unda a detectorulului la 240 nm.
Etalonare
Se injecteaza portiuni de 10ml din fiecare solutie de conservant standard
(2.17) in cromatograful de lichide (3.2). Pentru fiecare solutie se determina
rapoartele dintre inaltimile picurilor conservantilor investigati si inaltimea
picului standardului intern,obtinute din cromatograme. Se traseaza un grafic
pentru fiecare conservant punand in relatie raportul inaltimii picului cu
concentratia fiecarei solutii standard.
Asigurati-va ca in procedeul de etalonare, pentru solutiile standard, se obtine
un raspuns linear.
Determinare
Se injecteaza 10ml extract de proba (4.1.1) in cromatograful de lichide (3.2) si
se inregistreaza cromatograma. Se injecteaza 10ml solutie de conservant
standard (2.17) si se inregistreaza cromatograma. Se compara
cromatogramele obtinute. Daca in cromatograma extractului de proba (4.1.1) nu apare prezent nici un pic avand aproximativ acelasi timp de retentie ca acidul 2-metoxibenzoic (standardul intern recomandat), se injecteaza 10ml extract de proba cu adaos de standard intern (4.1.2) in cromatograful de lichide si se inregistreaza cromatograma.
Daca se observa in cromatograma extractului de proba (4.1.1) un pic ce
interfereaza, avand acelasi timp de retentie ca acidul 2-metoxibenzoic,
trebuie selectat un alt standard intern adecvat. (Daca unul dintre conservantii
investigati este absent din cromatograma, acest conservant poate fi folosit
drept standard intern).
Asigurati-va ca cromatogramele obtinute pentru o solutie standard si solutia
proba sa indeplineasca urmatoarele cerinte:
-- separarea picului celei mai prost separate perechi trebuie sa fie de cel putin
0,90 (pentru definirea separarii picului, vezi figura 1)
5. CALCUL
Se folosesc rapoartele dintre inaltimile picurilor conservantilor investigati la inaltimea picului acidului 2-metoxibenzoic (standard intern) si graficul de etalonare pentru a calcula concentratia conservantilor acizi in solutia proba. Se calculeaza continutul de acid benzoic, acid 4-hidroxibenzoic, acid sorbic sau acid salicilic in proba, ca procent masic (xi) folosind formula:
|
|
in care:
a = masa (g) a probei pentru analiza (4.1.2.)
b = concentratia (mg/ml) de conservant in extractul de proba (4.1.2) obtinuta din graficul de etalonare.
REPETABILITATE (ISO 5725)
Pentru un continut de acid 4-hidroxibenzoic de 0,40%, diferenta dintre
rezultatele a doua determinari efectuate in paralel pe aceeasi proba nu trebuie
sa depaseasca o valoare absoluta de 0,035%.
Pentru un continut de acid benzoic de 0,50%, diferenta dintre rezultatele a
doua determinari efectuate in paralel pe aceiasi proba nu trebuie sa
depaseasca o valoare absoluta de 0,050%.
Pentru un continut de acid salicilic de 0,50% diferenta dintre rezultatele a
doua determinari efectuate in paralel pe aceiasi proba nu trebuie sa
depaseasca o valoare absoluta de 0,045%.
Pentru un continut de acid sorbic de 0,60% diferenta dintre rezultatele a doua
determinari efectuate in paralel pe aceiasi proba nu trebuie sa depaseasca o
valoare absoluta de 0,035%.
OBSERVATII
Rezultatele unui test efectuat metodei indica urmatoarele: cantitatea de acid sulfuric adaugata pentru extragerea acizilor din proba este critica, si limitele pentru cantitatea de proba luata in lucru trebuie sa fie mentinute in granitele prescrise.
Daca se doreste, poate fi folosita o coloana de siguranta adecvata.
C. DETERMINAREA ACIDULUI PROPIONIC
SCOP SI DOMENIU DE APLICARE
Aceasta metoda reglementeaza determinarea acidului propionic, de
concentratie maxima 2% (m/m), in produsele cosmetice.
DEFINITIE
Concentratia acidului propionic masurata prin aceasta metoda este exprimata
ca procent masic (% m/m) de produs.
PRINCIPIU
Dupa extragerea acidului propionic din produs, determinarea se realizeaza cu
ajutorul cromatografiei de gaz cu folosirea acidului 2-metilpropionic ca
standard intern.
REACTIVI
Toti reactivii trebuie sa fie de puritate analitica; trebuie sa se foloseasca apa
distilata sau apa de calitate echivalenta.
Etanol 96% (v/v)
Acid propionic
Acid 2-metilpropionic
Acid ortofosforic, 10 % (m/v)
Solutie acid propionic
Intr-un balon cotat de 50 ml se cantareste cu precizie circa 1,00 g ("p" grame)
acid propionic si se aduce la semn cu etanol (4.1)
Solutie standard intern
Intr-un balon cotat de 50ml se cantareste cu precizie circa 1,00 g ("e" grame)
acid 2-metilpropionic si se aduce la semn cu etanol (4.1)
APARATURA
Echipament uzual de laborator si:
Cromatograf de gaze cu detector cu ionizare in flacara
Vas de sticla cu dop filetat (20 x 150 mm)
Baie de apa la 60C
Seringa de sticla de 10ml cu membrana de filtrare (diametrul porilor: 0,45 mm)
PROCEDEU
Preparare proba
Preparare proba fara standard intern
Intr-o eprubeta de sticla (5.3) se cantareste circa 1 g proba. Se adauga 0,5ml
acid fosforic (4.4) si 9,5 ml etanol (4.1).
Se inchide eprubeta si se agita bine. Daca este necesar se pune eprubeta intr-o
baie de apa la 60C (5.4) pentru cinci minute, pentru dizolvarea completa a
fazei grase.
Se raceste rapid in curent de apa.
Se filtreaza cota parte din solutie printr-o membrana de filtrare (5.5).
Se cromatografiaza filtratul in aceiasi zi.
Preparare proba cu standard intern
Intr-o eprubeta de sticla se cantareste cu precizie la a treia zecimala 1 g
("a" grame) proba. Se adauga 0,5 ml acid fosforic (4.4), 0,5 ml solutie
standard intern (4.6) si 9 ml etanol (4.1)
Se inchide eprubeta si se agita bine. Daca este necesar se pune eprubeta intr-o
baie de apa la 60C (5.4) pentru cinci minute, pentru dizolvarea completa a
fazei grase. Se raceste rapid in curent de apa. Se cromatografiaza filtratul in
aceeasi zi.
Conditii pentru cromatografia de gaze.
Se recomanda urmatoarele conditii de operare:
Umplutura 10% SPTM 1000 (sau echivalent) + 1% H3PO4 pe Chromosorb WAW 100 pana la 120 ochiuri
Cromatogafiere
Etalonare
Intr-o serie de baloane cotate de 20 ml se pun cu pipeta 0,25, 0,50, 1,00, 2,00,
respectiv 4,00ml solutie acid propionic (4,5). In fiecare balon cotat se pun cu
pipeta 1,00ml solutie standard intern (4.6); se aduce la semn cu etanol (4.1) si
se amesteca. Solutiile preparate in acest mod contin "e" mg/ml acid 2-
metilpropionic ca standard intern (adica, 1 mg/ml daca e = 1000) si p/4, p/2, p,
2p, 4p mg/ml acid propionic (adica 0,25, 0,50, 1,00, 2,00, 4,00 mg/ml daca
p = 1000).
Se injecteaza 1ml din fiecare dintre aceste solutii si se obtine curba de
etalonare prin trasarea pe axa X a raportului masic acid propionic / acid 2-
metilpropionic iar pe axa y a raportului suprafetelor picurilor corespondente.
Se efectueaza trei injectari din fiecare solutie si se calculeaza raportul mediu al
suprafetelor picurilor.
Determinare
Se injecteaza 1ml filtrat de proba (6.1.1). se compara cromatograma cu cea a solutiilor standard (6.3.1). Daca un pic are aproximativ acelasi timp de retentie ca acidul 2-metilpropionic, se schimba standardul intern. daca nu este observata nici o interferenta, se injecteaza 1ml filtrat de proba 6.1.2 si se masoara suprafetele picurilor acidului propionic si al standardului intern.
Se efectueaza trei injectari din fiecare solutie si se calculeaza raportul mediu a suprafetelor picurilor.
CALCUL
Din curba de etalonare obtinuta la 6.3.1, se obtine raportul masic (K) corespunzator raportului suprafetelor picurilor calculat la 6.3.2.
Din raportul masic astfel obtinut se calculeaza continutul de acid propionic al probei (x) ca procent masic, folosind urmatoarea formula:
|
|
in care:
K = raportul calculat la 7.1
e = masa in grame a standardului intern cantarit la 4.6
a = masa in grame a probei cantarita la 6.1.2
Rezultatele se rotunjesc la o zecimala.
REPETABILITATE ( ISO 5725)
Pentru un continut de acid propionic 2% (m/m) diferenta dintre rezultatelea doua determinari efectuate in paralel pe aceeasi proba nu trebuie sa depaseasca 0,12%.
ANEXA nr.38
METODA DE IDENTIFICARE SI DETERMINARE CANTITATIVA PENTRU HIDROCHINONA, MONOMETILETER HIDROCHINONA, MONOETILETER HIDROCHINONA SI MONOBENZILETER HIDROCHINONA IN PRODUSELE COSMETICE
A. IDENTIFICARE
SCOP SI DOMENIU DE APLICARE
Metoda reglementeaza detectarea si identificarea hidrochinonei,
monometileter hidrochinonei, monoetileter hidrochinonei si monobenzileter hidrochinonei (monobenzonei) in produsele cosmetice pentru albirea pielii.
PRINCIPIU
Hidrochinona si eterii sai sunt identificati prin cromatografie in strat subtire (CSS).
REACTIVI
Toti reactivii trebuie sa fie puritate analitica.
Etanol, 96% (v/v)
Cloroform
Dietileter
Solvent de developare
Cloroform / dietileter, 66 : 33 (v/v)
Amoniac, 25% (m/m) (d420 = 0,91g/ml)
Acid ascorbic
Hidrochinona
Monometileter hidrochinona
Monoetileter hidrochinona
Monobenzileter hidrochinona (monobenzona)
Solutii de referinta
Urmatoarele solutii de referinta trebuie proaspat preparate, si sunt stabile doar
o zi:
Intr-o eprubeta gradata de 10ml se cantaresc 0,05 g hidrochinona (3.7). Se adauga 0,250g acid ascorbic (3.6) si 5ml etanol (3.1). Se adauga amoniac (3.5) pana cand pH-ul devine 10 si se aduce la semn cu etanol (3.1).
Intr-o eprubeta gradata de 10ml se cantaresc 0,05g monometileter hidrochinona (3.8). Se adauga 0,250g acid ascorbic (3.6) si 5ml etanol (3.1). Se adauga amoniac (3.5) pana cand pH-ul devine 10 si se aduce la semn cu etanol (3.1).
Intr-o eprubeta gradata de 10ml se cintaresc 0,05g monoetileter hidrochinona (3.9). Se adauga 0,250g acid ascorbic (3.6) si 5ml etanol (3.1). Se adauga amoniac (3.5) pana cand pH-ul devine 10 si se aduce la semn cu etanol (3.1).
Intr-o eprubeta gradata de 10ml se cintaresc 0,05g (monobenzileter) hidrochinona (3.10). Se adauga 0,250g acid ascorbic (3.6) si 5ml etanol (3.1). Se adauga amoniac (3.5) pana cand pH-ul devine 10 si se aduce la semn cu etanol (3.1).
Azotat de argint
Acid 12-molibdofosforic
Fericianura de potasiu hexahidrata
Clorura ferica hexahidrata
Reactivi de pulverizare
La o solutie apoasa 5% (m/v) azotat de argint (3.1.2), se adauga amoniac (3.5) pana la dizolvarea precipitatului care se formeaza.
Atentie:
In timp solutia devine exploziv-instabila, deci trebuie aruncata dupa folosire.
Solutie 10% (m/v) acid 12-(molibdofosforic )(3.13) in etanol (3.1).
Se prepara o solutie apoasa 1% (m/v) de fericianura de potasiu (3.14) si o solutie apoasa 2% (m/v) de clorura ferica (3.15). Se amesteca parti egale din ambele solutii chiar inainte de folosire
APARATURA.
Echipament uzual de laborator si:
Echipament uzual pentru cromatografie in strat subtire CSS
Placi pentru cromatografie in strat subtire CSS, gata preparate: silicagel GHR/UV254; 20 x 20 cm (Machery, Nagel sau echivalent). Grosime strat: 0,25 mm.
Baie ultrasonica
Centrifuga
Lampa UV, 254 nm.
PROCEDEU
Preparare proba
Intr-o eprubeta gradata se cantaresc 3g proba. Se adauga 0,250 g acid ascorbic (3.6) si 5ml etanol (3.1). Se regleaza ph-ul solutiei la 10, folosind amoniac (3.5). Se aduce la semn cu etanol. (3.1). Se inchide eprubeta cu un dop si se omogenizeaza pe o baie ultrasonica timp de 10 minute. Se filtreaza prin hartie de filtru sau se centrifugheaza la 3000 rot/min.
Cromatografiere in strat subtire
Se satureaza un tanc cromatografic cu solvent de developare (3.4)
Se pun pe o placa 2ml solutii de referinta (3.11) si 2ml solutie proba (5.1).
Se developeaza in intuneric la temperatura ambianta pana cand frontul de
solvent a migrat 15cm fata de start.
Se indeparteaza placa si se lasa sa se usuce la temperatura camerei.
Detectie
Se observa placa in lumina UV la 254 nm, si se marcheaza pozitia spoturilor.
Se pulverizeaza cu:
reactiv azotat de argint (3.16.1) sau
reactiv acid 12-molibdofosforic (3.16.3); se incalzeste la circa 120C, sau
solutie fericianura de potasiu si solutie clorura ferica (3.16.3).
IDENTIFICARE
Se calculeaza valoarea Rf pentru fiecare spot.
Se compara spoturile obtinute pentru solutia proba cu cele pentru solutiile de referinta din punct de vedere al: valorilor Rf, culorilor spoturilor la radiatie UV si culorilor spoturilor dupa vizualizarea cu reactiv pulverizat.
Se realizeaza cromatografierea de lichide de inalta performanta HPLC conform descrierii din capitolul urmator (B), si se compara timpii de retentie obtinuti pentru picul (picurile) probei cu cei ai solutiilor de referinta.
Se combina rezultatele obtinute prin CSS si HPLC pentru a identifica prezenta hidrochinonei si/sau a eterilor sai.
OBSERVATII
In conditiile descrise au fost observate urmatoarele valori Rf:
hidrochinona 0,32
monometileter hidrochinona 0,53
monoetileter hidrochinona 0,55
monobenzileter hidrochinona 0,58
SCOP SI DOMENIU DE APLICARE
Aceasta metoda reglementeaza procedeul pentru determinarea hidrochinonei,
monometileter hidrochinonei, monoetileter hidrochinonei, monobenzileter
hidrochinonei in produsele cosmetice pentru albirea pielii.
PRINCIPIU
Proba este extrasa cu un amestec de apa / metanol in conditii de incalzire
usoara pentru topirea oricarui material gras. Determinarea analitilor in solutia
rezultata este realizata prin cromatografie de lichide cu faza inversa cu
detectie UV.
REACTIVI
Toti reactivii trebuie sa fie de puritate analitica. Apa folosita trebuie sa fie apa distilata sau apa de puritate cel putin echivalenta.
Metanol
Hidrochinona
Monometieter hidrochinona
Monoetileter hidrochinona
Monobenzileter hidrochinona (monobenzona)
Tetrahidrofuran, puritate HPLC
Amestec apa/metanol 1 : 1 (v/v). Se amesteca un volum de apa si un volum de metanol (3.2)
Faza mobila: amestec tetrahidrofuran / apa 45 : 55 (v/v). Se amesteca 45 volume tetrahidrofuran (3.7) si 55 volume apa.
Solutie de referinta
Intr-un balon cotat de 50 ml se cantaresc 0,06 g hidrochinona (3.4), 0,08 g
monometileter hidrochinona (3.4), 0,10 g monoetileter hidrochinona (3.5) si
0,12g monobenzileter hidrochinona (3.6). Se dizolva si se aduce la semn cu
metanol (3.2). Se prepara solutia de referinta prin diluarea a 10,00ml din
aceasta solutie la 50,00ml cu amestec apa/metanol (3.8). Aceste solutii trebuie
sa fie proaspat preparate.
APARATURA
Echipament normal de laborator si:
Baie de apa, capabila de mentinerea temperaturii la 60 C.
Cromatograf de lichide de inalta performanta HPLC cu detector UV
cu lungime de unda variabila si ciclu de injectie de 10ml.
Coloana analitica:
Coloana cromatografica de otel inoxidabil, lungime 250 mm, diametru interior
4,6 mm, umplututa cu fenil Zorbax (fenetilsilan legat chimic pe Zorbax SIL,
la capete cu trimetilclorsilan), dimensiune de particule 6mm, sau echivalent.
Nu se foloseste o coloana de siguranta, cu exceptia sigurantei de fenil, sau
echivalent.
Hartie de filtru, diametru 90mm, Schleicher si Schull, Weissband nr.
5892, sau echivalent.
PROCEDEU
Preparare proba
Intr-un balon cotat de 50 ml se cantaresc cu precizie la a treia zecimala 1
g ("a" grame) proba. Se disperseaza proba in 25 ml amestec apa/metanol
(3.8). Se inchide balonul si se agita puternic pana la obtinerea unei suspensii
omogene. Se agita cel putin un minut. Se pune balonul intr-o baie de apa (4.1)
si se mentine la 60 C pentru imbunatatirea extractiei. Se raceste balonul si se
aduce la semn cu apa/metanol (3.8). Se filtreaza extractul folosind hartie de
filtru (4.4). Se realizeaza determinarea HPLC intr-un interval de cel mult 24
ore de la pregatirea extractului.
Cromatografiere de lichide de inalta performanta(HPLC)
Se regleaza debitul de curgere al fazei mobile (3.9) la 1,0 ml/min si se seteaza lungimea de unda a detectorului la 295 nm.
Se injecteaza 10ml solutie proba obtinuta conform descrierii de la punctul 5.1, si se inregistreaza cromatograma. Se masoara suprafetele picurilor. Se realizeaza etalonarea conform descrierii din 5.2.3. Se compara cromatogramele obtinute pentru proba si solutiile de referinta. Se folosesc suprafetele picurilor si factorii de raspuns (RF) calculati la 5.2.3. pentru a calcula concentratia substantelor analizate in solutia proba.
Etalonare
Se injecteaza 10ml solutie de referinta (3.10) si se inregistreaza cromatograma. Se injecteaza de mai multe ori pana cand este obtinuta o suprafata a picului constanta.
Se determina factorul de raspuns Rfi :
|
|
in care :
pi = suprafata picului pentru hidrochinona, monometileter hidrochinona, monoetileter hidrochinona sau monobenzileter hidrochinona, si
ci = concentratia (g/50 ml) in solutia de referinta (3.10) a hidrochinonei, monometileter hidrochinonei, monoetileter hidrochinonei sau monobenzileter hidrochinonei
Asigurati-va ca cromatogramele obtinute pentru o solutie standard si solutia proba sa indeplineasca urmatoarele cerinte:
-- separarea picului celei mai prost separate perechi trebuie sa fie de cel putin 0,90 (pentru definitia separarii picului, vezi figura 1)
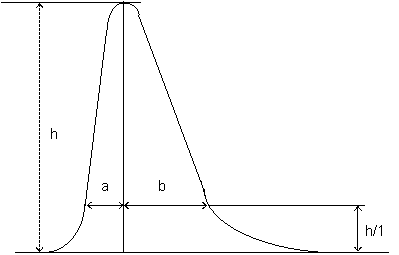
Figura 1 : Separarea picului
Daca nu se realizeaza separarea ceruta, sau trebuie folosita o coloana mai
eficienta sau trebuie ajustata compozitia fazei mobile pana la indeplinirea
cerintei.
-- factorul de asimetrie As al tuturor picurilor obtinute trebuie sa fie cuprins intr-un interval de la 0,9 pana la 1,5 (pentru definirea factorului de asimetrie As, vezi figura 2) pentru a inregistra cromatograma pentru determinarea factorului de asimetrie se recomanda o viteza de inregistrare a graficului hartiei de cel putin 2 cm/minut.

Figura 2: Factor de asimetrie a picului
Trebuie sa se obtina o linie de baza continua.
CALCUL
Se folosesc suprafetele picurilor corespunzatoare substantelor analizate pentru a calcula concentratiile acestora in proba. Se calculeaza concentratia substantelor analizate in proba, ca
|
procent masic (xi) , folosind urmatoarea formula |
|
|
in care:
a = masa probei in grame, si
bi = suprafata picului corespunzator substantei analizate "i" in proba
REPETABILITATE (ISO 5725 )
Pentru un continut de hidrochinona de 2,0 %, diferenta dintre rezultatele a doua determinari efectuate in paralel pe aceeasi proba nu trebuie sa depaseasca o valoare absoluta de 0,13 %.
Pentru un continut de monometileter hidrochinona de 1,0 %, diferenta dintre rezultatele a doua determinari efectuate in paralel pe aceeasi proba nu trebuie sa depaseasca o valoare absoluta de 0,1%.
Pentru un continut de monoetileter hidrochinona de 1,0 %, diferenta dintre rezultatele a doua determinari efectuate in paralel pe aceeasi proba nu trebuie sa depaseasca o valoare absoluta de 0,11%.
Pentru un continut de monobenzileter hidrochinona de 1,0%, diferenta dintre rezultatele a doua determinari efectuate in paralel pe aceeasi proba nu trebuie sa depaseasca o valoare absoluta de 0,11 %.
REPRODUCTIBILITATE ( ISO 5725 )
Pentru un continut de hidrochinona de 2,0% diferenta dintre rezultatele a doua determinari efectuate pe aceeasi proba dar in conditii diferite (laboratoare diferite, operatori diferiti, aparatura diferita si/sau moment diferit) nu trebuie sa depaseasca o valoare absoluta de 0,37 %.
Pentru un continut de monometileter hidrochinona de 1,0% diferenta dintre rezultatele a doua determinari efectuate pe aceeasi proba dar in conditii diferite (laboratoare diferite, operatori diferiti, aparatura diferita si/sau moment diferit) nu trebuie sa depaseasca o valoare absoluta de 0,21%.
Pentru un continut de monoetileter hidrochinona de 1,0% diferenta dintre rezultatele a doua determinari efectuate pe aceeasi proba dar in conditii diferite (laboratoare diferite, operatori diferiti, aparatura diferita si/sau moment diferit) nu trebuie sa depaseasca o valoare absoluta de 0,19%.
Pentru un continut de monobenzileter hidrochinona de 1,0% diferenta dintre rezultatele a doua determinari efectuate pe aceeasi proba dar in conditii diferite (laboratoare diferite, operatori diferiti, aparatura diferita si/sau moment diferit) nu trebuie sa depaseasca o valoare absoluta de 0,11 %.
OBSERVATII
Cand se intalneste un continut de hidrochinona considerabil mai mare decat 2% si este necesara o estimare precisa a continutului, extractul proba (5.1) trebuie sa fie diluat la o concentratie similara cu cea care ar fi obtinuta dintr-o proba continand 2% hidrochinona, si determinarea repetata.
(Pentru unele instrumente absorbanta poate depasi limitele de detectare pentru
concentratii inalte de hidrochinona).
Interferente
Metoda descrisa mai sus permite determinarea hidrochinonei si a eterilor sai
intr-un singur ciclu izocratic. Folosirea coloanei de fenil asigura o retentie
suficienta pentru hidrochinona, care nu poate fi garantata cand este folosita o
coloana C18 cu faza mobila descrisa.
Oricum, aceasta metoda este predispusa la interferente din cauza unui numar
de parabeni (derivati parabenzenici). In aceste cazuri determinarea trebuie
repetata cu un sistem diferit faza mobila / faza stationara.
Metode adecvate pot fi gasite in lucrarile de referinta 1 si 2, si anume:
Coloana: Zorbax ODS, 4,6 mm x 25 mm, sau echivalent:
temperatura: 36 C
debit: 1,5 ml/min
faza mobila, pentru:
hidrochinona: metanol / apa 5 / 95 (V/V )
monometileter hidrochinona: metanol / apa 30 / 70 (V/V)
monobenzileter hidrochinona: metanol/apa 80/20(V/V)(1)
Coloana: Spherisorb S5-ODS, sau echivalent:
faza mobila: apa / metanol 90 / 10 (V/V)
debit: 1,5 ml/min
Aceste conditii sunt adecvate pentru hidrochinona (2).
(1) M. Herpol-Borremans et M.-O. Masse, Identification et dosage de l'hydroquinone et de ses ethers methylique et benzylique dans les produits cosmetiques pour blanchir la peau. Int. J. Cosmet. Sci. 8-203-214 (1986).
(2) J. Firth and I. Rix, Determination of hydroquinone in skin toning creams, Analyst (1986), 111, p. 129.
ANEXA nr. 39
IDENTIFICAREA SI DETERMINAREA 2- FENOXIETANOLULUI,
1- FENOXIPROPAN-2-0LULUI, 4-HIDROXIBENZOATULUI DE METIL, ETIL, PROPIL, BUTIL SI BENZIL IN PRODUSELE COSMETICE
1. Obiectul si domeniul de aplicare
Prezenta metoda specifica un procedeu (CSS) care, in combinatie cu metoda de determinare descrisa in sectiunea B, permite identificarea 2 fenoxietanolului, 1-fenoxipropan-2-olului, 4-hidroxibenzoatului de metil, 4-hidroxibenzoatului de etil, 4-hidroxibenzoatului de propil, 4‑hidroxibenzoatului de butil si 4-hidroxibenzoatului de benzil in produsele cosmetice.
2. Principiu
Conservantii sunt extrasi din probele cosmetice acidificate cu acetona. Dupa filtrare, solutia de acetona este amestecata cu apa si, intr-un mediu alcalin, acizii grasi sunt precipitati sub forma sarurilor lor de calciu. Amestecul alcalin acetona/apa este extras cu dietileter pentru a indeparta substantele lipofilice. Dupa acidificare, conservantii sunt extrasi cu dietileter. O portiune din extractul dietileteric este picurata pe o placa pentru cromatografie in strat subtire acoperita cu silicagel. Dupa developarea placii, cromatograma obtinuta este observata in lumina UV si vizualizata prin utilizarea reactivului Millon.
3.Reactivi
3.1.Generalitati
Toti reactivii utilizati trebuie sa fie de puritate analitica. Apa este apa distilata sau apa de cel putin aceeasi puritate.
3.2 Acetona
3.3. Dietileter
3.4. n-Pentan
3.5. Metanol
3.6. Acid acetic glacial
3.7. Solutie de acid clorhidric, c(HCl) = 4 mol/l
3.8. Solutie de hidroxid de potasiu, c(KOH) = 4 mol/l
3.9. Clorura de calciu dihidratata (CaCl2.2H2O)
3.10. Reactiv de detectare: reactiv Millon
Reactivul Millon (azotat de mercur (II)) este o solutie gata preparata, disponibila in comert (Fluka 69820).
3.11. 2-Fenoxietanol
3.12. 1-Fenoxipropan-2-ol
3.13. 4-hidroxibenzoat de metil (metilparaben)
3.14. 4-hidroxibenzoat de etil (etilparaben)
3.14 4-hidroxibenzoat de n-propil (propilparaben)
3.15. 4-hidroxibenzoat de n-butil (butilparaben)
3.16. 4-hidroxibenzoat de benzil (benzilparaben)
3.18. Solutii de referinta
Se prepara solutii 0,1% (m/v) in metanol din fiecare din substantele de referinta 3.11, 3.12, 3.13, 3.14, 3.15, 3.16 si 3.17.
3.19. Solvent de developare
Se amesteca 88 volume de n-pentan (3.4.) cu 12 volume de acid acetic glacial (3.6.).
4.Aparatura
Echipament obisnuit de laborator si:
4.1.Baie de apa, capabila de mentinerea unei temperaturi de 60C
4.2.Tanc de developare (necaptusit cu hartie de filtru)
4.3. Sursa de lumina UV, 254 nm
4.4. Placi pentru cromatografie in strat subtire, 20 cm x 20 cm, preacoperite cu 0,25 mm silicagel 60F254 , cu zona concentratoare (Merck No. 11798, Darmstadt sau echivalent)
4.5. Cuptor capabil de mentinerea unei temperaturi pana la 105C
4.6.Uscator pentru par cu aer fierbinte
4.7.Rola pentru vopsirea lanii, lungime aproximativ 10 cm, diametru exterior aproximativ 3,5 cm. Grosimea stratului de lana va fi de 2 pana la 3 mm. daca este necesar, lana se ajusteaza.
A se vedea nota de la 5.2.
4.8 Vase de sticla de 50 ml cu dop filetat
4.9.Plita cu incalzire electrica, cu termostat pentru controlul temperaturii. Reglarea temperaturii: aproximativ 80C. Plita se acopera cu o placa de aluminiu de 20 x 20 cm si grosime de aproximativ 6 mm, pentru a obtine o distributie uniforma a temperaturii.
5.Procedura
5.1.Pregatirea probei
intr-un vas de sticla de 50 ml cu dop filetat (4.8) se cantareste aproximativ 1g de proba. Se adauga patru picaturi de solutie de acid clorhidric (3.7.) si 40ml de acetona.
Pentru produsele cosmetice puternic bazice, cum ar fi sapunul de toaleta, se adauga 20 de picaturi de solutie de acid clorhidric. Se inchide eprubeta, se incalzeste usor amestecul pana la aproximativ 60C pentru a facilita extragerea conservantilor in faza de acetona si se agita puternic timp de un minut.
Se masoara pH-ul solutiei cu
hartie indicatoare de pH si se regleaza pH-ul solutiei ![]() 3 cu solutie de
acid clorhidric. Se agita din nou puternic timp de un minut.
3 cu solutie de
acid clorhidric. Se agita din nou puternic timp de un minut.
Se raceste solutia la temperatura camerei si se filtreaza prin hartie de filtru intr-un pahar conic. Se transfera 20ml din filtrat intr-un pahar conic de 200ml, se adauga 60ml apa si se amesteca. Se regleaza pH-ul amestecului la aproximativ 10 cu hidroxid de potasiu (3.8.), folosind hartie indicatoare de pH.
Se adauga 1g clorura de calciu dihidratata (3.9.) si se agita puternic. Se filtreaza solutia prin hartie de filtru intr-o palnie de separare de 250ml continand 75ml dietileter si se agita puternic timp de un minut. Se lasa fazele sa se separe si se colecteaza stratul apos intr-un pahar conic de 200 ml. se regleaza pH-ul solutiei la aproximativ 2 cu solutie de acid clorhidric, folosind hartie indicatoare de pH. Ulterior se adauga 10ml dietileter si se agita puternic timp de un minut. Se lasa ca fazele sa se separe si se transfera aproximativ 2ml din stratul dietileteric intr-o fiola de proba de 5 ml.
Cromotografie in strat subtire (CSS)
Se pune o placa pentru (CSS) (4.4) pe placa de aluminiu incalzita (4.9.). Se pun 10μl din fiecare dintre solutiile de referinta (3.18.) si 100μl de solutie de proba (5.1.) pe linia de start a zonei concentratoare a placii pentru (CSS).
Daca se doreste, se poate folosi un curent de aer care faciliteaza evaporarea solventului. Se indeparteaza placa pentru (CSS) de pe plita si se lasa sa se raceasca la temperatura camerei. Se transfera 100ml solvent de developare (2.19) intr-un tanc de developare (4.2.).
Se pune imediat placa pentru (CSS) in camera nesaturata si se developeaza la temperatura camerei pana cand frontul de solvent avanseaza aproximativ 15cm fata de linia de pornire. Se indeparteaza placa din tancul de developare si se usuca intr-un curent de aer fierbinte cu ajutorul unui uscator pentru par cu aer fierbinte.
Se examineaza placa in lumina UV (4.3.) si se marcheaza pozitia spoturilor. Se incalzeste placa timp de 30 de minute intr-un cuptor (4.5.) la 100C pentru a indeparta excesul de acid acetic. Se vizualizeaza conservantii din cromatograma cu ajutorul reactivului Millon, prin inmuierea in reactiv a rolelor pentru vopsire si rularea peste placa pentru (CSS) pana la udare uniforma.
Nota: Ca alternativa, spoturile pot fi vizualizate in lumina UV prin aplicarea cu grija a unei picaturi din reactivul Millon pe fiecare spoturi marcata.
Esterii acidului 4-hidroxibenzoic apar ca spoturi rosii, 2-fenoxietanolul si 1-fenoxipropan-2-olul ca spoturi galbene.
De remarcat ca acidul 4-hidroxibenzoic insusi, care poate fi prezent in probe drept conservant sau drept produs de descompunere al derivatilor hidroxiparabenzoatici, apare de asemenea ca un spot rosu. A se vedea 7.3. si 4.4.
6.Identificare
Se calculeaza valoarea Rf pentru fiecare spot. se compara spoturi obtinute pentru solutia de proba cu acelea ale solutiilor de referinta, din punct de vedere al valorilor Rf, al comportamentului in radiatie ultravioleta si al culorii dupa vizualizare. Se trag concluzii preliminare asupra identitatii conservantilor.
Daca apar ca prezenti derivati hidroxiparabenzoatici, trebuie realizata procedura prin HPLC descrisa in sectiunea B. Se combina rezultatele obtinute prin (CSS) si prin cromatografiei de lichid de inalta performanta (HPLC) pentru a confirma prezenta a 2-fenoxietanolului, 1-fenoxipropan-2-olului si a derivatilor hidroxiparabenzoatici.
7.Observatii
7.1.Din cauza toxicitatii reactivului Millon, acesta se aplica cel mai bine printr-unul dintre procedeele descrise. Nu este recomandata pulverizarea.
7.2.Alti compusi continand grupari hidroxil pot de asemenea colora reactivul Millon. Un tabel continand culori si valori ale Rf obtinute pentru un numar de conservanti folosind acest procedura prin (CSS) poate fi gasit in: N. de Kruijf, M.A.H. Rijk, L.A. Pranato-Soetardhi si a. Schouten (1987): Determination of preservatives in cosmetic products I: Thin-layer chromatographic procedure for the identification of preservatives in cosmetic products (J. Chromatography 410, 395-411).
7.3.valorile Rf enumerate in urmatorul tabel servesc ca indicatie a valorilor care ar putea fi obtinute.
|
Compus |
hRf |
Culoare |
|
acid 4-hidroxibenzoic metilparaben etilparaben propilparaben butilparaben benzilparaben 2-fenoxietanol 1-fenoxipropan-2-ol |
rosu rosu rosu rosu rosu rosu galben galben |
Nu se obtine nici o separare pentru acidul 4-hidroxibenzoic si metilparaben sau pentru benzilparaben si etilparaben. Identificarea acestor compusi trebuie confirmata prin aplicarea procedurii prin HPLC descrisa in sectiunea B si compararea timpilor de retentie obtinuti pentru proba cu cei ai standardelor.
B. DETERMINARE
1.Obiectul si domeniul de aplicare
Prezenta metoda specifica un procedeu pentru determinarea 2‑fenoxietanolului, 1-fenoxipropan-2-olului, 4-hidroxibenzoatului de metil, 4-hidroxibenzoatului de etil, 4-hidroxibenzoatului de propil, 4‑hidroxibenzoatului de butil si 4-hidroxibenzoatului de benzil in produsele cosmetice.
2.Definitie
Cantitatile de conservanti determinate prin aceasta metoda sunt exprimate ca procente masice.
3.Principiu
Proba este acidificata prin adaugare de acid sulfuric si apoi suspendata intr-un amestec de etanol si apa. Dupa incalzirea usoara a amestecului pentru topirea fazei grase in vederea sustinerii extractiei cantitative, amestecul este filtrat.
Conservantii din filtrat sunt determinati prin HPLC cu faza inversa utilizand 4-hidroxibenzoat de izopropil ca standard intern.
4.Reactivi
4.1.Generalitati
Toti reactivii trebuie sa fie de puritate analitica si adecvati pentru HPLC, cand este cazul. Apa este apa distilata sau apa de puritate cel putin echivalenta.
4.2. Etanol absolut.
4.3. Fenoxietanol.
4.4. Fenoxipropan-2-ol.
4.5. hidroxibenzoat de metil (metilparaben)
4.6. hidroxibenzoat de etil (etilparaben)
4.7. hidroxibenzoat de n-propil (propilparaben)
4.8. hidroxibenzoat de izopropil (izopropilparaben)
4.9. hidroxibenzoat de n-butil (butilparaben)
4.10. hidroxibenzoat de benzil (benzilparaben)
4.11. Tetrahidrofuran
4.12. Metanol
4.13. Acetonitril
4.14. Solutie de acid sulfuric C(H2SO4) = 2 mol/l
4.15. Amestec etanol / apa
Se amesteca noua volume de etanol (4.2) si un volum de apa.
4.16.Solutie de standard intern
se cantaresc cu precizie 0,25g izopropilparaben (4.8), se transfera intr un balon cotat de 500 ml, se dizolva si se aduce la semn cu amestec etanol / apa (4.15).
4.17.Faza mobila: amestec tetrahidrofuran / apa / metanol / acetonitril.
Se amesteca 5 volume tetrahidrofuran, 60 volume de apa, 10 volume de metanol si 25 volume de acetonitril.
4.18.Solutie stoc de conservant
intr-un balon cotat de 100 ml se cantaresc cu precizie 0,2 g 2 fenoxietanol, 0,2 g 1-fenoxipropan-2-ol, 0,05g metilparaben, 0,05g etilparaben, 0,05 g propilparaben, 0,05g butilparaben si 0,025g benzilparaben, se dizolva si se aduce la semn cu amestec etanol / apa.
Pastrata in frigider, solutia este stabila timp de o saptamana.
4.19.Solutii standard de conservant
Din solutia stoc (4.18) se transfera in cinci baloane cotate de 50 ml, 20,00 ml, 10,00 ml, 5,00 ml, 2,00 ml si respectiv 1,00 ml. In fiecare balon se adauga 10,00 ml solutie standard intern (4.16) si 1,0 ml solutie de acid sulfuric (4.14) si se aduce la semn cu amestec etanol / apa. Aceste solutii trebuie sa fie proaspat preparate.
Echipament de laborator obisnuit si:
5.1.Baie de apa, capabila de mentinerea temperaturii la 60C1C.
5.2.Cromatograf de lichid de inalta performanta cu detector UV, lungime de unda 280 nm.
5.3.Coloana analitica:
Otel inoxidabil, 25 cm x 4,6 mm diametru interior (sau 12,5 cm x 4,6 mm diametru interior), umpluta cu Nucleosil 5C18 sau echivalent (vezi 10.1).
5.4. Vase de sticla de 100 ml cu dop filetat.
5.5.Granule pentru omogenizarea fierberii, carborundum, dimensiuni 2-4 mm sau echivalent.
6. Procedura
Prepararea probe
Pregatirea probei fara adaos de standard intern
intr-un vas de sticla de 100ml cu dop filetat se cantareste aproximativ 1,0g de proba. Se pun cu pipeta in eprubeta 1,0 ml solutie de acid sulfuric (4.14) si 50,0 ml amestec etanol / apa (4.15). Se adauga 1g de granule pentru omogenizarea fierberii (5.5), se inchide eprubeta si se agita puternic pana la obtinerea unei suspensii omogene. Se agita timp de cel putin un minut. Se introduce eprubeta pentru cinci minute intr-o baie de apa (5.1) mentinuta la 60C1C pentru a facilita extractia conservantilor in faza de etanol.
Vasul se raceste imediat intr-un curent de apa rece si se depoziteaza extractul in frigider pentru o ora. Se filtreaza extractul folosind hartie de filtru. se transfera aproximativ 2ml de filtrat intr-o fiola de proba de 5ml. Se depoziteaza extractele in frigider si se realizeaza determinarea HPLC intr-un interval de 24 ore.
Pregatirea probei cu adaos de standard intern
intr-un vas de sticla de 100ml cu dop filetat se cantareste cu precizie de trei zecimale 1,0 g0,1 g de proba.
Se pun cu pipeta in vas 1,0ml solutie de acid sulfuric si 40,0ml amestec etanol / apa. Se adauga aproximativ 1g de granule pentru omogenizarea fierberii (5.5.) si exact 10,00ml solutie standard. se inchide vasul si se agita puternic pana la obtinerea unei suspensii omogene. Se agita timp de cel putin un minut. Se introduce eprubeta pentru cinci minute intr-o baie de apa (5.1) mentinuta la 60C1C pentru a facilita extractia conservantilor in faza de etanol.
Se raceste imediat tubul intr-un curent de apa rece si se depoziteaza extractul in frigider pentru o ora. Se filtreaza extractul folosind hartie de filtru.
Se transfera aproximativ 2ml de filtrat intr-o fiola de proba de 5ml (solutie de analizat). se depoziteaza in frigider si se realizeaza determinarea HPLC intr-un interval de 24 ore.
6.2.Cromatografie de lichid de inalta performanta (HPLC)
6.2.1.Conditii pentru cromatografie
- Faza mobila: amestec tetrahidrofuran / apa / metanol / acetonitril;
- Debit: 1,5 ml/minut
- Lungime de unda a detectiei: 280 nm.
6.2.2.Etalonare
Se injecteaza 10μl din fiecare dintre solutiile standard de conservant (4.19). Din cromatogramele obtinute se determina rapoartele dintre picurile pentru solutiile standard de conservant si picurile pentru standardul intern. Se trateaza o curba pentru fiecare conservant, punand in relatie aceste rapoarte cu concentratiile solutiilor standard.
Determinare
Se injecteaza 10μl solutie de proba fara standard intern (6.1.1) in cromatograf si se inregistreaza cromatograma.
Se injecteaza 10μl din una dintre solutiile standard de conservant (4.19) si se inregistreaza cromatograma. Se compara cromatogramele obtinute.
Daca in cromatograma extractului proba (6.1.1) nu este prezent nici un pic avand aproximativ acelasi timp de retentie ca cel corespunzator isopropilparabenului (standardul intern recomandat), se continua prin injectarea a 10μl solutie de proba cu standard intern (6.1.2). Se inregistreaza cromatograma si se masoara inaltimile picurilor.
Daca se observa un pic ce interfereaza in cromatograma solutiei proba avand aproximativ acelasi timp de retentie ca cel corespunzator izopropilparabenului, trebuie selectat alt standard intern.
Daca unul dintre conservantii examinati este absent in cromatograma probei, acest conservant, acesta poate fi utilizat ca standard intern alternativ.
Se calculeaza rapoartele dintre inaltimile picurilor pentru conservantii investigati si inaltimea picului intern.
Se verifica daca pentru solutiile standard folosite in procedura de etalonare se obtine un raspuns liniar.
Se verifica daca urmatoarele cerinte sunt indeplinite de cromatogramele obtinute pentru o solutie standard si solutia de proba:
separarea picurilor celei mai prost separate perechi trebuie sa fie de cel putin 0,90 (Pentru definitia picului de separare, vezi figura 1.).
Varf de separare (p)
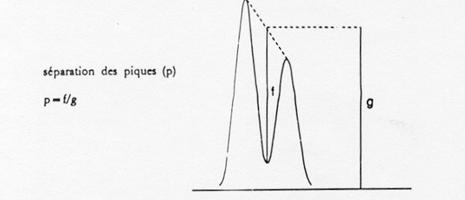
Figura 1: Pic de separare
Daca nu se realizeaza separarea ceruta, sau trebuie folosita o coloana mai eficienta sau trebuie ajustata compozitia fazei mobile pana la indeplinirea cerintei.
Factorul de asimetrie al tuturor picurilor obtinute, As, trebuie sa fie cuprins intr-un interval de la 0,9 pana la 1,5. (Pentru definitia factorului de asimetrie As, vezi figura 2.). pentru a inregistra cromatograma pentru determinarea factorului de asimetrie se recomanda o viteza a graficului de cel putin 2 cm/minut.
Factor de asimetrie (AS)
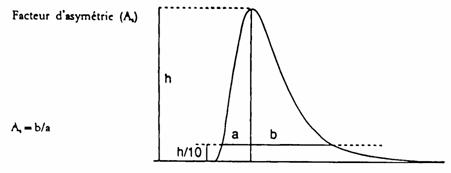
Figura 2: Factor de asimetrie a picurilor
Trebuie sa se obtina o linie de baza continua.
7. Calcul
Pentru a calcula concentratiile conservantilor in solutia de proba se folosesc curba de etalonare (6.2.2) si rapoartele dintre picurilor corespunzatoare conservantilor investigati si picului corespunzator standardului intern. Se calculeaza continutul de 2 fenoxietanol, 1-fenoxipropan-2-ol, 4-hidroxibenzoat de metil, 4‑hidroxibenzoat de etil, 4-hidroxibenzoat de propil, 4-hidroxibenzoat de butil si 4-hidroxibenzoat de benzil ca procent masic (% m/m), folosind formula urmatoare:
% wI (m/m) ![]()
in care:
bi = concentratia (μg/ml) conservantului "i" in solutia analizata, citita de pe curba de etalonare si
a = masa (g) portiunii analizate.
8. Repetabilitate([1])
A se vedea observatiile de la punctul 10.5.
9. Reproductibilitate(1)
A se vedea observatiile de la punctul 10.5.
10. Observatii
10.1. Faza stationara
Comportarea de retentie a substantelor dizolvate in determinarile HPLC este puternic dependenta de tipul, calitatea si istoria fazei stationare. Daca o coloana poate fi folosita pentru separarea conservantilor examinati, se poate concluziona din rezultatele obtinute pentru solutiile standard (vezi observatii, 6.2.3.). In plus fata de materialul propus pentru umplutura coloanei, s-a descoperit ca sunt adecvate de asemenea si Hypersil ODS si Zorbax ODS.
Alternativ, compozitia fazei mobile recomandate poate fi optimizata in vederea obtinerii separarii cerute.
10.2. Lungimea de unda a detectiei
Un test de rezistenta pe metoda descrisa a aratat ca o usoara schimbare in lungimea de unda a detectiei poate avea un efect major asupra rezultatelor determinarii.
De aceea, acest parametru trebuie controlat cu atentie pe durata analizelor.
10.3. Interferente
In conditiile descrise pentru prezenta metoda, multi alti compusi - cum ar fi conservantii si aditivii cosmetici - sunt de asemenea eluati. Timpii de retentie ai unui mare numar de conservanti mentionati in anexa VI a directivei Consiliului privind produsele cosmetice sunt enumerati in: N. de Kruijf, M.A.H. Rijk, L.A. Pranato-Soetardi si A. Schouten, (1989): Determination of preservatives in cosmetic products II. High-performance liquid chromatographic identification. (J. Chromatography 469, 317-398).
10.4. Pentru a proteja coloana analitica, se poate folosi o coloana de siguranta adecvata.
10.5. Metoda a fost cercetata intr-un test in colaborare la care au participat noua laboratoare. Au fost analizate trei probe. Urmatorul tabel contine, pentru fiecare dintre cele trei probe, media in % m/m (m), repetabilitatile (4) si reproductibilitatile (R) descoperite pentru substantele analizate pe care acestea le contin:
|
Proba |
2-fenoxi- etanol |
1-fenoxi- propan-2-ol |
Metilparaben |
Etilparaben |
Propilparaben |
Butilparaben |
Benzilparaben |
||||||
|
Crema cu vitamine |
m r R | ||||||||||||
|
Crema antirid |
m r R | ||||||||||||
|
Crema de masaj |
m r R | ||||||||||||
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3797
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved