| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
PROBLEME TERMOCHIMIE
1. Pentru obtinerea oxizilor de sulf SO2 si SO3, s-au propus si urmatoarele reactii:
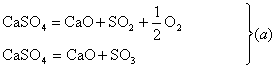
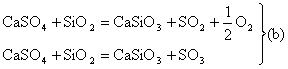
Sa se arate ca reactiile de tip (b) sunt mai economice din punctul de vedere al bilantului termic.
2. Caldurile de ardere ale glucozei si alcoolului etilic la 18 oC si 1 at sunt ΔHc = -674,0, respectiv -326,66 kcal · mol-1.
Sa se calculeze caldura de reactie la obtinerea a 1 mol alcool etilic din glucoza, prin fermentatie la 18 oC si 1 at (se neglijeaza caldurile de diluare).
3. Caldurile de neutralizare ale acizilor HCl (+200 H2O) si CH3COOH (+200 H2O) cu NaOH (+200 H2O) fiind -13,78, respectiv -13,40 kcal · mol-1, sa se calculeze caldura de disociere a acidului acetic.
4. Sa se explice urmatoarele rezultate experimentale:
HCl(aq) + AgNO3(aq) = AgCl + HNO3(aq);
ΔH298 = -15800 cal;
KCl(aq) + AgNO3(aq) = AgCl + KNO3(aq);
ΔH298 = -15800 cal;
![]() ;
;
ΔH298 = -15800cal;
CsCl(aq) + AgCH3COO(aq) = AgCl + CsCH3COO(aq);
ΔH298 = -15800 cal.
5. Cresterea temperaturii la arderea a 1 g de
zaharoza (standard) intr-un calorimetru adiabatic este 1,481o.
Caldura de ardere la volum constant este ![]() zaharoza (la 18 oC).
zaharoza (la 18 oC).
Cunoscand cresterile de temperatura in acelasi calorimetru, corespunzatoare arderii a cate 1 g din substantele:
benzen 3,751o; propil-benzen 3,890o
toluen 3,817o; izopropil-benzen 3,893o
mezitilena 3,882o; pseudocumen 3,873o
sa se calculeze caldurile de ardere ale acestor substante la volum constant.
6. Reactia care are loc in acumulatoarele de plumb poate fi formulata astfel:
![]()
Sa se calculeze caldura degajata la transformarea a 1 kg plumb metalic in PbSO4, care a avut loc la descarcarea ireversibila a acumulatoarelor.
7. La determinarea intr-o bomba calorimetrica a caldurii de formare a CO2 din grafit si oxigen s-au obtinut urmatoarele date:
a) valoarea medie a unei serii de sase determinari a cresteri rezistentei termometrului cu platina, corespunzatoare cresterii de temperatura, este 0,0649920 Ω pentru 1g CO2 format;
b) valoarea medie a sapte determinari pentru raportul dintre energia electrica necesara producerii unei variatii standard de temperatura a calorimetrului si variatia corectata de tmperatura a calorimetrului, este 137740 J, pentru o crestere de rezistenta de 1 Ω. Temperaturile initiala si finala sunt 23,5, respectiv 26,5 oC.
8. Intr-un calorimetru cu apa, prevazut cu termometru si agitator, se introduce un vas inchis de argint si o rezistenta R1. In vasul de argint, umplut cu hidrogen, se afla un creuzet cu CuO, infasurat intr-o rezistenta R2. Determinarea incepe cu incalzirea creuzetului prin rezistenta R2 timp de 45s. Reactia reducerii incepe dupa incalzire, iar la sfarsitul reducerii se constata o crestere a temperaturii de 0,5769 oC. Presiunea hidrogenului se mentine constanta prin introducerea continua de gaz in vasul de reactie. Trecerea curentului prin rezistenta R2 provoaca o crestere a temperaturii de 0,1995 oC in 45s.
Se trece un curent de 1,702 A prin rezistenta R1, timp de 5 minute. Tensiunea medie aplicata la R1 este 4,296V si cresterea corespunzatoare de temperatura este 0,6136 oC. In determinarea experimentala, scaderea in greutate a creuzetului (dupa uscare) este de 162,2 mg.
Sa se calculeze caldura de formare ΔH pentru 1 mol CuO din elemente, in aceste conditii (18 oC si 1 at), cunoscand caldura de formare a apei. Se neglijeaza vaporii de apa din aparat.
9. Un calorimetru cu gheata este format dintr-un vas deschis, cu pereti subtiri, A, introdus in vasul inchis B, care contine apa si gheata si care este prevazut cu un tub capilar cu mercur.
Prin schimbul de caldura, cantitatea de gheata se micsoreaza sau creste si mercurul intra sau iese din vasul B prin capilara.
In trei experiente succesive, vasul A contine
initial 10 ml solutie J2, respectiv JCl3 si HCl. Prin
dizolvarea in vasul A a 98,6 mg Au, respectiv 60,9 mg Cl2 si 171,0
mg AuCl, in vasul B patrund 143,6, 187,9, respectiv 195,8 mg Hg. Sa se determine
entalpia reactiei ![]() .
.
Se va presupune ca iodul si clorul sunt in
solutie sub forma J2, ![]() si
si ![]() .
.
Volumul specific al ghetii si apei la 0 oC este 1,0907, respectiv 1,0001 cm3 · g-1 si caldura de topire a ghetei este 79,67 cal · g-1.
10. Intr-un calorimetru se introduc doua vase A si B. Vasele sunt legate printr-un tub cu robinet. Temperatura calorimetrului este masurata printr-un termocuplu legat la un galvanometru cu oglinda cu o scala centimetrica. Citirea pe scala este proportionala cu diferenta de temperatura.
Se executa doua determinari:
a) Initial, in A se afla clor, iar in B se afla hidrogen. Deschizand robinetul, gazele se combina si, in final, vasele contin 334,4 μmol HCl, restul fiind clor. Deplasarea spotului luminos pe scala este de 24,88 cm.
b) Initial, in A se afla clor, iar in B se afla acid iodhidric. Combinarea corespunde unei deplasari de 35,39 cm a spotului luminos. Analiza arata ca, in final, in vas se gasesc 187,3 μmol J2, restul fiind HJ si HCl.
Sa se determine caldura de formare la presiune si la volum constant a acidului iodhidric, la temperatura experientei (25 oC), cunoscand entalpia de formare a acidului clorhidric (-22,00 kcal). Se va neglija cantitatea de JCl formata si diferenta de capacitati calorice in cele doua determinari.
11. Din urmatoarele date sa se calculeze afinitatea fata de electron a clorului (-ΔH) la 0 K (reactia Cl + e = Cl-).
Caldura de sublimare a Na(s) este 25,1 kcal · mol-1 (la 18oC si presiune constanta).
Caldura de disociere a Cl2(g) in atomi este 57,6 kcal · mol-1 (la 18 oC si presiune constanta).
Caldura de formare a NaCl din Cl2(g) si Na(s) este ΔH = -98,3 kcal · mol-1 (la 18 oC si presiune constanta).
Energia de ionizare a atomilor de sodiu (Na → Na+ + e) la 0 K este ΔU = 117,9 kcal, determinata din spectrul de linii al sodiului gaz.
Energia de retea calculata a NaCl (-ΔU la formarea NaCl din Na+ si Cl-) este 183,1 kcal.
Caldura necesara pentru incalzirea unui mol NaCl(s) si a unui mol Na(g) + Cl(g) de la 0 la 18 oC la 1 at este 2,4, respectiv 2,9 kcal · mol-1.
12. Sa se stabileasca reactiile posibile pentru a masura calorimetric entalpiile de formare la 25 oC ale substantelor: CaCl2 · 6H2O, C2H5OH(l), N2O(g), C6H5Cl(l) si CS2(l).
*13. Sa se calculeze caldura de formare a amoniacului la o presiune de 200 at si la temperatura de 659 oC.
*14. Sa se calculeze caldura de reactie pentru:
C2H2 + N2 = 2HCN
la temperaturile 298 si 1000 K, la presiunea de 1 at
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2448
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved