| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
DOCUMENTE SIMILARE |
||||
|
||||
Retele cristaline
Cristalele
Starea normala a materiei solide este cea cristalina. Aceasta este o stare de ordonare (aproape) perfecta a unitatilor de structura, adica a particulelor componente, atomi, ioni, molecule, ale substantelor; in contrast cu aceasta este starea de dezordine (aproape) totala a particulelor componente in gaze si lichide. In stare solida substantele se prezinta fie sub forma de cristale propiu zise, caracterizate prin forme geometrice vizibile macroscopic sau microscopic.
Caracteristica
pentru substantele cristalizate este trecerea brusca
de la starea solida la cea lichida, si invers, la o anumita temperature
Se cunosc si substante sau materiale solide, putine la numar, cum sunt sticlele, rasinele si smoala, in care particulele componente se afla intr-o stare de dezordine avansata sau completa. Aceste substante, numite amorfe, sunt compuse din molecule sau ioni de dimensiuni uriase in comparatie cu moleculele obisnuite (macromoleculele sau macroni).
Cristalele se formeaza fie din lichide (topituri) prin racire, fie din solutii saturare, prin racire (solubilitatea scazand de obicei cu temperature), sau prin evaporarea dizolvantului. Se formeaza uneori cristale si direct din vapori, prin racire (zapada), sau prin depunere pe suprafete reci (sublimare). Cristalele cresc cu viteza limitata, prin depunere de material pe fete.
Cristalizarea incepe in diferite puncte ale lichidului, numite germeni de cristalizare. Cristalele bine formate, de dimensiuni mari, se obtin atunci cand cristalizarea decurge incet, prin racire latenta, asa incat sa apara un numar mic de germeni de cristalizare si sa nu se produca curenti in lichid.
Cristalele se disting prin forme poliedrice, marginite prin fete plane, care se intretaie in muchii, ce se intalnesc in colturi. Formele cristalelor sunt
mult variate.
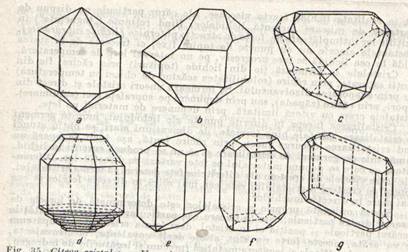
Fig.1
a. Un cristal ideal din sistemul hexagonal;
b. Un cristal deformat din acelasi sistem, asa cum poate aparea in natura;
c. Blenda, sulfura de zinc, ZnS, sistemul cubic;
d. Wurtzita, ZnS. sistem hexagonal;
e. Aragonita, carbonat de calciu, sistem Rombic;
f. Sulf, sistem Monoclinic;
g. Sulfat de cupru, sistem Triclinic.
Retele spatiale
S-a presupus inca de mult ca forma regulata a cristalelor este datorita constructiei lor perfect ordonate din particulele minuscule. Aceasta presupunere a fost intru totul confirmata mai tarziu prin cercetarea cristalelor cu raze X.
Daca am putea vedea unitatile de structura ale unui cristal (atomi, ioni, molecule), suprafata lui ne-ar aparea
ca un
In fiecare substanta cristalizata, particulele componente (atomi, ioni sau molecule), sunt aranjate dupa un anumit plan; cu alte cuvinte fiecare substanta are o retea spatiala proprie. Aceasta este caracterizata prin simetria ei, prin pozitiile unitatilor de structura, identice sau diferite, si prin distantele dintre ele. Pentru a descrie exact o retea este suficient sa cunoastem o mica portiune a ei, numita celula elementara sau paralelipiped elementar, care se repeta in cele trei directii ale spatiului, pana la marginile cristalului, asa cum un zid este construit din caramizi. O celula elementara este complet definita cand se cunoaste:
a. Cele trei dimensiuni a, b si c (fig.2);
b. Unghiurile pe care le formeaza intre cele trei muchii ale celulei;
c. Felul, numarul si pozitia unitatilor de structura (atomi, ioni si molecule) din care este construita celula.
Natura retelei cristaline nu determina numai forma geometrica, macroscopica, a cristalului, ci si proprietatile fizice ale sale. De asemenea probleme se ocupa cristalografia fizica.
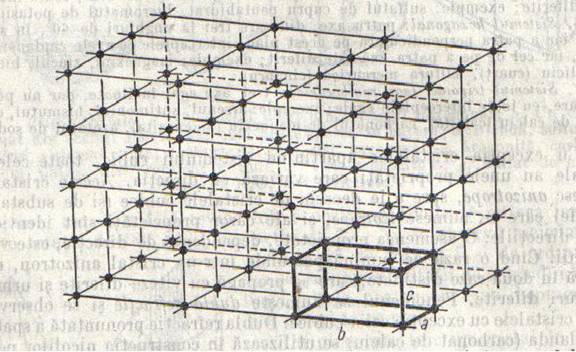
Fig.2 O retea spatiala cu coordonatele oblice, arbitrare. Se distinge o celula elementara cu cele trei dimensiuni a, b si c
Retele de ioni
Fig.3
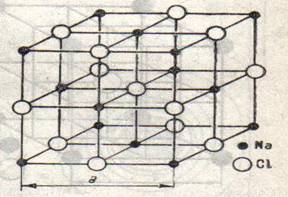
Una din retele cele mai simple este aceea a clorurii de sodiu (fig.3). Se observa din figura ca fiecare ion de sodiu se afla in centrul unui octaedru ale carui sase colturi sunt ocupate de ionii de clor si, in mod similar, fiecare ion de clor este inconjurat de un octaedru de ioni de sodiu. Ionii sunt retinuti in retea prin forte de atractie electrostatice (electrovalente).
Distanta dintre centrul unui ion de sodiu si al unui ion de clor este
d = a/2 = 2,814 A
Retele de acelasi tip cu a clorurii de sodiu se intalnesc in toate halogenurile metalelor alcaline, cu exceptia bromurii si iodurii de cesiu. Retelele de tipul NaCl difera intre ele numai prin distantele interionice.
Reteaua clorurii de sodiu nu este specifica halogenurilor metalelor alcaline, ci apare in oxizi si sulfuri de metale bivalente, de ex. In MgO, CaS si PbS.
La bromura si iodura de cesiu reteaua cristalina este diferita de a celorlalte halogenuri de metale alcaline, anume este o retea de cuburi centrate intern. Interesanta este clorura de cesiu care cristalizeaza in doua forme α si β ( substanta dimorfa): sub 460 este stabila α-CsCl, cu retea de cuburi centrate intern; peste aceasta temperatura, are loc o transformare in forma β-CsCl, cu retea de clorura de sodiu.
In fig.4 s-a desenat ionul de iod in centrul cubului si ionii de cesiu la colturi. Tot atat de correct ar fi fost daca se desenau ionii de cesiu in centru si ionii de iod la colturi. Contrar aparentelor, raportul intre ionii de cesiu si de iod, in retea, este 1:1, asa cum cere formula chimica CsI.
Distanta intre centrele a doi ioni diferiti, in retele de tipul iodurii de cesiu, este egala cu jumatatea diagonalei spatiale a cubului, deci cu a/2
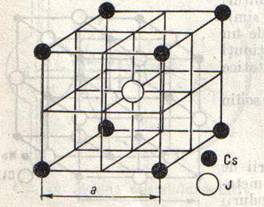
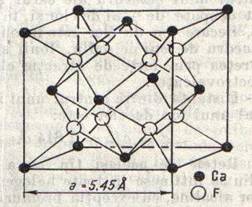
Fig.4 Fig.5
Toate cristalele
descrise mai sus sunt acelea ale unor substante cu formula generala AB.
In fig.5 se reda celula elementara a unui compus ionic cu formula
![]() ,
fluorura de calciu sau fluorite,
,
fluorura de calciu sau fluorite, ![]() .
Fiecare ion
.
Fiecare ion ![]() este inconjurat de 8 ioni
este inconjurat de 8 ioni ![]() ,
asezati la colturile unui cub, iar fiecare ion
,
asezati la colturile unui cub, iar fiecare ion ![]() de
4 ioni
de
4 ioni ![]() ,
asezati la colturile unui tetraedru.
,
asezati la colturile unui tetraedru.
Primele determinari ale structurii de retelei cristaline ale clorurii de sodiu au dovedit ca acesta sare nu este compusa din molecule de NaCl, caci in acest caz ar fi trebuit sa se gaseasca grupe de cate doi atomi Na si Cl apropiati, la distante mari unele de altele. Dimpotriva s-a gasit ca punctele retelei sunt ocupate alternative de sodiu si clor. Nu era insa nicidecum sigur daca aceste elemente apar, in retea, sub forma de ioni.
Retele de ioni complexi
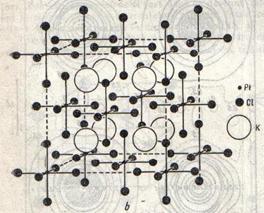
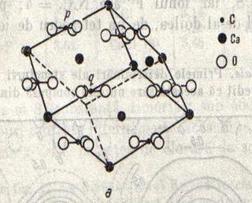
Fig.7 Fig.6
Retelele substantelor continand ioni compusi din mai multi atomi nu se deosebesc in principiu de retelele substantelor cu ioni monoatomici, descries mai sus. Ca si in aceasta din urma, ionii se atrag reciproc prin electrovalente; atomiii care compun ionul complex sunt insa legati intre ei prin covalente si poseda deci forme geometrice bine determinate si invariabile. Din cauza formelor sau dimensiunilor complexi, simetria retelii este de obicei diferita de a retelelor ionice simple. Halogenurile de amoniu cristalizeaza fie in reteaua clorurii de sodiu, fie in aceea a iodurii de cesiu.
In fig.6 este
reprezentata celula elementara a calcitei, un carbonat de calciu natural,
cristalizat in sistemul trigonal, compus din ionii ![]() si
si![]() .
.
Acesti
ioni sunt oranduiti spatial la fel ca ionii![]() si
si![]() in celula clorurii de sodiu, dar din cauza formei diferite a ionului
in celula clorurii de sodiu, dar din cauza formei diferite a ionului ![]() celula elementara a calcitei are forma unui
romboedru. Se observa in figura ca cei trei atomi de oxigen ai ionului
celula elementara a calcitei are forma unui
romboedru. Se observa in figura ca cei trei atomi de oxigen ai ionului ![]() se afla in acelasi plan cu atomul de carbon si
sunt grupati la aceeasi distanta de acesta, iar legaturile C - O formeaza
unghiuri de 120
se afla in acelasi plan cu atomul de carbon si
sunt grupati la aceeasi distanta de acesta, iar legaturile C - O formeaza
unghiuri de 120
Metoda analizei cristalelor cu raze X a permis sa se stabileasca nu numai tipul retelelor ci si forma anionilor si cationilor complexi.
Retele de atomi
Asa cum intr-un cristal ionic, fortele de atractie dintre ionii care ocupa punctele retelei sunt forte electrostatice (electrovalenta), intr-un alt tip de cristale punctele retelei sunt ocupate de atomi, iar acestia sunt legati intre ei prin covalente. Covalentele atomilor polivalenti au , in combinatiile lor, o orientare spatiala bine definite (determinate prin tipul de hibridizare al legaturii respective). Aceeasi orientare se intalneste si in reteaua cristalina. Un cristal atomic (fara defecte) poate fi astfel considerat ca o molecula uriasa, totii atomii fiind legati covalent.
O retea atomica reprezentativa este reteaua diamantului (fig.8), compusa din atomi de
carbon. Carbonul este tetravalent, iar valentele sale (valente hibride ![]() ,
legaturi σ ) sunt orientate in spatu formand intre ele unghiuri de
10928'. Fiecare atom se afla in centrul unui tetraedru, ale
carui colturi sunt ocupate de alti patru atomi de carbon; constructia aceasta
tetraedrica se continua in tot cristalul.
,
legaturi σ ) sunt orientate in spatu formand intre ele unghiuri de
10928'. Fiecare atom se afla in centrul unui tetraedru, ale
carui colturi sunt ocupate de alti patru atomi de carbon; constructia aceasta
tetraedrica se continua in tot cristalul.
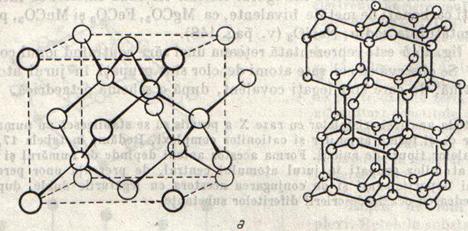
Fig.8
Natura covalenta a legaturilor dintre atomii de carbon, in retaua diamantului, a fost determinate si prin analiza Fourier. Densitatea norului electronic intre doi atomi de carbon vecini nu scade niciodata la zero, ci pastreaza o valoare mare.
Retele de acelasi tip cu a diamantului (retele adamantine) au si alte elemente din grupa IV a sistemului periodic, cum sunt siliciul, germaniul si staniul (modificatia cenusie), precum si unele combinatii binare, de ex. Sulfura de zinc sau blenda, ZnS.
Reteaua blendei corespunde in totul reteli diamantului, dar atomii de Zn alterneaza cu atomi de S si invers (fig.9). S-a observat ca, la compusii cu retea adamantin, suma electronilor de valenta ai celor doua elemente este 8, de ex. In ZnSe si CdS (2+6), in AlSb si GaS (3+5), in CuBr (1+7).
O retea putin diferita de a blendei, dar in care atomii sunt oranduiti tot dupa schema tetraedrica, este cea a wurtzitei, ZnS, o modificatie cristalina a sulfurii de zinc. Reteaua wurtzitei se mai intalneste in sulfuri ca CdS, HgS, in oxidul de zinc, ZnO, in carbura de siliciu, SiC, si in nitrura de aluminiu AlN.
Retele de atomi mai poseda unii compusi de tip AB: NiAs, PtSb. In acesti compusi nu sunt utilizati toti electronii de valenta pentru formrea legaturii, ceea ce determina adesea caracter semimetalic.
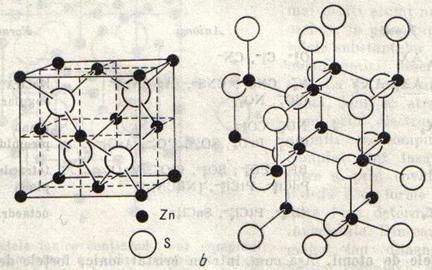
Fig.9
Retele metalice
Metalele cristalizeaza, cu putine exceptii, in retele cu simetrie inalta. Metalele alcaline, bariul, ferul, cromul etc. Formeaza retele de cuburi centrate intern; cuprul, argintul, paladiul, platina, plumbul etc. cristalizeaza in cuburi cu fete centrate, iar o a treia grupa de metale, printer care magneziul si zincul, cristalizeaza in retele cu simetrie hexagonala (fig.10).
Structurile cristaline ale metalelor determina intr-o mare masura proprietatile acestora.
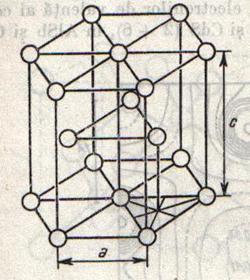
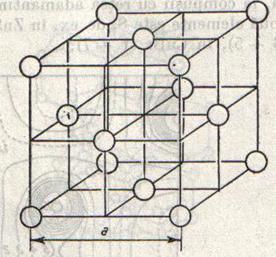
Fig.10 Fig.11
Retele de molecule
Substantele covalente formeaza cristale in care moleculele sunt retinute prin forte de atractie slabe, imperfect definite din punct de vedere fizic, cuprinse sub numele de forte van der Waals. ( In cristalele substantelor cu molecule polare intervin si forte de atractie dipole-dipol).
Cele mai simple retele de acest tip sunt acele ale gazelor inerte. Toate gazelle inerte, cu exceptia heliului, cristalizeaza in cuburi cu fete centrate (fig.11), cu urmatoarele distante intre atomi, corespunzand unor legaturi van der Waals:
Ne Ar Kr Xe
a = 4.52 5.42 5.59 6.18 A
Heliul cristalizeaza intr-o structura haxagonala compacta (fig.10).
Figura 12 reprezinta celula elementara a unui cristal de iod.Se disting moleculele I cu cei doi atomi la distanta de 2.70 A, corespunzand legaturii van der Waals, este 3.54 A. In fig.13 sunt reprezentate moleculele sulfului rombic, compuse din opt atomi, legati prin covalente sub forma unui inel, in doua planuri paralele, cate patru atomi in fiecare plan. Cristalul trioxidului de arsen, cu formula bruta As2O3, este construit in realitate din molecule As4O6, avand forma reprezentata in fig.14. Moleculele As4O6 sunt oranduite in celula elementara .
Cele mai multe substante organice cristalizeaza in retele moleculare. Una dintre acestea, ureea cu formula de structura de mai sus , formeaza reteaua redata in fig.15.
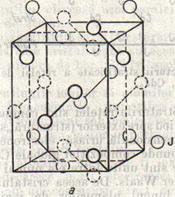
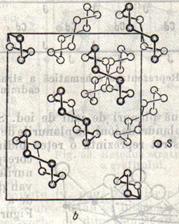
Fig.12 Fig.13
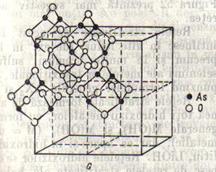
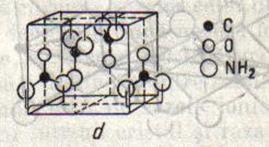
Fig.14 Fig.15
Bibliografie
C.D. Nenitescu - CHIMIE GENERALA,
Editura TEHNICA
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 18868
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved