| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Solutia este o faza omogena, condensata, formata din doi sau mai multi componenti miscibili intre care se exclud reactiile chimice.
Din punct de vedere termodinamic solutia este un sistem omogen, policomponent, la care amestecarea se face la scara moleculara, spre deosebire de amestecurile mecanice care sunt sisteme eterogene.
In cele mai multe cazuri, o solutie este formata dintr-un component majoritar, numit dizolvant sau solvent si unul sau mai multi componenti minoritari, numiti dizolvati sau soluti.
Studiul termodinamic al solutiilor este important intrucat in natura substantele chimice absolut pure reprezinta un caz limita. In general, chiar prin cele mai moderne metode de purificare, se obtin substante care mai contin aproximativ 10-8 % impuritati dizolvate.
In caracterizarea termodinamica a solutiilor, uzual, marimile solventului sunt desemnate prin indicele 1, iar cele ale substantelor dizolvate prin indicii 2, 3, i. Solutiile pot fi clasificate dupa diverse criterii, ca in tabelul 1.
|
Nr. crt. |
Criteriul de clasificare |
Tipul solutiilor |
|
Starea de agregare a componentilor |
- solutii solide, de exemplu aliajele; - solutii lichide, de exemplu apa marina; - solutii gazoase, de exemplu. aerul; |
|
|
Numarul componentilor |
- solutii binare; - solutii multicomponente: (ternare, cuaternare, etc.) |
|
|
Natura componentilor |
- solutii de neelectroliti - solutii de electroliti in apa; - solutii de electroliti in alti solventi neaposi, etc. |
|
|
Concentratiile componentilor |
- solutii diluate; - solutii moderat diluate; - solutii concentrate. |
|
|
Proprietatile termodinamice |
- solutii perfecte; - solutii diluate ideale; - solutii partial ideale, - solutii neideale (reale). |
In termodinamica criteriul cel mai riguros de clasificare il constituie proprietatile termodinamice diferite ce caracterizeaza solutia.
2 Solutiile ideale
Solutia ideala reprezinta un caz limita, fiind caracterizata de relatii termodinamice simple.
Sunt doua tipuri de solutii care se apropie de proprietatile unei solutii ideale:
a) solutiile perfecte, la care legile solutiilor ideale sunt valabile pe intreg domeniul de concentratii, cunoscute si ca "solutii ideale propriu-zise";
b) solutiile foarte diluate, la care legile solutiilor ideale sunt valabile numai la concentratii mici, cunoscute si ca "solutii ideale conventionale".
Ecuatiile solutiilor ideale sunt importante din punct de vedere matematic, intrucat se bazeaza pe un model matematic simplu care poate fi extins direct la solutiile reale cu ajutorul activitatilor termodinamice si a functiilor de exces. De asemenea, ele pot fi aplicate direct la unele clase de solutii, cum ar fi amestecurile de gaze la presiuni moderate, amestecurile de substante cu proprietati foarte apropiate (izotopi, izomeri optici) sau solutii foarte diluate.
2.1 Solutii perfecte
Solutiile perfecte sunt formate din componenti cu structura chimica apropiata, moleculele lor avand practic aceleasi dimensiuni. Se pot da ca exemplu izomerii optic activi, amestecurile de izotopi sau diverse alte amestecuri cu structuri asemanatoare (de exemplu brombenzen si clorbenzen).
Definirea solutiilor perfecte se bazeaza pe o ipoteza de natura cinetico-moleculara si anume ca formarea unei solutii ideale perfecte din componenti puri, la T si P constante, are loc fara modificari ale energiilor de interactiune dintre molecule. In consecinta, la formarea unei solutii perfecte din componenti puri, in conditii izobar-izoterme, entalpia si volumul solutiei se compun aditiv din entalpiile respectiv volumele componentilor puri, nefiind afectate de termeni corectivi. Marimile de exces corespunzatoare sunt nule, adica :
![]()
![]()
Potentialul chimic al oricarui component intr-o
solutie perfecta ia forma:
![]()
Tinand cont ca potentialul chimic standard este identic in acest caz cu
![]()
potentialul
chimic al componentului in stare pura sau cu potentialul Gibbs molar, se poate
scrie:
(4)
Din figura 1, unde se urmareste variatia potentialului chimic in functie de lnxi , se constata ca potentialul chimic este reprezentat printr-o dreapta cu panta RT, ceea ce denota o comportare ideala.
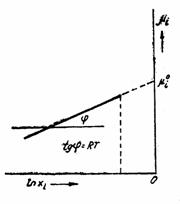
Figura 1 Potentialul chimic al unui component i.
Potentialul chimic ![]() este o marime ipotetica, obtinuta prin
extrapolarea dreptei reprezentative, la xi = 1.
este o marime ipotetica, obtinuta prin
extrapolarea dreptei reprezentative, la xi = 1.
Functiile termodinamice pot fi scrise atat pentru un component i din solutie cat si pentru solutia cu i componenti. In tabelul 2 sunt prezentate functiile caracteristice solutiei perfecte.
Functiile de amestecare sunt definite, in general, dupa o expresie de tipul:
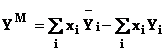
(5)
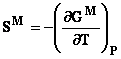
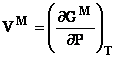
Evaluarea
functiilor de amestecare in cazul unei solutii perfecte conduce la expresii de
tipul:
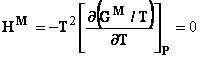
(6)
In figura 2 se prezinta variatia liniara cu concentratia, atestand o comportare perfecta a sistemului propionat de etil (1)-acetat de propil (2). In figura 3 sunt prezentate functii de amestecare in solutii perfecte binare.
In general, pentru o solutie perfecta, se constata urmatoarele aspecte:
q entalpia libera Gibbs scade la formarea unei solutii (binare, de exemplu) ea fiind intotdeauna mai mica decat cea calculata aditiv din componentii puri.
q formarea unei solutii perfecte are loc la entalpie constanta, la valori date ale temperaturii si presiunii, fara degajare sau absorbtie de caldura:
![]()
Reciproca indica faptul ca daca amestecarea se realizeaza la presiune constanta, in conditii adiabatice, in cazul unei solutii perfecte nu au loc schimbari de temperatura.
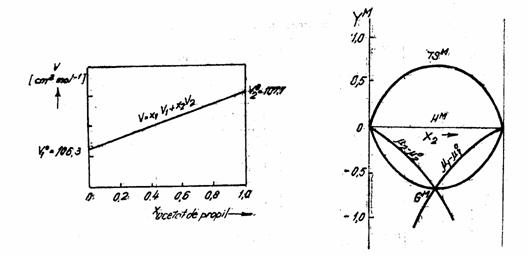 Figura 2 Volumul molar mediu in functie Figura 3 Functii de amestecare in
solutii
Figura 2 Volumul molar mediu in functie Figura 3 Functii de amestecare in
solutii
de compozitie, sistemul propionat de perfecte binare
etil-acetat de propil
intr-o solutie perfecta toate functiile termodinamice de amestecare sunt egale cu 0 cu exceptia celor care contin entropia. Amestecarea nu este insotita nici de expansiune si nici de contractia solutiei. In consecinta energia interna de amestecare este egala cu 0:
![]()
(8)
Tabelul 2 Functii termodinamice pentru solutia perfecta
|
Nr.crt. |
Simbolul functiei |
Expresia functiei termodinamice |
||||||
|
Pentru un component i in solutia perfecta |
||||||||
|
|
|
|||||||
|
|
|
|||||||
|
|
|
|||||||
|
|
|
|||||||
Pentru solutia perfecta cu i componenti |
||||||||
|
|
|
|||||||
|
|
|
|||||||
|
|
|
|||||||
|
|
|
|||||||
In categoria solutiilor de neelectroliti, solutiile diluate ideale constituie cazul limita in care cantitatea de solvent este predominanta in timp ce cantitatea de dizolvat este foarte mica, raportul dintre numarul de moli de dizolvat si de solvent fiind in general mai mic decat 10 -2 . Aceste solutii respecta regularitati simple specifice.
Desi in unele tratari ale solutiilor diluate este comparata starea moleculelor dizolvate cu cea a moleculelor in faza de gaz, aceasta abordare nu este corecta intrucat in solutii diluate fiecare molecula dizolvata este supusa unei forte de interactie in raport cu moleculele solventului. Potentialul chimic al solventului, in cazul unei solutii diluate ideale, este o functie liniara de logaritmul fractiei molare:
![]()
(9)
![]()
iar pentru un component i¹1 din solutia diluata este valabila ecuatia:
(10)
unde ![]() este potentialul
chimic standard al solventului pur si
este potentialul
chimic standard al solventului pur si ![]() este potentialul
chimic standard al componentului i pur, adica valoarea potentialului
cand fractia molara tinde catre unitate. Al doilea termen din ecuatiile (10) se numeste termen de amestecare si este functie de temperatura si
concentratie, el reprezinta contributia la amestecare a componentului i.
Rezulta din ecuatiile (9) si (10) si faptul ca pentru o solutie diluata ideala
solventul respecta conditiile specifice unei solutii perfecte:
este potentialul
chimic standard al componentului i pur, adica valoarea potentialului
cand fractia molara tinde catre unitate. Al doilea termen din ecuatiile (10) se numeste termen de amestecare si este functie de temperatura si
concentratie, el reprezinta contributia la amestecare a componentului i.
Rezulta din ecuatiile (9) si (10) si faptul ca pentru o solutie diluata ideala
solventul respecta conditiile specifice unei solutii perfecte:
![]()
(11)
![]()
iar pentru un component oarecare i¹1 potentialul standard este diferit de potentialul Gibbs
molar. Se constata ca potentialul standard al dizolvatului i este
![]() in timp ce pentru solvent coincide cu potentialul solventului pur,
in timp ce pentru solvent coincide cu potentialul solventului pur, ![]()
Ca si la gaze perfecte, celelalte functii ale componentului i din amestec se obtin din variatia potentialului chimic cu parametrii de stare.
Marimile termodinamice ale solutiei ideale diluate sunt date de ecuatiile cuprinse in tabelul In tabel sunt prezentate separat contributia data de functia standard si contributia data de functia molara de amestecare. Fiecare functie termodinamica trebuie citita pe orizontala, prin insumarea celor doua contributii.
Din setul de ecuatii de mai sus se observa proprietatile caracteristice ale unei solutii diluate ideale:
solutia ideala se formeaza fara variatie de volum (expansiune sau comprimare), volumul total al solutiei calculandu-se aditiv din volumele componentilor puri;
|
Nr.crt. |
Simbolul functiei |
Functia standard |
Functia molara de amestecare |
|||||||||
|
|
|
|
||||||||||
|
|
| |||||||||||
|
|
|
|
||||||||||
|
|
| |||||||||||
|
|
|
|
||||||||||
|
|
|
|
||||||||||
|
|
|
|
||||||||||
|
|
|
|
||||||||||
|
|
|
|
||||||||||
|
|
|
|
||||||||||
|
|
|
|
||||||||||
|
|
|
|
||||||||||
solutiile diluate ideale se caracterizeaza prin termoneutralitate, adica formarea solutiei nu este insotita de efecte termice iar entalpia solutiei se calculeaza aditiv din entalpiile componentilor puri;
solutiile diluate ideale la echilibrul de faza lichid-vapori sau solid-vapori respecta anumite regularitati si anume legea lui Raoult pentru fiecare component i¹1 si legea lui Henry pentru solvent.
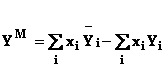
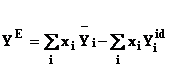
Functiile de amestecare si de exces pentru solutii ideale se
obtin din ecuatiile:
(13)
In cazul solutiilor diluate ideale se constata ca valorile functiilor de exces sunt nule si deci independent de natura chimica a componentilor acestia au aceiasi comportare in solutie la scara moleculara ca si in starea lor pura.
Solutiile diluate ideale sunt formate din componenti cu forme, mase moleculare si dimensiuni apropiate, din izomeri sau izotopi. De exemplu amestecurile de benzen-toluen, dibrompropan, dibrommetan, benzen-dicloretan, hexan-octan etc. In figura 4 se observa dependenta de concentratii a proprietatilor termodinamice ale unei solutii ideale, prezentadu-se cazul solutiei dibrompropan-dibrommetan.
La aceste solutii solventul respecta legea lui Raoult, iar solutul respecta legea lui Henry. Compozitia unui component al unei solutii ideale in faza lichida si in faza sa de vapori este diferita, adica yi ¹ xi.
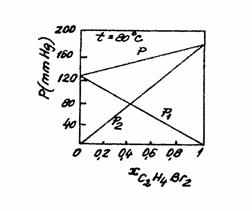
Figura 4 Presiunea de vapori a solutiei ideale dibrompropan-dibrommetan
Pentru o solutie binara este usor de gasit relatia de legatura intre y2 si x2:
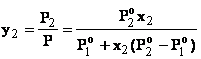
(14)
3 Solutii cu comportare partial ideala
O categorie aparte de solutii o constituie solutiile cu comportare partial ideala. Din aceasta categorie fac parte solutiile regulare si solutiile atermice.
Solutiile regulare au fost studiate de Hildebrand si cuprind amestecuri ce prezinta anumite regularitati observate experimental. Guggenheim introduce notiunea de amestec strict regular in monografia sa Regular Solutions si se refera la o categorie de amestecuri mult mai restransa decat cea tratata initial de Hildebrand, dar care poate fi tratata riguros conceptual.
![]()
![]()
Caracterul de comportare partial ideala este
sustinut de faptul ca solutiile regulare satisfac toate conditiile unui amestec
ideal, cu exceptia entalpiei de amestecare, respectiv a entalpiei de exces,
care sunt diferite de zero:
(15)
![]()
![]()
![]()
Acest tip de solutii pot fi tratate dupa un model molecular simplu.
In cazul unui amestec binar se demonstreaza ca aparitia unui efect termic la amestecare se atribuie variatiei energiei configurationale, la trecerea componentilor din stare pura in solutie.
![]()
In acest caz energia molara de amestecare a solutiei
binare cu fractiile molare xA si xB este:
unde: c este numarul de molecule coordonate iar De este interactia intre moleculule de tip A si B. Entalpia de amestecare pentru sisteme regulare este:
![]()
![]()
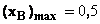
![]()
Daca b nu depinde de concentratie, entalpia de amestecare este o functie
parabolica de concentratie cu punctul
extrem situat la fractii molare egale, avand punctul extrem caracterizat prin
urmatoarele coordonate:
![]()
Daca insa b depinde de concentratie, entalpia de amestecare este o functie parabolica cu punctul de extrem deplasat de la pozitia xA xB , iar abaterea sistemului atesta o deviere de la o comportare regulara.
Entropia de exces se anuleaza numai atunci cand distributia moleculelor componentilor din solutie este intamplatoare si in absenta oricaror forte de orientare sau efecte chimice. In cazul solutiilor regulare agitatia termica determina o amestecare complet intamplatoare.
Pentru o solutie regulara binara functiile termodinamice sunt prezentate in tabelul 4.
Exemple de solutii cu comportare regulara sunt solutiile de iod in benzen, in tetraclorura de carbon sau in heptan; solutiile de SnI4 in benzen, cloroform, eter sau tetraclorura de carbon sau solutiile unor gaze cum ar fi hidrogenul in sulfura de carbon, benzen sau in toluen.
|
Nr.crt. |
Expresia functiei termodinamice |
Calculul functiilor de ansamblu |
|||
|
| |||||
|
|
|
||||
|
|
|
||||
|
|
|
![]()
![]()
![]()
Caracterul de solutie cu comportare partial ideala
este sustinut de faptul ca solutiile atermice satisfac toate conditiile unui
amestec ideal, cu exceptia entropiei de exces care este diferita de zero:
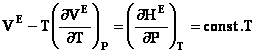
(20)
Solutiile atermice s-ar putea apropia de solutiile regulare, datorita caracterului lor partial ideal, dar ele se deosebesc fundamental datorita naturii lor complet diferite. In timp ce solutiile regulare sunt reprezentate de sisteme formate din molecule cu dimensiuni apropiate, componentii solutiei atermice sunt reprezentate de polimeri cu greutati moleculare mult mai mari decat ale solventului constituit din molecule organice cu dimensiuni obisnuite.
Solutiile atermice au fost studiate initial de Fowler si Rushbrooke care au propus pentru studiul acestor tipuri de solutii modelul de retea. Mai tarziu Chang, folosind metoda lui Bethe, a tratat statistic amestecurile de monomeri si dimeri, iar Miller a tratat amestecurile de monomeri si trimeri. Huggins a extins metoda la diferite amestecuri atermice, stabilind o ecuatie de stare.
El a propus un modelul de retea in care moleculele monomere pot ocupa un singur loc pe retea, iar macromoleculele constituite din r unitati monomere si numite r-meri, pot ocupa r locuri. Huggins demonstreaza ca entropia molara de exces este pozitiva pentru r>1, iar energia libera Gibbs, GE , prezinta valori negative.
Aceasta constatare se verifica in toate cazurile in care dizolvantul are un grad mare de polimerizare. Functiile termodinamice ale solutiilor atermice pot fi formulate simplu prin aroximatiile facute de O.J. Flory, bazate insa tot pe ecuatiile lui Huggins pentru r-meri cu lant deschis. Din datele experimentale, utilizand masuratori de tensiune de vapori, de entalpii de dizolvare si de densitati la mai multe temperaturi, s-au confirmat proprietatile termodinamice ale solutiilor atermice. Ecuatia lui O. J. Flory aproximeaza bine rezultatele masuratorilor experimentale pentru solutii de polimeri.
Functii de abatere de la idealitate a componentilor solutiei si ale solutiei in ansamblu pentru solutiile reale se regasesc in formularile corectate ale marimilor proprii sistemelor ideale ce redau comportarea reala a sistemului.
Ele pot fi exprimate prin una din urmatoarele categorii de functii: activitate sau fugacitate termodinamica, coeficienti de activitate si de fugacitate, coeficienti osmotici sau functii termodinamice de exces.
4.1 Activitatea termodinamica si coeficientul de activitate termodinamica
![]()
Daca trebuie sa se cunoasca comportarea solutiei pe
intreg domeniul de concentratie, expresia potentialului chimic, caracteristica
sistemului ideal prin dependenta ei de logaritmul fractiei molara, trebuie
corectata pentru comportarea reala:
(21)
![]()
sau:
unde gi este coeficientul de activitate si descrie deviatia solutiei reale fata de solutia ideala, iar ai se numeste activitatea componentului i.
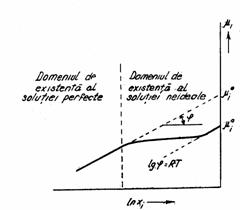
Figura 5 Potentialul chimic al componentului i dintr-o solutie neideala
In figura 5 este prezentata variatia potentialul chimic al componentului i dintr-o solutie neideala. Activitatea componentului i se defineste ca si fugacitatea relativa sau ca produsul dintre coeficientul de activitate si concentratie, exprimata ca fractie molara:
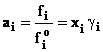
ai este o functie de T si P si de compozitie (x1, x2 ..xi).
![]()
![]()
Activitatea
unui component intr-o solutie se
poate defini si ca o limita, atat pentru solvent cat si pentru substanta
dizolvata
Se constata din ecuatiile de mai sus ca activitatea unui component poate avea orice valoare numerica dar depinde de starea de referinta aleasa. In cazul in care xi 0, activitatea devine egala cu unitatea. In cazul solutiilor ideale gi = 1 pentru tot domeniul de concentratii iar referinta, adica starea standard a lichidului, este tocmai lichidul pur la T si P dati ai solutiei.
Se defineste drept stare de referinta a unui component a unui sistem real, starea sistemului pentru care coeficientul de activitate al componentului este egal cu unitatea.
Se defineste starea standard a unui component dintr-un sistem real drept starea sistemului pentru care activitatea componentului este egala cu unitatea sau este definita in asa fel incat sa fie egala cu unitatea.
In cazul solutiilor reale se pot utiliza diferite stari standard de referinta:
a) Pentru substantele pure, deci pentru sistemele monocomponente, starea standard este lichidul sau solidul pur la P = 1 atm si la orice temperatura. Corespunzator acestei conventii, activitatea oricarui lichid sau solid pur la 1 atm este egala cu unitatea la orice temperatura;
b)
![]()
Pentru solventul din solutie starea standard este
solventul pur la aceiasi temperatura si presiune ca si a solutiei, adica:
![]()
(25)
(26)
Precizare: activitatea termodinamica este definita ca fugacitate relativa. Deci, activitatea solventului pur este egala cu unitatea, in timp ce activitatea solventului intr-o solutie este intotdeauna mai mica decat unitatea la orice concentratie finita.
Valoarea
coeficientului de activitate poate fi mai mare decat unitatea pentru solventul
care manifesta abateri pozitive de la legea lui Raoult si mai mic decat
unitatea pentru solventul care prezinta abateri negative de la legea lui
Raoult. In figura 6 se evidentiaza prin curba continua variatia coeficientului
de activitate al solventului in solutie iar linia punctata reprezinta
comportarea solventului in solutia ideala. In general in solutia reala este valabila
ecuatia:
(27)
![]()
iar la limita ecuatia:
(28)
Coeficientul de activitate al solventului intr-o solutie ideala, la toate concentratiile, este egal cu unitatea:
![]()
Deci, starea de referinta a solventului intr-o solutie reala este solventul in solutia ideala iar coeficientul de activitate masoara deviatiile de la idealitate.
c) Pentru substanta dizolvata (solut) starea standard se poate stabili prin doua modalitati si anume:
In cazul in care componentii solutiei sunt perfect miscibili se foloseste asa numita conventie asimetrica. In acest caz conform acestei conventii starea standard pentru solut este solutul pur la T
si P al solutiei, deci nu se face distinctie intre solvent si soluti,
![]()
adica :
![]()
In acest caz sunt necesare informatii experimentale suplimentare despre
solut, de exemplu despre starea sa fizica sau alte date experimentale despre solutie la o concentratie suficient de mare a solutiei, astfel incat legea lui Raoult sa poata fi utilizata prin extrapolare pentru a obtine la x2=1 activitatea termodinamica a2.
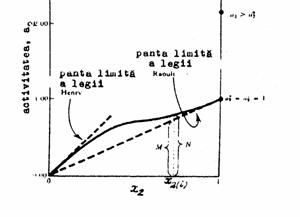
Figura 6 Variatia activitatii daca solutul pur este ales ca stare standard
In general astfel de date nu sunt disponibile pentru cei mai multi soluti.
In figura 6 este evidentiata variatia activitatii solutului cu fractia molara cand starea standard este solutul pur. Valoarea coeficientului de activitate la o fractie molara x2 este raportul N/M si asa cum reiese si din figura este supraunitar. Daca deviatia de la legea lui Raoult ar fi negativa, curba continua ar fi sub linia punctata si coeficientul de activitate al solutului ar fi mai mic decat unitatea.
![]()
![]()
In cazul in care componentii solutiei au
solubilitatea limitata se foloseste conventia asimetrica data de ecuatia :
iar starea standard este o stare ipotetica a solutului obtinuta prin extrapolarea legii limita a lui Henry la fractia molara a solutului egala cu unitatea.
Din figura 6 se observa ca starea standard este cea obtinuta prin extrapolarea legii lui Henry iar coeficientii de activitate ai solutului dat de raportul N/M sunt mai mici decat unitatea. Precizare: desi valorile coeficientilor de activitate si ale activitatilor sunt diferite, depinzand de starea standard aleasa, variatiile de energie libera Gibbs precum si alte marimi termodinamice raman neschimbate si nu depind de alegerea starii standard.
4.2 Functii termodinamice exprimate prin intermediul coeficientilor de activitate pentru solutii reale
![]()
In cazul unei solutii reale, expresia potentialului
chimic:
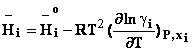
genereaza toate celelalte functii termodinamice
molare partiale pentru un component al unei solutii reale:
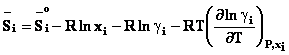
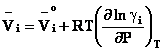
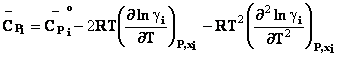
(35)
(36)
Functiile de amestecare pentru componenti si solutie sunt prezentate in
tabelul 5.
![]()
![]()
![]()
Relatii intre
coeficientii de activitate ai dizolvatului intr-o solutie reala. Dupa modul
de exprimare al concentratiilor, activitatile termodinamice ale dizolvatului
dintr-o solutie binara se poate formula astfel :
Tinand cont de relatiile dintre diversele moduri de exprimare ale
concentratiei, se obtine :
![]()
Tabelul 5 Functii de amestecare pentru solutii reale de neelectroliti
|
Nr. crt. |
Pentru un component I |
Pentru intregul amestec |
||||||
|
|
|
|||||||
|
|
|
|||||||
|
|
|
|||||||
|
|
|
|||||||
|
|
|
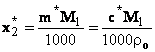
Daca se considera solutii foarte diluate, densitatea
solutiei se asimileaza cu cea a solventului, ro iar
concentratiile sunt notate cu x2*, m* si c*
ecuatia (38) devine:
![]()
Coeficientii corectivi ai concentratiei in cazul solutiei diluate
se asimileaza cu unitatea deci:
![]()
Pentru o solutie oarecare raportul concentratiilor
unui dizolvat din solutia oarecare si o solutie foarte diluata exprima
coeficientul de activitate in urmatoarele moduri:
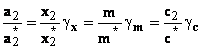
(41) (42)
Inlocuind ecuatiile (39), (41) si (42) in ecuatia (40) se obtin relatii intre coeficientii de activitate rationali ( gx) si practici (gm) si (gc
![]()
![]()
Pentru coeficientul de activitate se pot extrage diverse relatii pentru aprecierea valorii acestuia functie de expresiile functiilor termodinamice caracteristice solutiei reale. Expresiile cele mai des utilizate sunt prezentate in tabelul 6.
Tabelul 6 Expresii utilizate pentru coeficientul de activitate
|
Nr.crt. |
Functia termodinamica |
|||
|
|
||||
|
|
||||
|
|
||||
|
|
||||
|
|
||||
|
|
||||
|
|
||||
|
|
|
|||
|
|
||||
|
|
4.3 Coeficientul osmotic
Pentru a caracteriza comportarea termodinamica a solventului se utilizeaza adesea un alt corectiv al concentatiei, introdus de Bjerrum, sub denumirea de coeficient osmotic. Se cunoaste coeficientul osmotic rational, g, care a fost inclus in expresia potentialului chimic ca un corectiv al termenului de amestecare :
![]()
In practica se utilizeaza coeficientul osmotic practic, F definit prin relatia:
![]()
(45)
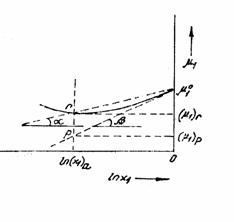 Notiunea de coeficient osmotic a fost generata
de constatarea echivalentei sale cu raportul dintre presiunea osmotica a unei
solutii imperfecte si presiunea osmotica a solutiei ideale, vezi figura 7.
Notiunea de coeficient osmotic a fost generata
de constatarea echivalentei sale cu raportul dintre presiunea osmotica a unei
solutii imperfecte si presiunea osmotica a solutiei ideale, vezi figura 7.
Figura 7 Variatia coeficientului osmotic tga gRT; tgb RT.
Coeficientul osmotic are o valabilitate generala, putand fi extins la studiul tuturor proprietatilor solutiilor. El poate fi usor evaluat din date practice. Utilizarea sa este comoda in caracterizarea termodinamica a solvantului, in special in conexiune cu studiul proprietatilor coligative ale solutiilor. Legatura dintre marimile corective se stabileste cu ajutorul ecuatiilor:
![]()
![]()
(46) (47)
![]()
(47a)
Coeficientul osmotic este mai sensibil decat coeficientul de activitate la abaterile solutiei de la idealitate. In solutii diluate x1 g 1, iar lng 0. Daca se imparte insa lng cu lnx1, care este foarte mic, se obtin valori relativ mari pentru (g-1). Daca x2 0 coeficientul osmotic tinde catre 1.
4.4 Functii termodinamice de exces
utilizarea functiilor de exces introduse de Raymond si Scatchard.
Daca functia Y este o proprietate generala, functia de exces este definita de diferenta dintre functia caracteristica sistemului real si cea care caracterizeaza sistemul ideal:
![]()
![]()
Lewis restrange definitia de la o solutie la un
singur component in solutie
Aplicarea acestor definitii la evaluarea excesului unei marimi molare
partiale in raport cu un component i din solutie conduce la expresii de tipul celor cuprinse in tabelul 7.
Functiile de exces ale ansamblului se obtin fie prin aplicarea ecuatiei generale Gibbs, fie prin aplicarea definitiei functiei de exces si insumarea pentru cei i componenti. Functiile de exces au un caracter extensiv si se raporteaza, de obicei, la un mol de substanta.
|
Nr.crt. |
Tipul functiei |
Expresia functiei de exces |
||||||
|
|
|
|||||||
|
|
|
|||||||
|
|
|
|||||||
|
|
|
|
Nr.crt. |
Tipul functiei |
Expresia functiei de exces |
||||||
|
|
|
|||||||
|
|
|
|||||||
|
|
|
|||||||
|
|
|
|
Nr.crt. |
Expresia functiei de exces |
|||
|
|
||||
|
|
||||
|
|
||||
|
|
Functiile termodinamice de exces se concretizeaza in expresiile
functiilor de exces la amestecare, definite in tabelul 9.
Daca se compara ecuatiile din tabelul 8 cu ecuatiile din tabelul 9 se
constata o serie de identitati intre functiile de exces si cele de amestecare cuprinse in tabelul 10.
|
Nr.crt. |
Identitatea de formulare intre functii termodinamice |
Functii de amestecare |
|||
|
|
|
||||
|
|
|
||||
|
|
|
||||
|
|
|

Figura 8 Functii de exces la diferite compozitii Figura 9 Functii de exces pentru
ale sistemului dioxan- apa la 25 oC ciclohexan-benzen la 70 oC

Figura 10 Functii de exces pentru sistemul Figura 11 Functii de exces pentru sistemul
izooctan-etanol la 25 oC piridina-apa la 80 oC
In figurile 2.8, 2.9, 2.10, 2.11, 2.12 si 2.13 se pot evidentia variatiile curbelor caracteristice functiilor de exces cu compozitia justificand faptul ca semnul functiilor de exces depinde de natura componentilor din sistem.

Figura 12 Functii de exces pentru sistemul Figura 13 Functii de exces pentru sistemul
apa oxigenata-apa la 25 oC n-heptan-hexan la 20 oC
Descrieti solutiile perfecte.
Explicati proprietatile termodinamice ale solutiilor cu comportare partial ideala.
Explicati proprietatile termodinamice in solutiile reale.
Descrieti coeficientul de activitate termodinamica.
Explicati coeficientul osmotic.
Explicati functiile de exces si cele de amestecare pentru solutii reale de neelectroliti.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3161
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved