Transportul de masa si transferul de caldura
intr-un reactor electrochimic
1. Transportul
de masa in reactorul electrochimic
Transportul de masa intr-un reactor electrochimic
poate avea loc prin difuzie, datorita unui gradient de concentratie, prin migratiune,
datorita unui gradient de potential sau forta electrostatica, si prin convectie,
datorita unui gradient de densitate sau unei forte mecanice exterioare.
Daca ne raportam la o specie
ionica j, se poate defini fluxul acesteia, Nj,x, in directia x, prin
numarul de moli de j ce trece prin unitatea de suprafata normala pe directia x
(in mod identic se poate proceda si pentru definirea fluxului pe directiile y
si/sau z ale spatiului), in unitatea de timp [1]:
Nj,x = vj,x Cj
= - (kj RT ) (dCj / dx) - kj Cj zj
F (dFs / dx) + Cj Vx
(1)
unde:
vj,x - viteza de
miscare a ionilor j pe directia x, [m/s];
Cj - concentratia
speciei j, [mol/m3];
kj - constanta de
proportionalitate;
R - constanta universala a
gazelor, [J/mol K];
T - temperatura in grade Kelvin;
zj - sarcina ionului j;
F - numarul lui Faraday, [A s];
Fs - potentialul intern al
solutiei, [V];
Vx - viteza convectiva
pe directia x, [m/s].
Ecuatia (1) este o relatie de
baza a transportului ionic intr-un RE. Daca in primii doi termeni se introduce
coeficientul de difuzie al speciei j, Dj, se obtine:
Nj,x = - Dj (dCj/dx) - (DjCj
zjF/RT) (dFs/dx) + Cj Vx.
(2)
unde:
Dj = kj.RT (3)
Cei trei termeni din dreapta
ecuatiei (2) reprezinta fluxurile ionice de difuzie, respectiv de migratie si
de convectie, iar mentinerea electroneutralitatii solutiei presupune:
S zjCj = 0, (4)
unde semnul zj va fi acelasi cu al ionului
j.
Ecuatiile (2) si (4), desi
generale, nu sunt suficiente pentru a descrie complet transportul ionilor
intr-un RE. Concentratia ionilor se modifica suplimentar datorita reactiilor
care au loc, iar aceste modificari trebuie evaluate cantitativ prin bilantul de
masa.
Pe de alta parte, variatia
vitezei de convectie cu pozitia si timpul poate fi evaluata doar prin aplicarea
ecuatiilor din dinamica fluidelor.
Curgerea fluidelor intr-un RE
contribuie la indepartarea produsilor de pe electrod sau la transportul unor
reactanti la electrod, la controlul si reglarea temperaturii, a presiunii si a
compozitiei electrolitului.
Complexitatea transportului de
masa din RE impune sa se apeleze, ca si in cazul reactorului chimic, la
utilizarea unor relatii bazate pe criterii adimensionale.
in cele ce urmeaza se face o
prezentare sumara a criteriilor adimensionale cel mai des folosite in
caracterizarea transportului de masa in reactoarele electrochimice.
Curgerea fluidelor este
determinata, printre altele, de vascozitatea acestora. Vascozitatea dinamica
este:
[m]SI = [kg∙m-1∙s-1] = [Pa∙s] (5)
iar
vascozitate cinematica este:
n = m /r, [n]SI = [m2 s-1] (6)
unde
r este densitatea fluidului.
Curgerea este caracterizata prin regimul de curgere
definit de criteriul adimensional Reynolds, Re:
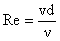 (7)
(7)
unde:
v - viteza de curgere
d - diametrul echivalent sau un
alt parametru ce caracterizeaza forma si dimensiunile sectiunii de curgere.
Se considera o curgere laminara prin spatiul dintre
electrozi daca Re < 2000, o curgere intermediara pentru 2000 < Re <
3000, respectiv o curgere turbulenta pentru Re > 3000.
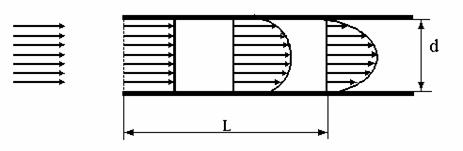
Odata cu patrunderea fluidul in spatiul dintre
electrozi, profilul de viteze se modifica datorita frecarii de electrozi si,
dupa parcurgerea unei distante, L, se
atinge asa numitul flux complet dezvoltat (Fig.1.)
Pentru a asigura functionarea RE in conditiile unui
flux complet dezvoltat, la intrarea in acesta trebuie sa existe o zona 'de
intrare', in care peretii nu sunt activi electrochimic, pentru a asigura o
lungime echivalenta care sa determine stabilizarea regimului hidrodinamic.
|
|
|
Fig. 1. Evolutia profilului de viteze la curgerea unui fluid printre
electrozi plan paraleli
|
Cele mai folosite criterii adimensionale in ingineria
electrochimica sunt cele prezentate in Tabelul 1 [2], in care simbolurile utilizate
au urmatoarele semnificatii:
km - coeficientul de transport de masa,
l - lungimea caracteristica,
D - coeficientul de difuzie,
v - viteza de curgere,
n - vascozitatea cinematica,
m - vascozitatea dinamica,
r - densitatea lichidului,
g - acceleratia gravitationala,
L - lungimea electrodului.
Tabelul 1. Criteriile adimensionale folosite
in ingineria electrochimica pentru caracterizarea transportului de masa.
|
Criteriul
adimensional
|
Ecuatia
de definitie
|
Semnificatia
|
Nr.
ecuatiei
|
|
Sherwood, Sh
|
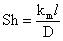
|
Transportul
de masa prin convectie fortata
|
(8)
|
|
Stanton, St
|
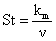
|
Transportul
de masa prin convectie fortata
|
(9)
|
|
Reynolts, Re
|
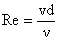
|
Curgerea
prin convectie fortata
|
(7)
|
|
Grashof, Gr
|
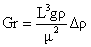
|
Curgerea
prin convectie naturala
|
(10)
|
|
Schmidt, Sc
|
Sc = 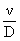
|
Proprietatile
transportului
|
(11)
|
Semnificatia lungimii caracteristice, l, depinde de
geometria electrodului sau/si a RE, astfel ca acest parametru poate sa
semnifice:
(i) distanta interpolara;
(ii) diametrul echivalent;
(iii) diametrul sau raza electrodului disc rotitor
(EDR) sau a electrodului cilindric rotitor (ECR);
(vi) diametrul porilor in cazul electrozilor
tridimensionali, 3D;
(v) diametrul sau raza particulelor care alcatuiesc un
electrod in pat fix sau fluidizat.
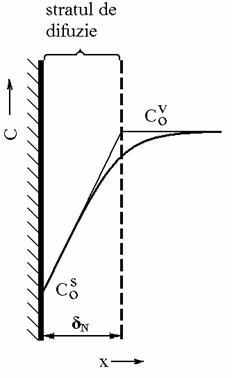
Pentru definirea unui nou
parametru se vor considera urmatoarele ipoteze simplificatoare: (i) in zona de
volum a solutiei de electrolit exista o concentratie uniforma, iar (ii) in
vecinatatea electrodului variatia de concentratie este practic liniara.
Aceasta situatie este prezentata
schematic in Fig. 2, prin intermediul careia se defineste si grosimea stratului
de difuzie Nernst, dN. Valoarea lui dN coincide cu distanta de la
electrod pana la punctul in care se intersecteaza dreapta ce descrie variatia
de concentratie din vecinatatea electrodului cu dreapta definita de
concentratia (uniforma) din faza de volum a solutiei de electrolit.
|
|
|
Fig. 2. Profilul de concentratie in stratul de difuzie
|
Pe baza ecuatiilor de difuziei ale lui Fick, aplicate
pentru cazul simplificat prezentat in Fig. 2, si a ecuatiei fluxului de specie
j [3], rezulta:
Nj
=(D/dN) (CO - COs) = km (CO - COs) (12)
Ecuatia (8) se poate scrie si in functie de grosimea
stratului de difuzie Nernst, astfel:
dN = D / km (13)
iar
criteriul Sherwood devine:
Sh
= l / dN (8a)
indicand
de cate ori dN este mai mare decat l.
Este important de precizat faptul ca prin intermediul
lui dN se poate evalua km,
asa cum se va arata in continuare.
Corelarea criteriilor adimensionale pentru cazul convectiei naturale sau
fortate se face sub forma generala:
Sh
= a Reb Grc Scd , (14)
Constantele a - d pot fi obtinute pe cale pur
teoretica, analizand ecuatiile transportului de masa, dar, cel mai des, ele
sunt evaluate pe cale empirica, prin analiza datelor experimentale. Exista doua
cazuri limita; cel al convectie naturale, pentru care:
Sh
= a Grc Scd , (15)
si
cel al convectiei fortate (mai des intalnit), pentru care:
Sh
= a Reb Scd . (16)
Deoarece corelarea se realizeaza adeseori
pe baza unui numar redus de date experimentale, extrapolarile pot duce la
aprecieri gresite. Extrapolarea in afara domeniilor de valori in care s-au
facut masuratorile este afectata de erori mari.
Alaturi de expresiile de definitie prezentate in Tabelul 1 si de cele generale de
tipul (14), in literatura sunt prezentate numeroase alte relatii criteriale
[2-5].
Coeficientul de transport de masa, km,
reprezinta o constanta eterogena de viteza ce caracterizeaza viteza de
transport de masa, in conditii cunoscute cu privire la compozitia
electrolitului, temperatura si conditiile de curgere. Acest coeficient poate fi
determinat pe patru cai:
(i) Utilizand criteriile
adimensionale care caracterizeaza transportul de masa in RE, de exemplu,
criteriul Sherwood:
km = 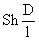 (17)
(17)
cand km poate fi
determinat dintr-un Sh cunoscut.
(ii) Din masuratori ale conversiei intru-un RE
operat in conditiile unui proces controlat de transportul de masa, aplicand
ecuatii de dimensionare specifice unui anumit tip de reactor ideal (cel mai
apropiat de conditiile de operare ale RE real). Un caz particular este
utilizarea modificarii masei electrodului (datorita electrodepunerii sau
electrodizolvarii acestuia) sau analiza chimica a solutiei de electrolit.
(iii) Determinarea grosimii stratului de difuzie
Nernst:
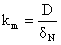 (19)
(19)
(iv) Determinarea curentului limita si aplicarea
relatiei:
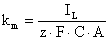 (20)
(20)
Metodele (i) - (iv) permit
accesul la o valoare macroscopica a lui km, care reprezinta o
valoare medie raportata la intreaga suprafata a electrodului.
Metoda (iv) este cea mai
utilizata pentru determinarea lui km si se bazeaza pe trasarea
curbelor curent - potential si evaluarea curentului limita. Metoda se aplica
unui proces de electrod in prezenta unei concentratii mari de fond
electrolitic. In aceste conditii, contributia migratiei la transportul de masa
al speciei active la electrod poate fi ignorata si problema se reduce la
convectie si difuzie.
Valoarea curentului
limita nu este intotdeauna usor de evaluat. Astfel, este posibil ca peste
curentul datorat reactiei de interes sa se suprapuna un curent corespunzator
unei reactii secundare, nedorite, sau un curent rezidual. De asemenea, uneori, datorita
unui transfer de sarcina lent, in inregistrarea curent-potential nu se poate
evidentia un palier net.
2. Aspecte
energetice in reactorul electrochimic
Consumul de energie este un parametru important pentru
procesele electrochimice, atat in faza de proiectare cat si in cea de
productie. Minimizarea consumurilor energetice este un deziderat principal in ingineria
electrochimica.
In cazul proceselor electrochimice, determinarea
consumurilor energetice se face pe aceleasi principii ca si in cazul celor
chimice, cu un specific determinat de prezenta unei forme complementare de
energie si anume energia electrica necesara desfasurarii proceselor de la
electrozi.
In legatura cu aceasta din urma, considerand ca un RE
functioneaza la o intensitate de curent, I, si o tensiune la borne, EB,
timp de t secunde, consumul de energie pentru un mol de produs, j, este dat de
relatia [1]:
Wj
= EBIt / nj (21)
unde
nj reprezinta numarul de moli obtinuti in timp de t secunde.
Se poate defini si un consum minim de energie ce s-ar
realiza intr-un RE discontinuu izoterm-izobar fara schimb de masa cu
exteriorul:
Wmin
= ∆Gj (22)
unde
∆Gj este variatia de entalpie libera pentru un mol de specie j.
Pentru un proces termodinamic reversibil:
∆Gj
= ∆Hj - T∆Sj (23)
Din relatiile (22) si (23) rezulta:
Wmin,j
+ T∆Sj = ∆Hj
Daca in RE au loc si alte reactii, bilantul descris de
ecuatia (25) devine:
EBI
t = n∆Hj + Q, (24)
Deoarece, in general, ∆Hj >
∆Gj, cele mai multe procese au loc in reactorul electrochimic
cu ∆Sj > 0. La operarea unui RE in apropierea conditiilor
de echilibru este necesara o cantitate suplimentara de energie egala cu
T∆Sj. Aceasta energie poate fi furnizata din afara RE sub
forma de caldura, dar, pentru ca toate sistemele sunt operate in regim dinamic,
caldura generata de efectul Joule in cursul operari face inutil aportul ei din
exterior.
In cazul unei functionari izoterme si cu rF =
100%, bilantul de energie pentru un RE functionand la EB si
intensitatea de curent Ij este:
EBIj
t = nj∆Hj + Q, (25)
unde Q este cantitatea de caldura care trebuie extrasa
din RE pentru a mentine temperatura constanta. (26)
unde:
I
= 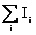 si (27)
si (27)
n∆Hj
= 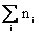 ∆Hj. (28)
∆Hj. (28)
Ecuatia (26) poate fi extinsa la o ecuatie generala
incluzand termeni aditionali de entalpie pentru toate materialele intrate si
iesite:
EBI
t + ∆ 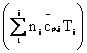 =
=
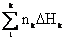 + Q, (29)
+ Q, (29)
unde:
EBI
t reprezinta consumul de energie
electrica;
∆
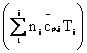 -
caldura transportata de toate materialele intrate si iesite din RE;
-
caldura transportata de toate materialele intrate si iesite din RE;
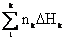 - entalpia de reactie neta;
- entalpia de reactie neta;
 - capacitatea calorica molara
medie a speciei j;
- capacitatea calorica molara
medie a speciei j;
Tj
- temperatura de operare, iar:
Q
= Q1 + Q2 (30)
unde:
Q1
- cantitatea de caldura necesara incalzirii solutiei de electrolit si a RE;
Q2
- consumul de caldura necesar compensarii pierderilor in mediul exterior.
Cantitatea de caldura Q1 poate fi
explicitata:
Q1
= (V∙q∙r+ q1∙m1 +q2∙m2)
(tf -ti) (31)
unde:
V - volumul solutiei de electrolit;
q - caldura specifica a solutie de electrolit;
r - densitatea solutie de
electrolit;
q1 si q2 - caldurile specifice
ale materialelor din care este confectionat RE si captuseala acestuia;
m1 si m2 - masele materialelor
enuntate anterior;
tf si ti - temperaturile finala
si initiala.
in cazul proceselor electrochimice
care sunt operate la temperaturi mai ridicate decat cea a mediului ambiant se
are in vedere si energia rezultata prin efect Joule:
QJ
= I2∙Rel∙t (32)
unde
Rel este rezistenta electrica a solutiei de electrolit.

