| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
GAZE REALE. VAPORI. CICLUL CLAUSIUS - RANKINE.
1 Gaze reale
1.1 Generalitati
Gazele reale nu satisfac decat cu aproximatie legile gazului ideal, pentru care moleculele gazului se presupun punctiforme, lipsite de volum propriu, perfect elastice si fara interactiune reciproca.
La presiuni mari si temperaturi mici, moleculele sunt mai apropiate, deci volumul propriu al moleculelor si fortele intermoleculare nu pot fi neglijate. In acest caz, gazele reale prezinta abateri mari fata de gazele ideale.
Comportarea gazelor reale a fost pusa in evidenta, printre altii si de Andrews, care a studiat pe cale experimentala comprimarea izoterma a gazelor reale.
|
Figura 1 |
K = punct critic; I = zona fazei lichide; II = zona bifazica (lichid + vapori); III = zona fazei gazoase; IV = substanta in stare supracritica. Pentru gazul ideal: S-a constatat
experimental ca pentru gazul real: z = factor de comprimare. |
1.2 Ecuatiile calorice de stare ale gazelor reale sub forma diferentiala
( expresiile pentru du, di, ds in functie de parametrii de stare)
In capitolul 3 a fost prezentata relatia (3. ) pentru entalpie:
![]() (1)
(1)
Calculul derivatei partiale ![]() din relatia 1:
din relatia 1:
![]() (2)
(2)
Entropia s si entalpia i fiind marimi de stare, se pot exprima in functie de 2 parametri de stare T,p sau T,v sau p,v.
Exemplu: i = i (T, p)
s = s (T, p)
Diferentiind functiile i si s si inlocuind in (2) T
![]()
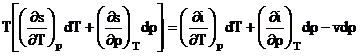
egaland coeficientii diferentialelor dT si dp T
![]() (3)
(3)
si ![]() (4)
(4)
din (3)![]() derivand in raport cu presiunea p, rezulta:
derivand in raport cu presiunea p, rezulta:
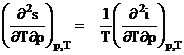 (5)
(5)
din (4) T 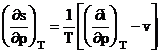 derivand in raport cu
T, rezulta:
derivand in raport cu
T, rezulta:
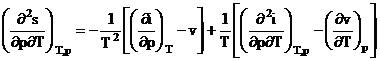 (6)
(6)
Aplicand teorema lui Schwartz: ![]() .
.
din (5) si (6) T 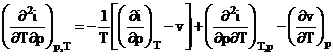
![]()
rezulta 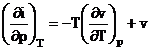 (7)
(7)
din (7)si (1) T 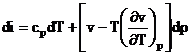 (8)
(8)
Relatia (8) reprezinta ecuatia calorica de stare a gazului real pentru entalpie.
Similar se pot determina expresiile pentru du si ds.
Relatia (8) permite calculul entalpiei daca se cunoaste cp si ecuatia termica de stare a gazului real necesara calcularii derivatei partiale (ecuatia termica de stare a gazului real la cursul de fizica; exemplu ecuatia Van der Waals).
1.3 Laminarea (strangularea) adiabatica a gazelor reale. Efectul Joule - Thomson
Laminarea adiabatica este procesul de curgere a unui gaz printr-un orificiu cu sectiune mult mai mica decat sectiunile de curgere din amonte si aval.
|
Figura 2 |
i = constant (pentru gaze reale) |
Este un proces ireversibil caracterizat prin scaderea presiunii si mentinerea constanta a entalpiei. Fiind un proces ireversibil, entropia gazului creste.
Pentru gaze ideale, entalpia este functie doar de temperatura (di =cpdT). Deoarece in cazul laminarii entalpia i = const, rezulta ca T = const, deci laminarea gazelor ideale se desfasoara izotermic.
In cazul gazelor reale, laminarea este insotita in general de modificarea temperaturii
Variatia temperaturii gazelor reale in cursul procesului de laminare adiabatica se numeste efect Joule-Thomson.
laminare T di = 0 , din (8) T 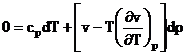
T 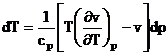
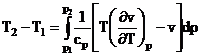 (9)
(9)
In procesul de laminare, presiunea p scade dp < 0. Deci semnul variatiei de temperatura va fi dat de semnul expresiei din paranteza dreapta a relatiei (9):
![]() daca
daca ![]() , efect J-T pozitiv
(gazul se raceste).
, efect J-T pozitiv
(gazul se raceste).
![]() daca
daca ![]() , efect J-T negativ (gazul se incalzeste).
, efect J-T negativ (gazul se incalzeste).
![]() daca
daca ![]() (10)
(10)
In acest caz (T1=T2), gazul real se comporta ca un gaz ideal. Derivata partiala din relatia (10) se face la p = const. Pentru fiecare presiune a gazului real, relatia (10) impreuna cu ecuatia termica de stare reprezinta un sistem de 2 ecuatii cu 2 necunoscute v si T. Deci, pentru fiecare presiune p, va exista o temperatura T pentru care va fi satisfacuta relatia (10). Punctul caracterizat de aceasta presiune si temperatura corespunzatoare se numeste punct de inversiune.
Totalitatea punctelor de inversiune alcatuiesc curba de inversiune a efectului Joule-Thomson.
Exemplu: diagrama presiune-entalpie (p - i) pentru aer:
|
Figura 3 |
Zona I - efect Joule Thomson pozitiv - temperatura scade prin laminare.
(exemplu: laminare de la pA la pB, temperatura scade de la 300 K la 200 K)
Zona II - efect Joule Thomson negativ - temperatura creste prin laminare.
(exemplu: laminare de la pC la pD, temperatura creste de la 400 K la 500 K)
Fenomenul se intalneste, de exemplu, la curgerea gazelor pe langa supapele motoarelor.
Efectul Joule-Thomson are rol important in tehnica frigului, pentru lichefierea gazelor (daca efectul Joule-Thomson este pozitiv).
2 Vapori
2.1 Vaporizarea la presiune constanta
Vaporii reprezinta gaze aflate in apropierea punctului lor de lichefiere.
Studiul experimental al vaporizarii la presiune constanta se face incalzind o cantitate de lichid aflata intr-un cilindru cu piston asupra caruia actioneaza presiunea constanta p (de exemplu, o greutate asezata pe piston).
Deoarece aplicatiile tehnice sunt in majoritate legate de apa, denumirile din paranteze sunt pentru apa si vapori de apa.
|
Figura 4 |
de la a la b: Incalzire lichid (apa) pana la ts = temperatura de saturatie (sau fierbere). In aceasta zona volumul specific creste foarte putin.
de la b la d: Vaporizare la ts = const. Amestecul celor doua faze aflate in echilibru termodinamic, adica la aceeasi p si T, lichid la saturatie si vapori saturati uscati, poarta denumirea de vapori saturati umezi. In aceasta zona volumul specific creste foarte mult.
de la d la e: Supraincalzirea vaporilor saturati uscati.
Marimile de stare specifice ale lichidului la saturatie (cazul b) se noteaza cu indice prim (v', u', i', s'), iar cele corespunzatoare vaporilor saturati uscati (cazul d), cu indice secund (v', u', i', s').
Se repeta experienta pentru diferite presiuni constante si se reprezinta in diagrama p - v:
|
Figura 5 |
Procesul de vaporizare este similar pentru orice presiune pana la pcritic, cand trecerea din starea lichida in cea gazoasa se realizeaza direct, fara existenta zonei bifazice si fara modificarea volumului specific.
Pentru fiecare lichid, la o presiune data corespunde o singura temperatura de saturatie sau fierbere ts (de exemplu, apa fierbe la 100C doar la presiunea atmosferica normala; la alte presiuni, temperatura de fierbere a apei este diferita de 100 C).
Titlul vaporilor
Pentru a caracteriza la un moment dat starea vaporilor saturati umezi, se introduce marimea
x = titlul vaporilor saturati umezi.
![]()
mv = masa vaporilor saturati uscati;
ml = masa lichidului din amestecul lichid la saturatie si vapori saturati uscati.
|
Figura 6 |
Pentru curba
limita stanga: Pentru curba
limita dreapta: |
Relatii de calcul
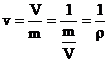
![]()
Pentru
curba limita stanga ![]() Pentru curba
limita dreapta
Pentru curba
limita dreapta ![]()
Pentru un punct intermediar N: ![]()
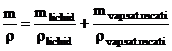
![]()
![]()
![]()
T ![]() relatia de determinare a volumului
specific pentru un punct intermediar pe palier, cand se cunoaste titlul
si volumele specifice de pe curbele limita (11)
relatia de determinare a volumului
specific pentru un punct intermediar pe palier, cand se cunoaste titlul
si volumele specifice de pe curbele limita (11)
Similar se pot determina marimile calorice de stare:
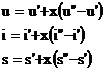 (12)
(12)
Pentru alta presiune de vaporizare exista un alt punct caracterizat de acelasi titlu x, adica acelasi raport intre masa vaporilor si masa amestecului. Unind aceste puncte se obtin curbele de titlu constant:
|
Figura 7 |
2.3 Determinarea marimilor de stare din tabele si diagrame entropice
Din tabele
In general marimile de stare (parametrii de stare p, v, T si marimile calorice de stare u, i, s) se grupeaza in 2 tipuri de tabele:
a) marimi de stare pentru lichid la saturatie si vapori saturati uscati (curbele limita stanga si dreapta);
b) marimi de stare pentru lichid sub temperatura de saturatie si pentru vapori supraincalziti (exteriorul curbei limita).
Pentru evolutiile izobare a-b-c-d-e de incalzire lichid, vaporizare respectiv supraincalzirea vaporilor, cantitatile de caldura necesare rezulta din PT l:
![]()
Pentru incalzirea lichidului (a - b): ![]()
Pentru vaporizare (b - c - d): ![]()
(![]() se numeste caldura latenta de vaporizare)
se numeste caldura latenta de vaporizare)
Pentru supraincalzirea vaporilor (d - e):
caldura necesara: 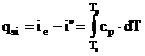 T
T 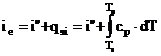
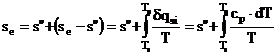
Din diagrame entropice
a) Diagrama T - s
|
Figura 8 |
In interiorul curbei limita izobarele sunt si izoterme. In zona vaporilor supraincalziti, izobarele se aproprie de curbele gazului ideal (curbe logaritmice). |
Diagrama T - s permite determinarea caldurilor prin planimetrarea suprafetelor:
|
Figura 9 |
b) Diagrama i - s (entalpie - entropie).
Este tot o diagrama entropica in care diferenta de entalpii (necesara pentru determinarea lucrului mecanic tehnic produs intr-o instalatie) rezulta usor prin diferenta de segmente.
In interiorul curbei limita izobarele sunt si
izoterme. Panta lor ![]() se calculeaza din relatia:
se calculeaza din relatia:
![]() T
T ![]()
Rezulta ca izobarele au panta cu atat mai mare cu cat temperatura este mai mare.
|
Figura 10 |
In diagrama i - s punctul critic K este situat lateral stanga pe curba limita. |
2.4 Transformarile de stare ale vaporilor (de apa)
La fiecare transformare se va urmari schimbul de energie cu exteriorul sub forma de caldura si lucru mecanic.
Transformarile, exceptand laminarea, se considera reversibile.
a) Transformarea izocora de incalzire
Se intalneste in cazul cazanelor de abur cand distribuirea aburului catre consumatori este oprita.
|
Figura 11 |
Daca ![]() T prin incalzire titlul aburului creste.
T prin incalzire titlul aburului creste.
![]()
T ![]()
Titlul punctului 2 (daca transformarea incepe in
starea 1 unde se cunosc toti parametrii) se determina pornind de la
relatia: ![]()
![]()
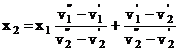
Daca ![]() T prin incalzire titlul scade din punctul 5 pana in 6, cand in
cazan exista doar lichid. Situatia trebuie evitata pentru
ca incalzind izocor in continuare, presiunea creste foarte mult
(vezi curbele Andrews) si poate distruge cazanul.
T prin incalzire titlul scade din punctul 5 pana in 6, cand in
cazan exista doar lichid. Situatia trebuie evitata pentru
ca incalzind izocor in continuare, presiunea creste foarte mult
(vezi curbele Andrews) si poate distruge cazanul.
b) Transformarea izobara
Este specifica incalzirii apei, vaporizarii sau condensarii in cazane sau in schimbatoare de caldura.
|
Figura 12 |
![]() T
T ![]()
Dar pentru izobara, 1 si 2 sunt pe acelasi
palier T ![]() si
si ![]()
T ![]()
Lucrul mecanic exterior:
![]()
dar ![]() si
si ![]()
T ![]()
c) Transformarea izoterma
|
|
In domeniul bifazic relatiile sunt cele de la izobara.
Pentru abur supraincalzit:
![]()
Din PT l T ![]()
![]()
d) Transformarea adiabatica
Daca se neglijeaza schimbul de caldura intre agentul de lucru si mediul exterior, destinderea aburului in turbine sau in motoare cu piston se poate considera transformare adiabatica. Daca este si reversibila rezulta ca entropia ramane constanta.
|
Figura 14 |
Lucrul mecanic tehnic pe care-l poate efectua aburul care se destinde adiabatic in organul motor rezulta din:
![]() ,
, ![]() ,
, ![]() T
T ![]()
Prin destindere adiabatica, aburul supraincalzit din starea 1 se transforma in abur umed.
Titlul aburului in punctul 2 rezulta din
![]()
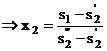
|
Figura 15 |
Prin destinderea adiabatica a aburului umed cu titlul x < 0,5 se obtine micsorarea umiditatii, adica cresterea titlului. |
e) Laminarea (strangularea) adiabatica a vaporilor
Transformarile studiate pana acum au fost considerate reversibile.
Laminarea este o
transformare ireversibila care
se desfasoara la entalpie constanta si cu
micsorarea presiunii. Deoarece este ireversibila T ![]() .
.
Fiind o transformare izentalpica (entalpie constanta), se studiaza cel mai usor in diagrama i-s.
|
Figura 16 |
Se observa ca in toate cele trei cazuri de laminare intre aceleasi presiuni p1 si p2, temperatura scade.
Transformarea se intalneste in instalatiile termoenergetice unde aburul viu (aburul produs de cazan) isi micsoreaza presiunea dar entalpia ramane constanta, putand astfel fi utilizat pentru incalzirea incaperilor sau in procese tehnologice.
3 Ciclul Clausius - Rankine motor
3.1 Centrala termoelectrica (CTE) functionand dupa un ciclu Clausius-Rankine
Cele 2 evolutii izoterme ale ciclului Carnot de primire a caldurii de la sursa calda, respectiv cedarea caldurii la sursa rece, nu pot fi realizate in practica. Din aceasta cauza, cele 2 transformari au fost inlocuite cu 2 izobare, obtinandu-se un ciclu realizabil in practica, dar care are un randament mai mic decat ciclul Carnot functionand intre aceleasi extreme de temperaturi. Acest ciclu se numeste Clausius - Rankine.
|
Figura 17 |
Prin arderea combustibilului se cedeaza apei o cantitate de caldura care serveste la incalzirea apei, vaporizare si supraincalzirea aburului. Cele 3 transformari sunt izobare. Aburul supraincalzit intra in organul motor (turbina sau motor cu piston) unde se destinde adiabatic si efectueaza lucru mecanic tehnic obtinut la axul turbinei care, prin intermediul generatorului electric se transforma in energie electrica (de obicei, aburul supraincalzit se destinde pana ajunge abur umed cu titlul x2).
Din turbina, aburul destins (la o presiune scazuta) este introdus in condensator unde aburul cedeaza apei de racire caldura latenta de vaporizare. Ca urmare, aburul se transforma in lichid, iar apa de racire iese din condensator cu temperatura marita corespunzator cantitatii de caldura primite.
Din condensator, condensatul (apa lichida) este aspirat de pompa de lichid care ii mareste presiunea (transformare adiabatica) si il introduce in cazan, reluand astfel ciclul.
Reprezentarea ciclului in diagrame:
|
Figura 18 |
Lucrul mecanic al ciclului pentru 1 kg fluid = suma algebrica a lucrului mecanic obtinut prin destinderea adiabatica a fluidului in turbina si lucrul mecanic tehnic necesar pentru comprimarea fluidului in pompa.
![]()
![]()
(Observatie: pentru CTE cu abur, ![]() i1 - i2 >> i3 - i4 rezulta ca (i3 - i4)
se poate neglija in calculele preliminare)
i1 - i2 >> i3 - i4 rezulta ca (i3 - i4)
se poate neglija in calculele preliminare)
Energia schimbata de 1 kg fluid de lucru cu exteriorul sub forma de caldura este:
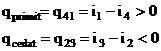
Randamentul termic al ciclului Clausius Rankine este:
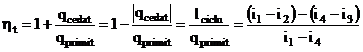
Deoarece destinderea adiabatica reala din turbina este ireversibila, aburul se destinde adiabatic pana la aceeasi presiune (p2) ca in cazul reversibil, dar pana in punctul 2irev pentru care s2irev>s2.
|
Figura 19 |
Deci, lucrul mecanic tehnic al turbinei datorita ireversibilitatii evolutiei este:
![]()
Se defineste randamentul intern al turbinei:
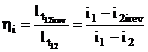
De asemenea, datorita frecarilor mecanice, lucrul mecanic tehnic efectiv obtinut la axul turbinei:
![]()
Se defineste randamentul mecanic al turbinei:
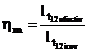
T ![]()
Inmultind acest lucru mecanic cu debitul masic de abur
care circula in instalatie: ![]() , rezulta puterea turbinei:
, rezulta puterea turbinei:
![]()
3.2 Centrala electrica de termoficare (CET)
Pentru a utiliza cat mai eficient caldura degajata prin arderea combustibilului, in CET se produce concomitent atat energie electrica cat si energie termica in scopul incalzirii locuintelor.
La CTE caldura evacuata prin condensarea aburului, caldura primita de apa de racire, era evacuata in atmosfera.
La CET, aburul din turbina se destinde pana la
o presiune mai mare decat la CTE, deci se mareste temperatura
minima a ciclului, temperatura la care aburul cedeaza apei de
racire caldura latenta de vaporizare. In acest fel apa de
racire poate iesi din condensatorul instalatiei la o
temperatura ![]() C si folosita pentru alimentarea cu caldura a unui
consumator extern CE (de exemplu locuinte).
C si folosita pentru alimentarea cu caldura a unui
consumator extern CE (de exemplu locuinte).
Deci randamentul general al unei CET este: 
4 Aerul umed
Aerul atmosferic este un amestec format din aer uscat si vapori de apa, amestec care se numeste aer umed.
Aerul uscat are in mod normal compozitia volumica 78,09 azot, 20,95 oxigen si alte gaze (argon, CO2, etc.).
Aerul umed, in afara de vapori de apa, poate contine si picaturi mici de apa lichida (ceata) sau cristale de gheata, fulgi de zapada, praf, etc., dar acest caz prezinta interes in special in meteorologie.
Aerul umed este utilizat ca agent de lucru in instalatiile de ventilatie, conditionare, de uscare, in industria lemnului, industria textila, etc.
Studiul proceselor ce utilizeaza ca agent de lucru aerul umed, se refera la cazul cand apa continuta se afla in stare de vapori.
Din legea lui Dalton: p = pau + pv
unde: p = presiunea aerului umed
pau = presiunea partiala a aerului uscat
pv = presiunea partiala a vaporilor de apa
Presiunea partiala a vaporilor de apa continuti in aer este foarte scazuta (cativa mm Hg). Corespunzator acestei presiuni scazute si temperatura de saturatie (fierbere) a apei este foarte mica. Deci, la temperatura mediului, apa din aerul umed se va afla de obicei in stare de vapori supraancalziti.
Diagrama T-s pentru vaporii de apa din aer
Figura 20 |
Cand atmosfera este clara, transparenta, vaporii de apa se afla in stare supraancalzita, adica presiunea partiala a vaporilor (pv) este mai mica decat presiunea lor de saturatie (ps), corespunzatoare temperaturii T a amestecului aer-vapori de apa (adica a mediului).
Starea vaporilor supraancalziti aflati in aer la presiunea partiala pv si temperatura T se reprezinta in diagrama T-s a vaporilor de apa prin punctul 1.
Aerul compus din aer uscat si vapori supraancalziti se numeste aer umed nesaturat.
Daca temperatura atmosferica scade, dintr-un motiv oarecare, de la temperatura T la Tr, continutul de vapori de apa ramane acelasi, deci pv nu se schimba, dar se poate ajunge la starea de saturatie a vaporilor si vaporii continuti in aer devin vapori saturati uscati (punctul 3).
Temperatura punctului 3, in care incepe condensarea vaporilor de apa raciti izobar la presiunea pv se numeste temperatura de roua (Tr).
Daca temperatura atmosferica scade sub Tr (T'r <Tr), atunci o parte din vapori se condenseaza sub forma de ceata (picaturi mici de apa lichida), deci scade continutul de vapori si prin urmare si presiunea pv va scadea pana la p'v corespunzatoare temperaturii T'r.
Acelasi fenomen de saturare a aerului cu vapori de apa se observa daca, plecand de la starea initiala 1, se mareste cantitatea de vapori de apa din aer in conditii de temperatura constanta (T = const.), de exemplu prin aducerea de vapori de apa de catre vant din alta regiune. In acest caz, presiunea partiala pv creste si poate deveni egala cu presiunea de saturatie ps corespunzatoare temperaturii T (punctul 2).
Aerul umed care contine vapori de apa la starea de saturatie se numeste aer umed saturat.
Orice surplus foarte mic de vapori de apa adus in acest caz, sau orice scadere foarte mica de temperatura produce ceata.
Deoarece procesele ce utilizeaza ca agent de lucru aerul umed decurg la presiuni apropiate de presiunea atmosferica, iar presiunea partiala a vaporilor este foarte mica, se poate considera cu suficienta precizie ca aerul umed se supune legilor gazelor ideale si amestecurilor de gaze ideale.
Cantitatea de vapori de apa din atmosfera variaza in functie de conditiile atmosferice momentane, din aceasta cauza toate marimile ce caracterizeaza aerul umed nu se raporteaza la 1 kg aer umed, ci la 1 kg aer uscat.
Marimile caracteristice mai importante ale aerului umed sunt:
a) Continutul de umiditate (x) reprezinta cantitatea de vapori de apa ce revine la 1 kg aer uscat, adica din (1+x) Kg aer umed:
![]()
b) Umiditatea relativa (j) reprezinta raportul dintre presiunea partiala a vaporilor (pv) la temperatura T si presiunea de saturatie (ps) corespunzatoare aceleiasi temperaturi T (punctele 1, respectiv 2):
![]()
Pentru aerul atmosferic j
In punctul 2 j
c) Temperatura termometrului umed (tum), reprezinta temperatura aerului umed masurata cu un termometru obisnuit, la care bulbul termometrului este acoperit cu o panza umezita in permanenta cu apa.
|
Figura 21 |
O parte din apa se evapora luand caldura din aerul inconjurator (caldura latenta de vaporizare), deci temperatura aerului din jurul termometrului scade. Masurand temperatura aerului umed cu un alt termometru fara panza umezita va rezulta temperatura reala a aerului umed de umiditate relativa j Diferenta de temperaturi Dt este proportionala cu umiditatea relativa a aerului umed. Daca aerul umed este saturat, cele doua termometre vor indica aceeasi temperatura. Acesta este de fapt principiul constructiv al psihrometrului cu care se poate masura umiditatea relativa a aerului umed. |
Umiditatea aerului mai poate fi masurata si utilizand proprietatea unor corpuri de a-si modifica dimensiunile functie de umiditatea aerului (ex. firul de par se lungeste sau se scurteaza in functie de umiditate).
Studiul transformarilor aerului umed se face cu ajutorul diagramelor (i1+x - x) construite fiecare pentru o anumita presiune a aerului umed. Entalpia i1+x reprezinta entalpia aerului umed, adica entalpia a (1+x) kg aer umed.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3523
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved