| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Proprietati coligative ale solutiilor
Reducerea presiunii vaporilor
Cresterea temperaturii de fierbere (ebuliosopie)
Reducerea temperaturii de congelare (crioscopie)
Osmoza
OBS.
Presiunea de vapori, punctul de fierbere si de congelare (topire) ale unei solutii nu sunt aceleasi cu cele ale solventului pur.
Variatiile punctelor de fierbere si de congelare, pentru solutiile diluate sunt proportionale cu concentratiile molare ale substantei dizolvate.
Reducerea presiunii de vapori.
v Odata cu formarea unei solutii se modifica atat proprietatile substantei dizolvate cat si proprietatile dizolvantului.
v Diagrama de faze a apei comparativ cu cea a unei solutii apoase:
|
|
O: punctul triplu al apei
OS: punctul triplu al solutiei
Presiunea de vapori a solutiilor, Pi, este mai mica cu ∆P decat presiunea de vapori a solventului pur, P0, iar scaderea de presiune este proportionala cu fractia molara a substantei dizolvate, Xi.
Acest enunt este cunoscut ca Legea lui Raoult:
∆P = (Po-Pi) = Xi∙Po,
Xi = ν2/ (ν1+ν2) ~ ν2/ ν1
→ nr. moli subst. dizolv.
ν1→ nr. moli solvent
(Po-P)/Po = (m2/M2)/(m1/M1) = (ν2/1000)∙M1~ Cmolara
Scaderea relativa a pesiunii de vapori este proportionala cu concentratia molara a solutiei.
Cresterea temperaturii de fierbere (ebulioscopie):
Ca urmare a micsorarii presiunii de vapori, o solutie fierbe la o temperatura Tfierb.sol superioara temperaturii Tfierb.solv. a solventului pur.
Cresterea punctului de fierbere al solutiei depinde numai de concentratia solutiei si nu de natura substantei dizolvate:
Tebulioscopic= Tfierb.sol - Tfierb.solvent![]()
Cresterea temperaturii de fierbere a unei solutii in comparatie cu temperatura de fierbere a solventului pur se numeste efect ebulioscopic
Raoult: Pentru acelasi solvent, cresterea temperaturii de fierbere a solutiei fata de cea a solventului pur este proportionala cu concentratia solutiei.
ΔTebulioscopic = KECmolara
KE ![]() constanta
ebuloscopica (ridicarea punctului de fierbere atunci cand in sol. se afla un mol de
substanta dizolvata in 1000 g solvent).
constanta
ebuloscopica (ridicarea punctului de fierbere atunci cand in sol. se afla un mol de
substanta dizolvata in 1000 g solvent).
Reducerea temperaturii de congelare (crioscopie)
Efectul crioscopic consta in scaderea punctului de congelare (inghetare) unei solutii in comparatie cu punctul de congelare al solventului pur:
Tcrioscopic= Tcong. solvent- Tcong. sol.
Raoult Pentru orice solvent pur, scaderea temperaturii de congelare a solutiei fata de cea a solventului pur este proportionala cu concentratia molara a solutiei.
ΔTcrioscopic = KCCmolara
KC![]() constanta crioscopica ( coborarea punctului de
congelare cand in solutie se gaseste un mol de
substanta dizolvata in 1000 g solvent).
constanta crioscopica ( coborarea punctului de
congelare cand in solutie se gaseste un mol de
substanta dizolvata in 1000 g solvent).
OBS.
In cazul neelectrolitilor, ΔTcrioscopic si KC nu depind de natura substantei, ci doar de numarul de molecule-gram dizolvate.
In cazul electrolitilor, datorita disociatiei vor exista mai multe particule in unitatea de volum. Rezulta un factor de corectie, i:
ΔTcrioscopic = iKCCmolara
i = 1+ (γ-1) α, unde γ = nr. de ioni si α = grd. de disociere
Osmoza
DEF.
Daca doua solutii de concentratii diferite snt despartite printr-o membrana semipermeabila are loc un fenomen de difuzie selectiva a moleculelor solventului, fenomen numit osmoza.
4.1. Presiunea osmotica - Legea van't Hoff
Pentru a pune in evidenta fenomenul de difuzie a substantelor prin anumite membrane, Pfeffer a realizat urmatoarea experienta:
|
|
|
Osmometrul Pfeffer |
capatul inferior al
unui tub din sticla ![]() membrana
semipermeabila
membrana
semipermeabila
tubul a fost umplut pana la un anumit nivel cu o solutie de zahar si apoi cu partea acoperita de membrana s-a introdus intr-un vas cu apa pana la nivelul la care se afla solutia de zahar
ridicarea nivelului
solutiei in tubul respectiv ![]() patrunderea apei
in tub prin membrana semipermeabila.
patrunderea apei
in tub prin membrana semipermeabila.
![]() apa patrunde
prin membrana in tub pana cand va fi oprita din cauza atingerii
unei stari de echilibru, cand presiunea osmotica devine egala cu
diferenta de presiune hidrostatica.
apa patrunde
prin membrana in tub pana cand va fi oprita din cauza atingerii
unei stari de echilibru, cand presiunea osmotica devine egala cu
diferenta de presiune hidrostatica.
DEF.
Diferenta de presiune aparuta pe cele doua parti ale membranei se numeste presiune osmotica.
CONCLUZIE:
Prin osmoza se intelege, deci, fenomenul de trecere preferentiala si cu viteza mare a solventului pur sau a unei solutii mai diluate spre o solutie mai concentrata.
Exercitarea presiunii osmotice:
|
|
OBS.
transferul nu are loc dinspre solutia concentrata spre cea diluata pentru egalizarea concentratiilor, ci invers.
solventul poate trece prin membrana, dar nu si solvatul si in acest caz procesul care are loc se va desfasura sub actiunea presiunii osmotice.
Van't Hoff ![]() analogie intre
presiunea exercitata de o solutie diluata si neelectrolitica
si presiunea exercitata de un gaz, aplicand in cazul solutiei
legea generata a gazelor perfecte, adica:
analogie intre
presiunea exercitata de o solutie diluata si neelectrolitica
si presiunea exercitata de un gaz, aplicand in cazul solutiei
legea generata a gazelor perfecte, adica:
![]()
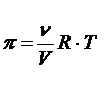 unde
unde 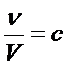 reprezinta
concentratia molara.
reprezinta
concentratia molara.
Cu aceste inlocuiri obtinem pentru presiunea osmotica:
π = cRT
legea van't Hoff (laureat al premiului Nobel pentru chimie in anul 1904).
p reprezinta presiunea osmotica, c concentratia molara, R constanta universala a gazelor, iar T reprezinta temperatura.
![]() doua solutii
care au aceeasi concentratie molara si au aceeasi
temperatura au presiunile osmotice egale, indiferent de natura lor.
doua solutii
care au aceeasi concentratie molara si au aceeasi
temperatura au presiunile osmotice egale, indiferent de natura lor.
DEF.
Doua solutii cu presiunile osmotice egale se numesc izotonice.
Trecerea apei din exterior spre interior se numeste endosmoza, iar invers, spre exterior se numeste exosmoza.
Daca doua solutii au presiuni osmotice diferite, cea cu presiunea osmotica mai mare se numeste hipertonica, iar ce cu presiunea osmotica mai mica se numeste hipotonica.
4.2. Importanta biologica a osmozei
Osmoza intervine in multe procese fiziologice care au loc in interiorul plantelor si animalelor, jucand un rol important in schimbarile dintre organisme si mediul lor de viata, intre celulele si mediul extracelular.
OBS.
O celula introdusa intr-o solutie izotonica nu va suferi nici o modificare a volumului, deoarece nu se produce nici un schimb de substanta intre solutie si citoplasma.
Turgescenta reprezinta fenomenul de marire a volumului unei celule prin patrunderea apei in interiorul ei (endosmoza).
Atunci cand celulele se gasesc intr-o solutie hipotonica, apa intra in celula cautand sa dilueze continutul ei.
Fenomenul invers, de micsorare a volumului unei celule prin iesirea apei, atunci cand se gaseste intr-o solutie hipertona se numeste plasmoliza.
Hemoliza:
Daca celula este o hematie si se introduce intr-o solutie hipotonica, ea se va umfla datorita patrunderii apei, insa doar pana la o anumita limita, cand se va rupe si in consecinta va elibera hemoglobina trecand in lichidul de suspensie.
Fenomenul de rupere a hematiei se numeste hemoliza iar volumul la care se rupe hematia se numeste volum critic de hemoliza.
In final celula moare, iar fenomenul se numeste citoliza.
OBS.
Izotonia este o conditie importanta de care trebuie sa se tina cont atunci cand se introduc cantitati de lichid in sange, fie in scop curativ (prin injectii intravenoase), fie in cazul conservarii sangelui. Pentru a nu se modifica echilibrul osmotic al serului sanguin, solutiile injectate trebuie sa aiba aceeasi presiune osmotica.
La animale, ca urmare a existentei substantelor coloidale (substante cu diametrul 1 - 100 mm) apare o presiune coloid osmotica (oncotica).
Formarea edemelor in starile patologice se explica prin dereglarea presiunii coloid osmotice.
Membranele animale nu sunt perfect semipermeabile, deoarece lasa sa treaca si substantele cristaloide dizolvate, dar nu lasa sa treaca suspensiile coloidale. Aceasta insusire permite separarea substantelor sub forma coloida de cele cristaloide, proces ce se numeste dializa.
|
|
|
Realizarea dializei |
Solutia cu amestecul de coloizi si cristaloizi se introduce in vasul prevazut cu membrana. Cristaloizii difuzeaza in curentul de apa curata, in timp ce coloidul este retinut.
Apa si importanta ei in lumea vie
Clasificarea apei din organismele vii
o In raport cu celulele exista apa intracelulara si extracelulara, care la randul ei poate fi interstitiala si circulanta (intravasculara).
o Dupa starea ei de fixare in organism, apa poate fi legata (continuta in structuri moleculare) si libera.
o In functie de provenienta, apa poate fi exogena (adusa din exterior) sau endogena (rezultata din procesele metabolice).
Proprietatile fizice ale apei
Datorita proprietatilor fizice pe care le are, apa are o importanta deosebita pentru organismele vii, influentand existenta, conformatia si functiile acestora.
Variatia densitatii apei cu temperatura
o
Spre
deosebire de celelalte lichide, apa isi mareste volumul prin
solidificare si isi micsoreaza densitatea. Ea are
densitatea maxima la
o
Prin
racire, intre
(Aceasta anomalie se explica prin faptul ca, o data cu scaderea temperaturii, creste gradul de ordonare al moleculelor de apa, prin cresterea numarului de legaturi de hidrogen. Reteaua moleculara devine tot mai structurata, ceea ce determina marirea volumului ghetii si scaderea densitatii).
Proprietatile termice ale apei
o Ca urmare a activitatii metabolice, organismele vii produc energie, mai ales sub forma de caldura.
o
Daca
se presupune ca un organism viu ar fi un sistem izolat avand caldura
specifica apropiata de cea a apei (1 cal/ggrad), atunci valoarea
temperaturii lui ar creste mult peste 37 -
OBS.
Prin proprietatile fizice si valorile constantelor termice, apa are un rol deosebit de important in procesele de termoreglare ale organismului (rol termoregulator).
o Organismele vii pot primi din exterior cantitati insemnate de caldura, care insa produc incalziri mici. Sangele, prin continutul ridicat de apa, transporta o mare cantitate de caldura din locul unde se produce in tot organismul, uniformizand temperatura acestuia. Prin intermediul vaselor sanguine din apropierea suprafetei corpului, sangele cedeaza caldura mediului exterior prin radiatii.
o Conductivitatea termica a apei este mare in comparatie cu alti constituenti organici si, in concluzie, organismele vii pot evita hipertermiile locale prin transport rapid al caldurii.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3583
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved