| CATEGORII DOCUMENTE |
| Alimentatie nutritie | Asistenta sociala | Cosmetica frumusete | Logopedie | Retete culinare | Sport |
VIRUSUL CITOMEGALIC
Modificarile histopatologice atribuite ulterior virusului citomegalic au fost descrise prima data in 1904 in viscerele unui copil cu sifilis1. Ele erau reprezentate de celule mari (20-30 mm) care contineau incluziuni mari intranucleare. Modificari similare au fost mai tarziu observate in tesutul parotidian provenit de la un copil2. Initial s-a crezut ca aceste modificari erau produse de unele protozoare din genul amoeba.
In 1921, Goodpasture si Talbot au atribuit acestor celule modificate numele de "cytomegalia". Ei nu au reusit sa evidentieze protozoare in tesuturile cu modificari citomegalice, dar au sesizat ca incluziunile intranucleare sunt similare cu cele observate la nivelul leziunilor cutanate din varicela, preconizand astfel ipoteza etiologiei virale3.
In 1926, intr-o suspensie provenita din tesut glandular salivar cu modificari citomegalice s-a evidentiat un agent viral filtrabil4.
In aceasta perioada majoritatea studiilor erau efectuate pe tesuturi necropsiate. S-a observat ca 1-2% din copiii necropsiati aveau leziuni citomegalice diseminate plurivisceral, motiv pentru care a fost introdus termenul de "Cytomegalic inclusion disease". Alti autori au aratat prezenta modificarilor citomegalice la 10% din glandele salivare provenite de la copii decedati din diferite cauze5.
In 1952, s-au evidentiat modificari citomegalice in celulele din sedimentul urinar ale unui copil care ulterior a decedat. Pe baza acestor modificari s-a stabilit diagnosticul de "Cytomegalic inclusion disease". Tot atunci s-a stabilt ca aceasta boala este mortala la copil atunci cand este generalizata5.
In 1954, Smith a izolat in culturi celulare o tulpina CMV din tesut glandular salivar provenit de la soarece6. Izolarea CMV in glandele salivare umane a fost raportata aproape concomitent in 1956 de 3 grupuri independente de cercetatori conduse de Smith, Weller si Rowe7-9. Pana in 1960 virusul a purtat numele de Salivary gland virus (SGV) sau Cytomegalic inclusion disease virus, dupa care el a fost numit cytomegalovirus (CMV)10.
In 1965 a fost descris pentru prima data la un adult sanatos un sindrom mononucleozic care a fost atribuit CMV11. Apoi a fost citat un sindrom mononuclozic postranfuzional, care a fost atribuit tot CMV12.
2. Particularitati virusologice si imunologice
2.1. Morfologie si structura
Virusul citomegalic (CMV) sau Human Herpes Virus 5 (HHV5) apartine familiei Beta-herpesviridae. El are dimensiuni mari, fiind considerat cel mai mare dintre virusurile patogene pentru om. CMV este alcatuit din genom, nucleocapsida, tegument si anvelopa lipidica.
a) Genomul
CMV are cel mai complex genom dintre toate virusurile patogene pentru om.
Genomul CMV este alcatuit dintr-un ADN linear bicatenar, care contine 230.000 perechi de baze. Continutul procentual in guanina si citozina este de 57%. Secventialitatea nucleotidica a genomului a fost complet descifrata. El codifica 230 proteine virale, spre deosebire de virusul hepatitei B care codifica numai 4 proteine.
Tulpina CMV de referinta, care a fost cea mai mult studiata se numeste AD169. Analiza moleculara, prin tehnica restrictiei genice a demonstrat o omologie nucleotidica de 80-90% intre diferitele tulpini clinice de CMV si tulpina AD169. Genomul tulpinii AD169 este mai scurt decat genoamele majoritatii tulpinilor izolate in clinica. Spre exemplu tulpina CMV Toledo cuprinde un fragment aditional de ADN de 15.000 perechi de baze.
In functie de secventialitatea genomului herpesvirusurilor umane au fost descrise 5 paternuri diferite de genom, notate de la A la E. Genomul CMV apartine alaturi de genomul HSV 1 si HSV 2 paternului E13.
ADN-CMV contine un lant lung (L) si unul scurt (S) unite intre ele prin legaturi covalente. Fiecare lant are o secventa unica de citire: UL si US. Fiecare dintre acestea este flancata la capete de niste secvente repetitive: la capatul extern de TRL si TRS (terminal repeat), iar la capatul intern de IRL si IRS (internal repeat). Aceste secvente repetitive sunt indispensabile replicarii virale. CMV apartine beta-herpesvirusurilor deoarece genomul sau contine secvente TR complementare cu ale celorlalte beta-herpesvirusuri. Schema detaliata a genomului a fost deja prezentata la capitolul II (Virusurile herpes simplex 1 si 2).
Genomul CMV este compus din cantitati egale din cele patru forme izomerice de ADN viral, generate in urma a trei inversiuni, survenite in timpul replicarii virale la nivelul jonctiunii segmentelor L si S.
Nu se cunoaste cu precizie forma sub care ADN-ul viral persista in interiorul celulei gazda, dar extrapoland modelul HSV, se pare ca el nu se integreaza in genomul celulei gazda. Probabil, ADN-ul viral este impachetat in structuri nucleozomale, numindu-se ADN episomal, forma sub care poate persista 'latent' in limfomonocite si in unele celule epiteliale sau endotelilale, de unde poate fi ulterior reactivat in caz de immunodepresie.
b) Proteinele CMV
Genomul CMV codifica peste 200 de proteine, dintre care 35-45 sunt proteine structurale, restul fiind proteine functionale. Din totalul proteinelor virale numai o treime au fost identificate ca structura si functie biologica. Dintre acestea cele mai importante si mai bine cunsocute sunt :
UL54 sau ADN-polimeraza virala este codificata de gena UL54. Ea este indispensabila replicarii virale si reprezinta principala tinta a chimioterapicelor anti-CMV. Activitatea ADN polimerazei virale este amplificata de proteina accesorie UL44 codificata de aceeasi gena. In celulele infectate cu CMV cele 2 proteine (UL54 si UL44) formeaza complexul functional al ADN-polimerazei virale.
UL89, recent identificata, se pare ca ar cliva precursorul ADN-ului viral in mole- cule mai mici, care sa poata intra in interiorul viitorilor virioni. Ea va costitui probabil o noua tinta pentru antivirale.
UL97, recent izolata, este o fosfotransferaza, codificata de gena UL97. Rolul ei in replicarea virala nu este complet cunoscut. In celulele infectate cu CMV, proteina UL97 are activitate enzimatica si transforma ganciclovirul in ganciclovir-monofosfat. Aceasta etapa este indispensabila actiunii antivirale a ganciclovirului. Enzima UL97 este similara timidinkinazei (TK) care asigura monofosforilarea acyclovirul in celulele infectate cu HSV. Observatia recenta, conform careia UL97 poate fosforila si acyclovirul a deschis noi perspective in tratamentul si profilaxia infectiilor CMV, la imunodeprimati. Studii recente au aratat ca UL 97 ar putea interveni in replicarea CMV prin fosforilarea unor proteine (reziduri de serina) necesare replicarii virale17.
c) Capsida proteica
Capsida icosaedrica compusa din 162 de capsomere inconjoara genomul viral si contine poteina antigenica pp65. Aceasta proteina este foarte importanta in diagnosticul infectiei CMV, ea putand fi usor detectata in celulele infectate prin imunofluorescenta sau imunoperoxidaza.
d) Tegumentul
Tegumentul sau matrixul este o structura amorfa, proteica, electronodensa situata intre capsida si anvelopa. El contine o serie de proteine functionale cu rol important in initierea replicarii virale.
e) Anvelopa
Anvelopa imbraca capsida si genomul, are structura lipidica, in ea fiind inserate glicoproteinele virale (gp) sub forma de spiculi. Nu se cunoaste cu precizie numrul de gp ale CMV. Unele gp intervin in procesul de adsorbtie si penetrare a virusului in celula. Anvelopa deriva din membrana nucleara a celulei gazda infectate, are doua straturi fosfolipidice si se invecineaza catre interior cu tegumentul. Prezenta anvelopei face ca CMV sa fie fragil, fiind usor inactivat de numerosi agenti fizicochimici, fapt care face ca transmiterea CMV sa presupuna un contact interuman apropiat.
2.2 Replicarea virala
Proteinele celulare care servesc ca receptori pentru CMV nu au fost inca identificate, dar se pare ca CMV pentreaza celula printr-un proces de endocitoza, dupa o prealabila fuziune intre anvelopa virala si membrana celulei gazda. Se pare ca prima interactiune intre CMV si celula gazda se face intre glicoproteinele virale B si CII cu structurile heparan sulfat de la suprafata celulara.
Nucleocapsida si tegumentul patrund si se acumuleaza in citoplasma, la nivelul unor microtubuli, de unde sunt transportate catre porii nucleari. Genomul decapsidat si niste proteine patrund in nucleu unde ADN-ul linear se circularizeaza si se transforma in episomi.
Initierea replicarii virale este marcata de exprimarea genelor care codifica ADN polimeraza virala si a pachetului de gene care codifica restul enzimelor necesare replicarii virale.
Replicarea CMV (Fig.1) este un proces secvential, care cuprinde 3 faze: IE (immediate early), E (early) si L (late).
In faza IE sunt activate un numar foarte restans de gene virale IE, care vor codifica sinteza unor proteine virale functionale ce vor activa transcrierea genelor E. Se pare ca proteinele virale IE au actiune transactivatoare atat asupra genelor virale cat si a celor celulare.
In faza E sunt sintetizate proteinele indispensabile replicarii ADN-ului viral. Aceasta are loc in nucleul celular sub actiunea ADN polimerazei virale, fapt care duce la aparitia incluziunilor gigante intranucleare, care sunt marker al infectiei CMV. Aceste incluziuni sunt alcatuite din agregate de nucleoproteine CMV. Replicarea ADN viral este precedata de circularizarea acestuia sub actiunea secventelor TR. Noile molecule de ADN sunt generate continuu plecand de la molecula parentala circulara. Ele sunt clivate in secventele descrise anterior si apoi "impachetate" in noile capside. Majoritatea genelor virale sunt exprimate dupa replicarea ADN.
In faza L se sintetizeaza majoritatea proteinelor structurale virale. Definitivarea ciclului replicativ al CMV este dependenta de gradul de diferentiere al celulei gazda. Un ciclu replicativ complet conduce de obicei la distrugerea celulei gazda, dar se pare ca si expresia partiala a proteinelor CMV va afecta metabolismul celular. Cum o mare parte a celulelor gazda apartin sistemului imun, acest efect va antrena o imunosupresie. CMV contine niste gene care codifica proteine direct implicate in dereglarea sistemului imun al gazdei. Aceasta are ca rezultat final "evadarea" CMV de sub actiunea raspunsului imun. Una dintre aceste proteine impiedica exprimarea moleculei HLA 1 la suprafata celulei infectate. Astfel, moleculele HLA 1 si glicoproteinele CMV nu pot forma complexe la suprafata celulei infectate, fapt care nu va permite recunoasterea si distrugerea acesteia de catre limfocitele T CD814. In acest mod genomul CMV poate ramane nestingherit in interiorul celulei gazda, la adapost de sistemul imun.
Fig 1. Diagrama replicarii CMV (dupa Griffith PD)21
Studiile in vitro au aratat ca replicarea completa a CMV are loc numai in fibroblaste. In celelalte celule sunt exprimate un numar redus de gene (IE si uneori E). Lipsa exprimarii genelor L face ca in celula respectiva sa nu apara noi virioni (infectie abortiva).
In vivo, efectul citopatic caracteristic CMV, care reflecta o infectie productiva este observat in multe tesuturi si organe. Celulele tinta pentru replicarea CMV in vivo sunt: monocitele, macrofagele, neutrofilele, celulele endoteliale si epiteliale, fibroblastele si celulele musculare netede. In cursul primoinfectiei au loc viremii cu diseminarea CMV in diferite organe, unde se va stabili latenta. Studiile pe modele animale au aratat ca instalarea si importanta latentei sunt dependente de intensitatea replicarii si diseminarii sanghine a CMV in cursul primoinfectiei. Infectia congenitala CMV se soldeaza cu un nivel inalt de latenta.
Discrepanta observata intre replicarea CMV in vivo si in vitro a fost recent lamurita. Tulpina salbatica de CMV contine un fragment de ADN aditional, care codifica probabil tocmai tropismul acestei tulpini in vivo si / sau raspandirea intercelulara a virusului.
2.3. Mecanismele latentei si reactivarii virale
CMV, fiind un herpesvirus, determina o infectie latenta, care se poate reactiva la imunodeprimati, la care produce infectii grave, deseori letale.
2.3.1. Sediul latentei CMV
Organele in care CMV isi poate stabili latenta au fost identificate prin studii de hibridizare in situ si imunocitochimie. Acestea sunt endoteliul vascular, pulmonul, creierul, rinichiul, splina, ficatul si glandele salivare. Ele vor constitui surse de contaminare.
Celulele in care s-a identificat CMV latent non-replicativ sunt neutrofilele, limfocitele T, monocitele, celulele epiteliale renale, celulele glandulare salivare, celulele endoteliale si celulele musculare netede. Aceste celule au aspect histologic normal. Evidentierea antigenelor CMV in celulele endoteliale a condus la implicarea CMV in etiopatogenia bolilor vasculare inflamatorii si aterosclerozei.
2.3.2. Mecanismele prin care este mentinuta latenta CMV nu sunt bine cunoscute. Se pare ca un rol important il are capacitatea CMV de a impiedica expresia moleculei HLA 1 la suprafata celulei14.
Se pare ca macrofagele si celulele endoteliale joaca un rol in mentinerea latentei CMV. Se stie ca sursa majora de CMV la indivizii seropozitivi CMV este reprezentataa de celulele mononucleare din sangele periferic. S-a demonstrat insa ca mononuclearele periferice nu sunt numai sursa de infectie dar si vector pentru diseminarea viscerala a CMV. Astfel se explica de ce infectia CMV se transmite cu multa usurinta prin intermediul organelor grefate, care reprezinta si ele rezervor de infectie.
Monocitele sunt infectate in proportie mare, dar infectia este nonproductiva si noncitopatica21. Atunci cand limfocitul T activat vine in contact cu un monocit infectat, se produce diferentierea acestuia din urma in macrofag si este indusa replicarea virala. Aceasta interactiune se produce frecvent in timpul raspunsului imun celular care apare la pacientii ce au primit alogrefe. Persistenta CMV in macrofage se datoreaza si capacitatii virusului de a se acumula vacuole citoplasmatice. Macrofagele au un "trafic intens" in tesuturi si interactioneaza cu multe alte celule, pe care le poate infecta cu CMV in timpul procesului de fuziune21.
Celulele endoteliale vasculare reprezinta un alt potential situs pentru persistenta CMV. Virusul a fost detectat in peretele aortei la pacienti seropozitivi CMV asimptomatici. De aceea s-a lansat ipoteza implicarii CMV in aterogeneza. S-a dovedit cu certitudine ca CMV este implicat in proliferarea fibrelor musculare netede vasculare din boala cunsocuta sub numele de "coronary artery restenosis"21. Infectia CMV a celulelor endoteliale din creier este o infectie productiva, care conduce la liza celulara, spre deosebire de infectia celulelor endoteliului aortic care este noncitopatogena21.
Nu exista modele in vitro pentru studierea latentei si reactivarii CMV la om. Tentativele de reactivare directa a CMV in vitro, pornind de la celule infectate latent in vivo, au furnizat totusi date interesante. Astfel, un studiu efectuat pe monocite provenite de la purtatori sanatosi de CMV au aratat o mare dificultate in a reactiva virusul, in pofida prezentei ADN-CMV in celule, inaintea diferentierii. Diversele stimulari ale monocitelor provenite de la indivizi seropozitivi-CMV (cu cortizon / PMA si GM-CSF) nu au indus expresia litica a virusului15.
Tinand cont de ansamblul de rezultate obtinute la om si pe modele animale, se poate spune ca CMV isi instaleaza latenta in diverse celule din numeroase organe si ca 'evenimentele' care survin in cursul unei imunodepresii sau imunomodulari sunt propice reactivarii CMV.
2.3.3. Mecanismele reactivarii CMV
Reactivarea CMV survine in timpul imunodepresiilor iatrogene (chimioterapie, transplant) sau naturale (SIDA, boli limfoproliferative, sarcina, stress). Ea mai poate fi indusa de ciroza hepatica, diabetul zaharat, unele boli transmise sexual si de reactia grefei contra gazdei.
Reactivarea CMV consta in reluarea replicarii CMV, aparitia viremiei si a bolilor de organ. Bolile CMV aparute prin reactivare virala sunt de regula mai putin severe si au durata mai scurta fata de cele aparute in cursul primoinfectiei. Reactivarile CMV pot fi confundate cu reinfectiile CMV deoarece au o evolutie similara si pentru ca deseori la acelasi individ isi stabilesc latenta mai multe tulpini CMV, putand apare chiar recombinari genetice intre acestea.
Mecanismul intim al reactivarii CMV este incomplet cunoscut, dar se pare ca citokinele au un rol important. Astfel, la transplantati s-au decelat concentratii serice mari de TNFa, care ar putea reactiva CMV. Aceasta supozitie este sustinuta de observatia ca in vitro, TNFa stimuleaza activitatea promotorului genelor IE-CMV (immediate early) pe liniile de monocite nediferentiate, inhiband-o insa pe liniile de monocite / macrofage. Deoarece CMV persista latent in celulele precursoare medulare, se poate presupune ca o crestere importanta a nivelului seric de TNFa ar putea induce rectivarea CMV in aceste celule. Efectul TNFa este in parte mediat de receptorul p75 si prin secventele de raspuns la factorul de transcriptie NFkB, care se afla in structura promotorului genelor IE-CMV15. IL1, IL6 si GM-CSF nu influienteaza activitatea promotorului IE. Hidrocortizonul induce o expresie limitata a CMV, desi unii autori sustin ca ar stimula replicarea virala. Gonadotrofina stimuleaza replicarea CMV, in timp ce progesteronul si estradiolul o inhiba. Acesti factori pot avea un rol in reactivarea sau mentinerea latentei CMV la gravida15.
2.4. Efectul citopatic
CMV produce un efect citopatic caracteristic, reprezentat de aparitia unor celule gigante, cu incluziuni intranucleare mari (citomegalice), cu aspect de 'ochi de bufnita' (Fig 2). Prezenta acestor modificari in tesutul biopsiat este absolut necesara pentru a incrimina CMV in patologia organului respectiv, deoarece CMV este deseori prezent ca 'pasager inofensiv' in diferite organe sau umori, fara a fi implicat in patologia acestora.
Fig. 2. Efectul citopatic specific CMV (dupa Weller TH)
Prezenta CMV in culturi celulare este anuntata de aparitia efectului citopatic, care survine insa tardiv, dupa 1-3 saptamani.
Mecanismele prin care CMV afecteaza tesuturile si organele
CMV poate afecta diferitele tesuturi si organe prin trei mecanisme: agresiune tisulara directa, agresiune imunologica si prin mecanisme indirecte.
a) Agresiune tisulara directa
Ca oricare alt virus, CMV poate produce moartea celulei pe care o infecteaza, producand leziuni tisulare. CMV afecteaza in principal celulele epiteliului ductal din glandele salivare, rinichi si ductele bilare. El poate afecta epiteliul mucoasei gastroeintestinale, producand leziuni ulcerative precum si epiteliul mucoasei vezicii urinare cu eliminarea virusului prin urina.
b) Agresiune imunologica
Afectarea pulmonara pare sa fie mediata imunologic, leziunile celulare fiind rezultatul agresiunii exercitate de catre limfocitele T citotoxice si citokinele eliberate de acestea. Se pare ca CMV poate stimula direct sinteza de TNFa si IL121.
CMV ar putea induce tot prin mecanism imunologic reactia grefei contra gazdei. Recent s-a demostrat ca CMV incorporeaza molecula CD13 in virionul sau. In acest context molecula CD13 asociata virionului induce autoanticorpi in reactia grefei contra gazdei21,89. Autoanticorpii specifici anti-CD13 pot contribui la leziunile tisulare observate in cursul reactiei cronice a grefei contra gazdei.si pot explica de ce infectia CMV este un factor de risc pentru aparitia acestei complicatii autoimune dupa grefele medulare.
CMV pare implicat si in rejetul cronic al grefei prin scleroza vaselor din organul grefat. Aceasta a fost raportata la 5 ani post-transplant in 30-50% din alogrefe21. Histologic aceasta entitate clinica se caracterizeaza prin proliferari vasculare la nivelul fibrelor musculare netede, care migreaza catre intima vasului. Boala este asemanatoare cu ateroscleroza, care este si ea asociata infectiei CMV. Mecanismul intim al proliferarii pare a fi fie infectarea cu CMV a celulelor musculare netede din peretele vasului, fie stimularea producerii unor factori de crestere ce stimuleaza proliferarea21.
c) Mecanisme indirecte
Prin mecanisme indirecte CMV poate produce supresie medulara si diferite fenomene autoimune cum ar fi: anemia hemolitica, purpura trombocitopenica, epidermoliza, sindromul Guillain Barre, reactia cronica a grefei contra gazdei etc. Aceste fenomene autoimune se pot explica prin aparitia de autoanticorpi, de limfocite atipice, granulocitopenie si cresterea nivelului seric total de IgG. In cursul infectiei CMV se deceleaza frecvent anticorpi anti-muschi neted, aglutinine la rece, crioglobuline (IgG, IgM si IgA), factor reumatoid, hipergamaglobulinemie policlonala, factor antinuclear si test Coombs pozitiv.
2.6. Interactiunile dintre CMV si HIV
Numeroase studii au aratat ca progresia infectiei HIV de la stadiile pre-SIDA spre SIDA este de 3 ori mai rapida la pacientii infectati concomitent cu CMV, in timp ce alte studii nu au putut confirma aceasta ipoteza16. Nu s-a putut face o corelatie intre prezenta CMV la necropsie si intervalul dintre diagnostiarea SIDA si deces.
CMV este unul din cei mai importanti agenti patogeni oportunisti in SIDA si se stie ca exista o corelatie intre numarul de limfocite CD4 si nivelul infectiei active CMV.
Deoarece, o afectare viscerala CMV poate apare concomitent cu alte infectii oportuniste ale organului respectiv, este dificil de afirmat ca CMV este agentul cauzal al bolii de organ. Dar exista o serie de manifestari clinice in care CMV este in mod cert implicat..
Infectia CMV este imunosupresiva prin ea insasi. Efectul imunosupresor al CMV asupra unui sistem imunitar deja compromis prin infectia HIV va duce la o prabusire mai rapida a sistemului de aparare imunitara a gazdei.
a) Interactiunile intre 2 celule, una infectata cu CMV si alta cu HIV
Acest tip de interactiuni sunt mediate de citokine. Incubarea celulelor mononucleate din sangele periferic in prezenta CMV se soldeaza cu sinteza de IL1 si TNFa, care sunt capabile sa stimuleze 'promotorul' replicarii HIV18. CMV induce si producerea de 'Transforming growth factor b care va inhiba proliferarea limfocitelor, contribuind la deteriorarea sistemului imunitar. Raspunsul imun la infectia CMV ar putea antrena secretia de citokine care sa stimuleze replicarea HIV, fapt sustinut de un studiu in vitro efectuat de Tremblay si coll18. De asemenea, raspunsul imun anti-CMV ar putea antrena distructia limfocitelor prin apoptoza. Groux si apoi Schwartz au aratat ca limfocitele care au suferit o stimulare la nivelul receptorilor CD4, in absenta unei costimulari a receptorului T (TcR) sunt susceptibile de a intra in apoptoza, atunci cand ele primesc ulterior o stimulare via TcR, spre exemplu in urma recunoasterii antigenelor CMV18.
Schimbarile induse la suprafata celulelor infectate cu CMV ar putea face posibila infectarea ulterioara cu particule HIV 'imbracate' in imunoglobuline, deoarece CMV antreneaza expresia
de receptori Fc la suprafata celulelor pe care le infecteaza.
b) Interactiunile CMV - HIV atunci cand ele coinfecteaza aceeasi celula
Doua studii au aratat ca HIV si CMV pot coinfecta aceeasi celula, fie in creier, fie la nivelul celulelor endoteliale, fie in monocite / macrofage. In vitro, aceste interactiuni in interiorul unei celule coinfectate CMV-HIV au fost studiate pe celule SNC. Atunci cand cele 2 virusuri se replica in mod permisiv, CMV va reprima replicarea HIV. Daca expresia CMV este limitata, ea nu va avea efect asupra replicarii HIV. Atunci cand expresia HIV este limitata, CMV poate amplifica expresia HIV18,19.
In alte sisteme celulare, CMV, chiar inactivat prin caldura sau ultraviolete a fost capabil sa stimuleze replicarea HIV.
Deci, interactiunile intre HIV si CMV in aceeasi celula difera in functie de tipul celulei si de nivelul initial de replicare a fiecarui virus.
Alte studii au aratat ca proteinele foarte precoce ale CMV (IE-CMV) determina stimularea regiunii LTR-HIV, care controleaza replicarea HIV. IE-CMV sunt niste fosfoproteine nucleare a caror expresie este obligatorie in cadrul ciclului de replicare al CMV16.
Se pare insa ca expresia IE-CMV nu este sinonima cu replicarea activa a CMV, ele fiind prezente la bolnavii seropozitivi HIV si in unele celule cu aspect histologic normal. Raspunsul LTR-HIV la IE-CMV depinde de tipul celulei studiate.
In concluzie se poate spune ca CMV este un puternic cofactor pozitiv asupra replicarii HIV si implicit asupra accelerarii evolutiei bolii de la stadiul de seropozitiv HIV la cel de SIDA.
2.6. Raspunsul imun celular anti-CMV
Ca in orice infectie virala raspunsul imun celular are un rol esential in apararea organismului contra CMV.
Studiile efectuate la om au aratat ca majoritatea limfocitelor T citotoxice au ca tinta proteina pp65, iar limfocitele T CD4 interactioneaza cu proteinele IE. Limfocitele CD4 si CD8 au diferite functii in controlarea infectiei CMV79. Citokinele produse de limfocitele T CD4 sunt specifice IE-CMV si par sa joace un rol important in stabilirea si controlarea latentei CMV in vivo.
IFg si TNFa inhiba replicarea CMV79. Protectia contra infectiei simptomatice CMV este asigurata de limfocitele T citotoxice. Recent s-a demonstrat ca raspunsul imun celular anti-CMV poate fi reconstituit la pacientii imunodeprimati dupa transplante medulare prin administrarea unor clone de limfocite T CD8 specifice anti-CMV, provenite de la donatori sanatosi seropoziivi CMV. Studiile efectuate cu aceasta alternativa terapeutica au aratat ca infuzia de limfocite T CD8 anti-CMV previne viremia si infectia simptomatica CMV la imunodeprimati.
2.7. Raspunsul imun umoral anti-CMV
Rolul imunitatii umorale anti-CMV este insuficient cunoscut, dar se stie ca anticorpii specifici anti-CMV nu pot impiedica reactivarea, reinfectia sau transmiterea transplacentara a CMV.
Instalarea raspunsului imun anti-CMV al gazdei va conduce la vindecarea primoinfectiei CMV si apoi la controlarea si mentinerea starii de latenta a CMV.
Studiile pe animale au aratat ca tinta anticorpilor neutralizanti anti-CMV este reprezentata de glicoproteina anvelopei gpB. Rolul anticorpilor anti-gpB in controlarea infectiei poate fi sintetizat astfel21:
Inactivarea sau diminuarea infectiozitatii virale prin:
formarea de agregate imunoglobuline-virus
alterarea moleculelor virale de suprafata, indispensabile atasarii la celula gazda
neutralizarea virala
Favorizarea eliminarii virale prin:
activarea complementului si / sau opsono-fagocitoza
fagocitoza mediata prin receptorul Fc
Liza celulelor infectate prin:
medierea citotoxicitatii limfocitelor T
medierea activitatii citotoxice a complementului
2.9. Efectul imunosupresor al CMV
Recent s-a demonstrat ca proteinele codificate de genele US2, US3 si US11 pot distruge moleculele HLA I sintetizate de celula gazda. Acest fapt conduce la diminuarea expresiei lor la suprafata celulelor infectate si la scaparea acestor celule de sub supravegherea stricta a sitemului imun algazdei79. Astfel se ajunge in final la instalarea latentei CMV.
Proteina US11 poate disloca molecula HLA I din reticulul endoplasmatic catre citosol, unde va fi degradata de proteozomi79.
Alte proteine virale afecteaza negativ moleculele HLA II printr-un mecanism necunoscut, contribuind la efectul imunosupresor al CMV79.
Proteina pp65 poate bloca mecanismul de procesare si de prezentare a antigenelor IE-CMV catre limfocitele T. Se pare ca proteina pp65 amplifica fosforilarea antigenelor IE.
Unele studii au aratat ca CMV poate cauza imunosupresie si prin interferarea sintezei de citokine79.
3. Istoria naturala a infectiei CMV
Ca orice herpesvirus, CMV produce o infectie latenta care parcurge mai multe etape.
a) Primoinfectia CMV
Primoinfectia are loc in copilarie, fiind in majoritatea cazurilor asimptomatica. In cursul primoinfectiei, CMV se multiplica intens la poarta de intrare, dupa care disemineaza hematogen in numeroase tesuturi si organe. In sange, este vehiculat in interiorul polimorfonuclearelor neutrofile, de unde infecteaza celulele reticuloendoteliale capilare si celule epiteliale ale canalelor glandulare. CMV provoaca leziuni de vasculita obliteranta ischemica si focare inflamatorii in majoritatea tesuturilor. Sunt afectate preferential tesuturile glandulare, motiv pentru care virusul este excretat prin saliva, lacrimi, urina, lapte matern, secretii genitale, respiratorii si digestive
b) Latenta CMV
Dupa primoinfectie, CMV persista indefinit in stare latenta in unele limfomonocite, celule endoteliale si glandulare, fara a se replica si fara a exprima proteine virale.
c) Reactivarea CMV
In anumite conditii pot apare episoade de reactivare CMV, in cursul carora virusul este excretat prin saliva, urina sau secretii cervicale. Reactivarile CMV sunt asimptomatice, dar uneori se pot insoti de viremii, diseminare hematogena si transplacentara. Imunodepresia indusa de chimioterapie sau de infectia HIV reprezinta principala cauza de reactivare a infectiei latente CMV.
d) Reinfectia cu CMV
Reinfectiile CMV sunt posibile dar rare, fiind insa mai frecvente la imunodeprimati. La pacientii cu SIDA se pot decela in urina concomitent mai multe tulpini de CMV. Reinfectiile sunt greu de diferentiat de reactivarile CMV. Pentru a diagnostica cu certitudine o reinfectie CMV trebuie demonstrat, prin analiza moleculara a genomului viral ca este vorba de o alta tulpina virala.
Seroprevalenta globala a infectiei CMV in populatia generala are mari variatii geografice (Fig. 3). Astfel, daca in America de Nord si Europa de Vest seroprevalenta medie este de 50% (40-80%), in Japonia, America de Sud si Africa aceasta poate atinge 100%. Variatiile geografice se pot explica prin diferentele de nivel socio-economico-sanitar. Se pare ca aglomeratiile umane si contactul interuman apropiat joaca un rol important.
Fig. 3. Seroprevalenta globala a infectiei CMV (dupa Mach Michael, 2001)83.
Exista 2 grupe de varsta la care rata achizitiei infectiei CMV este mare:
In primii 5-6 ani de viata. In USA, 14-31% din copiii sub varsta de 4 ani sunt seropozitivi CMV. Calea principala de transmitere este cea de la mama la copil (prenatal, perinatal sau postnatal) sau contactul apropiat cu excretorii de virus.
Intre varstele de 16-30 de ani, cand transmiterea se face predominent sexual (homo sau heterosexual). Acum se ating valorile maxime ale seroprevalentei CMV.
Transmiterea infectiei CMV este favorizata de contactul apopiat intre copiii mici din crese, gradinite sau leagane. Un studiu efectuat in SUA arata ca 10% din copiii sub varsta de 1 an excreta virus prin saliva sau urina, acest procent crescand rapid la 80% la copiii intre 12-18 luni20.
4.2. Rezervorul natural de infectie si caile de transmitere
4.2.1. Rezervorul natural de infectie
Rezervorul natural de infectie este exclusiv uman, fiind reprezentat de omul bolnnav sau excretorul sanatos de virus. Transmiterea CMV impune un contact interuman apropiat.
4.2.2. Caile de transmitere
Caile de transmitere interumana a infectiei CMV sunt multiple, ele putand fi clasificate astfel21 :
Verticala (congenitala sau maternofetala) prin pasajul transplacentar al CMV.
Perinatala si postnatala prin contactul nou nascutului cu fluide biologice materne infectate: secretii cervicale, urina, saliva sau lapte matern.
Orizontala:
Non-iatrogena, prin contact cu lichide biologice infectate: saliva si secretii orofaringiene (cel mai frecvent), urina, secretii vaginale sau sperma, lacrimi, fecale, lapte matern si sange.
Iatrogena, prin: transfuzii de sange proaspat sau grefe de organe
a) Transmiterea maternofetala
Femeile care nu poseda anticorpi anti-CMV sunt expuse riscului de a se infecta in cursul unei sarcini si de a transmite infectia la fat. Seroprevalenta CMV la femeile aflate la varsta procreerii este mult mai mare in tarile sarace (90%) fata de tarile dezvoltate economic (50%). Ea este de asemenea mai mare la femeile care au inceput viata sexuala inaintea varstei de 15 ani, au avut multi parteneri sexuali si multe sarcini22-23.
Atingerea fetala depinde de tropismul CMV pentru unele tesuturi embrionare, precum si de perturbarile celulare induse de infectie. CMV poseda un mare neurotropism datorat prezentei unor receptori si a unor factori celulari care activeaza specific unele gene virale26. Studii recente arata ca tesuturile embrionare "tinta" sunt determinate genetic26.
Riscul unei gravide seronegative CMV de a face primoinfectia in timpul sarcinii este evaluat la 1-3%. Acesta este mai mare la femeile provenite din medii defavorizate, la cele care vin in contact apropriat cu copiii mici si la cele care au multiplii parteneri sexuali in cursul sarcinii.
Primoinfectia CMV in sarcina are cel mai mare risc de infectare a fatului, deoarece ea se insoteste de viremii repetate si importante. Acest risc este apreciat la 40-50% in trimestrul I, 8-25% in trimestru II si 0-7% in trimestrul III25. Cu cat primoinfectia materna este mai precoce cu atat riscul de infectare a fatului este mai mare, iar prognosticul afectarii fetale este mai sumbru.
Se apreciaza ca 0,2-2,2% din totalitatea nou-nascutilor vii sunt infectati in utero cu CMV. Dintre acestia:
10% vor face forme severe, simptomatice in utero sau la nastere. Dintre ei 30% vor deceda, iar 80-100% din supravietuitori vor ramane cu sechele neurologice severe.
90% vor face forme asimptomatice la nastere, urmate insa de sechele neurologice in 10-15% din cazuri (surditate si retard psihomotor)24-26.
Se pare ca prezenta anticorpilor materni anti-CMV au un efect protector important impotriva infectiei neonatale simptomatice cu CMV. Astfel transmiterea transplacentara a CMV la o femeie seronegativa CMV este apreciata la 35-40%, in timp ce la o gravida seropozitiva CMV este de numai 0,2-2%24-26.
Reactivarea CMV in timpul sarcinii
Riscul de reactivare a CMV in ultimul trimestru de sarcina, obiectivat prin prezenta CMV in secretiile cervicale este mai mare decat in absenta sarcinii, fiind evaluat la 30%24-26. Se pare ca in ultimele 2 trimestre de sarcina are loc o scadere a raspunsului imun celular anti-CMV, care ar favoriza reactivarea CMV. Rolul raspunsului imun umoral anti-CMV este neclar. Se stie ca IgM si IgG anti-CMV nu sunt capabile sa impiedice nici reactivarile sau reinfectiile mamei, nici transmiterea CMV de la mama la fat. Riscul de transmitere a infectiei la fat in cursul reactiva- rilor este apreciat la 0,5-3% si creste proportional cu nivelul excretiei CMV in secretiile cervicale ale mamei26. Fatul este infectat in majoritatea cazurilor in urma unor viremii secundare reactivarii. Mai rar, infectarea fatului se face prin contiguitate, pe cale ascendenta, de la secretiile genitale infectate ale mamei21.
Reinfectia cu alta tulpina CMV in timpul sarcinii este rara si dificil de diagnosticat.
Se apreciaza ca 10-30% din gravidele seropozitive CMV excreta virus prin secretiile cervicale in timpul nasterii. Acest risc scade semnificativ cu varsta gravidei, ajungand la zero dupa varsta de 30 de ani20. Aproximativ 30% din mame excreta intermitent virus prin laptele matern in primul an dupa nastere20.
Rata transmiterii perinatale a infectiei CMV variaza intre 8-60%, ea facandu-se fie intrapartum prin contact cu secretiile vaginale infectate ale mamei, fie postpartum prin lapte matern21.
Din fericire infectarea perinatala cu CMV nu are consecinte negative asupra dezvoltarii neuropsihice ulterioare a copiilor, cu exceptia prematurilor cu greutate la nastere sub 1.200 g 26.
In USA se apreciaza ca 10% din nou nascutii vii sunt infectati cu CMV prin una din cele 3 cai posibile: transplacentar, contact cu secretii vaginale sau cu laptele matern infectat.
c) Transmiterea orizontala
Aceasta presupune un contact fizic apropiat cu lichide biologice infectate: secretii orofaringiene, urina, secretii vaginale, sperma, sange, lacrimi, lapte matern sau fecale.
Copiii infectati congenital sau perinatal excreta CMV timp de ani de zile prin urina sau saliva, reprezentand importante surse de infectie pentru parinti, copiii cu care vin in contact apropiat si personalul medical sau de ingrijire din colectivittile de copii20.
4.3. Populatiile la risc pentru infectia CMV
Parintii copiilor mici care merg in colectivitati (crese, gradinite, camine). Rata de seroconversie CMV la acesti parinti este apreciata la 20% pe an, fata de parintii ai caror copii nu merg in colectivitati, la care rata seroconversiei este sub 2% pe an. Procentul de seroconversii creste la 30% pe an atunci cand copiii sunt excretori de virus si la 40% cand copiii au varsta mai mica de 18 luni.
Personalul colectivitatilor de copii (educatoare, ingrijitoare), la care rata seroconversiei CMV variaza in functie de autor intre 11-20% pe an (Tabelul I). Avand in vedere ca acest personal este cu precadere feminin, rezulta ca riscul de infectie CMV in cursul unei sarcini este mai mare decat pentru femeile cu alte profesii.
Tabelul I. Transmiterea CMV la personalul colectivitatilor de copii
(sinteza unor studii de cohorta)20
|
Autor |
Rata de seroconversie / an (%) |
Risk ratio |
Adler | ||
|
Murph et al | ||
|
Pass et al |
Personalul medical pare a avea un risc ceva mai mare de infectie CMV, dar acesta nu este bine documentat si pare mai mic decat la anterioarele categorii de risc, probabil din cauza unei igiene mai riguroase in spitale si a folosirii echipamentului de protectie.
Persoanele cu comportament sexual la risc: viata sexuala debutata precoce, parteneri sexuali multipli, antecedente de boli sexual transmisibile. Riscul de transmitere sexuala este sustinut de cresterea importanta a seroprevalentei CMV dupa pubertate si de frecventa mai mare a infectiei la persoanele cu comportament sexual la risc.
Pacientii care necesita transfuzii repetate, mai ales cei imunodeprimati. Subiectii seropozitivi CMV care primesc sange de la donatori seropozitivi CMV au un risc de infectie de 14% (5-67%)20. Infectia CMV postransfuzionala poate fi primoinfectie atunci cand donatorul a fost seropozitiv si primitorul seronegativ, reactivare a CMV latent sau reinfectie cu alta tulpina virala. Aproximativ 30% din cei infectati fac o infectie simptomatica20. Reinfectia cu alta tulpina CMV provenita de la donator este mai severa decat reactivarea tulpinii CMV latente a transfuzatului. Riscul postransfuzional de infectii CMV simptomatice severe este mare in urmatoarele situatii20: nou nascutii prematur (50-90%), copii seronegativi CMV, gravidele seronegative, pacientii grefati medular, bolnavii cu SIDA, pacientii politransfuzati, bolnavii cu neoplasme aflate sub chimioterapie si cei cu imonodepresii severe. La nou nascuti rata mortalitatii depaseste 40%20. Riscul de transmitere transfuzionala este evaluat la 3-4% pe unitate de sange netestata serologic pentru CMV20.
Pacientii care sufera transplante medulare sau de organe solide. Primoinfectie CMV postgrefa apare atunci cand primitorul este seronegativ CMV, iar donatorul este seropozitiv. In restul cazurilor vorbim de o infectie secundara, care poate fi fie reactivare, fie reinfectie CMV. In absenta unei simptomatologii sugestive vorbim despre o "infectie CMV" iar in prezenta simptomelor vorbim de o "boala CMV". Infectia CMV post-transplant are un efect imunosupresiv prin afectarea monocitelor si macrofagelor, fapt care conduce la o crestere a riscului de aparitie a infectiilor fungice sau bacteriene si implicit la sporirea mortalitatii.
Transplantele de organe solide
Aproximativ 40% din primitorii de grefe de organe sunt seronegativi CMV, iar 60% sunt seropozitivi28-30. In absenta unei profilaxii specifice anti-CMV jumatate din primitorii seropozitivi vor dezvolta o infectie CMV, iar un sfert vor face o boala CMV. In cazul primitorilor seronegativi care au primit grefa de la un donator seropozitiv, infectia CMV apare la 60% din pacienti, iar boala CMV la 30-50% din bolnavi28-30. Factorii de risc sunt bine cunoscuti, fapt ce a permis definirea populatiilor la risc pentru boala CMV: primitor seronegativ cu donator seropozitiv (D+, P-); gradul imunosupresiei care influenteaza reactivarea CMV; utilizarea unei imunosupresii bazate pe anticorpi anti-limfocitari mono sau policlonali; transplantul hepatic si cardio-pulmonar; aparitia unui rejet acut al grefei; viremia CMV si mai ales incarcatura virala mare; excretia de CMV in lichidele biologice; numarul de incompatibilitati HLA28-30. Aplicarea pe scara larga a unor strategii complexe de profilaxie a infectiei CMV a condus la scaderea morbiditatii si mortalitatii prin infectie CMV post-transplant. Recent s-au introdus noi imunosupresoare potente (tacrolimus, mycophenolat, mofetil) care pot modifica epidemiologia infectiei CMV post-transplant29.
Transplantele medulare
In pofida progreselor inregistrate in diagnostic si tratament, infectia CMV ramane cea mai frecventa complicatie infectioasa dupa grefele medulare alogenice, fiind responsabila de peste 15-30% din mortalitatea post-transplant28-30. Incidenta infectiei CMV creste odata cu intensitatea si durata imunodepresiei. Ea ajunge la 70% atat pentru pentru primitorii seronegativi cat si pentru cei seropozitivi CMV, atunci cand primesc grefe medulare alogenice de la donatori seropozitivi CMV28. Infectia CMV (dovedita prin culturi pozitive) evolueaza spre boala CMV la aproximativ 50% din pacientii la care nu s-a efectuat profilaxia CMV si la 15-25% din cei care au beneficiat de profilaxie28.
In cazul grefelor medulare autologe incidenta infectiei si bolii CMV este mai mica decat dupa grefelor alogenice, dar mortalitatea prin pneumonie CMV este similara. Pana acum nu s-a stabilit o strategie eficienta de profilaxie a CMV pentru grefele medulare autologe.
Primoinfectia CMV apare de obicei la sugar, copil sau adolescent si mult mai rar la adult.
La imunocompetenti (IC) ea este in 95% din cazuri asimptomatica, putand fi obiectivata prin surprinderea seroconversiei CMV. Atunci cand este simptomatica, primoinfectia CMV poate imbraca mai multe tablouri clinice:
5.1.1. Sindrom febril prelungit
El consta in febra mare (38-400C), in platou, care persista peste 15 zile, rareori pana la 3 luni. Febra se poate insoti de: astenie, artralgii, cefalee sau faringita. Examenul obiectiv este sarac, evidentiind in 25% din cazuri o adeno-hepato-splenomegalie.
Sindrom mononucleozic (SM-CMV)
Se apreciaza ca 21% din SM sunt produse de CMV, restul fiind atribuite EBV (SM-EBV)14.
a) Tablou clinic
SM-CMV se caracterizeaza prin sindrom febril prelungit, adeno-hepato-splenomegalile si are de obicei evolutie favorabila, fara complicatii. Angina alba (foliculara sau pseudomembranoasa) este mai rar intalnita decat in SM-EBV. Unii autori sustin ca in SM-CMV predomina simptomatologia sistemica (febra, adenopatii, splenomegalie), motiv pentru care l-au numit "SM tifoiodal"36. Alti autori sustin ca in SM-CMV rareori predomina adenopatia si splenomegalia.14. Afectarea hepatica este de obicei asimptomatica, dar citoliza hepatica este in mod constant prezenta. Uneori, ea se manifesta clinic prin varsaturi, febra mare si se insoteste de leziuni hepatice granulomatoase cu celule gigante si un procent mare de limfocite atipice (peste 50%)14. Evolutia hepatitei CMV este intotdeauna catre vindecare totala. Pneumonia interstitiala cu evolutie benigna este rareori intalnita. Exantemul maculopapular sau rubeoliform apare indus sau nu de ampicilina si este de obicei moderat, rareori sever. Muller-Stamou37 a citat in 1974 un caz in care un barbat de 40 de ani cu viremie si virurie CMV a dezvoltat o epidermoliza la 8 saptamani dupa debutul unei hepatite.
b) Complicatii
La adultul IC cu SM-CMV apar rareori complicatii, care uneori reprezinta prima manifestare a bolii. Au fost citate in literatura miocardite, pericardite, colite pseudomembranoase sau ulcerative, gastrite hipertrofice, poliradiculonevrite (Guillain Barre), meningoencefalite, trombocitopenii si anemii hemolitice.
Sindromul Guillain Barre (SGB)
In 1971 au fost descrise 9 cazuri de SM-CMV insotit de o simptomatologie sugestiva pentru SGB: polinevrita caracterizata prin deficit senzitiv si motor la extremitati si afectarea nervilor cranieni. Un studiu amplu efectuat pe 94 cazuri de SGB a aratat ca 10 cazuri au fost produse de CMV (prezenta IgM anti-CMV)14.
Miocardita
Sunt descrise in literatura multe cazuri de pacienti cu markeri serologici de primoinfectie CMV care au prezentat miocardita cu sau fara insuficienta cardiaca insotita de hepatita, encefalita, coagulopatie, insuficienta suprarenaliana etc14. Modificarea EKG cea mai des intalnita a fost inversarea undei T14.
Trombocitopenia si anemia hemolitica apar frecvent la copiii cu infectie congenitala si mult mai rar in cadrul SM-CMV la adultul IC. Sunt citate insa in literatura la adultul IC si forme severe cu purpura generalizata, sindrom hemoragipar difuz, scaderea numarului de trombocite sub 500/mmc, a hemoglobinei sub 3,6g/dl si reticulocitoza peste 12%. Evolutia lor a fost intotdeauna favorabila sub corticoterapie14.
c) Paraclinic
Modificari hematologice caracteristice: leucocitoza discreta sau moderata, cu limfocitoza relativa (peste 50%) si prezenta de limfocite atipice ("celule albastre") in proportie de 10%. Aceste modificari persista in medie 15 zile dupa debutul febrei.
Testul Paul Bunell de evidentiere a anticorpilor heterofili este negativ in SM-CMV, spre deosebire de SM-EBV unde este de obicei pozitiv.
Citoliza hepatica discreta si fara icter pare a fi un element constant si util in diagnosticul SM-CMV14. Atat in SM-EBV cat si in SM-CMV pot apare perturbari imunologice obiectivate prin aparitia de aglutinine la rece, factor reumatoid, crioglobuline sau factor antinuclear14. Hepatita CMV izolata, manifestata prin citoliza hepatica si icter, a fost descrisa mai ales posttransfuzional.
Caracteristicile clinice, virusologice si imunologice ale primoinfectiei CMV la IC sunt prezentate in figura 4
Fig 4. Caracteristicile infectiei CMV la adultul imunocompetent (dupa Griffith PD)21
Instalarea raspunsului imun anti-CMV va conduce la vindecarea primoinfectiei CMV si apoi la controlarea si mentinerea starii de latenta a CMV.
Reactivarile CMV la IC sunt de obicei asimptomatice.
5.2 Manifestarile clinice ale infectiei CMV la imunodeprimati
La imunodeprimati (ID) atat primoinfectia CMV cat si reactivarile si reinfectiile CMV imbraca forme mai severe decat la imunocompetenti, antrenand o mortalitate ridicata.
Tipul manifestarilor clinice variaza in functie de cauza si gradul imunodepresiei.
Riscul cel mai mare pentru infectii severe CMV il au: nou nascutii, pacientii cu SIDA, bolnavii cu grefe medulare sau de organe solide, pacientii neoplazici aflati sub chimioterapie.
In tabelul II este prezentata comparativ frecventa diverselor manifestari clinice CMV la pacientii cu infectie HIV si la cei transplantati21.
Tabelul II. Tipul si incidenta manifestarilor clinice CMV la pacientii imunodeprimati prin infectie HIV si transplante de organe21
|
Pacienti cu transplante de organe |
Pacienti infectati HIV cu CD4 sub 50 / mmc |
|
|
Incidenta globala a manifestarilor clinice CMV |
10-25% - in SIDA 50-70% - necroptic |
|
|
Pneumonie CMV |
< 10% |
|
|
Febra + simptome constitutionale | ||
|
Manifestari gastrointestinale | ||
|
Hepatita | ||
|
Retinita |
< 1% | |
|
Manifestari SNC |
< 1% |
5.2.1. Manifestari clinice la pacientii cu infectie HIV
Infectia CMV este cea mai frecventa infectie virala oportunista intalnita la bolnavii seopozitivi HIV. Se apreciaza ca inainte de era HAART (highly active antiretroviral therapy) 21-44% din pacientii cu infectie HIV dezvoltau o boala CMV14. Dupa introducerea profilaxiei primare pentru Pneumocystis carinii (Pc), soldata cu prelungirea supravietuirii, s-a schimbat profilul infectiilor oportuniste: a scazut incidenta pneumoniei cu Pc, a crescut incidenta infectiei cu Mycobacterium avium intracelulare de la 17% la 33% si a infectiei CMV de la 25% la 45%18.
In tarile dezvoltate, dupa utilizarea pe scara larga a HAART s-a constatat o scadere dramatica a incidentei infectiilor oportuniste precum si o amelioarare semnificativa a supravietuirii bolnavilor. In acest context s-a inregistrat o scaderea a incidentei afectarilor viscerale CMV cu peste 80%14,19,38. Daca inaintea epocii HAART aparitia retinitei reprezenta un factor de prognostic nefavorabil pentru infectia HIV, dupa introducerea HAART s-a constatat ca retinita nu mai are aceasta semnificatie negativa. HAART reduce incarcatura virala sub limita detectabilitatii si amelioreaza semnificativ statutul imunologic al pacientului, inclusiv raspunsul imun anti-CMV.
Primoinfectia CMV este rara la adultii seropozitivi HIV, la care predomina manifestarile clinice datorate reactivarii CMV. Acestea apar atunci cand numarul de limfocite CD4 a scazut sub 100 / mmc.
In timpul vietii, 10-25% din pacientii seropozitivi HIV dezvolta o infectie CMV simptomatica, dar la necropsie s-a constatat ca 50-70% din pacienti au o boala CMV18, 19. Incidenta infectiei CMV creste progresiv pe parcursul evolutiei bolii, ajungand la 40% la 3 ani dupa diagnosticarea SIDA18. Manifestarile clinice CMV apar mai frecvent la barbatii homosexuali si bisexuali decat la toxicomani, probabil din cauza riscului crescut de infectare CMV pe cale sexuala31. Coinfectia HIV-CMV este intalnit la peste 90% din barbatii homosexuali14.
a) Retinita
Retinita este cea mai frecventa manifestare clinica CMV la pacientii infectati HIV, iar in USA este considerata cea mai frecventa infectie oportunista oculara (95%)14. In Franta si America de Sud toxoplasmoza reprezinta cea mai frecventa manifestare oculara33. Retinita CMV apare in stadiile tardive ale infectiei HIV, de obicei la 18 luni dupa declararea debutului SIDA si atunci cand numarul de limfocite CD4 scade sub 50/mmc14,19,31,32,33. Necroptic, la 32% din pacientii cu SIDA se deceleaza retinita14. Ea consta intr-o necroza retiniana progresiva, care in absenta terapie anti-CMV evolueaza catre cecitate in 4-6 luni. Retinita este consecinta traversarii barierei hematoreniene de catre CMV in cursul unei viremii. De aceea descoperirea unei viremii CMV la un pacient seropozitiv HIV impune efectuarea periodica a fundului de ochi (FO). Retinita CMV este bilaterala in 35-50% din cazuri, iar atunci cand este unilaterala se bilateralizeaza in 60% din cazuri33. Ea este asimptomatica la peste 50% din pacienti, fiind descoperita intamplator cu ocazia efectuarii sistematice a unui FO14,31-33. In cazurile simptomatice pacientii se plang de tulburari de vedere ca: "muste zburatoare", privire incetosata, scotoame sau scaderea acuitatii vizuale.
Forma tipica de retinita CMV este edematoasa si consta in prezenta de infiltrate retiniene albe vatoase perivasculare, care alterneaza cu zone de hemoragie retiniana, fara reactie inflamatorie asociata si fara afectarea segmentului anterior al ochiului (Fig. 5).
Fig. 5. Aspect tipic de retinita CMV- forma edematoasa (dupa Cassoux N)33
Sub tratament antiviral de atac leziunile retiniene se cicatrizeaza in 15-21 zile, dar terapia antivirala de intretinere trebuie continuata toata viata.
Diagnosticul retinitei CMV este in principal clinic prin FO. Angiografia retiniana este uneori utilizata pentru diagnosticarea formelor atipice de boala si pentru diagnosticul diferential33. Dozarea anticorpilor anti-CMV in umoarea apoasa ofera un procent mare de rezultate fals pozitive si negative datorate activarii policlonale a limfocitelor B. Cercetarea ADN-ului viral in tesutul retinian sau umoarea apoasa, prin hibridizare in situ sau PCR nu se face de rutina, ea putand fi utila pentru diagnosticul formelor atipice de boala.
Diagnosticul diferential al retinitei CMV este prezentat in tabelul III18.
Tabelul III. Diagnosticul diferential al retinitei CMV33
|
Retinopatia HIV (AIDS retinopathy) |
Noduli vatosi, care dispar spontan in 4-6 saptamani Hemoragii in "scanteie" Uneori ischemie retiniana |
Ocluzia venei centrale a retinei |
Insoteste deseori meningita criptococozica Edem papilar, dilatatii venoase, hemoragii retiniene profuze |
Sindromul de necroza acuta retiniana(ARN syndrom) |
Grad mic de imunodepresie Etiologie: virus varicelozosterian sau virusul herpes simplex 1 Necroza retiniana initial periferica si vascularita oclusiva Extensie rapida in deget de manuse Reactie inflamatorie vitreana marcata |
PORN syndrom |
Numar redus de CD4 Etiologie: virus varicelozosterianFocare de necroza retineana profunda Afectare precoce a polului posterior Extensie rapida |
Toxoplasmoza retino-coroidiana |
Focare de necroza bine circumscrise, non-hemoragice, unice sau multiple Inflamatie oculara marcata Uneori cicatrice vechi Afectare cerebrala concomitenta Necesita angiografie retiniana |
Sifilis secundar sau tertiar |
Inflamatie anterioara si vitreana marcata Vascularita, infiltrate retiniene |
Candidoza intravitreana |
Toxicomanoie iv Focare corioretiniene albe la polul posterior care se extind catre vitros Inflamatie intraoculara marcata |
Limfom intraocular |
Infiltrate retiniene Infiltrat celular al vitrosului Leziuni cerebrale asociate |
Coroidita cu Pneumocystis carinii |
Pacienti sub profilaxie cu aerosoli de pentamidina Leziuni rotunjite, galbene, profunde |
Tuberculi coroidieni |
b) Manifestari neurologice
Manifestarile neurologice CMV sunt mai frecvent descoperite necroptic decat in timpul vietii si reprezinta intotdeauna un factor de prognostic negativ. Diagnosticul clinic este dificil datorita simptomatologiei similare cu a altor manifestari neurologice intalnite in cursul infectiei HIV. Sunt descrise 3 sindroame neurologice: encefalita / ventriculoencefalita, mielita / mieloradiculita si neoropatie periferica (Tabelul IV)18.
|
Encefalita / Ventriculoencefalita |
Mielita / Mieloradiculita |
Neuropatie periferic |
|
Febra, cefalee Alterarea statusului mental Deficit motor Paralizii de nervi cranieni Convulsii Nistagmus RMN: semnal periventricular si largirea ventriculilor LCR: ADN-CMV (PCR) |
Deficit motor/ senzorial mb. inferioare Parestezii Areflexie Tulburari sfincteriene LCR:ADN-CMV (PCR) |
Deficit motor sau senzorial Parestezii Durere Biopsie nerv: vasculita si necroza endoneurala |
O simptomatologie neurologica survenita acut sau subacut la un pacient seropozitiv HIV cu CD4 sub 50/mmc sugereaza etiologia CMV, dupa excluderea altor etiologii (toxoplasmoza, encefalopatie HIV).
Poliradiculopatia este cea mai frecventa manifestare neurologica CMV la acesti pacienti14. Aceasta se caracterizeaza la debut prin deficit motor la extremitati care evolueaza ascendent, diminuarea reflexelor osteotendinoase si apoi instalarea tulburarilor sfincteriene. Deseori primele semne care apar sunt dureri lombosacrate cu iradiere radiculara si perianala, urmate la 1-6 saptamani de paralizii flasce progresive14. Modificarile histopatologice caracteristice CMV sunt decelate la nivelul cozii de cal si a nervilor lombosacrati. Ele constau in infiltrat celular cu mononucleare, distrugerea axonilor si incluzii intranucleare in celulele Schwann si celulele epiteliale14. Examinarea LCR arata prezenta de polinucleare, cresterea moderata a albuminorahiei si scaderea discreta a glicorahiei, modificari care creeaza probleme de diagnostic diferential cu meningitele bacteriene. Implicarea CMV este dovedita prin evidentierea in LCR a CMV prin culturi celulare sau a ADN-CMV prin PCR.
Meningoencefalita CMV poate avea o simptomatologie asemanatoare poliradiculopatiei. Prezenta de cefalee intensa, fotofobie, letargie sau sindrom piramidal sugereaza meningoencefalita. In LCR se decelaeza o pleiocitoza limfocitara moderata.
Utilizarea tehnicii PCR pentru evidentierea ADN-CMV in LCR asigura actualmente un diagnostic si un tratament precoce in manifestarile neurologice produse de CMV.
c) Pneumonia interstitiala
Ea este rar intalnita in infectia HIV comparativ cu pacientii imunodeprimati post-transplant medular. Explicatia ar putea fi aceea ca patogenia pneumoniei CMV are o componenta imunologica (raspuns citotoxic agresiv asupra parenchimului pulmonar), pe care pacientii infectati HIV sunt incapabili sa o genereze34. CMV este frecvent izolat prin culturi celulare sau imunofluorescenta (IF) din lavajul bronhioloalveolar (LBA) la pacientii seropozitivi HIV, dar prezenta CMV nu este suficienta pentru stabilirea diagnosticului de pneumonie CMV14,18, 31,32,34. Criteriile necesare acestui diagnostic sunt: simptome / semne clinice si radiologice de pneumonie evolutiva; prezenta CMV in LBA (culturi, IF); modificari histopatologice specifice CMV in celulele din LBA sau biopsia pulmonara (celule gigante, multinucleate, cu incluziuni intranuclaeare); absenta unui alt agent etiologic; un raspuns favorabil la terapia anti-CMV34. Radiologic, pneumonia CMV se caracterizeaza prin infiltrate interstitiale. In fata unei pneumonii la un pacient cu SIDA trebuie exclusa etiologia Pneumocystis carinii si Mycobacterium inainte de a suspiciona implicarea CMV.
d) Manifestarile digestive
Manifestarile digestive intalnite la pacientii cu SIDA sunt: esofagita ulcerativa, colita ulcerativa si/sau pseudomembranoasa, pancreatita, hepatita, colecistita nelitiazica14,18,31,34. Incidenta lor a scazut in tarile in care se aplica pe scara larga HAART. Diagnosticul clinic este dificil fiind intotdeauna necesare investigatii endoscopice. Confirmare virusologica si histopatologica este obligatorie34.
Esofagita este sugerata de prezenta disfagiei si odinofagiei. Endoscopic se deceleaza ulceratii hemoragice si inflamatia mucoasei in treimea inferioara a esofagului spre deosbire de candidoza esofagiana care afecteaza treimea superioara a esofagului.
Colita este sugerata clinic de o diareee apoasa exploziva, uneori sanghinolenta insotita adesea de dureri abdominale, febra, alterarea starii generale, inapetenta, scadere ponderala. Sigmoidoscopia evidentiaza ulcere serpiginoase, numeroase eroziuni, placi pseudomembra-noase si leziuni hemoragice14. Ele afecteaza deseori si rectul. La examenul histopatologic se decelaza celule mari cu incluzii CMV in epiteliul sau in criptele mucoasei, iar in culturi sau prin IF se poate identifica CMV.
e) Adrenalita
Adrenalita pare a fi frecventa, dar insuficienta suprarenaliana este rara. Pacientii pot avea o limitare a capacitatii de a raspunde la stres18.
5.2.2. Manifestari clinice la pacientii imunodeprimati post-transplant
Manifestarile clinice induse de CMV difera in functie de tipul transplantului si gradul imunosupresiei. Sursa de infectie la pacientii seronegativi CMV este reprezentata de organul grefat si de sangele sau derivatele de sange provenite de la donatori seropozitivi. Pentru a dovedi ca organul grefat este sursa CMV pentru pacientul grefat trebuie demonstrat prin tehnici de biologie moleculara ca tulpina CMV provenita de la donator este identica cu cea de la primitor. Reactivarea CMV latent reprezinta sursa de infectie pentru pacientii seropozitivi.
a) Dupa tranplante medulare
Cele mai frecvente manifestari clinice CMV dupa grefele medulare sunt: pneumonia interstitiala, manifestarile eso-gastro-intestinale si hepatita. Mult mai rar sunt intalnite retinita si encefalita.
Pneumonia CMV este mult mai des raportata dupa grefa medulara decat dupa transplantul renal14. La pacientii care primesc grefe medulare autologe gradul de imunosupresie este mai redus, motiv pentru care incidenta pneumoniei CMV este mai mica, dar riscul de mortalitate este similar cu al grefelor alogenice28. Se pare ca dupa transplante medulare infectiile simptomatice CMV apar in special prin reactivarea CMV latent si mai putin ca primoinfectie CMV. Acesti pacienti au o incarcatura virala CMV mai mare in sange decat in urina28.
Pneumonia CMV apare in primele 120 zile dupa transplant si este de obicei interstitiala, dar uneori poate avea o componenta alveolara, obiectivata radiologic prin opacitati nodulare14. Debutul este de cele mai multe ori brusc cu febra, tuse neproductiva si dispnee. Hipoxia apare in formele severe si necesita respiratie asistata. Evolutia este severa cu mortalitate ridicata, care poate depasi 80%14. O parte din severitatea pneumoniei se datoreaza reactiei "grefei contra gazdei" din plaman. Aceasta reactie este mai frecventa la pacientii cu pneumonie CMV (82%) fata de cei fara pneumonie (27%)14.
b) Dupa transplante de organe solide
Infectiile simptomatice CMV apar de obicei in primele 4 luni dupa grefa, infectiile tardive fiind rare28. Sunt afectate mai frecvent organele grefate. Se pare ca dupa transplante de organe solide riscul de infectie CMV simptomatica este mai mare atunci cand organele grefate provin de la un donor seropozitiv CMV. Doua studii au demonstrat ca dupa transplantele renale primoinfectia CMV apare la 83% din grefatii seronegativi CMV ai caror donori au fost seropozitivi. Aparitia infectiei CMV la cei cu donori seronegativi pentru CMV a fost rara40,41. Pacientii transplantati renal care dezvolta o infectie CMV simptomatica au o incarcatura virala mai mare in urina decat in sange28. Un studiu efectuat in 1990, pe 1276 pacienti grefati renal a aratat ca rata infectiei CMV dupa transplant a variat intre 59-70%. Infectia CMV a fost semnificativ mai mare la cei care erau seropozitivi anterior transplantului (84%), fata de cei seronegativi (52%)39.
Dupa transplantul renal, pneumonia interstitiala CMV survine mai rar si este mai putin severa decat dupa grefele medulare. La pacientii seronegativi CMV cu donori seropozitivi cea mai comuna manifestare clinica CMV este primoinfectia CMV, care este simptomatica in majoritatea cazurilor. Un studiu40 efectuat pe 154 de pacienti transplantati renal a aratat ca 13 din cele 18 infectii primare CMV s-au manifestat prin cel putin doua din urmatoarele simptome: febra, leucopenie, limfocitoza, prezenta de limfocite atipice, hepatosplenomegalie, mialgii si artralgii. Acest tablou a fost numit "CMV sindrom" si este definit ca infectia CMV care asociaza febra neexplicata de peste 48 de ore, stare de rau general si scaderea neutrofilelor la 3 determinari succesive14. Prezenta febrei este un element constant, spre deosebire de infectiile secundare CMV, in care febra apare numai in 19% din cazuri14. Hepatita CMV este rar intalnita dupa transplantele renale, dar cresterea enzimelor de citoliza hepatica este descrisa in 63% din cazurile de primoinfectie CMV41. Rejetul acut al grefei renale a fost raportat la 25% din pacientii cu primoinfectie CMV41. Nu s-a inregistrat niciun rejet acut de grefa la pacientii seronegativi CMV cu donori seronegativi41. Din pacate nu exista suficiente studii care sa confirme ipoteza conform careia infectia CMV creste riscul de rejet acut al grefei renale.
Riscul de infectie simptomatica CMV dupa transplantul renal, in functie de serologia CMV a donatorului si primitorului este prezentat in tabelul V 82.
Tabelul V. Riscul de infectie simptomatica CMV dupa transplantul renal in functie de serologia CMV a donatorului si primitorului82
|
Serologia CMV |
Risc de infectie simptomatica CMV |
|
|
Donor |
Primitor |
|
Pozitiv |
Negativ |
Risc inalt: 40-73% |
|
Negativ sau pozitiv |
Pozitiv |
Risc moderat: 6-38% |
|
Negativ |
Negativ |
Risc mic: 1% |
Dupa transplantele hepatice infectia CMV este mai frecventa la grefatii seronegativi cu donori seropozitivi, variind intre 50-70%14. Hepatita CMV de primoinfectie reprezinta o mare problema la pacientii transplantati hepatic. Ea apare in primele 14 saptamani dupa transplant si determina cresterea costului si a duratei spitalizarii. Hepatita CMV se manifesta prin febra prelungita, cresterea bilirubinei si a enzimelor de citoliza hepatica. Ea poate evolua catre insuficienta hepatica, care impune repetarea transplantului. O forma severa de hepatita CMV este greu de diferentiat de rejetul acut al grefei, biopsia hepatica fiind absolut necesara in aceste cazuri. Diferentierea acestor doua entitati clinice este obligatorie pentru o conduita terapeutica corecta: rejetul de grefa necesita cresterea dozelor de imunosupresoare, in timp ce hepatita CMV impune instituirea unui tratament antiviral si scaderea imunosupresiei.
Locul infectiei CMV in ansamblul infectiilor intalnite dupa transplantele de organe solide este ilustrat in tabelul VI 82.
Tabelul VI. Incidenta diverselor infectii dupa transplantele de organe solide82
(% din pacientii grefati)
|
T. hepatic |
T. renal |
T. cardiac |
T. pulmonar T. cardiopulmonar |
T. pancreatic |
|
|
Bacterii | |||||
|
CMV | |||||
|
HSV | |||||
|
VZV | |||||
|
Candida | |||||
|
Fungi | |||||
|
P. carinii |
5. 3. Manifestarile clinice ale infectiei congenitale CMV
(Dr. Radu Vladareanu)
Infectia fetala este in majoritatea cazurilor asimptomatica, astfel incat diagnosticul este pus rareori in timpul sarcinii, cu exceptia cazurilor in care mama a facut o primoinfectie CMV simptomatica, confirmata serologic.
Infectia fetala simptomatica se manifesta prin anomalii multiple si nespecifice, care pot fi evidentiate prin ecografie si/sau RMN fetal. Anomaliile cele mai frecvent intalnite sunt: retardul cresterii, oligoaminos, anasarca, dilatatie ventriculara, calcificari intracraniene, microcefalie, revarsat pericardic, imagini hiperecogene intraabdominale, calcificari intrahepatice insotite de ascita25,26,42. Aceste anomalii pot duce la moartea in utero a fatului. Decelarea unor astfel de anomalii fetale in timpul sarcinii trebuie sa ridice suspiciunea de infectie CMV, impunand efectuarea de culturi pe medii celulare din lichidul aminiotic (LA). In majoritatea cazurilor aceste anomalii raman nediagnosticate in cursul sarcinii, ele fiind observate abia la nastere.
Prematuritate si hipotrofie (35-50% din cazuri)
Hepatosplenomegalie (70-80% din cazuri) cu sau fara icter
Purpura trombocitopenica (70-80% din cazuri)
Afectarea SNC: convulsii, paralizii, encefalita, microcefalie (50% din cazuri), hidrocefalie, anomalii imagistice (calcificari intracerebrale, polimicrogiria, pseudo-lisencefal, hipoplazie cerebeloasa, intarzierea mielinizarii).
Pneumonie interstitiala
Corioretinita (15% din cazuri)
Hernii inghinale, anomalii ale primului arc branhial, eventratie diafragmatica
Prognosticul vital si functional este grav datorita mortalitatii ridicate si sechelelor neuro-senzorile importante. Mortalitatea este evaluata la 30%, fiind mai mare la cei cu afectari neurologice42. Decesele survin in primele luni de viata. Acesti copii vor excreta CMV luni sau ani de zile prin saliva sau urina, reprezentand importante surse de infectie.
Dintre supravietuitori, 80-100% vor dezvolta sechele neurosenzoriale importante: surditate progresiva, corioretinita, retard mental, microcefalie, afectare neuromusculara42.
b) Infectia CMV asimptomatica la nastere
Ea reprezinta 90-95% din totalul infectiilor congenitale CMV25,26,42 In absenta unui depistaj sistematic ele raman nediagnosticate in marea majoritate a cazurilor. Studii recente au aratat ca acesti copii au un retard de crestere intrauterin comparativ cu al copiilor din loturile martor. Nu s-a putut insa stabili daca exista corelatii intre existenta retardului de crestere intrauterin si aparitia ulterioara a sechelelor. La acesti copii sunt indicate examene complementare pentru a evidentia anomalii biologice (anemie, trombopenie, citoliza hepatica) sau anomalii cerebrale (RMN, tomografie computerizata).
Incidenta sechelelor la acesti copii nu este precis evaluata, ea fiind apreciata intre 5-15%. Surditatea este handicapul cel mai frecvent intalnit. Ea este uni sau bilaterala, progresiva si are severitate variabila de la caz la caz. De aceea nou-nascutii asimptomatici la nastere, dar care excreta CMV prin urina trebuie dispensarizati si supusi unor controale repetate neurologice, audiometrice, ecografice si imagistice, in scopul depistarii precoce a surditatii42.
Alte sechele observate mai rar la acesti copii sunt: retardul psihomotor, corioretinita si distrofiile de smalt dentar42. Se pare ca dintre acesti copii se recruteaza o parte dintre encefalopatiile infantile cu retard psihomotor.
6. Diagnostic de laborator
In ultimul deceniu s-au facut progrese remarcabile in diagnosticul de laborator al infectiei CMV. Acestea au permis diagnosticarea si tratarea precoce a infectiilor severe CMV ce apar la imunodeprimati, fapt care a condus la ameliorarea prognosticului si scaderea mortalitatii acestora. De asemenea, gratie acestor progrese s-a ameliorat si diagnosticul infectiei congenitale CMV.
Diagnosticul de laborator al infectiei CMV are 3 componente: diagnosticul histopatologic, virusologic si serologic.
6. 1. Diagnosticul histopatologic
El consta in evidentierea la nivelul tesutului biopsiat a unor modificari histopatologice (HP) caracteristice, reprezentate de aparitia unor celule gigante cu incluziuni intranucleare mari (citomegalice) asemanatoare 'ochilor de bufnita'. Aceste modificari sunt vizibile pe frotiuri colorate Giemsa sau Hematoxilin Eozina si prezenta lor este absolut necesara pentru a implica CMV in patogenia bolii organului biopsiat. Simpla prezenta a CMV intr-un tesut sau fluid biologic nu este suficienta pentru a afirma ca CMV a produs sindromul clinic de organ, deoarece acest virus este deseori prezent ca 'pasager inofensiv' in diverse organe sau secretii, mai ales la pacientii infectati HIV. Deci, prezenta modificarilor HP este markerul unei infectii active, replicative in tesutul biopsiat.
Din punct de vedere istoric modificarile HP caracteristice au fost prima data observate in celulele din sedimentul urinar la copiii cu infectie congenitala CMV.
6. 2. Diagnosticul virusologic
6.2.1. Izolarea CMV in culturi celulare
Cultura reprezinta inca diagnosticul de referinta ("the gold standard") pentru CMV, cu toate ca este o metoda laborioasa care ofera rezultate tardive.
Produsele patologice in care se poate izola CMV sunt:
Sangele - prezenta CMV in sange semnifica viremie, care este suportata de o fractiune a polinuclearelor neutrofile si de mononucleare
Urina - prezenta CMV in urina semnifica virurie
LCR, lavajul bronhioloalveolar (LBA), aspiratul bronsic, exudatul faringian, secretiile genitale, lichidul amniotic (LA), biopsiile tisulare.
CMV este dificil de cultivat din sange, chiar si la ID. El poate fi izolat in secretiile cervicale provenite de la femei sanatoase si din sperma barbatilor homosexuali sanatosi. Prezenta CMV in urina, secretii faringiene si sange este anormala, dar numai o cultura pozitiva din sange are semnificatie patologica, deoarece prezenta virusului in urina si faringe este asociata frecvent cu o infectie asimptomatica14.
Pacientii cu primoinfectie CMV elimina virus prin urina si secretii faringiene timp de cateva saptamani.
La ID se poate izola CMV din secretiile faringiene si LBA, dar prezenta virusului are semnificatie patologica numai atunci cand sunt prezente concomitent si modificarile HP caracteristice.
Recoltarea produselor patologice trebuie efectuata steril, iar transportul lor la laborator trebuie sa fie rapid. Se recomanda utilizarea unor medii de transport virusologic, care sa pastreze infectiozitatea CMV in probele recoltate. Aceste medii trebuie sa conserve pH-ul si osmolaritatea fiziologica si sa contina un crioprezervant si antibiotice pentru inhibarea florei bacteriene44.
Pentru urina se folosesc medii cu sorbitol 50%. In diagnosticul infectiei congenitale CMV la nou-nascut, se recomanda recoltarea a 3 probe de urina, in 3 dimineti succesive, in primele 3 saptamani de viata. Urina trebuie sa ajunga la laborator in primele 2 ore de la recoltare, iar daca transportul rapid nu este posibil, ea poate fi pastrata la - 700C, cu riscul scaderii infectiozitatii probei44.
Pentru sange se va recolta steril, sange venos neheparinat, pentru ca heparina inhiba infectiozitatea CMV si este toxica pentru culturile celulare. Sangele trebuie sa ajunga la laborator in primele 24-48 de ore dupa recoltare, utilizand medii de transport care sa pastreze o temperatura de - 40C. Serul poate fi pastrat insa 1 saptamana la - 40C sau indefinit la - 200C44.
Biopsiile de organe trebuie sa contina cat mai putine secretii, pentru ca CMV poate fi prezent in secretii fara a fi implicat in patologia organului respectiv. Tesutul biopsiat trebuie supus obligatoriu atat exanenului virusologic cat si celui HP. Pentru diagnosticul necroptic, recoltarea trebuie efectuata imediat dupa deces. Tesutul biopsiat trebuie si el transportat rapid la laborator, de preferinta pe medii de transport virusologic. Biopsiile trebuie efectuate tintit din organele din partea carora exista simptome sugestive. Prezenta CMV intr-un tesut nu exclude co-implicarea altor agenti infectiosi in patologia organului respectiv, fapt care obliga la cercetarea acestora.
Mediile utilizate sunt linii diploide de fibroblaste umane embrionare MRC5 sau WI38.
Clasic, prezenta CMV in cultura este obiectivata prin evidentierea efectului citopatogen caracteristic (Fig. 6), care apare dupa 1-3 saptamani, fapt care intarzie diagnosticul. Rapiditatea aparitiei efectului citopatogen in culturile celulare depinde de concentratia virala din inoculul infectant.
Fig.6. Efect citopatogen tipic al CMV pe culturi celulare de fibroblaste umane (dupa Mach Michael)83
Actualmente, prezenta CMV in cultura, este anuntata de aparitia antigenelor precoce (IE si E) ale CMV, evidentiate dupa 2-3 zile, prin imunomarcaj cu ajutorul anticorpilor monoclonali E1314,43,44,45 . Sensibilitatea acestei metode este mai mare decat a metodei clasice (mai ales pentru LBA si sange), putand fi crescuta de 4 ori prin centrifugarea produselor patologice44.
In figura 7 sunt prezentate celule infectate cu CMV identificate prin IF idirecta cu ajutorul anticorpilor monoclonali anti-IE (Shell vial assay)83.
Fig. 7. Celule infectate cu CMV identificate prin IF idirecta cu ajutorul anticorpilor monoclonali anti-IE (Shell vial assay) (dupa Mach Michael)83
O viremie pozitiva, care consta in prezenta de particule virale fagocitate in interiorul neutrofilelor, semnifica o infectie CMV litica, activa si extensiva. Ea are valoare predictiva pentru aparitia diseminarii si afectarii viscerale, prin intermediul leucocitelor si celulelor endoteliale infectate. S-a observat ca la imunodeprimatii prin grefe de organe si mai putin la cei cu infectie HIV, o viremie CMV pozitiva precede cu cateva luni aparitia unei afectari viscerale CMV.
O virurie pozitiva, are valoare diagnostica si predictiva mult mai mica decat viremia, pentru
ca viruria CMV poate fi observata si la imunocompetenti, ca martor al unei infectii asimptomatice.
6.2.2. Decelarea de antigene CMV intracelulare solubile
Antigenele virale intracelulare sunt decelate prin tehnici de imunofluorescenta (IF) sau ELISA cu ajutorul anticorpilor monoclonali.
Produsele patologice care se preteaza la aceasta metoda de diagnostic sunt: leucocitele din sangele periferic, LBA, aspiratul bronsic si biopsiile tisulare. In urina nu pot fi evidentiate antigene solubile CMV deoarece acestea sunt mascate de beta-2-microglobulina44. Rezultatele acestei metode de diagnostic difera in functie de tipul si calitatea prelevarilor. Astfel, LBA ofera rezultate mai bune decat punctia biopsie pulmonara, deoarece ea furnizeaza mai usor si mai multe celule alveolare infectate, permitand si centrifugarea prelevatului.
Avantajele acestei metode de diagnostic sunt simplitatea si rapiditatea (cateva ore). Sensibilitatea si specificitatea sunt similare culturii clasice. Aceste tehnici, desi costisitoare sunt mai accesibile decat PCR.
a) Antigenemia pp65 leucocitara
In 1988, The83 a identificat pentru prima data antigene CMV in leucocitele unor pacienti cu infectie activa CMV, denumind aceasta tehnica "antigenemia assay". Este vorba despre identificarea si cuantificarea proteinei virale pp65 (ppUL83) in granulocitele circulante. Antigenemia pp65 leucocitara are actualmente o mare importanta diagnostica. Proteina pp65 poate fi cercetata si in LCR14.
Ea consta in separarea leucocitelor sanghine pe dextran, efectuarea de frotiuri dupa citocentrifugare, marcarea cu anticorpi monoclonali anti-fosfoproteina pp65, urmata de conjugarea cu anti-IgG de soarece, fluorescenti sau marcati enzimatic cu peroxidaza (Fig. 8).
Celulele sanghine infectate sunt polinuclearele neutrofile, care sunt usor de identificat la examenul microscopic, datorita faptului ca nucleul lor capata o fluorescenta granulara, in urma marcarii cu anticorpi fluorescenti.
Fig. 8. Antigenemia pp65 pozitiva in leucocitele unui pacient cu grefa renala (dupa Mach Michael)83
Este un test rapid (4-5 ore) cu o sensibilitate mai mare decat cultura. Se apreciaza ca sensibilitatea antigenemie pp65 in infectia CMV asimptomatica este de 60-70%, iar pentru infectia simptomatica ajunge la 100%83.
Antigenemia pp65 poate fi cuantificata prin aprecierea numarului de leucocite infectate din 2 x 105 leucocite. Un numar de leucocite infectate mai mare de 50 din 2 x 105 leucocite este considerat marker precoce de afectare viscerala CMV la imunodeprimati28. Dupa grefele de organe, numarul de leucocite infectate este direct proportional cu prezenta si gravitatea afectarii viscerale CMV. La bolnavii cu SIDA, valoarea predictiva a antigenemiei pp65 pentru afectarea viscerala CMV difera in functie de organul afectat. Astfel retinita CMV evolueaza cu antigenemie pp65 negativa, in timp ce restul localizarilor se insotesc de antigenemie pp65 intens pozitiva43. In 64 % din cazuri pozitivarea antigenemiei pp65 precede aparitia semnelor clinice de afectare viscerala CMV18,43. Cuantificarea antigenemiei leucocitare pp65 este de 35 de ori mai sensibila decat simpla evidentiere in cultura a antigenelor precoce CMV si reprezinta actualmente in tarile dezvoltate diagnosticul de rutina al afectarilor viscerale CMV, cu exceptia celor SNC, oculare si a infectiei congenitale CMV44.
6.2.3. Evidentierea ADN-CMV
Cercetarea ADN-CMV s-a lovit de dificultati tehnice datorate variabilitatii genetice a CMV. Majoritatea tehnicilor se adreseaza celor mai constante regiuni ale genomului viral, reprezentate de genele IE (UL123) si E (UL98)14,18,44.
Principala tehnica folosita pentru evidentierea ADN-CMV este PCR, care este mult mai sensibila decat hibridizarea moleculara in situ.
Prin PCR se pot evidentia cantitati mici de ADN-CMV in leucocite, ser sau alte fluide biologice.
Aceasta tehnica reprezinta actualmente cea mai sensibila si mai specifica metoda de diagnostic a unei infectii active CMV, fiind insa mai putin accesibila decat antigenemia pp65, datorita costului. Actualmente exista atat tehnici PCR calitative cat si cantitative. Tehnicile calitative sunt mai des utilizate si au o sensibilitate cuprinsa intre 5-50 genoame CMV.
La pacientii cu SIDA, prezenta ADN-CMV in sange are valoare predictiva pozitiva de 60% pentru aparitia unei afectari viscerale in urmatoarele luni14 si este un factor de prognostic nefavorabil, anuntand o supravietuire de scurta durata. De asemenea tehnica PCR pentru evidentierea ADN-CMV in sange a revolutionat recent managementul infectiilor CMV la transplantati. Scopul terapiei anti-CMV post-transplant este de a mentine ADN-CMV la valori nedetectabile, pentru a preveni aparitia afectarilor viscerale CMV. Pozitivarea ADN-CMV la acesti pacienti impune trecerea de la terapia antivirala preventiva la cea curativa.
Exista actualmente 3 metode diferite83 de PCR:
"1-step PCR" in care fragmentele de ADN-CMV tinta sunt amplificate exponential (30-40 cicluri) cu ajutorul unei ADN-polimeraze termostabile si a unor scurte oligonucleotide (primeri),
"Nested PCR" in care o parte din secventele amplificate in primul "step" sunt supuse ulterior unei alte runde de amplificare cu alti primeri, fapt care creste sensibilitatea metodei. Prin aceasta tehnica se poate identifica ADN-CMV in sangele periferic al donatorilor seropozitivi CMV asimptomatici.
"RT-PCR" in care in prima etapa este transcris ARN-ul in ADN cu ajutorul unei reverstranscriptaze (RT). Apoi amplificarea ADN este efectuata prin una din metodele anterioare. Aceasta metoda are avantajul ca poate diferentia genomul latent de cel activ (transcriptional).
a) Evidentierea ADN-CMV in leucocite
Prezenta ADN-CMV in leucocite reprezinta cel mai precoce marker de afectare viscerala la imunodeprimati, avand insa valoare predictiva mai mica decat antigenemia pp65, deoarece ADN- CMV poate fi prezent in unele leucocite si in absenta unei infectii active, reprezentand de fapt genomul CMV latent43. Pentru a diferentia un portaj leucocitar de CMV latent de infectia activa CMV se utilizeaza actualmente tehnici prin care se deceleaza ARN mesageri. Acestia sunt markerii transcrierii genelor tardive CMV si implicit ai infectiei productive CMV14.
ADN-CMV leucocitar se pozitiveaza foarte precoce, cu 3 saptamani inaintea viremiei si antigenemiei pp65, fiind deci foarte valoros in diagnosticul precoce al afectarilor viscerale CMV43. El persista mai mult decat viremia si are sensibilitate egala cu antigenemia pp65 dar mai mica decat cultura44.
Genomul viral este decelat cu o sensibilitate de 1 copie / 40.000 leucocite83.
Se poate face si o cuantificare a ADN-CMV leucocitar prin evaluarea numarului de copii de ADN-CMV / 104 leucocite, care are valoare prognostica in SIDA. Astfel un numar de peste 8.000 copii / 104 leucocite semnifica afectare viscerala CMV si deci prognostic nefavorabil43.
b) Cuantificarea ADN-CMV seric
Cuantificarea ADN-CMV seric este cunoscuta sub numele de incarcatura virala CMV.
O incarcatura virala de peste 105 copii / ml reprezinta un marker major de infectie activa si afectare viscerala la imunodeprimati, mai ales la cei cu grefe de organe si mai putin in SIDA28, avand deci valoare predictiva mare pentru aparitia unei afectari viscerale CMV. Simptomatologia clinica de afectare viscerala CMV apare la o incarcatura virala de peste 106-7 copii / ml. Dupa unii autori83 valoarea predictiva negativa a ADN-CMV pentru afectarile organice CMV este 100% dupa transplant, in timp ce valoarea predictiva pozitiva este mai mica (38-66% dupa grefele medulare si 25-40% dupa grefele hepatice).
Sensibilitatea incarcaturii virale CMV (83%) este mai mare decat a viremiei (78%), ea corelandu-se foarte bine cu antigenemia pp65 leucocitara28. Este insa mai putin accesibila datorita costului ridicat.
Actualmente incarcatura virala sta la baza monitorizarii tratamentului profilactic al infectiilor CMV la imunodeprimatii prin grefe de organe, la care nivelul ADN-CMV seric trebuie mentinut dupa transplant sub valoarea de 105 genomi / ml28.
c) Evidentierea ADN-CMV in situ (in tesuturi biopsiate)
Prezenta ADN-CMV in situ este evidentiata prin PCR, tehnica superioara hibridizarii in situ44. Decelarea ADN-CMV in LCR reprezinta actualmente cea mai rapida si mai sensibila metoda de diagnostic pentru afectarile SNC produse de CMV, asigurand astfel un tratament precoce si o ameliorare a prognosticului acestora. Sensibilitatea acestei metode este de 80-100% fata de a culturilor din LCR care este de numai de 30-50%18,43.
Trebuie mentionat ca manifestarile SNC ale CMV in SIDA sunt frecvente, dar din cauza diagnosticului dificil intravitam ele sunt mult subevaluate. S-a demonstrat necroptic ca 33% din pacientii decedati prin SIDA au encefalite CMV, marea majoritate nediagnosticate intravitam18.
Evidentierea ADN-CMV in umoarea apoasa sau in LBA pot contribui la diagnosticul retinitei si a manifestarilor pulmonare CMV la ID.
6.2.4. Evidentierea ARN mesageri
Prezenta ARN mesageri (ARNm) arata transcrierea genelor tardive (L) ale CMV si semnifica o infectie activa productiva (litica). Ea asigura diagnosticul diferential intre portajul latent leucocitar de CMV si infectia CMV activa. ARNm sunt in acelasi timp markerii unei afectari viscerale CMV, pozitivandu-se la 77% dintre pacientii care vor dezvolta ulterior o afectare viscerala CMV18,44.
Prezenta ARNm in diverse fluide biologice sau tesuturi reflecta direct replicarea CMV. Astfel prezenta ARNm al pp67 (UL65) reflecta replicarea virala si diseminarea infectiei, in timp ce disparitia acestuia este dovada unui succes terapeutic. Recent, Laboratoarele Organon Teknika au comercializat primele teste standardizate care monitorizeaza ARNm al pp67 (The NucliSens CMV pp67 Assay)81. Testele se bazeaza pe extractia ARN si amplificarea ARN specific prin tehnica NASBA (Nucleic Acid Sequence-Based Amplification). Se pare ca detectarea ARNm pentru proteinele tardive reflecta mai fidel aparitia unei infectii simptomatice CMV comparativ cu detectarea ADN-CMV.
In tabelul VII este prezentata valoarea predictiva pentru diagnosticul manifestarilor neurologice CMV a NucliSens pp67 comparativ cu ADN-CMV in LCR81.
Tabelul VII. Valoarea predictiva a NucliSenspp67 si ADN-CMV in LCR pentru diagnosticul manifestarilor neurologice CMV81
|
Valoare predictiva pozitiva |
Valoare predictiva negativa |
|
|
Cultura pe medii celulare | ||
|
NucliSens CMVpp67 | ||
|
PCR-ADN-CMV |
Monitorizarea terapiei anti-CMV se face mai bine cu NucliSens CMV pp67 comparativ cu PCR-ADN-CMV deoarece nivelul ADN viral scade lent sub tratament, in timp ce ARNm pp67 scade rapid, avand un t1/2 scurt.
In Tabelul VIII 21 sunt prezentate comparativ sensibilitate, specificitatea, rapiditatea si valoarea prognostica a diferitelor metode de diagnostic virusologic.
Tabelul VIII. Sensibilitatea, specificitatea, rapiditatea si valoarea prognostica a metodelor de diagnostic virusologic21
|
Metoda |
Sensibilitate |
Specificitate |
Rapiditate |
Valoare prognostica |
|
Culturi celulare conventionale | ||||
|
Decelare de antigene precoce (IE) prin IF | ||||
|
Decelarea de antigene leucocitare | ||||
|
PCR |
6.3. Diagnosticul serologic
Serologia CMV are importanta diagnostica mai mica decat metodele de diagnostic virusologic si histopatologic.
6.3.1. Evidentierea IgM, IgG si IgA anti-CMV
Actualmente se utilizeaza tehnici ELISA care necesita o mixtura de proteine virale recombinante, considerate markeri de infectie acuta (pp150, 52, 65 si 38)44. Pentru trierea rapida a donatorilor se utilizeaza teste de aglutinare latex. Laboratoarele Ortho-diagnostic au comercializat recent teste ELISA cantitative, care cuantifica concomitent IgM si IgG anti-CMV. Rezultatele sunt considerate pozitive cand IgM este mai mare de 150 UI /ml, iar IgG mai mare de 1,2 UI / ml. Din pacate aceste teste sunt mai greu accesibile, din cauza costului ridicat.
In tabelul IX sunt prezentate secventele de aminoacizi din proteinele virale necesare testelor serologice83.
Tabelul IX. Secventele de aminoacizi din proteinele virale necesare testelor serologice83
|
Proteina virala |
Secventa de aminoacizi |
|
|
IgG |
IgM |
|
|
ppUL32 (pp150) | ||
|
ppUL44 (p52) | ||
|
ppUL83 (pp65) | ||
|
ppUL99 (pp28) | ||
|
gpUL55 (gpB) | ||
|
gpUL75 (gpH) | ||
|
ppUL80A | ||
|
ppUL57 | ||
Prezenta IgM anti-CMV semnifica o primoinfectie CMV actuala sau recenta.
Deseori in SIDA, IgM anti-CMV apar tarziu dupa primoinfectie sau nu apar deloc, avand valoare diagnostica redusa, facand absolut necesare tehnicile de diagnostic virusologic.
Uneori, IgM anti-CMV persista mult timp dupa primoinfectie, creind mari probleme de diagnostic atunci cand sunt prezenti la debutul unei sarcini. Astfel, un studiu recent a aratat ca din 20 de gravide cu IgM anti-CMV prezente la debutul sarcinii, numai 4 (20%) au nascut copii infectati congenital cu CMV26,42. Unii autori sustin ca IgM anti-CMV reapar in cursul reactivarilor, odata cu cresterea titrului de IgG anti-CMV.
Tehnica serologica cea mai utilizata pentru identificarea IgG anti-CMV este ELISA. Sunt actualmente comercializate mai multe teste ELISA, dar din pacate rezultatele nu sunt intotdeauna comparabile. Se spera intr-o imbunatatire a performantei testelor prin utlizarea proteinelor recombinante. Studiile efectuate pana acum cu teste de tip imunoblot care utilizeaza antigene recombinante au evidentiat o buna corelare intre prezenta IgM si antigenemia pp65 sau PCR83.
Prezenta IgG anti-CMV este markerul unui contact anterior cu CMV (infectie veche) si are valoare diagnostica numai in urmatoarele situatii: screeningul serologic al femeilor fertile inainte sau la debutul sarcinii; screeningul donatorilor si primitorilor de grefe de organe si al donatorilor de sange; studii seroepidemiologice; selectarea donatorilor pentru prepararea imunoglobulinelor. Din pacate chiar si cele mai noi teste serologice nu exclud toate rezultatele fals negative si fals pozitive.
Prezenta IgG anti-CMV nu are valoare in diagnosticul unei infectii active CMV, desi unii autori sustin ca in cursul reactivarilor se inregistreaza cresteri ale titrului de IgG anti-CMV.
Cele mai fiabile si mai utilizate teste sunt cele ELISA, care au o sensibilitate de 80-100% si o specificitate de 84-99%. Pentru a avea performante maxime testele ELISA pentru evidentierea IgG anti-CMV ar trebui sa contina obligatoriu proteinele virale recombinante pp150 si pp52. Testele serologice bazate pe fixarea complementului, aglutinare latex, sau imunofluorescenta au sensibilitate mai mica si sunt utilizate in laboratoarele mai putin performante.
Evidentierea IgA anti-CMV pare sa aiba valoare de prognostic favorabil in SIDA, fiind corelata cu un numar mare de limfocite CD4 si cu o supravietuire de lunga durata43.
Evaluarea afinitatii IgG anti-CMV fata de CMV
Evaluarea afinitatii IgG anti-CMV fata de CMV este o metoda de diagnostic relativ recent introdusa, foarte utila in aprecierea riscului de infectie congenitala CMV, la gravidele care au IgM anti-CMV la debutul sarcinii.
O afinitate mica a IgG anti-CMV fata de CMV (<35%) semnifica primoinfectie recenta si risc major de infectie congenitala CMV26,42.
O afinitate mare a IgG anti-CMV fata de CMV (>65%) semnifica infectie veche CMV si absenta riscului de infectie congenitala26,42.
In Tabelul X este prezentata comparativ valoarea diverselor metode de diagnostic de laborator in infectia CMV.
Tabelul X. Valoarea comparativa a diverselor metode de diagnostic de laborator in infectia CMV83
|
Produs patologic |
Confirmarea unei infectii vechi |
Identificarea unei infectii active |
Monitorizarea unei terapii profilactice post-transplant |
Controlul terapei |
|
|
Izolare virala |
Leucocite, urina, biopsii tisulare, lavaj bronhiolo- alveolar (LBA) | ||||
|
ADN-CMV (PCR- calitativ) |
IDEM | ||||
|
ADN-CMV (PCR- cantitativ) |
Leucocite, ser / plasma | ||||
|
Antigenemia pp65 |
Leucocite | ||||
|
Seologie |
Ser |
(IgG) |
(IgM) |
Legenda: - - - complet nepotrivit; - nepotrivit; + potrivit; + + foarte potrivit; + + + cel mai potrivit
6.4. Diagnosticul infectiei congenitale CMV (Dr. Radu Vladareanu, Dr. Gheorghita Sardescu)
a) Diagnosticul serologic se bazeaza pe evidentierea anticorpilor IgM si IgG anti-CMV. Testele serologice sunt rapide, au o buna sensibilitate si specificitate, dar au un cost inca ridicat pentru a fi disponibile in orice laborator.
Din pacate, diagnosticul serologic al infectiei CMV pune deseori probleme de interpretare deoarece:
Titrul de IgG anti-CMV fluctueaza in cursul vietii, astfel incat o crestere a titrului de anticorpi nu reprezinta o dovada a primoinfectiei CMV.
Prezenta IgM anti-CMV nu este intotdeauna un argument decisiv in favoarea unei primoinfectii deoarece IgM nu apar in 100% din promoinfectiile CMV, iar pe de alta parte IgM pot persista multe luni dupa primoinfectie, punand probleme delicate de interpretare atunci cand sunt detectate in primul trimestru de sarcina. De asemenea se pare ca IgM anti-CMV pot uneori reapare in cursul reactivarilor CMV odata cu cresterea titrului de IgG anti-CMV26,42.
Spre deosebire de alte infectii virale, confirmarea serologica a unei primoinfectii CMV este dificila. Astfel, prezenta IgM anti-CMV si cresterea de 4 ori a titrului de IgG anti-CMV intre 2 determinari succesive nu sunt intotdeauna suficiente pentru a confirma primoinfectia CMV. Singura dovada certa a primoinfectiei CMV este surprinderea seroconversiei, adica pozitivarea serologiei CMV la o gravida, care pana atunci avea serologie negativa.
Din cauza acestor dificultati de interpretare se cauta noi tehnici care sa ajute diagnosticul de primoinfectie CMV.
Relativ recent s-a lansat testul de aviditate a IgG anti-CMV pentru antigenele virale, disponibil deocamdata numai in laboratoare specializate.
O aviditate redusa (< 35%) semnifica infectie recenta, in timp ce o aviditate mare (>65%) arata infectie veche26,42. Deci prezenta IgM anti-CMV coroborata cu o aviditate redusa a IgG anti-CMV, asigura diagnosticul de primoinfectie CMV.
In Romania, laboratoarele mari din Centrele Universitare pot efectua teste ELISA pentru evidentierea IgM si IgG anti-CMV. Deci, atunci cand se suspecteaza o primoinfectie CMV la gravida se recomanda urgent cercetarea: IgM anti-CMV (o singura proba de sange) si IgG anti-CMV in dinamica (2 probe la interval de 2 saptamani). Prezenta IgM anti-CMV si / sau cresterea de 4 ori a titrului de IgG anti-CMV trebuie interpretate ca primoinfectie CMV42.
b) Diagnosticul virusologic se bazeaza pe izolarea virusului in culturi celulare din sange, urina sau secretii cervicale sau pe evidentierea ADN viral prin PCR in diverse produse patologice. Prezenta unei viremii CMV la gravida semnifica o infectie activa, productiva cu diseminare hematogena si cu risc de transmitere transplacentara. Absenta viremiei la gravida nu exclude total riscul transmiterii materno-fetale. In mod normal, primoinfectia CMV se insoteste de o viremie de scurta durata, care se suprapune cu debutul clinic. La femeia gravida se pare ca viremia este mai prelungita in timp, ceea ce creste riscul transmiterii maternofetale26,42.
Se recomanda ca inaintea oricarui gest invaziv asupra fatului (amniocenteza, punctia cordonului fetal), obstetricianul sa se asigure de absenta unei viremii CMV. Simpla prezenta a CMV in urina sau secretiile cervicale nu permite diagnosticul de primoinfectie CMV, deoarece se stie ca 30% din gravide excreta CMV in urma reactivarii unei infectii vechi latente26.
a) Diagnosticul serologic se bazeaza pe evidentierea IgM anti-CMV in sangele fetal, dupa saptamana 22 de sarcina. Acestea sunt prezente insa numai la 20-75% din infectiile fetale cu CMV.
b) Diagnosticul virusologic bazat pe evidentierea CMV in lichidul amniotic (LA) pe culturi celulare reprezinta metoda de electie pentru diagnosticul infectiei fetale. Aceasta tehnica are o specificitate de 100% si o sensibilitate de 80-100%26,42. Dupa majoritatea autorilor punctia amniotica trebuie efectuata la 4 saptamani dupa momentul infectiei materne. Evidentierea ADN-CMV in LA prin PCR are sensibilitate mai mare decat culturile celulare, dar din cauza costului ridicat, nu a intrat in practica curenta.
6.4.3. Diagnosticul infectiei CMV la nou-nascut (dupa nastere)
a) Diagnosticul virusologic consta in:
Evidentierea CMV pe culturi celulare din urina recoltata in primele 10 zile de viata, deoarece dupa aceasta varsta poate fi vorba de o infectie CMV postnatala. Se recomanda recoltarea sterila a urinii matinale, 3 zile consecutiv si transportul rapid la laborator (1-2h). Daca transportul rapid nu este posibil urina se pastreaza la -700C. Se mai recomanda utilizarea de medii de transport cu sorbitol 50% si antibiotice pentru a conserva infectiozitatea CMV, care este inhibat de bacterii si fungi. CMV poate fi cultivat si din saliva nou nascutului .
Evidentierea ADN-CMV in LCR prin PCR este cea mai sensibila metoda de diagnostic. Ea este pozitiva si atunci cand culturile din LCR sunt negative. Prezenta CMV in LCR are valoare prognostica nefavorabila.
Evidentierea CMV pe culturi celulare din placenta are mare valoare diagnostica.
b) Diagnosticul serologic: 70-80% din nou nascutii virurici au in sange IgM anti-CMV, evidentiate prin IF sau ELISA26,42.
In figura 9 este prezentat un algoritm de diagnostic al infectiei CMV in timpul sarcinii83
In figura 10 este prezentata cinetica anticorpilor si a detectiei virale in cursul primoinfectiei CMV83.
Fig. 9. Algoritm de diagnostic al infectiei CMV la femeia gravida83
Prima proba de sange pentru serologie CMV,
la inceputul sarcinii, mai ales in caz de expunere sau de suspiciune clinica de primoinfectie CMV
![]()
![]()
![]()
IgG + / IgM - IgG + / IgM + IgG - / IgM + IgG- / IgM-
= = =
Infectie veche Suspiciune de Primoinfectie sau Seronegativ CMV sau
primoinfectie IgM fals pozitiv incubatie
![]()
![]()
![]()
A 2-a proba de sange pentru serologie dupa 2 sapt.
![]()
![]()
![]() identificarea CMV in sangele matern (antigenemia
pp65, PCR) si urina
identificarea CMV in sangele matern (antigenemia
pp65, PCR) si urina
![]()
![]()
![]() IgG / IgM + Titru IgG constant / IgM+ IgG- / IgM+ IgG - / IgM + IgG - / IgM -
IgG / IgM + Titru IgG constant / IgM+ IgG- / IgM+ IgG - / IgM + IgG - / IgM -
CMV + CMV - CMV - CMV - sau + CMV -
![]()
![]()
![]()
![]()
![]()
IgG - / ? Infectie inactiva Nespecific Primoinfectie A 3-a proba de sange dupa 2-3 sapt
![]() inaintea sarcinii cu persistenta IgM
inaintea sarcinii cu persistenta IgM
![]()
![]() Primoinfectie CMV ? Punctia
cordon fetal in sapt 22-23: IgM anti-CMV +
Primoinfectie CMV ? Punctia
cordon fetal in sapt 22-23: IgM anti-CMV +
Decelare CMV in lichidul amniotic (pp65 + , ADN-CMV+)
![]()
Intreruperea sarcinii ??
Fig. 10. Cinetica anticorpilor si a detectiei virale in cursul primoinfectiei CMV83.
perioada
pp65 Ag CMV ADN PCR![]() de incubatie
de incubatie ![]()
![]()
![]()
![]()
![]()
![]()
![]() simptome
simptome
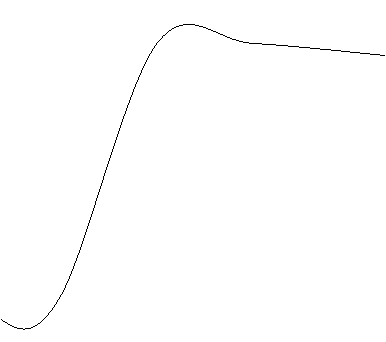 IgG
IgG
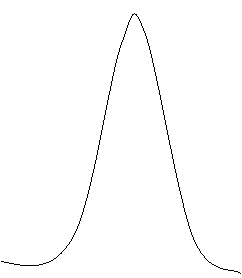 IgM
IgM
![]()
![]()
![]()
Infectia
![]()
![]()
![]()
![]()
![]()
zile saptamani luni ani
7. Tratament
7.1. Substante active asupra CMV
Antiviralele avizate pana in mai 2001 de FDA pentru terapia infectiilor cu CMV sunt prezentate in tabelul XI84,85.
Tabelul XI. Antivirale avizate de FDA pentru terapia infectiilor cu CMV84,85
|
Antivirale (DCI) |
Anul avizarii de FDA |
|
Ganciclovir iv | |
|
Foscarnet iv | |
|
Ganciclovir po | |
|
Ganciclovir implant intravitrean | |
|
Cidofovir iv | |
|
Fomivirsen injectii intravitreene | |
|
Valganciclovir po |
In Romania este inregistrat numai ganciclovirul sub numele de Cymevene (Roche), atat forma po, cat si cea iv.
Structura chimica si mecanismele de actiune ale principalelor substante active pe CMV sunt schematizate in figura 11.
Fig 11. Structura chimica si mecanismele de actiune ale principalelor substante active pe CMV (dupa Whitley R)
In tabelul XII sunt prezentate comparativ concentratiile inhibitorii in vitro ale analogilor nucleozidici activi pe herpesvirusuri
TabelulXII. Concentratiile inhibitorii in vitro ale analogilor nucleozidici asupra herpesvirusurilor14
|
Virus |
Concentratia inhibitorie (mg/ml) |
|||
|
Acyclovir |
Penciclovir |
Ganciclovir |
Cidofovir |
|
|
HSV 1 | ||||
|
HSV 2 | ||||
|
VZV | ||||
|
CMV |
| |||
|
EBV |
< 0,03 |
|||
In continuare vor fi descrise pe larg substantele active pe CMV, cunoscute pana acum.
7.1.1. Ganciclovir (GAN)
GAN, este foarte activ asupra CMV, fiind prima substanta utlizata in terapia infectiilor CMV.
In Europa este comercializat sub numele de Cymevene (Roche) si Vitrasert (Chiron Vision France). Preparatul Cymevene este disponibil sub forma de gelule (1 gelula = 250 mg) si pulbere pentru administrare iv (1 flacon = 500 mg), iar Vitrasertul sub forma de dispozitiv intravitrean (1 dispozitiv = 4,5 mg)32,52.
In SUA, GAN este comercializat sub numele Cytovene sub forma de preparat po, iv si dispozitiv intravitreal (Vitrasert)50,51.
Structura chimica
GAN este un analog dezoxiguanozinic, foarte asemanator structural cu acyclovirul (AV). El are insa o activitate anti-CMV de 50 de ori mai mare. El difera de AV prin aditia unei grupari hydroximethyl in pozitia 3'a lantului aciclic lateral. Formula sa chimica este: (9-[1,3-dihydroxy-2-propoxylmethyl]guanine)
GAN actioneaza similar cu AV, inhiband ADN polimeraza CMV (proteina UL54) si implicit replicarea ADN-ului viral. Exista insa unele deosebiri fata de AV:
In celulele infectate cu CMV, prima fosforilare a GAN nu este realizata de timidinkinaza (TK), ci de o alta enzima virala, dependenta de gena UL97 a CMV, numita proteinkinaza, cu activitate de fosfotransferaza. Urmatoarele 2 fosforilari au loc sub actiunea unor enzime celulare.
GAN-Trifosfat (GAN-TP) nu este un "codon stop" absolut, motiv pentru care in nucleul celular continua sa se sintetizeze mici fragmente de ADN-CMV neinfectios. Deci GAN are o activitate antivirala mai mica decat a AV.
GAN este activ in vitro pe CMV, HSV1 si HSV2, VZV, EBV, HHV8 si virusul herpes simiae.
In vivo el este foarte activ pe CMV.
Farmacocinetica
Pana nu de mult GAN exista numai ca preparat de administrare iv. In 1995 a fost comercializat GAN de administrare po.
Dupa administrarea iv (5 mg / kg / doza) se realizeaza concentratii plasmatice mari (6-15 mg/ml) care inhiba majoritatea tulpinilor CMV; T ½ plasmatica este de 3h la pacientii cu functie renala normala. El creste linear odata cu scaderea clearance-ului la creatinina, putand ajunge la 28-40 ore atunci cand creatinina serica este mai mare de 4,5 mg/dl14,33.
Dupa administrarea po: absorbtia digestiva este lenta; biodisponibilitatea este redusa (5-8%), fiind amelioarata dupa ingestia de alimente; concentratiile plasmatice dupa administrarea unor doze de 1.000 mg x 3/zi sunt mici (0,5-1 mg/ml); eficacitatea antivirala a GAN po este mai mica decat a GAN iv, dar se pare ca este suficienta clinic14,33.
T ½ intracelulara a GAN-TP este de 16,5 h, fata de numai 2,5 h pentru AV, ceea ce permite administrarea in priza zilnica unica 14. GAN-TP se concentreaza de 10 ori mai bine intracelular si are T1/2 intracelulara mult mai mare, motiv pentru care in vivo GAN este un inhibitor mult mai potent al CMV decat AV14. In celulele neinfectate cu CMV concentratia GAN este de 10 ori mai mica14.
Legarea de proteinele plasmatice este de numai 1-2%. Nivelele realizate in LCR sunt de 24-70% din nivelul plasmatic, iar in SNC de 38%14.
GAN se elimina nemetabolizat, predominent renal (90%) atat prin filtrare glomerulara cat si prin secretie tubulara. Este necesara reducerea dozelor atunci cand clearance-ul la creatinina este sub 80 ml/min (tabelul XIII). O singura sedinta de dializa reduce nivelul plasmatic al GAN cu 50-60%14.
Tabelul XIII. Reducerea dozelor de ganciclovir in functie de clearance-ul la creatinina14
|
Clearance la creatinina (ml/min/1,73m2) |
Doza iv (mg/kg) |
Interval (h) |
Doza po |
Interval |
|
> 70 | ||||
|
<10 |
3 / sapt |
3 / sapt |
GAN are dezavantajul unei toxicitati sistemice importante.
Medulotoxicitate (supresie medulara)
Dupa administrarea iv apar mai des granulocitopenii reversibile (20-40%) si mai rar trombocitopenii (15-20%) sau anemii (6%)14,32,50. Acestea sunt intalnite mai ales la pacientii cu infectie HIV si mai rar post-transplant. Medulotoxicitatea apare printr-un mecanism toxic direct al GAN pe maduva hematogena. In cazul aparitiei acestui efect toxic se recomanda: reducerea dozelor cand apare neutropenie sub 1000/mm3; intreruperea tratamentului cand neutropenia este sub 500/mm3; administrarea de G-CSF (factor de crestere granulocitara); evitarea asocierilor cu alte medulotoxice (AZT, cotrimoxazol, azatioprina). Neutropenia apare de obicei in a doua saptamana de tratament si este reversibila intr-o saptamana dupa sistarea administrarii GAN14.
Dupa administrarea po tulburarile hematologice sunt mai rar intalnite: granulocitopenie in 18% din cazuri, trmobocitopenie in 6% din cazuri si anemie in 12% din cazuri50.
Neurotoxicitatea se poate manifesta prin cefalee, confuzie, vertij, delir, tulburari de comportament si mai rar prin convulsii si coma14. Apare rar (5-15%), probabil printr-un efect toxic direct al GAN pe SNC. Efectul neurotoxic este potentat de asocierea cu alte medicamente neurotoxice14,50. Aparitia lui impune intreruperea terapiei.
3. Insuficienta hepatorenala severa apare rar, probabil prin cristalizarea GAN in tubii renali. Se impun aceleasi masuri profilactice ca si pentru AV. Insuficienta renala este mai des intalnita la pacientii transplantati renal care se afla sub chimioprofilaxie cu GAN14.
4. Efect mutagenic, carcinogenic, imunosupresiv si teratogen la animale. La om aceste efecte nu au fost demonstrate14.
Introducerea recenta a GAN po, precum si a implantelor intravitreene a dus la o scadere a incidentei acestor efecte toxice, care a ajuns la 0 in cazul administrarii intravitreene.
Reactiile adverse apar rar, avand aceeasi frecventa atat dupa administrarea iv cat si po. Ele sunt reprezentate de14,50:
Febra (48%) si cefalee, care impun reducerea dozelor
Flebite de cateter datorate alcalinitatii solutiei de GAN
Rash (10%), care apare prin idiosincrazie si impune intreruperea terapiei in formele moderate si severe
Eozinofilie
Greata, varsaturi (50%), diaree, dureri abdominale (19%).
Dupa administrarea intravitreala a GAN s-au raportat cazuri de hemoragii si infectii intraoculare, tulburari de vedere si dezlipire de retina (11%)50,51.
Interactiuni medicamentoase
Trebuie evitata administrarea concomitenta a GAN cu alte medicamente cu toxicitate hematologica si/sau neurologica: dapsona, pentamidina, flucitozina, antineoplazice, zidovudina, amfotericina B, cotrimoxazol, alti analogi nucleozidici33.
De asemenea trebuie evitata asocierea cu medicamente care modifica secretia sau reabsorbtia tubulara. Probenecidul creste cu 45% nivelul plasmatic al GAN14.
GAN po determina cresterea nivelului plasmatic al unor antiretrovirale ca didanozina (ddI) si zacitabina (ddC), fapt care antreneaza o amplificarea a toxicitatii acestora14,33.
Asocierea GAN cu AZT ar trebui evitata din cauza potentarii efectului de supresie medulara. Atunci cand ea nu poate fi evitata se recomanda o monitorizare hematologica atenta33.
Dupa asocierea GAN cu imipenem-cilastatine s-au raportat convulsii, al caror mecanism este incert33.
Tulpinile CMV deficiente in UL97 sunt cele mai frecvente, sunt deseori rezistente si la AV, dar raman sensibile la Foscarnet si HPMC. Aceste tulpini au IC50 de 4-20 ori mai mare14. Ele sunt incapabile sa monofosforileze GAN. Mecanismul intim al rezistentei este reprezentat de mutatii la nivelul codonilor 460, 520, 590 sau 59614.
Tulpinile CMV deficiente in ADN-pol sunt rareori intalnite si sunt rezistente si la FOS sau HPMC.
Tulpinile CMV deficiente atat in UL97 cat si ADN-pol sunt rareori intalnite si au un nivel inalt de rezistenta (IC50 > 10 mg/ml)14. Aceste tulpini se selecteaza dupa terapii anti-CMV prelungite.
Factorii favorizanti pentru aparitia rezistentei la GAN sunt imunodepresia si tratamentele de intretinere cu doze mici.
7.1.2. Foscarnet (FOS)
FOS este un pirofosfat (trisodium phosphonoformate), fiind un analog organic al pirofosfatului anorganic. El blocheaza reversibil situsul de legare pirofosfat al ADN-pol virale la nivelul nucleozidelor, in maniera noncompetitiva si cu respectarea dezoxinucleotid-TP. Aceasta conduce la sistarea replicarii ADN viral. Mai precis, FOS blocheaza clivarea grupului pirofosfat al dezoxiguanozin-TP, fapt ce va impiedica fixarea ADN-pol virale si va determina blocarea elongarii lantului de ADN viral. FOS, nefiind analog nucleozidic, nu necesita fosforilari prealabile, dependente de TK virala, fapt care antreneaza o scadere a selectivitatii, exprimata prin afectarea celulelor neinfectate, care va duce la o crestere a toxicitatii sistemice. Totusi FOS are o afinitate de 100 ori mai mare pentru ADN-pol virala a herpesvirusurilor si reverstranscriptaza HIV decat fata de ADN-pol celulara.
Pentru a fi activ FOS trebuie sa fie prezent in concentratii intracelulare mari. In acest fel el ramane in contact cu ADN-pol virala. Atunci cand concentratia intracelulara a FOS scade se reia replicarea ADN14.
El este comercializat sub numele de Foscavir (Astra) atat in Europa cat si in SUA si exista numai sub forma de preparat iv32,50,51,52 (flacoane de 6g / 250 ml sau 12 g / 500 ml).
FOS se administreaza exclusiv iv, deoarece preparatul oral este greu tolerat si are o biodisponibilitate redusa (2-5%). Proprietatile farmacocinetice ale preparatului iv sunt14:
Concentratii plasmatice bune: dupa administrarea iv continua 140-1256 mol/l, iar dupa iv intermitenta 98-509 mol/l.
Legarea de proteinele plasmatice: 15%
Distributie tisulara buna (inclusiv SNC, LCR), unde realizeaza concentratii egale cu 40-60% din nivelul seric.
T ½ plasmatic: 6h.
Nu este metabolizat in organism.
Eliminare predominent renala (80%), in special prin filtrare glomerulara. Se impune ajustarea dozelor dupa clearance-ul la creatinina (tabelul XIV). Probenecidul nu afecteaza eliminarea renala a FOS.
Tabelul XIV. Ajustarea dozelor de FOS dupa clearance la creatinina14
|
Clearance la creatinina (ml/min/kg) |
Doza de inductie (mg /kg / 8h) |
Doza de intretinere (mg / kg / zi) |
|
> |
120 |
|
|
120 |
||
|
104 |
||
|
104 |
||
|
100 |
||
|
100 |
||
|
94 |
||
|
94 |
||
|
84 |
||
|
84 |
||
|
76 |
||
|
76 |
||
|
76 |
1. Nefrotoxicitatea apare la peste o treime din pacienti si se datoreaza actiunii toxice directe a FOS asupra tubilor renali. Ea se manifesta prin azotemie, proteinurie si uneori necroza acuta tubulara. Au fost raportate si cazuri de cristalurie, acidoza tubulara, diabet insipid nefrogenetic si nefrita interstitiala14. Cresterea creatininei serice incepe in a doua saptamana de tratament si este reversibila in 2-4 saptamani dupa oprirea FOS. Nefrotoxicitatea este favorizata de: dozele mari, administrarea rapida sau continua, deshidratarea si co-administrarea altor droguri nefrotoxice (aminoglicozide, amfotericina B, pentamidina). Pentru prevenirea ei se recomanda: hiper-hidratarea bolnavului cu 1-2 litri ser fiziologic iv, inaintea PEV cu FOS; monitorizarea ureei si creatininei; evitarea asocierii cu alte medicamente nefrotoxice; ajustarea dozelor la bolnavii cu insuficienta renala dupa clearance-ul la creatinina.
2. Tulburari hidroelectrolitice: hipocalcemii (15-35%), hipomagneziemii (15-44%), hipopotasemii (10-16%) si hipofosfatemii14,32,50. Ele apar frecvent si se datoreaza efectului de chelare a cationilor divalenti. Hipocalcemia se manifesta prin parestezii, aritmii, tetanie, convulsii etc. Pentru evitarea acestor tulburari hidroelectrolitice se recomanda: administrare iv lenta cu ajutorul injectomatelor, fara a depasi 1mg/kg/min; monitorizarea electrolitilor serici de cel putin 2ori / saptamana in primele 2 saptamani de tratament; reechilibrarea electrolitica po sau iv.
3. Medulotoxicitatea este net inferioara GAN. Se intalnesc in special anemii si mai rar leucopenii sau trombocitopenii14. Ele apar rar, printr-un efect toxic direct al FOS asupra maduvei hematogene. Rareori este nevoie de reducerea dozelor. La pacientii cu infectie HIV anemia este mai des intalnita (20-50%)50.
4. Neurotoxicitatea se manifestata prin cefalee (25%), tremor, iritabilitate, convulsii (10%), halucinatii14,32,50. Convulsiile sunt datorate tulburarilor hidroelectrolitice.
5. Efect mutagenic si posibil teratogen la animale, dupa administrarea de doze mari.
Reactii adverse febra (65%); rash; diaree (30%); greata si varsaturi (50%) datorate tulburarilor hidroelectrolitice; anxietate; fatigabilitate; modificarea testelor hepatice etc14,32,50. Ele impun rareori reducerea dozelor.
Ulceratiile genitale sunt rar intalnite si se datoreaza unei dermatite de contact indusa de acumularea locala de FOS si de concentrarea mare a FOS in urina14. Se recomanda o igiena riguroasa dupa fiecare mictiune si o hidratare corespunzatoare. Ele se rezolva in cateva saptamani dupa stoparea terapiei.
Interactiuni medicamentoase
Eliminarea FOS poate fi modificata de medicamentele care inhiba secetia tubulara renala.
Administrarea concomitenta de medicamente nefrotoxice (amfotericina B, aminoglicozide, pentamidina) potenteaza nefrotoxicitatea FOS.
Adminsitrarea concomitenta de medicamente hipocalcemiante si de pentamidina potenteaza efectul hipoglicemiant al FOS.
FOS nu interactioneaza cu zidovudina, desi unii autori au raportat cresterea riscului de anemie14.
7.1.3. Cidofovir (HPMC)
Cidofovirul este comercializat sub numele de Vistide (Pharmacia-Upjohn) sau Forvade (Gilead-Science)32.
Este disponibil in USA si Europa sub forma de preparat iv (Vistide) si sub forma de gel dermic (Forvade)32,50,51,52. Preparatul iv este conditionat in flacoane de 375 mg (5 ml), iar gelul in tuburi de 3 g (1%)32,50. El este avizat in Europa si SUA numai pentru tratamentul retinitei CMV din SIDA.
Cidofovirul este un analog nucleozidic monofosforilat de citozina cu urmatoarea formula chimica: ((S)-1[3-hydroxy-2(phosphorylmethoxy)propyl]cytokine)14.
- herpesvirusuri umane:
CMV (inclusiv tulpinile GAN-Rezistente). HPMC este de 2 ori mai activ pe CMV decat GAN si FOS.
HSV1 si HSV2 (inclusiv tulpinile AV-Rezistente). HPMC este mai activ decat AV.
VZV (inclusiv tulpinile AV-Rezistente).
EBV, HHV6 si HHV8
alte virusri ADN:
Papilomavirusuri umane (HPV)
Poliomavirusuri
Adenovirusuri
Poxvirusuri
VHB
In vitro, HPMC este sinergic cu GAN si FOS asupra CMV.
HPMC are un mecanism de actiune asemanator AV, de care se deosebeste prin faptul ca fiind deja monofosforilat, nu necesita TK virala, fapt care atrage scaderea selectivitatii pentru celulele infectate si implicit cresterea toxicitatii. Fiind pre-monofosforilat, HPMC este activ si pe tulpinile de HSV si VZV deficiente in TK, precum si pe cele CMV deficiente in UL97. Urmatoarele 2 monofosforilari sunt asigurate de enzime celulare.
In vitro, concentratia inhibitorie asupra CMV este cuprinsa intre 0,2-0,7 mg/ml14.
Farmacocinetica
Biodisponibilitatea dupa administrarea orala este redusa (sub 5%). Dupa administrarea iv nivelul plasmatic este proportional cu doza si scade bifazic, cu un T 1/2 terminal de 2,6 h.
HPMC-TP are un T 1/2 intracelulara mare (17-65 h), putand fi administrat 1 data pe saptamana14. Doza maxima tolerata pe cale intravenoasa este de 5 mg / kg / saptamana. In cursul terapiei de atac HPMC se administreaza saptamanal in primele 2 saptamani si apoi la interval de 2 saptamani. El trebuie administrat in asociere cu probenecid po (2g inaintea fiecarei prize iv de HPMC)14.
Legarea de proteinele plasmatice este sub 6%. Penetrarea in LCR si ochi nu este inca bine evaluata. Absorbtia sistemica dupa aplicarea de HPMC gel este minima (sub 0,5 mg/ml) si depinde de marimea leziunii14.
Eliminarea este predomominent renala (90%) sub forma nemetabolizata, prin filtrare glomerulara si secretie tubulara14. Utilizarea unor doze mari de probenecid po (2g cu 3 ore inainte si 1 g la 2 si 8 ore dupa fiecare adminsitrare iv) reduce clearance-ul renal al HPMC prin blocarea secretiei tubulare si determina cresterea concentratiei plasmatice a acestuia14. Probenecidul asigura o crestere a concentratiei plasmaticie a HPMC de la 11,6 la 26,1 mg/ml (dupa o doza de 5 mg/kg de HPMC)14. Efectul hemodializei si al insuficientei renale asupra farmacocineticii HPMC este insuficient studiat. Administrarea concomitenta a altor substante nefrotoxice este contraindicata in timpul terapiei cu HPMC si se recomanda un interval liber de minim 7 zile dupa o terapie cu aminoglicozide, pentamidina, amfotericina B, foscarnet, AINS sau substante de contrast.
Studiile clinice efectuate pana acum au aratat ca HPMC este eficace in:
1. Tratamentul topic al: infectiilor cutaneomucoase cu tulpini HSV AV-Rezistente; keratoconjunctivitei produse de HSV, VZV sau adenovirusuri; retinitei CMV (injectii intravitreene); papilomatozei genitale (aplicatii cutanate sau injectii intratumorale).
2. Tratamentul sistemic (iv) al: retinitei CMV; infectiilor viscerale cu CMV la imunodeprimati; infectiilor cu HSV si VZV la imunodeprimati; leucoplazia paroasa a limbii (EBV).
In USA, HPMC este aprobat pentru terapia retinitei CMV la bolnavii cu SIDA. Eficacitatea si tolerabilitatea sa nu a fost inca bine documentata in alte afectari viscerale produse de CMV la pacienti imunodeprimati non-HIV.
HPMC a fost utilizat sporadic pentru infectiile cutaneo-mucoase cu tulpini HSV AV-Rezistente.
Gelul cu HPMC incorporat in polietilenglicol, aplicat 1 data / zi, timp de 5 zile, reduce durerea si excretia virala, grabeste vindecarea leziunilor produse de tulpinilr HSV AV-Rezistente la bolnavii infectati HIV14.
Administrarea intralezionala a HPMC in leziunile de papilomatoza respiratorie a condus la reducerea dimensiunilor leziunilor. Se asteapta acelasi efect si de la administrarea HPMC in leziunile genitale produse de HPV.
Adminstrarea intravitreala a HPMC poate fi eficienta in retinita CMV, dar este contraindicata din cauza toxicitatii locale. Se afla in studiu o formula pentru un gel oftalmic, care sa fie utilizat in keratoconjunctivita adenovirala.
Studiile clinice efectuate pana acum au utilizat urmatoarea posologie:
In tratamentul de atac: iv lent (1 h): 3-5 mg/kg, o data pe saptamana sau la 2 saptamani.
In tratamentul de intretinere: iv. lent, aceeasi doza, o data la 2 saptamani.
Nefrotoxicitatea dependenta de doza este principalul efect advers dupa administrarea de HPMC iv. Ea se manifesta prin proteinurie, azotemie, glicozurie, bicarbonaturie, acidoza metabolica, fosfaturie, poliurie si sindrom Fanconi-like. HPMC produce leziuni degenerative si necrotice la nivelul celulelor tubului contort proximal, care pot fi ireversibile. Nefrotoxicitatea poate fi evitata prin: hiperhidratarea bolnavului cu solutii saline, administrarea concomitenta de probenecid, ajustarea dozelor dupa clearance-ul la creatinina, distantarea prizelor. Utilizand niste doze de intretinere de 5mg / kg / saptamana s-a observat ca 50% din bolnavi dezvolta proteinurie, iar 15% au nivele crescute de creatinina14. Se recomanda reducerea dozelor in cazul cresterilor discrete ale creatininei si sistarea terapiei atunci cand creatinina serica atinge valori mari sau cand se instaleaza proteinuria.
Hepatotoxicitatea apare numai dupa doze mari.
Neutropenia apare in 29% din cazuri, fiind necesara monitorizarea leucogramei14,50.
Efect mutagenic, gonadotoxic, embriotoxic si teratogenic la animale. Cidofovirul este considerat la om un potential agent carcinogenetic si teratogenic, fiind contraindicat in sarcina..
Reactii adverse posibile febra (31%), greata, varsaturi (48%), diaree, cefalee, rash, astenie, mialgii (16%), alopecie (16%), uveita anterioara, hipotonie oculara, hipersensibilitate la probenecid (16%)14,32,50,52. Aplicatiile locale cu HPMC pot fi urmate de durere, arsura, prurit, iar intr-o treime de cazuri de ulceratii14. Nu s-au raportat cazuri de toxicitate sistemica dupa adminstrare locala.
Interactiuni medicamentoase
Probenecidul determina o crestere a concentratiei serice a AZT, motiv pentru care se recomanda reducerea dozelor zilnice de AZT14.
Este contraindicata asocierea cu alte medicamente nefrotoxice14.
HPMC nu are rezistenta incrucisata cu AV, GAN sau FOS, fiind deci activ pe tulpinile HSV, VZV, CMV deficiente in TK si rezistente la AV, GAN sau FOS. Aceasta se datoreste faptului ca HPMC, fiind deja monofosforilat, nu necesita TK virala, el fiind activ si pe tulpinile TK- deficiente.
Tulpinile rezistente prin mutatii la nivelul ADN-pol virale sunt rezistente si la HPMC. Rezistenta la HPMC este rar intalnita. S-au raportat cazuri de tulpini cu rezistenta inalta la GAN, care erau concomitent rezistente si la HPMC14.
HPMC este considerat actualmente 'o mare speranta' a terapeuticii antiherpetice.
Oligonucleotide metilsulfonate antisens (OMP-S)
Oligonucleotidele metilsulfonate antisens (d-OMP-S) reprezinta cea mai noua si promitatoare clasa de antivirale. Principalul reprezentant al acestei clase este ISIS 2922, produs sub numele de Adefovir (Isis Pharma). El se afla actualmente in studii clinice.
ISIS 2922, nefiind analog nucleozidic, are un mecanism de actiune diferit de AV. El blocheaza expresia genelor virale esentiale fixandu-se la nivelul secventelor complementare ale ARNm.
In SUA este avizat un preparat pentru administrare intravitreala sub numele de Fomivirsen (Vitravene)14,50.
OMP-S au un spectru larg, cuprinzand: CMV, HIV si VHB. Studiile clinice aflate in desfasurare arata ca OMP-S sunt foarte eficace in retinita CMV si in alte infectii herpetice aparute in SIDA.
Indicatii, posologie, efecte adverse
In SUA este avizata utilizarea intravitreala a Formivirsenului la bolnavii HIV pozitivi, care nu tolereaza sau au contraindicatii la alte substante anti-CMV.
Doza este de 330 mg injectate intravitreal la fiecare 2 saptamani14.
Efectele adverse raportate pana acum sunt: uveita, irita, vitreita, cresterea presiunii intraoculare, tulburari de vedere, inflamatia camerei anterioare, cataracta50.
Este recomandat ca bolnavul care primeste Formivirsen sa nu fi primit in ultimle saptamani cidofovir (iv sau intravitreal) deoarece se potenteaza efectele secundare oculare50.
7.1.5. Substante anti-CMV "de perspectiva"
Se apreciaza ca substanta anti-CMV ideala ar trebui sa indeplineasca urmatoarele criterii: administrare per os; eficienta clinica anti-CMV atat in terapia de atac, cat si in cea de intretinere; sa nu necesite cateter venos permanent; usor de dozat ; toxicitate si reactii adverse limitate.
Dintre antiviralele cu actiune anti-CMV aflate in curs de evaluare, cele mai studiate sunt valganciclovirul, lobucavirul si moribavirul14.
a) Valganciclovirul (V-GAN) este un ester al ganciclovirului, fiind un preparat oral, produs de compania Roche (Valcyte : 1 cp = 450 mg). Asa cum GlaxoSmithKline a sintetizat valaciclovirul pentru a ameliora biodisponibilitatea orala a aciclovirului, Roche a sintetizat in acelasi scop valganciclovirul care are o biodisponibilitate de 60% fata de numai 6-10% pentru GAN.
V-GAN este rapid metabolizat in GAN prin hidroliza in tractul gastrointestinal. El are spectru antiviral, mecanism de actiune si efecte adverse similare ganciclovirului.
V-GAN are avantajul unei farmacocinetici lineare, concentratia plasmatica si aria de sub curba fiind predictibile odata cu cresterea dozelor.
Dozele recomandate in retinita CMV la bolnavii cu SIDA sunt:
tratament de atac: 900 mg x 2/zi, timp de 21 de zile
tratament de intretinere : 900 mg x 1 /zi.
Dozele de V-GAN trebuie ajustate la pacientii cu insuficienta renala, in functie de clearance-ul la creatinina (tabelul XV)84, 85.
Tabelul XV. Ajustarea dozelor de valganciclovir in functie de clearance-ul la creatinina84,85.
|
Clearance-ul la creatinina (ml / min) |
Doza - tratament de atac |
Doza - tratament de intretinere |
|
Peste 60 |
900 mg x 2 / zi |
900 mg x 1 / zi |
|
450 mg x 2 / zi |
450 mg x 1 / zi |
|
|
450 mg x 1 / zi |
450 mg la 2 zile |
|
|
450 mg la 2 zile |
450 mg x 2 / saptamana |
Sunt in desfasurare studii care evalueaza eficienta V-GAN asupra infectiilor CMV posttransplant, precum si asupra infectiei congenitale cu CMV.
b) Lobucavirul (LOB) este un analog nucleozidic de guanina, activ in vitro pe herpesvirusuri, HIV si VHB. Pe modele animale LOB este activ pe HSV, CMV si HBV14,46. In vitro, concentratia inhibitorie pentru CMV si VHB este de 0,5 mg/ml, in timp ce pentru HSV si VZV este de 0,01-0,02 mg/ml14. Citotoxicitatea apare in functie de tipul celulei la 8 mg/ml14.
Mecanism de actiune
LOB inhiba sinteza ADN-ului viral, actionand la nivelul ADN-pol virale. In celulele infectate cu HSV el sufera trei fosforilari, in timp ce in celulele infectate CMV si in celulele neinfectate concentratia LOB-TP este mult mai mica. LOB-TP este un inhibitor puternic al ADN-pol CMV si VHB. ADN-pol CMV are o afinitate mult mai mare fata de LOB-TP decat fata de substratul natural. ADN-pol celulara este inhibata numai de concentratii foarte mari ale LOB-TP.
LOB este mai putin activ asupra tulpinilor CMV GAN-rezistente si de 25 de ori mai putin activ asupra tulpinilor HSV TK-deficiente (rezistente la acyclovir).
Farmacocinetica
Biodisponibilitatea dupa administrarea orala este dependenta de doza, variind intre 25-40% pentru doze de 200 mg14. Ea scade la doze mai mari si nu este influentata de ingestia de alimente. Concentratia plasmatica maxima (0,3-0,6 mg/ml) apare la administrarea orala dupa doze de 200 mg14.
Dupa administrarea iv, T 1/2 plasmatic este de aproximativ 2 h. Peste 80% din LOB este regasit in urina sub forma nemetabolizata. Legarea de proteinele plasmatice este de 10%14.
T1/2 intracelular al LOB-TP este de peste 10 h 14.
Eficacitate clinica
In trialurile clinice efectuate pana acum, LOB s-a dovedit activ si eficient pe leziunile HSV orolabiale si genitale la imunocompetenti14,49. Este actualmente evaluat pentru CMV si VHB14.
S-a demonstrat ca administrarea de 200 - 400 mg LOB x 4/zi, po a condus la supresia viruriei CMV la pacientii cu infectie HIV14,47, dar sunt necesare studii aprofundate pentru evaluarea eficacitatii clinice.
Dupa un tratament po de 1 luna cu 200 mg LOB x 2-4 /zi s-a obtinut o scadere de 100 de ori nivelului plasmatic al ADN-VHB, care insa a revenit la nivelul de baza dupa intreruperea terapiei14,48. Sunt actualmente in desfasurare studii clinice de lunga durata.
Toxicitate
La animale, LOB este mutagenic si determina supresie medulara si degenerescenta testiculara. El nu pare teratogen la animale.
LOB administrat pe cale orala poate produce cefalee, insomnie si tulburari gastrointestinale. Nu s-au raportat efecte toxice de organ. Dupa administrarea iv s-au citat cresteri ale enzimelor de citoliza hepatica si neutropenie.
c) Moribavir (1263W94), produs al companiei GlaxoSmithKline, aflat in studii de faza IB si IIA este un derivat de benzimidazol, activ in vitro pe CMV si EBV. El blocheaza sinteza ADN viral prin inhibarea proteinkinazei virale UL97 si nu prin inhibarea ADN plomerazei virale. Studiile preclinice si clinice disponibile pana acum au aratat o buna disponibilitate orala (>50%), o importanta activitate anti-CMV, o penetrare redusa in SNC, un nivel inalt al legarii de proteinele serice si un bun profil de siguranta14. Se pare ca 1263W94 are o farmacocinetica lineara la un evantai mare al dozelor.
Nu se cunoaste mecanismul rezistentei la 1263W94, dar in mod cert este diferit de mecanismul rezistentei la GAN, motiv pentru care 1263W94 este o buna alternativa terpautica pentru pacientii cu infectii CMV rezistente la GAN.
In tabelul XVI. sunt prezentate comparativ caracteristicile principalelor antivirale cu actiune anti-CMV84.
Tabelul XVI. Caracteristicile principalelor substante cu actiune anti-CMV84
|
Ganciclovir |
Foscarnet |
Cidofovir |
1263W94 |
|
|
Inhiba sinteza ADN viral |
Da |
Da |
Da |
Da |
|
Inhiba ADN- polimeraza virala |
Da |
Da |
Da |
Nu |
|
Mecanismul rezistentei (mutatia) |
UL 97 ADN pol |
ADNpol |
ADNpol |
Necunoscut |
|
Spectrul antiviral |
Toate herpesvirusurile |
Toate herpesvirusurile |
Toate herpesvirusurile |
CMV EBV |
|
Activitatea anti-CMV in vitro: IC50(mM): tulpina AD169 IC50(mM): tulpina izolata in clinica |
Se mai afla in studii clinice inca 2 molecule anti-CMV: un produs al companiei Tularik si altul al companiei Pharmacia Upjon. Ambele sunt active atat pe CMV cat si pe alte herpesvirusuri.
7.2. Tratamentul retinitei CMV
Tratamentul retinitei CMV se bazeaza pe administrarea de antivirale. Utilizarea GAN si FOS iv a fost primul tratament utilizat si reprezinta inca tratamentul de referinta14. Ele au eficacitate comparabila. Au fost ulterior introduse noi forme de administrare pentru GAN (po si intravitrean) si noi substante active (cidofovir, formivirsen,valganciclovir).
Terapia retinitei CMV cuprinde obligatoriu o faza de atac, urmata de o terapie de intretinere cu durata indefinita.
7.2.1. Tratamentul de atac14 dureaza 3 saptamani si se poate face cu:
Ganciclovir iv: 7,5-15 mg/kg/zi, in 2-3 perfuzii iv lente (1h). Cea mai utilizata schema este: 5 mg / kg / 12 ore. Dupa un tratament de 3 saptamani se obtine cicatrizarea leziunilor in 85% din cazuri14. Evolutia favorabila este vizibila la FO dupa 10-14 zile. La 90% din pacienti viremia se negativeaza dupa 7-15 zile14. In absenta unei terapii de intretinere recaderile apar in medie dupa 7 saptamani la majorotatea pacientilor HIV pozitivi14.
Foscarnet iv: 60 mg / kg / 8 ore, in PEV lente (90-120 min) cu 1 litru de ser fiziologic14. Aproximativ 90% din retinitele CMV tratate cu FOS se cicatrizeaza dupa 14-21 zile. Studiile comparative cu GAN arata o eficienta similara in vindecarea leziunilor retiniene la pacientii HIV pozitivi. FOS se pare ca prelungeste mai mult durata de supravietuire a pacientilor HIV pozitivi, cu toate ca efectele toxice care impun schimabarea terapiei anti-CMV sunt de 3 ori mai frecvente la FOS14. Exista 2 ipoteze care pot explica pelungirea duratei de supravietuire la pacientii tratati cu FOS: efectul antiretroviral al FOS si absenta toxicitatii hematologice care permite mentinerea terapiei cu zidovudina33.
Biterapia GAN iv (5 mg / kg / zi) + FOS iv ( 90 mg / kg / zi) este superioara monoterapiei si poate fi utilizata in caz de esec la monoterapie si in cazul recaderilor. Biterapia este mai putin toxica decat monoterapia pentru ca se pot utiliza doze mai mici din fiecare substanta. Ea mai are avantajul ca scade riscul selectarii de tulpini CMV rezistente33.
GAN injectii intravitreene: 400 mg x 2 / saptamana, pana la cicatrizare. Cu 1 ora inaintea injectiei intraoculare se administreaza 1 comprimat de acetazolamida pentru a preveni hipertonia oculara. Injectia se face in conditii de asepsie riguroasa dupa o anestezie locala topica. Doza de 200-400 mg / saptamana se dizolva in 0,05 cm3 de ser fiziologic si se injecteaza in partea plana a ochiului cu un ac de 30 G33.
Cidofovir iv: 5 mg / kg / saptamana timp de 2 saptamani in asociere cu probenecid 2 g inainte de fiecare administrare.
Valganciclovir : 900 mg x 2/zi, timp de 21 de zile
La pacientii fara neutropenie, majoritatea clinicienilor prefera GAN iv in tratamentul de atac al retinitei CMV pentru ca il considera mai bine tolerat si mai ieftin14.
7.2.2. Tratamentul de intretinere dureaza toata viata si se poate face cu:
FOS sau GAN iv, dozele zilnice fiind jumatate din dozele de atac, intr-o singura priza / zi. Doza de GAN este de 5 mg / kg / zi, iar cea de FOS este de 90 mg / kg / zi. Pentru GAN se mai poate utliza schema terapeutica: 6 mg/kg x 5 zile / saptamana50.
GAN in injectie intravitreana mg / saptamana este eficient, dar nu previne alte afectari viscerale CMV. Toleranta este buna, iar complicatiile sunt rare. Decolarea de retina si atrofia optica observata in 8% din cazuri par mai de graba complicatii ale retinitei decat ale injectiilor intravitreene33. Riscul de endoftalmie creste odata cu durata tratamentului. Aceasta cale de administrare este foarte utila la pacientii cu insuficienta renala sau agranulocitoza, la pacientii ale caror vene sunt compromise si la cei care refuza tratamentul general.
GAN dispozitiv intravitrean (Vitrasert), care se monteaza chirurgical si nu afecteaza vederea. El elibereaza 1mg GAN /1h, realizand concentratii intravitreale mari timp de 8-10 luni. In USA, s-au introdus recent dispozitive noi care elibereaza GAN timp de 2 ani14. Eficienta in prevenirea recaderilor este similara cu a GAN iv, dar nu previne aparitia altor afectari viscerale CMV14. Unele studii arata ca dispozitivele intravitreene cu GAN au eficienta mai mare decat GAN iv33. Nu exista diferente in durata de supravietuire a bolnavilor intre pacientii tratati cu GAN iv si pacientii tratati cu GAN intravitrean. Riscul de retinita CMV la ochiul contralateral este insa mai mare pentru dispozitivele intravitreene (40%) fata de administrarea iv (16%). Efectele secundare ale dispozitivului intravitrean sunt: hemoragii intravitreene fara gravitate, decolare de retina (18%) si endoftalmie.
Interventia chirurgicala de implantare a dispozitivului presupune urmatorii timpi: anestezie locala peribulbara, dezinsertia conjunctivei temporale inferioare, hemostaza sclerei, incizie transfixianta de 6 mm pe partea plana la 4 mm de limb, controlarea deschiderii coroidei pe toata lungimea sa, excizarea vitrosului prolabat, implantarea si apoi fixarea dispozitivului la marginile sclerei si suturarea inciziei33. Din pacate costul implantului si al interventiei chirurgicale depaseste 4.000 $50.
GAN po 1g x 3 / zi are eficienta similara cu GAN iv in prevenirea recaderilor.
Cidofovir iv: 5 mg / kg / la 2 saptamani
Formivirsen intravitreal mg la fiecare 2 saptamani
Valganciclovir po: 900 mg x 1 / zi
GAN si FOS administrate iv au toxicitate mare, dar au avantajul ca asigura concomitent profilaxia infectiilor CMV extraoculare. GAN administrat intravitrean este lipsit de toxicitate sistemica, dar nu previne afectarea celuilat ochi si nici infectia CMV extraoculara. GAN po reprezinta o buna alternativa pentru tratamentul de intretinere, avand eficacitate egala cu celelalte alternative si scazand riscul toxicitatii sistemice cu 40%14. Un alt avantaj al administrarii GAN po este acela ca asigura concomitent profilaxia sarcomului Kaposi14. El nu este insa avizat pentru tratamentul de atac al retinitei CMV.
FOS este mult mai rar utilizat in injectii intravitreene. Doza este de 2.400 mg si se injecteaza in acelasi mod si ritm ca si GAN33.
In retinita CMV, eficacitatea V-GAN po este similara cu cea a GAN iv.
Posibilitatea intreruperii terapiei anti-CMV de intretinere atunci cand pacientul are sub HAART un raspuns virusologic si imunologic sustinut ramane o problema controversata. Unii specialisti sustin ca terapia de intretinere nu trebuie intrerupta, deoarece un raspuns imunologic si virusologic sustinut nu protejaza complet impotriva recaderilor retinitei CMV84. Alti autori sustin ca terapia de intretinere poate fi intrerupta atunci cand pacientul aflat sub HAART are de peste 6 luni incarcatura virala nedectabila si CD4 > 150 / mm3. Ei considera ca recaderile retinitei CMV la acesti pacienti se datoreaza unor deficiente in HAART, cauzate in majoritatea cazurilor de non-complianta bolnavilor. Nu exista insa recomandari ferme si standardizate pentru intreruperea terapiei anti-CMV. Decizia de intrerupere a terapiei trebuie luata in urma unui consult interdisplinar (oftalmolog, infectionist, virusolog, imunolog)84,85.
7.3. Tratamentul afectarilor neurologice CMV
Nu exista un tratament standardizat32,50,52.
Monoterapia cu GAN este deceptionanta in afectarile neurologice CMV, datorita penetrarii reduse a acestuia in LCR si SNC14. De aceea pentru poliradiculopatia si encefalita CMV care survin in infectia HIV se recomanda biterapie precoce cu GAN si FOS iv14. Dozele sunt similare cu cele recomadate la retinita.
7.4. Tratamentul afectarilor digestive CMV
Pentru esofagita si colita CMV se recomanda GAN sau FOS iv in doze similare cu cele de la retinita, timp de 3 saptamani32,50,52.
Un studiu controlat-placebo efectuat pe pacienti seropozitivi HIV in 1986 a demonstrat ca GAN iv (5mg/kg x 14 zile) amelioreaza net vindecarea leziunilor ulcerative la 23% din pacienti, fata de 9% in grupul placebo (p=0,03), stabilizeaza greutatea bolnavilor, negativeaza culturile, dar nu influenteaza simptomatologia clinica. Diareea a persistat pana la sfarsitul tratamentului atat in grupul placebo, cat si in cel tratat cu GAN iv. Aceste rezultate sugereaza ca durata tratamentului ar fi prea mica sau ca este nevoie de un tratament de intretinere.14 De aceea unii autori recomanda ca tratamentul sa dureze 3-6 saptamani in functie de evolutia clinica.
Pentru hepatita CMV nu exista un tratament standardizat.
7.5. Tratamentul pneumoniei CMV
La pacientii HIV pozitivi cu pneumonie CMV administrarea de GAN sau FOS iv este eficienta14.
La pacientii tranplantati medular cu pneumonii CMV terapia cu GAN iv asociata sau nu cu corticoterapie are un beneficiu virusologic, dar nu reduce mortalitatea. Asociera GAN iv cu imunoglobuline specifice anti-CMV scade mortalitatea de la 80-90% la 30-50%14.
FOS nu pare eficace in terapia pneumoniei CMV la pacientii grefati medular14.
Schema terapeutica recomandata in USA este50:
Initial: GAN 2,5 mg /kg / 8ore x 20 zile + imunoglobuline anti-CMV 500 mg/kg/zi x 10 doze
Apoi: GAN 5mg / kg / zi x 3-5 / saptmana, pana la 20 de doze + imunoglobuline anti-CMV 500 mg / kg x 2 / saptamana, pana la un total de 8 doze.
8. Profilaxie
8.1. Profilaxia infectiei CMV dupa transplante de organe
Recentele progrese inregistrate in domeniul diagnosticului si terapiei infectiei CMV au condus la scaderea morbiditatii si mortalitatii asociate transplantelor medulare (TM) si de organe solide (TOS). Simptomatologia clinca si prevalenta afectarilor viscerale CMV post-transplant variaza in functie de tipul organului transplantat si intensitatea imunosupresiei.
Terapia imunosupresoare joaca un rol important in reactivarea CMV. Ciclofosfamida si azathioprina sunt suficiente pentru a reactiva CMV. Corticoizii in monoterapie sunt incapabili de a reactiva CMV, dar ei au efect sinergic cu restul agentilor chimioterapici. Tacrolimusul si ciclosporina in monoterapie nu cresc riscul de infectie CMV. Noile regimuri imunosupresive cresc frecventa si gravitatea infectiilor CMV. Dintre acestea trebuie amintite OKT3 (utilizat in rejetul acut de grefa hepatica) si anticorpii antilimfocitari14.
Profilaxia infectiei CMV post-transplant reprezinta azi o mare prioritate si se bazeaza in primul rand pe chimioprofilaxia antivirala. Chimioprofilaxia cu GAN, AV si valaciclovir (VAL) reduce semnificativ frecventa infectiei CMV si a afectarilor viscerale CMV post-transplant. Utilizarea pe termen lung a GAN si FOS este eficienta, dar dificila din cauza toxicitatii si ricului selectarii de tulpini virale rezistente. In ultimii ani s-a autorizat utilizarea AV si VAL in profilaxia infectiei CMV post-transplant. Acestea au eficienta comparabila cu GAN si FOS, sunt lipsite de toxicitate si sunt mai bine tolerate. CMV poseda o enzima (fosfotransferaza UL97) similara timidinkinazei virusurilor HSV si VZV, capabila sa fosforileze AV, ceea ce face ca CMV sa fie sensibil la AV. IC50 pentru CMV este mai mare decat pentru HSV si VZV, fiind deci necesare doze mai mari. VAL are biodiponibilitate superioara AV si realizeaza concentratii plasmatice mai mari, fiind azi considerat unul dintre antiviralele de prima intentie in profilaxia infectiei CMV post-transplant.
8.1.1. Strategii de profilaxie a infectiei CMV post-transplant
Exista actualmente 2 strategii de prevenire a infectiei CMV post-transplant: profilaxia "oarba" si profilaxia tintita ("pre-emptive therapy"), ultima fiind relativ recent introdusa.
Profilaxia "oarba" consta in aplicarea masurilor preventive la toti pacientii transplantati, in speranta ca cei care ar urma sa dezvolte o infectie CMV nu o vor mai dezvolta. Numarul pacientilor tratati "pentru nimic" va fi mare, fapt care antreneaza o crestere importanta a costurilor globale ale transplantului28,29.
Profilaxia tintita consta in instituirea terapiei antivirale in momentul decelarii infectiei CMV, inainte de aparitia simptomelor clinice. Ea impune definirea prealabila a grupului de pacienti cu risc mare de infectie CMV si aplicarea masurilor profilactice numai acestora. In acest caz se amelioreaza raportul cost-eficienta, dar apare riscul ca unii pacienti la risc sa nu fie inclusi in profilaxia tintita si sa faca totusi boala28,29. Profilaxia tintita presupune accesul la tehnici performante de diagnostic virusologic (antigenemie pp65 sau PCR) pentru a putea diagnostica cat mai precoce infectia CMV.
Actualmente sunt utilizate ambele strategii deoarece nu se poate inca spune cu certitudine care este mai corecta. Se afla in desfasurare numeroase studii clinice care compara eficienta, toleranta si costul celor doua strategii de profilaxie a infectiei CMV post-transplant. Nu exista inca niste protocoale foarte bine definite pentru chioprofilaxia infectiei CMV post-transplant.
a) Profilaxia "oarba" are la dispozitie mai multe mijloace preventive:
Prevenirea transmiterii CMV la pacientul transplantat prin utilizarea de grefe de organe, sange si derivate de sange provenite numai de la donatori seronegativi CMV. Aceasta masura este foarte eficienta dar din pacate putin utilizabila din cauza penuriei de organe disponibile pentru transplante29. Riscul de transmitere prin sange si derivate de sange este mic pentru tansplantul renal, fiind insa mult mai mre pentru cel hepatic si pulmonar. Acest risc poate fi usor inlaturat prin utilizarea de sange si derivate provenite de la donatori seronegativi.
Evitarea supra-imunosupresiei prin limitarea utilizarii anticorpilor antilimfocitari.
Interferonul a nu mai este actualmente utilizat, pe de o parte din cauza eficientei limitate si pe de alta parte din cauza inducerii unor insuficiente renale acute ireversibile la pacientii cu grefe renale29.
Vaccinul anti-CMV nu este inca disponibil. Studiile efectuate cu vaccinuri aflate in curs de evaluare au aratat ca ele nu previn aparitia afectarilor viscerale CMV, dar induc o scadere a gravitatii acestora29.
Gamaglobulinele standard sau specifice anti-CMV aduc un beneficiu pacientilor cu risc mare de infectie CMV cum ar fi primitorii seronegativi CMV care primesc grefe de la donatori seropozitivi CMV (P-/D+). Rezultatele sunt contradictorii, dar multe studii arata ca imunoglobulinele scad gravitatea si mortalitatea infectiilor CMV29.
Chimioprofilaxia antivirala a inlocuit multe din metodele preventive citate anterior datorita eficacitatii sale. Couchoud55 a efectuat un studiu amplu pe pacienti transplantati renal si a aratat ca indiferent de antiviralul folosit s-a obtinut o scadere semnificativa a frecventei infectiei CMV si a afectarilor viscerale CMV. Winston56 a demonstrat acelasi lucru la bolnavii transplantati hepatic, la care chimioprofilaxia cu GAN a condus la scaderea incidentei infectiei CMV de la 38% la 5% si a afectarilor viscerale CMV de la 10% la 0,8%. Gane57 a raportat eficacitatea GAN po timp de 90 zile, obiectivata prin scaderea incidentei infectiei CMV de la 51,5% la 24,5% si a afectarilor viscerale CMV de la 18,9% la 4,8%. El a aratat ca eficienta chimioprofilaxiei a fost semnificativ mai mare la pacientii cu risc mare de infectie CMV (P- / D+). Recent, Lowance58 a utilizat dupa grefele renale VAL po timp de 90 de zile si a raportat o scadere a afectarilor viscerale CMV (in special pentru P-/D+), care a fost de 45% in grupul placebo fata de 16% in grupul VAL.
b) Profilaxia tintita are urmatoarele indicatii: pacientii cu risc mare de infectie activa CMV,
pacientii care necesita intensificarea imunosupresiei din cauza iminentei unui rejet acut de grefa si pacientii cu risc de recadere a infectiei CMV.
Profilaxia tintita pentru pacientii cu risc mare de infectie activa CMV (P- / D+). Ea consta in efectuarea unei monitorizari virusologice pacientilor la risc si initierea terapiei anti-CMV atunci cand prima proba virusologica s-a pozitivat. Acest tip de preventie este foarte utilizat in practica cu toate ca el nu este inca foarte bine evaluat. Principala problema este reprezentata actualmente de definirea modalitatii optime de monitorizare virala si de necesitatea standardizarii tehnicilor existente, pentru a le putea compara intre ele. La ora actuala sunt acceptate doua tehnici de monitorizare virala: antigenemia pp65 si PCR. Aceasta din urma are urmatoarele avantaje: permite o detectie mai precoce si mai sensibila a infectiei; permite o cuantificare a incarcaturii virale in functie de care se poate aprecia gravitatea infectiei; permite genotiparea atunci cand se suspicioneaza tulpini virale rezistente. Tehnicile PCR disponibile actualmente pentru CMV sunt heterogene si in absenta unei standardizari ele nu pot fi comparate intre ele. In plus, din cauza costului ridicat ele nu sunt accesibile tuturor laboratoarelor.
Profilaxia tintita aplicata pacientilor cu rejet acut de grefa. Acesti pacienti necesita intensificarea imunosupresiei, fapt care creste riscul reactivarii CMV. Hibbert59 a aratat ca atunci cand un rejet acut de grefa este tratat cu muromonab-CD3, incidenta afectarilor viscerale CMV creste de la 21% la 59%. GAN iv administrat concomitent cu muromonab-CD3 face ca incidenta afectarilor viscerale CMV sa ramana 21% .
Profilaxia tintita a recaderilor CMV. Dupa un tratament curativ de 14-21 zile cu GAN iv recaderile sunt frecvente, ele finnd estimate la 20-40%29.
c) Semne de intrebare pentru viitor
Eficacitatea si larga utilizare a acestor mijloace de profilaxie ridica multe semne de intrebare pentru viitor.
Infectia CMV este in mod real periculoasa dupa transplante ?
Pentru transplantul cardiac si hepatic exista dovezi convingatoare in sprijinul ideii ca infectia CMV are o influenta nefasta asupra transplantului29. Pentru grefele renale exista pana acum date contradictorii. Poteil-Noble60 a demonstrat ca exista o relatie statistica intre infectia CMV si rejetul acut de grefa. Datele din Registrul Nord-American arata ca aceasta relatie este modesta dar totusi semnificativa: infectia CMV scade durata de supravietuire la 3 ani a grefonului cu 5%29. Akposso61 a tratat cu GAN iv timp de 14 zile toate infectiile CMV obiectivate prin pozitivarea antigenemiei pp65. El a raportat ca supravietuirea pe termen lung a bolnavilor si a grefelor a fost comparabia intre pacientii care nu au dezvoltat niciodata o infectie CMV si cei care au fost tratati preventiv. Argumentul cel mai important a fost adus de Lowance58 in 1999, care a aratat ca preventia infectiei CMV la paceintii la risc (P- / D+) a dus la scaderea semnificativa a incidentei rejetului acut al grefei. Sunt necesare studii suplimentare care sa clarifice rezultatele discordante de pana acum.
Care este raportul cost-eficienta al preventiei ?
Infectia CMV antreneaza o prelungire a duratei spitalizarii in primul an post-transplant, care la randul ei determina cresterea de 2,3 ori a costului global29. Conform datelor furnizate in 1999 de Societatea Americana de Transplant costul transplantarii pacientilor seronegativi CMV cu organe provenite de la donori seropozitivi este mult mai mare decat pentru celelalte categorii de transplant. La ora actuala exista putine studii asupra relatiei dintre strategiile de preventie CMV si costul global al transplantului.
Care este impactul chimioprofilaxiei asupra rezistentei CMV la antivirale ?
La ora actuala, in literatura exista putine date referitoare la acest subiect. Datele existente se refera la impactul chimioprofilaxiei asupra rezistentei CMV la pacientii imunodeprimati prin infectie HIV. La acestia, dupa 3 luni de tratament anti-CMV, procentul de tuplini CMV rezistente la GAN a ajuns la 5%, iar dupa 1 an la 20%29.
Se impune efectuarea de studii pentru evaluarea impactului chimioprofilaxiei CMV post-transplant asupra rezistentei CMV la antivirale.
8.1.2. Profilaxia infectiei CMV dupa transplantele medulare
a) Transplante medulare allogenice (heterotransplante)
Infectia CMV este cea mai frecventa complicatie infectioasa dupa transplantele medulare alogenice (TMA). In absenta terapiei antivirale 50% din pacientii cu culturi pozitive CMV vor dezvolta o boala CMV. Din pacate, chiar in prezenta unei chimioprofilaxii antivirale "oarbe" sau "tintite" 15-25% din pacienti vor face o infectie simptomatica CMV28. Manifestarile clinice CMV cele mai frecvent intalnite dupa TMA sunt: pneumonia interstitiala, esofagita, colita si hepatita. Au fost rareori raportate retinita, enecefalita sau sindromul de supresia medulara. Ultimele recomandari ale Societatii Americane de Transplant pentru tratamentul curativ al infectiei CMV dupa TMA sunt prezentate in tabelul XVII28.
Tabelul XVII. Tratmentul antiviral al infectiei si bolii CMV dupa transplantul medular allogenic28
|
Tipul infectiei CMV |
Tratament antiviral |
Durata terapiei |
|
Infectie CMV asimptomatica |
GAN iv: 5 mg / kg x 2 / zi sau FOS iv: 60 mg / kg x 2 / zi |
- Atac: 2 saptamani - Intretinere: ½ din doza de atac pana la negativarea markerilor virusologici (ADN-CMV sau antigenemiei pp65) |
|
Pneumonie interstitiala |
GAN iv: 5 mg /kg x 2 / zi + Gamaglobuline anti-CMV |
Atac: 6 sapt Intretinere: pana la negativarea markerilor virusologici |
|
Gastroenterita CMV |
GAN iv: 5 mg /kg x 2 / zi |
Idem |
|
Hepatita CMV |
GAN iv: 5 mg /kg x 2 / zi |
Idem |
|
Retinita CMV |
GAN iv: 5 mg /kg x 2 / zi sau FOS iv: 60 mg / kg x 2 / zi |
Idem |
|
Sindrom de aplazie medulara |
FOS iv: 60 mg / kg x 2 / zi + Factor de crestere leucocitara (G-CSF) |
4 saptamani |
Terapia combinata GAN + gamaglobuline anti-CMV a dus la scaderea semnificativa a mortalitatii precoce prin pneumonie interstitiala CMV de la 80-90% la 30-50%14. Din pacate supravietuirea pe termen lung este de numai 30%62.
Prevenirea infectarii cu CMV exogen a pacientilor seronegativi CMV se poate face prin folosirea de grefe medulare si derivate de sange provenite de la donatori seronergativi CMV.
Chimioprofilaxia "oarba" suprima replicarea CMV la pacientii seropozitivi si este foarte eficace in prevenirea afectarilor viscerale CMV.
Acyclovir (AV)
Un studiu efectuat de Grupul de Studiu European asupra Profilaxiei CMV a utilizat doze mari de AV iv (500 mg /m2 x 3 / zi) pana in ziua 30 post-transplant. S-a observat ca AV a condus la scaderea semnificativa a incidentei infectiei CMV (obiectivata prin viremie) sau la intarzierea acesteia, dar nu a influientat semnificativ incidenta infectiei simptomatice CMV. Prelungirea terapiei cu AV dupa ziua 30 post-transplant nu a condus la o scadere suplimentara a riscului de infectie CMV, dar a prelungit semnificativ supravietuirea bolnavilor. Aceasta amelioarare a supravietuirii bolnavilor a fost mai evidenta la grupul de pacienti tratati dupa ziua 30 cu doze mari de AV iv, fata de grupul celor care au primit AV po30,63.
Valaciclovir (VAL)
Un studiu randomizat, prospectiv a comparat eficienta in profilaxia CMV a VAL po (2g x 4 / zi) cu AV po (800mg x 4 /zi) la un lot de 700 de bolnavi cu TMA. Tratamentul a inceput in ziua 29 post-transplant. S-a observat ca VAL a intarziat semnificativ mai mult decat AV aparitia viremiei sau viruriei CMV. Rata de aparitie a afectarilor viscerale CMV si supravietuirea pacientilor au fost similare in cele 2 grupuri64.
Ganciclovir (GAN)
Eficienta profilaxiei CMV cu GAN iv pana in ziua 100 post-transplant a fost evaluata prin mai multe studii. Toate au aratat ca GAN iv reduce semnificativ incidenta infectiei CMV si mai putin pe cea a afectarilor viscerale CMV dupa TMA28. Insa aceste rezultate au fost obtinute cu pretul aparitiei efectelor toxice, dintre care mai frecventa a fost neutropenia. Aceasta favorizeaza aparitia infectiilor bacteriene secundare.
Foscarnet (FOS)
Studiile efectuate cu FOS iv 60 mg / kg x 2 / zi au aratat ca efectul profilactic asupra infectiei CMV este mai mic decat al GAN iv, in schimb toxicitatea a fost mai rar raportata28.
Chimioprofilaxia tintita (Pre-emptive antiviral therapy)
Recent introdusa, chimioprofilaxia tintita recomanda administrarea terapiei antivirale numai pacientilor care au o infectie activa CMV si care au deci risc major sa dezvolte o afectare viscerala CMV.
Identificarea candidatilor pentru acest tip de terapie se poate face prin urmatoarele tehnici: culturi virale, PCR pentru identificarea ADN-CMV in leucocite sau plasma si determinarea antigenemiei pp65. Initierea rapida a terapiei anti-CMV este esentiala, deoarece virusul se replica extrem de rapid in tesuturile umane. Prin urmare este nevoie de o decelare cat mai precoce a markerilor de replicare virala. Actualmente sunt acceptate pentru screeningul virusologic al acestor pacienti numai PCR si antigenemia pp65, deoarece culturile celulare ofera rezultate tardive. Se recomanda ca aceste teste sa fie efectuate saptamanal in primele 3 luni dupa transplant pentru a surprinde cat mai devreme pozitivarea lor.
Un studiu care a comparat sensibilitatea culturii si a PCR in screeningul pacientilor cu TMA pentru terapia tintita a demonstrat superioritatea neta a tehnicii PCR28. De asemenea s-a observat ca in grupul PCR a scazut incidenta afectarilor viscerale CMV si mortalitatea indusa de CMV, iar durata terapiei antivirale a fost semnificativ mai mica. Supravietuirea globala dupa 100 si 180 de zile de la transplant a fost semnificativ mai mare in grupul PCR. Aceste rezultate au fost confirmate intr-un studiu retrospectiv recent, care a aratat ca ghidarea terapiei tintite cu ajutorul PCR a condus la scaderea semnificativa a incidentei infectiei simptomatice CMV, a mortalitatii induse de CMV, precum si a mortalitatii globale post-transplant65.
Tehnicile cantitative de PCR, care determina incarcatura virala sunt cele mai utile pentru initierea rapida si monitorizarea raspunsului la terapia antivirala. Astfel, terapia antivirala trebuie initiata atunci cand incarcatura virala in ser depasesete pragul de detectie pentru TM, sau atunci cand este cuprinsa intre 1.000-5.000 copii ADN /ml pentru TOS30. Cele mai utilizate teste de PCR cantitativ sunt "Amplicor CMV monitor test".
Oprirea terapiei antivirale se face numai atunci cand PCR s-a negativat. Prelungirea terapiei sau subdozarea acesteia reprezinta factori de risc pentru selectarea de tulpini rezistente.
Pragul antigenemiei pp65 care indica initierea rapida a terapiei antivirale este de numai 1-2 celule pozitive / 2x105 celule pentru TM si de 10 celule pozitive / 2x105 celule pentru TOS 30.
Actualmente se recomanda ca pre-emptive terapy sa fie aplicata numai in spitalele ale caror laboratoare pot asigura monitorizarea virala prin PCR sau antigenemia pp65. Atunci cand aceste tehnici nu sunt disponibile trebuie sa se apeleze la profilaxia antivirala "oarba".
Ganciclovir (GAN)
Terapia tintita ghidata dupa antigenemia pp65 a fost comparata cu chimioprofilaxia "oarba" efectuata pana in ziua 100 post-transplant. In ambele cazuri s-a folosit GAN. S-a observat ca mai multi pacienti din grupul terapiei tintite ghidate dupa antigenemia pp65 au dezvoltat o infectie simptomatica CMV inainte de ziua 100 post-transplant (15% versus 2,7%)66. Dintre pacientii cu nivel redus al antigenemiei pp65 au evoluat catre o infectie simptomatica CMV numai cei care au dezvoltat o reactie a grefei contra gazdei. Rata aparitiei infectiei simptomatice CMV, mortalitatea indusa de CMV, supravietuirea globala si neutropenia indusa de GAN au fost similare intre cele doua grupuri in ziua 180 post-transplant66.
Initierea terapiei cu GAN iv in momentul in care apare o cultura pozitiva cu CMV din sange, urina, exudat faringian sau lavaj bronhiolo-alveolar a fost evaluata prin 2 studii28.
In primul studiu s-a administrat GAN iv astfel: in prima saptamana doza a fost de 5 mg / kg x 2/zi; din saptamana 2 pana in ziua 100 doza a fost de 5 mg / kg x 1 / zi.
In al doilea studiu schema terapeutica a fost: in primele 2 saptamani 5 mg / kg x 2/zi; din saptamana 2 pana in ziua 100 doza a fost de 5 mg /kg/zi x 5 zile / saptamana.
In ambele studii terapia tintita cu GAN iv a redus incidenta afectarilor viscerale CMV si a scazut mortalitatea globala post-transplant. Dar 12-13% din pacienti au prezentat o afectare viscerala CMV inainte sau concomitent cu pozitivarea culturilor, fapt care a condus la o mortalitate de 10% prin infectie CMV.
Actualmente se considera ca terapia tintita cu GAN, ghidata dupa PCR sau antigenemia pp65 previne majoritatea cazurilor de infectie simptomatica CMV aparute inainte de ziua 100 post-transplant. Se asigura concomitent si o scadere a riscului de infectii fungice30.
Foscarnet (FOS)
A fost comparata eficacitatea terapiei tintite cu GAN iv si FOS iv printr-un studiu prospectiv randomizat. Eficacitatea a fost similara in cele doua grupuri si nu s-a remarcat o crestere a nefrotoxicitatii in grupul tratat cu FOS67.
Imunizarea pasiva cu imunoglobuline specifice anti-CMV
Eficacitatea imunoglobulinelor in prevenirea infectiei CMV dupa TMA este controversata. O ampla meta-analiza68 a aratat ca imunizarea pasiva permite reducerea ratei infectiei CMV si a pneumoniei CMV, dar alte studii controlate nu au confirmat aceste rezultate69. Avand in vedere costul ridicat si eficacitatea discutabila a imunoglobulinelor anti-CMV, nu este recomandata utilizarea lor in monoterapie pentru profilaxia infectiei CMV dupa TMA. Ele pot fi recomandate ca adjuvante ale profilaxiei antivirale.
b) Transplante medulare autologe (autotransplante medulare)
Incidenta infectiei CMV dupa autotransplante medulare este mai mica decat dupa TMA, dar rata mortalitatii prin pneumonie CMV ramane similara28. Pana acum nu s-a gasit o schema de chimioprofilaxie eficienta a infectiei CMV la autogrefatii seropozitivi CMV. Utilizarea dozelor mari de AV iv nu s-a dovedit eficienta.
Culturile nu se pozitiveaza intotdeauna inaintea debutului unei afectari viscerale CMV. Recent au fost evaluate antigenemia pp65 si PCR ca metode de screening. Un studiu prospectiv efectuat pe 67 pacienti autogrefati medular a aratat ca 39% din pacienti aveau antigemnemia pp65 pozitiva. Nivelul redus al antigenemiei nu s-a asociat cu o boala CMV, in timp ce 2 din cei 7 pacienti cu nivel inalt al antigenemiei (peste 5 celule pozitive) au dezvoltat o pneumonie fatala70.
Utilizarea PCR pentru screeningul a 98 pacienti autogrefati medular a demonstrat o rata a infectiei CMV similara cu cei la care screeningul s-a efectuat cu antigenemia pp65 (40%)71. Un nivel redus al ADN viral plasmatic (1-10 copii ADN-CMV/ml) nu se asociaza cu o boala CMV, in timp ce 30% din bolnavii care au > 2 determinari PCR pozitive vor dezvolta o boala CMV.
In concluzie, dupa autogrefele medulare nu pare sa fie nevoie de o chimioprofilaxie anti-CMV28.
8.1.3. Profilaxia infectiei CMV dupa transplante de organe solide
Infectia CMV este frecvent intalnita dupa transplantele de organe solide (TOS) allogenice, dar spre deosebire de cele medulare, ea are un prognostic favorabil in majoritatea cazurilor28. Incidenta infectie active CMV dupa TOS variaza intre 30-50% in functie de serostatutul CMV al donatorului si primitorului de organ si de intensitatea terapiei imunosupresoare28. Principalii factori de risc pentru infectia CMV dupa TOS sunt: grefarea unui organ provenit de la un donator seropozitiv CMV la un primitor seronegativ; folosirea in terapia imunosupresoare a anticorpilor anti-limfocitari; transplantul hepatic, pulmonar sau cardiac28.
Infectia simptomatica CMV survine de obicei in primele 4 luni dupa transplant, afecteaza in special organele grefate, astfel incat pneumonia si determinarile gastrointestionale sunt mai rar intalnite decat dupa transplantele medulare.
Necesitatea chimioprofilaxiei anti-CMV dupa TOS este inca o problema controversata din cauza faptului ca mortalitatea indusa de CMV dupa TOS este redusa. Insa aparitia unei infectii CMV simptomatice creste costul global al transplantului, motiv pentru care au fost evaluate mai multe strategii profilactice.
a) Chimioprofilaxia "oarba" anti-CMV
Acyclovir (AV)
Adminsitrarea de doze mari de AV po timp de 12 saptamani dupa transplantul renal conduce la o scadere semnificativa a infectiei simptomatice CMV atat la pacientii seronegativi CMV cu donori seropozitivi cat si la pacientii seropozitivi CMV. Aceasta schema profilactica nu a influientat insa supravietuirea la 1 an28,30.
Valaciclovir (VAL)
Lowance a utilizat VAL po 2g x 4 / zi, care a redus semnificativ infectia simptomatica CMV dupa transplantul renal73. Beneficiul este semnificativ mai mare dupa VAL decat dupa AV. Dintre primitorii seronegativi CMV care au primit organe de la donatori seropozitivi, incidenta infectiei simptomatice CMV la 90 de zile dupa transplant a fost 45% la pacientii din grupul placebo si 3% la pacientii din grupul VAL. La primitorii seropozitivi CMV aceste procente au fost 6% la grupul placebo si 0% la grupul VAL. La 6 luni, incidenta infectiei simptomatice CMV a fost de 45% la seronegativii din grupul placebo si 16% la cei din grupul VAL. S-a mai remarcat ca numarul de biopsii efectuate pentru suspiciuni de rejet acut al grefei a fost semnificativ mai mare la seronegativii din grupul placebo (52%) fata de seronegativii din grupul VAL (26%). Se stie ca VAL nu are efect imunomodulator si prin urmare aceasta reducere a ratei de rejet acut a grefei este probabil datorata impiedicarii aparitiei infectiei CMV de catre VAL. Pe langa reducerea incidentei infectiei CMV, VAL asigura si profilaxia infectiei HSV si VZV, precum si a infectiilor bacteriale si fungice favorizate de infectia CMV30. Astfel incidenta infectiei HSV la 6 luni a fost de 9% la pacientii din grupul VAL versus 24% la grupul placebo. Incidenta infectiilor cu Candida a fost de 10% in grupul VAL versus 22% in grupul placebo, iar a infectiilor stafilococice de 12% in grupul VAL versus 21% in grupul placebo73.
Ganciclovir (GAN)
Comparativ cu AV iv in doze mari, GAN iv administrat din ziua transplantului pana in ziua 100 dupa transplant a redus semnificativ rata infectiei CMV dupa transplantul hepatic28.
GAN iv administrat 4 saptamani dupa transplantul cardiac a condus la scaderea incidentei infectiei simptomatice CMV la 120 zile post-transplant28. Dupa transplantele pulmonare GAN iv pare a avea acelasi efect benefic, insa in acest caz se pare ca GAN ar putea induce un sindrom bronsiolitic obliterant28. Impactul pozitiv al adminstrarii GAN iv asupra infectiei CMV este observat numai la seronegativii CMV care primesc organe de la seropozitivi.
Utilizarea GAN po timp de 3 luni dupa transplantele renale asigura o profilaxie eficienta a infectiei CMV la primitorii seronegativi cu donori seropozitivi74.
Profilaxia cu GAN iv reduce atat incidenta infectiei CMV, cat si a infectiei HSV dupa transplantele hepatice si cardiace30.
Utilizarea GAN iv timp de 14 zile si apoi a AV po pana in ziua 100 este mai eficienta in reducerea incidentei infectiei simptomatice CMV dupa transplantul hepatic decat administrarea de doze mari de AV po timp de 120 de zile30.
GAN po este mai eficient decat AV po in profilaxia infectiei simptomatice CMV dupa transplantele renale30. GAN reduce incidenta infectiilor fungice si scade viteza fenomenului de ateroscleroza dupa grefele cardiace30.
Indicatiile actuale ale Societatii Americane de Transplant pentru profilaxia "oarba" a infectiei CMV dupa TOS sunt. pacientii seronegativi CMV care primesc grefele de la donatori seropozitivi si pacientii seropozitivi CMV tratati cu agenti antilimfocitari
Nu exista niste scheme standardizate care sa defineasca antiviralul si dozele adecvate fiecarui tip de trasplant in parte.
b) Terapia antivirala tintita anti-CMV (pre-emptive antiviral therapy)
Terapia antivirala tintita dupa TOS nu a fost la fel de bine studiata ca cea de dupa TMA. Sunt necesare noi studii care sa compare chimioprofilaxia "oarba" cu terapia tintita din punct de vedere al eficientei, costului, impactului asupra rejetului acut al grefei si asupra rezistentei CMV la antivirale. Nu exista scheme standardizate de terapie tintita pentru profilaxia CMV dupa TOS.
Pacientii cu rejet acut al allo-grefei renale care nu raspund la corticoterapie necesita terapie cu anticorpi antitimocite. Aceasta terapie creste masiv riscul de infectie simptomatica CMV. La acesti pacienti, PCR si antigenemia pp65 s-au dovedit superioare culturii in diagnosticarea precoce a infectiei active CMV28. Curele scurte de terapie anti-CMV in timpul episoadelor de supra-imunosupresie reprezinta o alternativa mai putin costisitoare fata de profilaxia "oarba". Utilizarea tehnicilor de PCR cantitativ, care determina incarcatura virala CMV pot ghida cel mai bine diagnosticul si terapia infectiei simptomatice CMV la acesti pacienti.
c) Imunizarea pasiva cu imunoglobuline anti-CMV
S-a demonstrat ca administrarea imunoglobulinelor anti-CMV dupa transplantele renale conduce la reducerea incidentei si severitatii infectiilor simptomatice la seronegativii CMV care au primit rinichiul de la un donator seropozitiv28. Acelasi efect benefic a fost observat si dupa tansplantul hepatic. El nu a fost observat insa dupa transplantul de cord sau pulmon. Imunizarea pasiva nu a influentat pozitiv supravietuirea la 1 an si nici riscul de rejet acut al grefei28.
Prin urmare imunizarea pasiva nu trebuie utilizata in monoterapie pentru profilaxia infectiei CMV dupa TOS30.
d) Chimioprofilaxia anti-CMV si rejetul acut al grefei
Infectia CMV a organului grefat si rejetul acut al grefei sunt deseori greu de diferentiat. O meta-analiza a studiilor prospective randomizate care au comparat orice terapie anti-CMV profilactica cu placebo, la pacienti transplantati renal, hepatic si cardiac a aratat ca terapia anti-CMV nu are un efect profilactic asupra rejetului acut al grefei si nici nu scade mortalitatea asociata transplantului72. Prin urmare nu exista argumente care sa justifice utilizarea terapiei anti-CMV pentru profilaxia rejetului acut al grefei.
In concluzie se poate spune ca:
Atat terapia "oarba" cat si cea tintita conduc la scaderea semnificativa a mortalitatii dupa transplantele medulare allogenice.
Nu exista inca niste protocoale bine definite si standardizate pentru chimioprofilaxia post-transplant. Schemele folosite mai des in chimioprofilaxia "oarba" a infectiei CMV dupa transplante de rinichi, inima, pulmon sau cord, recomandate atunci cand donatorul este seropozitiv CMV iar primitorul seronegativ sunt:
Valacyclovir, po: 2000 mg x 4 / zi, 3 luni.
Acyclovir, po: 800 mg x 4 / zi, 3 luni
Acyclovir, iv: 500 mg /m2/ 8 ore, 30 zile; apoi acyclovir po: 200-400 mg x 4 / zi, 6 luni.
Ganciclovir iv: 5 mg/kgc x 2 / zi, 7 zile; apoi 5 mg/kgc x 1 / zi pana in ziua 100 post-transplant.
Dupa transplantele medulare schema de profilaxie oarba cea mai utilizata este: Ganciclovir iv: 5 mg/kgc x 2 / zi, 7 zile; apoi 5 mg/kgc x 1 / zi pana in ziua 100 post-transplant.
Dupa transplantul renal, dozele de AV si VAL trebuie ajustate dupa functia renala.
AV si VAL sunt foarte bine tolerate post-transplant. S-au citat insa cateva cazuri de micro-angiopatie trombotica la pacienti puternic imunodeprimati, care au primit doze de VAL mai mari de 8.000 mg/zi.
Terapia tintita are urmatoarele avantaje: stratifica pacientii in functie de factorii de risc; reduce numarul de pacienti tratati; scade durata terapiei antivirale; reduce costurile; scade riscul de toxicitate al antiviralelor; reduce riscul de selectare a tulpinilor CMV rezistente. Screningul virusologic al pacientilor pentru terapia tintita, bazat pe PCR si antigenemia pp65, este costisitor si nu este disponibil in toate laboratoarele. Nu exista protocoale bine definite si standardizate pentru terapia antivirala tintita.
8.2. Profilaxia infectiei CMV la pacientii seropozitivi HIV
8.2.1 Profilaxia primara consta in prevenirea aparitiei unor infectii oportuniste atunci cand numarul de limfocite CD4 a scazut sub un anumit nivel critic. Ea se realizeaza prin instituirea in scop profilactic a unei terapii etiologice specifice. Dupa introducerea profilaxiei primare pentru Pneumocystis carinii s-a observat o scadere a incidentei acestei infectii oportuniste, o reducere semnificativa a mortalitatii si o prelungire a duratei medii de supravietuire.
Actualmente sunt recomandate urmatoarele profilaxii primare50: Pneumocystis carinii (la CD4 < 200/mm3), Toxoplasma gondii (CD4 < 100/mm3), Mycobacterium avium intracelulare (CD4 < 50/mm3), Candida albicans si Criptococcus neoformans (CD4 < 50/mm3), CMV (CD4 < 50/ mm3).
Profilaxia primara pentru CMV se face numai la cei care poseda IgG anti-CMV. Se pot utiliza:
de prima intentie: GAN po: 1 g x 3 /zi
alternative: VAL po: 2g x 4 /zi
Profilaxia primara CMV nu este unanim acceptata. Unii autori considera ca ar fi mai corect ca terapia anti-CMV sa debuteze atunci cand se deceleaza o viremie pozitiva (pre-emptive terapy)50 sau atunci cand apar primele manifestari clinice ale bolii. Asta ar presupune insa accesul la tehnici de laborator performante (PCR) si la o monitorizare clinca atenta din care sa nu lipseasca controlul periodic al FO (la CD4 < 100/mm3).
Alti autori sustin ca profilaxia primara anti-CMV ar trebui sa dureze numai pana cand CD4 depasesete 100/mm3, cu conditia ca bolnavul sa urmeze o schema HAART eficace, care sa scada incarcatura HIV sub limita detectabilitatii50.
Alti autori nu sunt de acord cu utilizarea GAN po in profilaxia primara deoarece: favorizeaza aparitia rezistentei la GAN, are toxicitate importanta, cost ridicat si nu exista date care sa confirme eficienta GAN po in scop profilactic50.
Nu toti autorii sunt de acord cu utilizarea AV sau VAL in profilaxia primara a CMV. Ei considera ca AV nu este eficace pentru aceasta indicatie, iar VAL poate induce o crestere neexplicata a mortalitatii la pacientii HIV pozitivi, tratati cu VAL pentru profilaxia CMV.
8.2.2. Profilaxia secundara este sinonima cu terapia anti-CMV de intretinere care urmeaza terapiei de atac (a se revedea subcapitolul 7 - Tratament). Ea are ca obiectiv prevenirea recaderilor.
8.2.3. Impactul HAART asupra terapiei si profilaxiei infectiei CMV
Dupa introducerea HAART (Highly Active Antiretroviral Therapy) s-a constatat o scadere masiva a incidentei infectiilor oportuniste, inclusiv a afectarilor viscerale CMV. Acestea din urma au scazut cu peste 80%. Concomitent s-a observat ca daca in epoca pre-HAART retinita CMV anunta o durata de supravietuire redusa, dupa introducerea HAART retinita CMV si-a pierdut aceasta semnificatie negativa.
Un studiu retrospectiv efectuat la Royal Free Hospital din Londra, a aratat ca numarul anual al cazurilor noi de retinita CMV a crescut semnificativ intre 1991-1996, de la 5 la 30 de cazuri. Dupa 1996, odata cu introducerea HAART s-a constatat o scadere brusca a numarului anual al cazurilor noi: 7 cazuri in 1997 si cate 2 cazuri in 1998,1999 si 200019. Acest studiu a mai aratat ca durata medie de supravietuire a bolnavilor cu retinita CMV inainte de HAART era de 7,8 luni, in timp ce dupa introducerea HHART ea a crescut la 43,5 luni19. Aceeasi autori au descris cazuri in care retinita CMV s-a vindecat sub HAART chiar si in absenta terapiei specifice anti-CMV. Aceasta observatie concorda cu observatiile altor autori care arata ca sub HAART s-au obtinut ameliorari ale sarcomului Kaposi, leucoencefalitei multifocale progresive, criptosporidiozei si candidozei19.
De asemenea s-a constatat ca riscul de aparitie a retinitei CMV scade substantial dupa initierea HAART, chiar si la pacientii cu nivel foarte redus al limfocitelor CD4, cu conditia ca viremia CMV sa fie negativa19. Prin urmare ar fi util un screenig pentru viremia CMV in momentul initierii HAART. Atunci cand viremia CMV este pozitiva ar fi recomandat ca inaintea initierii HAART sa se inceapa terapia anti-CMV.
Toate aceste observatii au fost explicate prin fenomenul de restaurare imunologica secundara HAART. Acest fenomen are implicatii pozitive obiectivate prin scaderea incidentei infectiilor oportuniste si prin posibilitatea intreruperii profilaxiei primare sau secundare a unor astfel de infectii atunci cand numarul de limfocite CD4 a ajuns la un nivel confortabil. Restaurarea imunologica are in mod paradoxal si unele implicatii negative cum ar fi sindromul inflamator de restaurare imunologica.
a) "Fenomenul de restaurare imunologica sub HAART" consta in restaurarea raspunsul imun contra mai multor agenti patogeni, inlcusiv CMV. S-a observat ca la pacientii cu viremie CMV pozitiva la care s-a initiat HAART, viremia s-a negativat in absenta oricarei terapii specifice anti-CMV. Niciunul din acesti pacienti nu a dezvoltat o afectare viscerala CMV in pofida incarcaturii virale CMV mari la debutul HAART. Efectul protector anti-CMV al HAART se datoreaza suprimarii replicarii CMV ca urmare a restaurarii raspunsului imun anti-CMV19.
Restaurarea raspunsului imun celular anti-CMV
Componenta celulara a raspunsului imun este esentiala in apararea organismului contra CMV. Autran75 a aratat ca restaurarea raspunsului imun celular anti-CMV sub HAART parcurge 3 etape:
cresterea numarului de celule CD4 cu memorie, observat in primele 4 luni de HAART
reducerea reactivitatii limfocitelor T, care se coreleaza cu scaderea incarcaturii virale HIV. Concomitent se observa o crestere a reactivitatii limfocitelor T CD4 in a recunoaste si interactiona cu antigene, inclusiv antigenele CMV. Acest efect este maxim in luna 4 de HAART.
cresterea numarului de limfocite T CD4 naïve cu reconstituirea raspunsului imun, care se definitiveaza dupa luna 4 de HAART.
Succesul HAART depinde de gradul si durata supresiei replicarii HIV si mai putin de gradul imunosupresiei in momentul initierii HAART.
Restaurarea raspunsului imun umoral anti-CMV
Raspunsul imun umural anti-CMV este important in reducerea riscului de transmitere verticala si de diseminarea hematogena. Tinta majora a anticorpilor anti-CMV neutralizanti este reprezentata de glicoproteina B (gpB). La pacientii HIV pozitivi cu infectie simptomatica CMV s-a observat un nivel redus al anticorpilor anti-gpB, spre deosebire de pacientii fara infectie CMV. Un studiu recent efectuat pe pacienti cu viremie CMV pozitiva a aratat ca dupa initierea HAART are loc o crestere a titrului de anti-gpB cu 2 log / luna76. Aceasta se face in paralel cu scaderea incarcaturii virale CMV. Anticorpii anti-gpB sunt neutralizanti si protejaza impotriva aparitiei unei infectii simptomatice CMV.
b) "Sindromul inflamator de restaurare imunologica"
Dupa obtinerea restaurarii imunologice sub HAART s-a observat o crestere a incidentei unor complicatii inflamatorii rar intalnite in epoca pre-HAART. Cea mai frecvent raportata este o complicatie inflamatorie la nivelul ochiului, care duce la scaderea acuitatii vizuale in absenta unei boli retiniene active. Este vorba despre vitrita, care poate evolua catre edem macular cistoid si catre formarea unei membrane epiretineale19. Mecanismul aparitiei acestor fenomene inflamatorii este incomplet cunoscut. Este vorba probabil de reactia raspunsului imun restaurat contra unor antigene persistente in tesuturi.
Acest sindrom pare tranzitor, dar creeaza probleme de diagnostic si tratament. Aparitia lui impune instituirea corticoterapiei. Pentru prevenirea acestui sindrom, unii autori recomanda temporizarea initierii HAART, in scopul pretratarii corecte a infectiilor oportuniste intermitente.
c) Intreruperea profilaxiei primare sau secundare dupa restaurarea imunologica sub HAART
Intreruperea profilaxiei primare sau secundare pentru diferite infectii oportuniste dupa ce s-a obtinut restaurarea imunologica sub HAART este o alternativa tentanta din urmatoarele motive: reducerea numarului zilnic de tablete inghitite, care favorizeaza o mai buna aderenta la HAART; scaderea riscului de efecte adverse si de interactiuni medicamentoase; reducerea riscului de aparitie a unor tulpini rezistente; scaderea costului.
Intreruperea profilaxiei a fost facuta pana acum in cazuri selectionate pentru: Pneumocystis carinii, Mycobacterium avium, toxoplasma gondii, candida, criptococcus neoformans, HSV si VZV19.
Recent s-a efectuat un studiu pe 325 pacienti, care au intrerupt profilaxia secundara pentru Pneumocystis carinii atunci cand sub HAART numarul de CD4 a depasit 200 / mm3. Nu a aparut nici o recadere in urmatoarele 13 luni77. Aceasta sugereaza ca intreruperea profilaxiei primare sau secundare poate fi facuta fara riscuri in unele cazuri selectionate.
S-au efectuat pana acum 9 studii in care s-a intrerupt terapia de intretinere (profilaxia secundara) pentru retinita CMV atunci cand sub HAART numarul de CD4 a depasit 100/mm3. In total au fost 78 de pacienti, iar mediana duratei de supraveghere dupa oprirea terapiei a fost cuprinsa intre 5,2 - 22,5 luni. Nu s-a inregistrat nici o recadere a retinitei in acest interval. Pacientii au fost insa selectionati dupa anumite criterii, care trebuie respectate ori de cate ori se opteaza pentru intreruperea terapiei de intretinere. Acestea au fost: retinita vindecata; absenta tulburarilor de vedere; CD4 > 100 / mm3; incarcatura virala HIV si CMV nedetectabile; HAART stabila de peste 6 luni; accesul pacientului la control oftalmologic periodic. Decizia de intrerupere a terapiei de intretinere trebuie luata numai de comun acord cu specialistul oftalmolog.
Esecul virusologic si / sau imunologic al HAART poate fi datorat aparitiei tulpinilor HIV rezistente, lipsei de aderenta a pacientului sau aparitiei efectelor toxice. El poate surveni orcand si se manifesta pein reluarea replicarii HIV, prabusirea numarului de CD4 si reaparitia riscului de infectii oportuniste, inclusiv CMV. In aceste cazuri se impune reluarea profilaxiilor primare sau secundare atunci cand ele au fost intrerupte. Pentru CMV se recomanda reluarea terapiei anti-CMV de intretinere atunci cand CD4 a scazut sub 100 / mm3.
8.3. Profilaxia infectiei congenitale CMV
Pana acum nici o terapie anti-CMV nu s-a dovedit eficienta in prevenirea transmiterii infectiei CMV la fat si nici in diminuarea frecventei sau severitatii afectarilor viscerale fetale. In plus niciuna din substantele active pe CMV nu este avizata pentru a fi utilizata in sarcina, din cauza efectului teratogen observat la animale.
Actualmente nu exista un vaccin eficace anti-CMV si nici alte metode specifice eficiente pentru profilaxia infectiei CMV la gravida.
De aceea tinerele gravide trebuie sa respecte niste masuri profilactice nespecifice, in special la prima sarcina: evitarea contactului apropiat cu copiii mici; evitarea contactelor sexuale neprotejate si a partenerilor sexuali multipli; evitarea transfuziilor sau utilizarea de sange provenit de la donatori seronegativi CMV.
Screeningul serologic prenatal al gravidelor este util, dar din pacate atata vreme cat nu exsita metode terapeutice si profilactice eficiente, diagnosticarea unei infectii CMV la o gravida ramane fara finalitate terapeutica. Insa, in urma unui diagnostic corect al primoinfectiei materne, gravida poate opta pentru intreruperea sarcinii, in momentul in care se confirma afectarea fatului.
Se spera ca in viitor sa se gaseasca niste mijloace eficiente de profilaxie a infectiei congenitale CMV:
un vaccin eficace care sa previna infectia materna si implicit infectia congenitala.
noi substante antivirale care:
sa poata fi utilizate in sarcina, la gravidele cu primoinfectie CMV, in scopul prevenirii transmiterii CMV la fat.
sa poata fi utilizate prenatal pentru a trata fatul deja infectat
sa poata fi utilizate la nou nascutul cu infectie congenitala in scopul scaderii frecventei si severitatii afectarii neurologice.
IHMF (International Herpes Management Forum) a stabilit un protocol de diagnostic precoce si profilaxie a infectiei maternofetale CMV (figura 12)21,42. Din pacate el implica costuri ridicate si nu este utilizat sistematic nici in tarile cu nivel economic ridicat.
Fig. 12. Algoritm de de diagnostic precoce si profilaxie a infectiei maternofetale CMV21,42
Serologie CMV la gravida , in cursul primului control prenatal.
![]()
![]()
gravida seronegativa CMV= gravida seropozitiva CMV
![]()
![]() risc de
primoinfectie CMV
risc de
primoinfectie CMV
![]() in sarcina
in sarcina
IgG + / IgM - IgM+ / IgG+
![]()
![]() evitarea
contactului strins
evitarea
contactului strins
![]()
![]() cu copii mici /
contacte absenta riscului de cercetarea afinitatii IgG pt CMV
cu copii mici /
contacte absenta riscului de cercetarea afinitatii IgG pt CMV
![]() sexuale
protejate infectie fetala
sexuale
protejate infectie fetala
![]()
![]() supraveghere
serologica CMV afinitate
< 35% afinitate > 65%
supraveghere
serologica CMV afinitate
< 35% afinitate > 65%
![]() lunara
lunara
seroconversie in sarcina (IgM antiCMV) primoinfectie CMV recenta infectie CMV

![]()
![]() = primoinfectie
CMV veche
= primoinfectie
CMV veche
![]()

punctie amniotica la 4 sapt cautarea IgM anti-CMV in
de la seroconversie + efec- singele fetal
tuarea de culturi / PCR din
lichidul amniotic
![]()
culturi / PCR / IgM CMV pozitive culturi / PCR / IgM CMV negative
![]() = infecatrea fatului cu CMV
= infecatrea fatului cu CMV
![]()
efectuarea de ecografii si repetarea lor dupa 3-8 saptamini
RMN repetate pt surprinderea
aparitiei semnelor precoce de
![]()
![]() afectare SNC
intrauterina
afectare SNC
intrauterina
apritia de : absenta semneleor de
- oligoamnios afectare SNC intrauterina
![]() -
microcefalie
-
microcefalie
- calcificari cerebrale periventriculare
-polimicrogirie ( lissencefalie)
-atrofie cerebeloasa si corticala
![]() - calcificari
hepatice + ascita.
- calcificari
hepatice + ascita.
INTRERUPEREA SARCINII ? nastere naturala cu ex. clinic si
paraclinic atent ( eco+TC+RMN)
![]() TRATAMENT
ANTIVIRAL al
nou nascutului
TRATAMENT
ANTIVIRAL al
nou nascutului
CU GANCICLOVIR ?
nou-nascut asimptomatic CMV nou - nascut simptomatic CMV:
![]() la nastere hipotrofie,
hepatosplenomegalie,
la nastere hipotrofie,
hepatosplenomegalie,
icter, purpura, microcefalie, poli-
microgirie, atrofie cerebeloasa,
cautarea viruriei CMV la nou nascut calcificari cerebrale, corioretinita
![]()
![]()
DISPENSARIZARE PRELUNGITA: NEUROLOGICA
ORL, RADIOLOGICA, TC, RMN pentru surprinderea
aparitiei sechelelor neurosenzoriale
8.4. Vaccinuri anti-CMV
Au fost si sunt evaluate numeroase vaccinuri anti-CMV, dar niciunul nu este inca disponibil. Unele dintre vaccinurile studiate au fost incluse in studii preclinice si clinice.
Principalele indicatii ale unui viitor vaccin anti-CMV sunt21,78:
femeile tinere aflate la varsta procreerii in scopul prevenirii afectarilor neurologice fetale, datorate infectiei congenitale CMV
profilaxia infectiilor simptomatice CMV la imunodeprimati (post-transplant)
Unii autori sunt de parere ca o vaccinare universala a copiilor ar scadea mult circulatia virusului in natura si ar diminua riscul de contaminare a persoanelor cu risc de infectii severe (gravide, nou nascut, imunodeprimati)78.
Cercetatorii au rezerve asupra viitorului vaccinurilor anti-CMV, deoarece se stie ca imunitatea naturala obtinuta dupa o infectie CMV nu este capabila sa impiedice reactivarea sau reinfectia. Foarte probabil nici imunitatea post-vaccinala nu va preveni reactivarea sau reinfectia CMV. Insa este bine cunoscut faptul ca imunitatea anti-CMV preexistenta face ca reactivarile si reinfectiile sa aibe gravitate mai mica.
Studiile experimentale la animale au aratat ca tinta anticorpilor neutralizanti anti-CMV este reprezentata de glicoproteina anvelopei gpB. Atat imunizarea activa cat si cea pasiva bazate pe gpB au protejat animalele impotriva unei infectii fatale cu CMV21. Imunizarea femelei gestante de cobai cu anti-gpB a scazut rata de transmitere transplacentara a CMV21. Intelegerea rolului diferitelor proteine CMV a condus la studierea mai multor vaccinuri recombinante anti-CMV. Proteinele CMV imunogenice, care ar putea fi utilizate in sinteza vaccinurilor anti-CMV sunt descrise in tabelul XVIII21
Tabelul XVIII. Proteinele CMV imunogenice21
|
Proteina |
Descriere |
|
gpB |
Glicoproteina de anvelopa Tinta majora a anticorpilor neutralizanti |
|
gpH |
Glicoproteina de anvelopa Tinta secundara a anticorpilor neutralizanti |
|
pp65 |
Principala proteina a tegumentului |
|
pp28 |
Proteina a tegumentului |
|
pp150 |
Idem |
|
pp82 |
Proteina non-structurala Anticorpi de tip IgM |
|
pp72, pp89 |
Proteine foarte precoce (immediate early proteins) |
Au fost studiate pana acum 2 tipuri de vaccinuri: vaccinuri cu virus viu atenuat si vaccinuri recombinnante.
8.4.1. Vaccinuri cu virus viu atenuat
Vaccinurile cu virus viu atenuat studiate pana acum au fost testate pe voluntari sanatosi si pe pacienti cu grefe de organe solide (in special renale).
a) Vaccinarea adultilor sanatosi
Primul vaccin testat la om a fost un vaccin cu virus viu care continea tulpina CMV de laborator AD169. El a fost administrat la voluntari sanatosi. S-a observat ca 25 din cei 26 de voluntari care au primit subcutanat 10.000 TCID50 au facut serconversia CMV. Reactiile locale au fost frecvente, iar virusul vaccinal nu a fost izolat de la niciunul din cei testati. Acest vaccin a fost investigat numai prin studii de faza I.
Tulpina Towne a fost utilizata pentru sinteza unui vaccin cu virus viu atenuat. Aceasta tulpina a fost izolata in 1970 si poarta numele copilului infectat congenital de la care a fost obtinuta. Pentru a fi introdusa in vaccin ea a fost atenuata prin 125 pasaje pe fibroblaste umane WI-38. Acest vaccin a fost administrat pentru prima data in 1975 la subiecti sanatosi, care au dezvoltat anticorpi si proliferare limfocitara. Un numar mic din voluntarii care au primit acest vaccin au fost pusi apoi in contact cu tulpina CMV Toledo. Numai 1 din cei 7 voluntari care primisera anterior vaccinul a dezvoltat boala, in timp ce toti cei 4 voluntari martor nevaccinati (seonegativi CMV) au facut boala.
Un studiu recent efectuat cu vaccinul Towne in scopul prevenirii infectiei CMV la adultii pusi ulterior in contact cu copii exceretori salivari de CMV a aratat ca nu exista diferente semnificative in rata infectiei intre pacientii din grupul placebo si grupul celor vaccinati.
b) Vaccinarea bolnavilor cu transplante renale
Plotkin21 a studiat in 1991 efectul vaccinului Towne asupra pacientilor seronegativi CMV care au primit grefa renala de la un donator seropozitiv. Acestia au risc de infectie CMV post-transplant. Nu s-au gasit diferente semnificative in rata infectiei CMV intre grupul pacientilor vaccinati si grupul placebo. Totusi s-a observat ca gravitatea infectiilor CMV dezvoltate de cei care au primit vaccinul Towne a fost mult mai mica decat a celor care au primit placebo. In tabelul XIX este prezentata o sinteza a studiilor efectuate cu acest vaccin la pacientii grefati renal
Tabelul XIX Eficacitatea vaccinului viu atenuat anti-CMV Towne la grefatii renal seronegativi CMV21,80
|
Minneapolis |
Philadelphia |
San Diego |
||||
|
Placebo |
Vaccin |
Placebo |
Vaccin |
Placebo |
Vaccin |
|
|
Numar | ||||||
|
Infectie CMV |
NR |
|||||
|
Boala CMV | ||||||
|
Boala severa CMV | ||||||
Nu s-au observat efecte adverse majore. S-au citat cazuri de leucopenie, trombocitopenie si cresterea transaminazelor hepatice78.
Un alt studiu prospectiv si controlat-placebo a analizat 237 pacienti seronegativi CMV care au primit grefa renala de la donatori seropozitivi si care au fost vaccinati pre-transplant. Au aparut reactii locale minore la 75% din pacientii vaccinati. Rata infectiei CMV a fost similara in cele 2 grupuri de pacienti. Severitatea infectiilor simptomatice CMV a fost mai mica in grupul pacientilor vaccinati comparativ cu placebo. S-a mai observat ca virusul vaccinal nu a fost excretat de vaccinati, nu a devenit latent si nu a avut efect oncogenic.
Avand in vedere eficacitatea limitata a vaccinului la grefatii renali, precum si existenta altor mijloace de preventie eficiente (chimioprofilaxia, pre-emptive terapy, imunizarea pasiva), vaccinul viu atenuat Towne nu si-a gasit indicatia la acest grup de pacienti la risc. Astfel, viitorul vaccinului viu atenuat Towne este limitat.
Desi nu au existat date care sa arate ca tulpina CMV vaccinala se poate reactiva la persoana vaccinata imunodeprimata, cercetatorii si-au pus problema implicatiilor pe termen lung ale acestui vaccin asupra organismului.
8.4.2. Vaccinuri recombinante
Au fost studiate mai multe vaccinuri recombinante.
Unul se afla in curs de evaluare in SUA, fiind utilizat in studii de faza I si II. El este produs de Chiron Biocine si contine gpB numita si UL55, obtinuta prin recombinare. A fost utilizat pentru prima data la adulti in 1990, in 3 administrari intramusculare (0,1,6 luni) si s-a dovedit imunogenic si fara reactii adverse. Vaccinatii au dezvoltat anticorpi neutralizanti anti-gpB si proliferare limfocitara21.
Un alt vaccin recombinant aflat in evaluare contine glicoproteina gpH (UL57), proteina care poate induce anticorpi neutralizanti80.
Proteina pp65 (UL83) este tinta limfocitului T citotoxic si prin urmare poate fi utilizata in vaccinuri in scopul reducerii diseminarii virale dupa infectie si pentru prevenirea reactivarii80.
8.5. Imunoglobuline anti-CMV
Desi se stie ca imunitatea celulara are rolul esential in apararea anti-CMV s-a demonstrat ca si imunitatea umorala poate juca un rol important.
La animale s-a demonstrat ca imunizarea pasiva cu anticorpi neutralizanti anti-gpB previne infectia letala CMV. Aceasta a sugerat ca anticorpii anti-gpB ar putea avea un rol in tratamentul si profilaxia infectiilor CMV la imunodeprimati.
Unele studii au demonstrat ca administrarea de imunoglobuline anti-CMV la pacientii cu transplante de rinichi sau ficat a avut efecte benefice modeste, dar totusi semnificative statistic comparativ cu placebo. Acestea au constat in reducerea incidentei infectiei simptomatice CMV si a infectiilor fungice Efectele benefice au fost mai evidente la grefatii seronegativi cu donori seropozitivi.
Alte studii au aratat ca efectele benefice ale imunoglobulinelor anti-CMV sunt nesemnificative si ca ele nu ar trebui utilizate in monoterapie pentru profilaxia infectiei CMV dupa transplante de organe solide.
Dupa transplantele medulare nu s-au folosit imunoglobuline in monoterapie, motiv pentru care eficienta lor nu a putut fi evaluata corect. Totusi s-a observat ca utilizarea imunoglobulinelor iv a scazut incidenta reactiei grefa contra gazda, iar asocierea imunoglobulinelor cu terapia anti-CMV are efecte benefice in pneumonia CMV survenita dupa transplantele medulare..
8.6. Imunoterapia
S-au efectuat studii in care la pacientii cu grefe medulare s-au administrat iv limfocite TCD8 specifice anti-CMV provenite de la indivizi imunocompetenti seropozitivi CMV. Scopul acestor studii a fost reconstituirea raspunsului imun celular anti-CMV21. S-a considerat ca aceasta noua tentativa terapeutica numita "adoptive immunotherapy" ar fi utila in profilaxia infectiilor CMV care apar tardiv dupa transplant (dupa ziua 100). Chimioprofilaxia antivirala. asigura profilaxia acestor infectii pentru primele 100 de zile post-transplant. Riscul acestor infectii tardive dupa transplantele medulare este de 4% la pacientii care nu au primit GAN profilactic, dar ajunge la 20% la cei care au primit GAN21. Explicatia ar putea fi ca in timpul terapiei cu GAN, pacientii nu dezvolta un raspuns imun celular anti-CMV21. Mortalitatea acestor infectii tardive ajunge la 50%. Un alt factor de risc pentru infectia CMV tardiva este aparitia unei reactii acute sau cronice a grefei contra gazdei. Rezultatele obtinute cu "adoptive immunotherapy" sunt promitatoare, dar ridica inca multe probleme legate de compatibilitatea in sistemul HLA a limfocitelor exogene administrate si nu in ultimul rand probleme legate de cost. Deocamdata aceasta noua terapie nu figureaza in niciunul din protocoalele utilizate pentru profilaxia infectiei anti-CMV post-transplant medular.
Bibilografie
Jesinonek ADN Kiolemenouglou. Uber einen Befund von protozoen-artigen Gebilden in den organen eines hereditar luetischen fotus. Munch Med Wsc 1904; 51:1905-1907.
Tietze A. Ein protozoenbefund in einer erkrankten parotitis. Mitteilungen aus den Grenzgebieten der Medizin und Chirurgie. 1905;14:303-310.
Goodpasture EW, Talbot FB. Concerning the nature of protozoan-like cells in certain lesions in infancy. Am J Dis Children 1921; 21:415-425.
Cole R. A filterable virus present in the submaxillary glands of guinea pigs. J Exp Med 1926;44:855-873.
Weller TH. Cytomegaloviruses: a historical perspective. Herpes, vol 7, nr.3, oct 2000, pag 66-70.
Smith MG et al. Propagation of salivary gland virus of the mouse in tissue cultures. Proc Soc Exp Biol Med. 1954; 86: 435-440.
Smith MG. Propagation in tissue cultures of cytopathogenic virus from human salivary gland virus (SGV) disease. Proc Soc Exp Biol Med. 1956;92:424-430.
Weller TH et al. Isolation of intranuclear inclusion producing agents from infants with illnesses resembling cytomegalic inclusion disease. Proc Soc Exp Biol Med. 1957; 94:4-12.
Rowe WP et al. Cytopathogenic agent resembling human salivary gland virus recovered from tissue cultures of human adenoids. Proc Soc Exp Biol Med. 1956; 92: 418-424.
Weller TH et al. Serologic differentiation of viruses responsible for cytomegalic inclusion disease. Virology1960;12: 130-132.
Klemola E et al. Cytomegalovirus as a possible cause of a disease resembling infectious mononucleosis. Br Med J 1965;1099:102.
Winston DJ et al. Cytomegalovirus infections associated with leukocyte transfusions. Ann Intern Med. 1970;93: 671-675.
Roizman B. Herpesviridae. In: Fields BN, Knipe DM, Rowley RM, eds Fields Virology. 3rd ed. Philadelphia: Lippincott-Raven; 1996: 2221-2230.
Cydes S. Crumpacker. Chapter 127 - Cytomegalovirus. In Mandell LG, Benett JE si Dolin R - Principles ADN practice of infectious diseases, fifth edition, pag 1586-1599.
Michelson S. La latence et reactivation du cytomegalovirus humain. In La lettre de l'infectiologue de la microbiologie a la clinique. Hors serie fev 1995, pag 4-6. Symposium CMV, Jerez, Espagne, 17 sept 1994.
Michelsion S. Interactions entre le virus de l'immunodeficience humaine (VIH) et le cytomegalovirus humain (CMV). La lettre de l'infectiologue de la microbiologie a la clinique. Hors serie fev 1995, pag 6-8. Symposium CMV, Jerez, Espagne, 17 sept 1994.
He Z, He YS, Kim Y. The human cytomegalovirus UL97 is a proteinkinase that autophosphorylates on serines and thereonines. J Virol 1997;71:405-411.
Wood MJ, Conant MA. Interaction between HIV and Herpsviruses. In Recomandations from the IHMF Management Strategies in Herpes. Workshop and 2nd Annual Meeting, 1995, pag 3-13.
Deayton JR. Changing trends in cytomegalovirus disease in HIV-infected patients. Herpes, vol 8, nr 2, 2001, pag 37-40..
Sandstrom E, Whitley RJ. Implications for transmission of cytomegalovirus. In Recomandations from the IHMF Management Strategies in Herpes. Workshop and 3nd Annual Meeting, 1996, pag 6-12.
Griffith PD, Whitley RJ. The natural history and pathogenesis of CMV infections. In Recomandations from the IHMF Management Strategies in Herpes. Workshop and 4nd Annual Meeting, 1997, pag 4-15.
Chandler SH, Alexander ER. Epidemiology of CMV infection in heterogeneous population of pregnant women. J Inf Dis 152:249, 1985.
Demmler CJ: Summary of a workshop on surveillance for congenital cytomegalovirus disease. Rev. Infect Dis 13:315, 1991.
Mandell GL, Bennett JE, Dolin R. Diseases of reproductive organs and sexually transmeted disease; In Principles and Practice of Infectious Diseases, 5th edition, 2000, pag 931-975.
Pilly E. Maladies infectieuses et grossesse. Infections neonatales; In Maladies Infectieuses, edition 2000, pag 452-462.
Ronald S, Gibbs RL, Sweet S. Maternal ADN fetal infectious; In Creasy and Resnik Maternal ADN fetal Medicine, 3th edition, 1994, pag 639-710.
Stagno S, Pass RF: Congenital cytomegalovirus infection. the relative importance of primary and recurent maternal infection. N Engl J Med 306:945, 1982.
Hebart H et al. CMV infection in bone marrow and solid transplant patients in the era of antiviral prophylaxis. Herpes, vol 7, nr 1, 2000, pag 13-17
Traitement preventif de l'infection a cytomegalovirus en l'an 2000. Viral, nr 23, oct 2000, pag 1-7.
Guidelines and new issues in the management of CMV infection in transplant recipients. Recomandations from International Herpes Management Forum - 8th Annual meeting the IHMF, Malta, nov. 2000.
Mouton Y. Guide du VIH - conduite pratique (realise grace au parteneriat de produits Roche- 1998).
Bouvet E, Casalino E. Guide des antiviraux. (realise grace au parteneriat de produits GlaxoWellcome - 1999).
Cassoux N, Le Hoang P, Katlama C. Cytomegalovirus - la retinite. Syb@com, 1997, Paris
Mayaud C. Atteintes respiratoires liees au cytomegalovirus au cours du SIDA. La lettre de l'infectiologue de la microbiologie a la clinique. Hors serie fev 1995, pag 13-16. Symposium CMV, Jerez, Espagne, 17 sept 1994.
Gazzard BG. Atteintes digestives liees au CMV. La lettre de l'infectiologue de la microbiologie a la clinique. Hors serie fev 1995, pag 13. Symposium CMV, Jerez, Espagne, 17 sept 1994.
Klemola E et al. Infectious - mononucleosis - like disease with negative heterophil agglutination test. Clinical features in relation to Epstein Barr virus and cytomegalovirus and antibodies. J Infect Dis. 1970;121 : 608-614.
Muller-Stamou A. Epidermolysis in a case of severe cytomegalovirus infection. Br Med J 1974;3:609-610.
Hammer SM et al. A controlled trial of two nucleoside analogues plus indinavir in persons with immunodeficiency virus infection and CD4 cell counts of 200 per cubic milimeter or loss. N Engl J Med. 1997; 337: 725-732.
Ho M. Cytomegalovirus: biology and infection. 2nd ed. New York: Plenum 1991:440.
Ho M et al. The transplanted kidney as a source of cytomegalovirus infection. N Engl J Med. 1975;293:1109-1112.
Betts RF. Transmission of cytomegalovirus infection with renal allograft. Kidney Int. 1975;8:387-394.
Arama V. Infectii virale in sarcina. Capitol 12 in Afectiunile medicale asociate sarcinii. Sub redactia Dr. Radu Vladareanu. Editura Info Medica, 1999; pag 263-320.
Freymuth F et al. Diagnostic virologique de l'infection a cytomegalovirus humain chez les patients atteints deSIDA. La lettre de l'infectiologue de la microbiologie a la clinique. Hors serie, fevrier 1995, Symposium CMV, Jerez, Espagne sept 1994, pag 8-12.
Morris DJ. Collection and transport of clinical specimens. Herpes, vol 2, nr 1, 1997, pag 17-20.
Morishima T. New diagnostic techniques for the managementof herpesviruses. Herpes, vol 3, nr 1, aprilie 1996, pag 5-13.
Mariod PL et al. Evaluation of BMS-200475 and lobucavir in the duck model hepatitis B virus infection. Abstract H-49 of the 38th Interscience Conference on Antimicrobial Agents and Chemotherapy, 1998;329.
Lalezari J et al. In vivo anti-CMV activity and safety of oral lobucavir in HIV-infected patients (protocol AI459-007). Abstract 301 of the 4th Conference on Retroviruses and oportunistic infections, 1997.
Sherman M et al. Lobucavir treatment for chronic hepatitis B infection: a placebo controlled phase ½ study. Abstract H-32 of the 37th Interscience Conference on antimicrobial agents and chemotherapy, 1997;219.
Wilber R et al. Efficacy and safety of oral lobucavir in patients with recurent genital herpes. Abstract of the 38th Interscience Conference on antimicrobial agents and chemotherapy, 1998;339.
Sande MA et al. The Sanford - Guide to HIV / AIDS Therapy, nine edition 2000.
Gilbert DN et al. The Sanford Guide to antimicrobial therapy, thirtieth edition, 2000.
Association des Professeurs de Pathologie infectieuses et tropicale. Le POPI - guide de traitement. 6e edition, 1999.
LeHoang Ph. Retinites a CMV et HIV.Compte-rendu symposium Retinites a CMV et HIV, Cannes, 24 avril, 1997. Med et Mal infect, 1997;27:743-748.
Raffi F. Ganciclovir oral en traitement de relais dela retinite a CMV. Med et Mal Infect, 1997;27:617-618.
Couchoud C. et al. Cytomegalovirus prophylaxis with antiviral agents in solid organ transplantation: a meta-analysis. Transplantation 1998;65 (5): 641-647.
Winston DJ et al. Randomised comparasion of ganciclovir and high-dose acyclovir for longterm CMV prophylaxis in liver-transplant recipients. Lancet 1995; 346 (8967): 69-74.
Gane E. et al. Randomised trial of efficacy and safety of oral ganciclovir in the prevention of CMV disease in liver-transplant recipients. Lancet 1997; 350 (9093): 1729-1733.
Lowance D et al. Valaciclovir for the prevention of CMV disase after renal trasplantation. N Engl J Med 1999; 340 (19): 1462-1470.
Hibbert PL et al. Preemptive ganciclovir terapy to prevent cytomegalovirus disease in CMV antibody-positive renal transplant recipients. Ann Intern Med 1995; 123 (1): 18-26.
Pouteil- Noble et al. Cytomegalovirus infection - an etiologic factor for rejetion ? A prospective study in 242 renal transplant recipients. Transplantation 1993;55 (4): 851-857.
Akposso K et al. Longterm prognosis of renal transplantation after preemptive treatment of CMV infection. Transplantation 1997; 63 (7): 974-976.
Reed EC et al. Treatment of CMV pneumonia with ganciclovir and immunoglobulin in patients with bone marrow transplant. Ann Intern Med 1988;109:783-788.
Prentice HG. Impact of long-term acyclovir on CMV infection and survival after allogenic bone marrow transplantation. Ruropean Acyclovir for CMV prophylaxis study group. Lancet 1994; 343:749-753.
Ljungman P et al. A randomized study of valaciclovir as prophylaxis against CMV infection and disease in B;T recipients. Abstrat 212.. Bone marrow transplant 1999;23: (Suppl 1):65.
Ljungman P et al. Results of different strategies for reducing cytomegalovirus-associated mortality in allogenic stem cell transplant recipients. Trasplantation 1999; 66: 1330-1334.
Boeckh M et al. Cytomegalovirus pp65 antigenemia guided early treatment with ganciclovir versus ganciclovir at engraftment after allogenic marrow transplantation: a randomised double-blind study.Blood 1996; 88: 4063-4071.
Ljungman P et al. A randomised study comparing ganciclovir and foscarnet for pre-emptive therapy of CMV infection in allogenic SCT recipients. Bone Marrow Transplant 1999; 23 (Suppl 1): EX8.
Bass EB et al. Efficacy of immunoglobulin in preventing complications of bone marrow transplantation: a meta-analysis. Bone Morrow Transplant 1993; 12: 273-282.
Hebart H et al. Management of CMV infection after solid organ or stem-cell tranplantation. Drugs 1998; 55: 59-72.
Boeckh M. CMV pp65 antigenemia after autologous bone marrow and peripheral blood stem transplantation. J Infect Dis 1996; 174: 907-912.
Hebart H. CMV-monitoring by PCR of patients undergoing autologous bone marrow and perpheral blood progenitor cell transplantation. J Infect Dis 1997; 175:1490-1493.
Couchoud C. Cytomegalovirus prophylaxis with antiviral agents in solid organ transplantation. Transplantation 1998; 65: 641-647.
Lowance D et al. Valaciclovir for the prevention of cytomegalovirus diseases after renal transplantation. N Engl J Med 1999;340:1462-1470.
Flechner SM. A randomized prospective controlled trial of oral aciclovir versus oral ganciclovir for CMV prophylaxis in high-risk kidney transplant recipients. Transplantation 1998; 66: 1682-1688.
Autran B et al. Positive effect of combined antiretroviral therapy on CD4+ T cell homeostasis and function in advanced HIV disease. Science 1997;227: 112-116.
Deayton JR et al. Early immune reconstitution and control of CMV replication following highly active antiretroviral therapy. Abstract of 8th Conference on Retroviruses and Opportunistic infections. Chicago, USA, 2001.
Ledergerber B et al. Discontinuation of secondary prophylaxis aginst pneumocystis carinii pneumonia in pattients with HIV infection who have a response to antiretroviral therapy. 8th European Study Groups. N Engl Jmed 2001; 334:168-174.
Smith Jo. Human herpesvirus vaccines: the current status of vaccine development. Herpes, vol 4, nr 3, nov 1997: 55-62.
Soderberg C. Mechanism of CMV disease. Herpes, vol 4, nr 1, march 1997: 4-10.
Marshall GS. Cytomegalovirus vaccines-two dfecade of progress. Herpes, vol 4, nr 1, march 1997: 20-25.
Middeldorp JM et al. Diagnosis of active CMV infection: the nRNA approach. Organs and Tissues, 2, an 2000: 99-107.
Snydmann DR. Infection in solid organ transplantation. Transpl Infect Dis 1999;1:21-28
Mach Michael. The Human cytomegalovirus - clinical manifestations, diagnosis and therapy. Roche diagnosis, 2001.
Whitley R. Roche- satellite symposium "Emerging trend in CMV infection from HAART to Heart" - 41st ICAAC, Chicago, dec 2001.
Nutley NJ. Valcyte (Valganciclovir HCl tablets) prescribing informations; Roche Laboratoires Inc; march 2001.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3729
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved