| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Compusii elementele grupei I-a si a II-a
Generalitati
Se poate spune ca chimia metalelor alcaline si cea a metalelor alcalino-pamantoase, este compusa mai de graba din anioni cu care ionul este asociat, decat cu ioni metalici. Chimia acestor compusi va fi discutata pe sectiuni, de exemplu nitratii - cu elementele grupei a V-a, sulfatii - cu elementele grupei VI si numai cateva componente vor fi discutate aici.
Hidrurile
Toate elementele grupei I si II, reactioneaza cu hidrogenul cu formare de hidruri metalice. Hidrurile metalelor, cu exceptia beriliului si a magneziului, sunt solide albe, in majoritate ionice, toate hidrurile grupei I-a avand structura cristalizata de tip NaCl. Toate hidrurile sunt stabile in aer, dar reactioneaza cu apa, reactia fiind cu atat mai energica cu cat creste masa moleculara a hidrurii, pentru oricare din cele doua grupe.

Aceasta reactie se datoreaza puternicei proprietati bazice a ionului H- care se comporta ca un puternic acceptor de proton, fiind in consecinta o baza puternica:
![]()
Cand hidrurile ionice topite sunt supuse electrolizei, toate formeaza hidrogen la anod si metalul la catod. Hidrurile grupei I-a, mai ales hidrura de litiu, reactioneaza cu hidrurile metalelor trivalente din grupa III pentru a forma hidruri complexe, probabil cea mai importanta fiind - tetrahidroaluminatul de litiu - LiAlH4, bine cunoscut agent reducator in chimia organica.
Hidrurile de Mg si Be sunt in mare parte covalente, hidrura de magneziu avand o structura "rutil", in timp ce hidrura de beriliu formeaza o structura polimera cu deficit de electroni. Legaturile din aceste hidruri metalice nu sunt simple si necesita o abordare care depaseste obiectul acestui curs.
Halogenurile
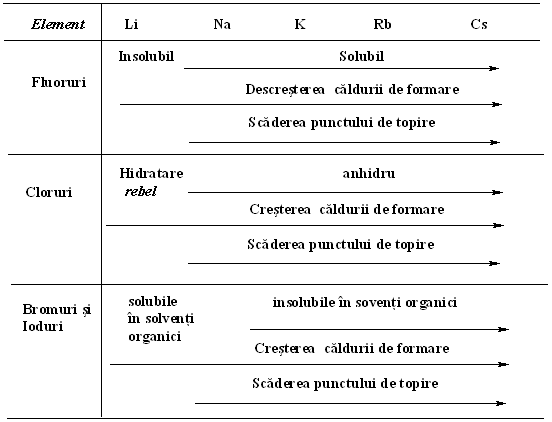
Metalele grupei I-a se combina direct cu toti halogenii. Reactiile sunt exoterme, cea mai mare caldura de formare fiind determinata atunci cand elementele acestor grupe se combina cu fluorul. Cu exceptia formarii fluorurilor, caldura de formare a unei anumite halogenuri creste cand grupa scade si energiile de ionizare ale elementelor metalice scad. Inversul este adevarat pentru fluoruri, caldura de formare scade pe masura ce grupa scade. Aceasta se datoreaza energiilor mari de catalizare produse prin combinarea "micului" anion fluorura si a cationului metalic.
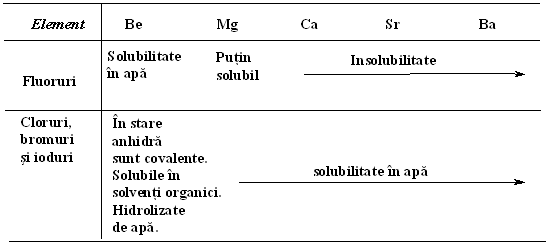
Toate halogenurile grupei I pot fi considerate ionice (bromura si iodura de litiu au un anumit grad de covalenta, dar aceasta nu afecteaza concluzia generala), acest fapt observandu-se in valorile mari ale punctului de topire si ale punctului de fierbere si a proprietatii topiturii de a conduce electricitatea. Toate sunt solubile in apa, cu exceptia fluorurii de litiu, insolubilitatea acesteia datorandu-se unei energii mari a retelei cristaline, destul de mare ca sa poata compensa energiile mari de hidratare a ionilor litiu si fluorura. Metalele grupei a II-a formeaza halogenuri prin combinare directa. Tendintele privind caldura de formare si punctul de topire, totusi, pe langa ca urmeaza linia generala a compusilor grupei I-a corespondenti, nu sunt atat de regulate. Ca o consecinta a energiei mari de ionizare a beriliului, halogenurile sale sunt practic covalente, cu punct de topire comparativ mic, topiturile fiind neconducatoare de electricitate (exceptie, fluorura de beriliu) si solubile in multi solventi organici.
Elementele din partea de jos a grupei a II-a formeaza halogenuri ionice, iar magneziu are proprietati intermediare, bromura si iodura de magneziu dizolvandu-se in solventi organici. Energiile de cristalizare ale fluorurilor elementelor grupei a II-a sunt in general mai mari decat cele corespondente din grupa I-a; in consecinta, toate in afara de fluorura de beriliu, sunt insolubile (Solubilitatea BeF2 se explica prin energia inalta de hidratare a ionului de Be). Energia mare de hidratare a ionului de Be2+ conduce la hidroliza in solutii neutre sau alcaline; in aceasta reactie halogenurile de Be se aseamana cu cele de Al.
Ionul de magneziu, avand o energie mare de hidratare (Tabelul 2.), hidrolizeaza dar nu la fel de puternic ca Be2+ si Al 3+. Clorura formeaza cativa hidrati care se descompun termic pentru a rezulta o sare bazica:
![]()
Alte halogenuri ale grupei a II-a sunt de fapt ionice si au punctul de topire destul de ridicat, topiturile fiind conducatoare si solubile in apa, dar nu si in solventi organici.
Proprietatile ale combinatiilor cu halogenii a elementelor grupei I-a si a II-a
Grupa I-a
Grupa a II-a
OXIZII SI HIDROXIZII
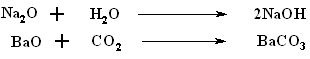
Oxizii solizi albi M21O si MIIO sunt formati prin reactia directa a elementelor. Oxizii M2O si MO pornind de la calciu si pana la radiu au legaturi ionice; ei reactioneaza exoterm cu apa pentru a forma hidroxizi, cu acizii pentru a forma saruri si cu dioxidul de carbon, pentru a forma carbonati. De exemplu:
Oxidul de magneziu este aproape inert fata de apa, dar se dizolva in acizi pentru a forma saruri; oxidul de beriliu este inert si aproape insolubil in apa sau in acizi.
Elementele grupei I-a, cu exceptia litiului, formeaza peroxizi M O cu exces de oxigen, iar potasiu, rubidiu si cesiu vor forma la randul lor super-oxizi MO . Acesti peroxizi si super-oxizi se prepara cel mai bine trecand oxigen printr-o solutie a unui metal in amoniac lichid.
Elementele grupei a II-a formeaza de asemenea peroxizi.
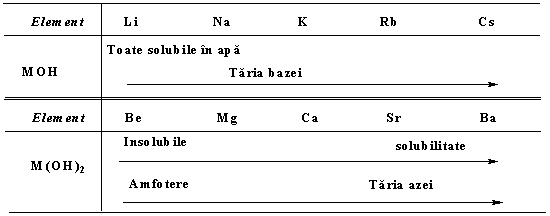
Hidroxizii MIOH sunt solubili in apa, in care acestia se comporta ca baze puternice (tari), de ex:
![]()
Hidroxizii MII(OH) sunt in general mai putin solubili si de aceea se numara printre bazele slabe. Hidroxizii grupei I-a sunt aproape unici, avand in vedere ca poseda o buna solubilitate - marea majoritate a hidroxizilor metalici fiind insolubili sau partial solubili; de aici hidroxidul de sodiu si mai putin utilizat hidroxid de potasiu, sunt folositi frecvent ca si surse ale ionului hidroxil HO-, atat in laboratoare cat si la scara larga.
Hidroxidul de sodiu este obtinut prin electroliza solutiei apoase concentrate de clorura de sodiu; celalalt produs al electrolizei, clorul, este la fel de important si de aici separarea in produsi la anod cat si la catod este necesara. Acest lucru este reprezentat printr-o diagrama (de exemplu in celulele electrolitice Hooker) sau prin folosirea unui catod de mercur, care va prelua sodiul format la catod ca un fel de amalgam (celulele Kellner-Solvay). Amalgamul, dupa trecerea de la celulele electrolite, este tratat cu apa, pentru a forma hidroxid de sodiu si mercur. Celula de mercur este cea mai costisitoare in utilizare, dar are ca rezultat cel mai pur produs.
Hidroxidul de potasiu este similar cu cel de sodiu, dar este o baza mai puternica; este mai solubil in alcool, iar solutia este uneori folosita ca si "reactiv". Ceilalti hidroxizi ai grupei I-a sunt similari, taria bazelor crescand in grupa de sus in jos; toate sunt solide higroscopice care ataca pielea, de aici si bine cunoscutul (vechiul) nume de "soda caustica" - NaOH -, "potasa caustica" - KOH - si reactioneaza cu dioxidul de carbon in prezenta aerului pentru a forma carbonati:
![]()
Cu un exces de dioxid de carbon, astfel incat daca gazul trece printr-o solutie de hidroxid, se formeaza o bicarbonat:
![]()
Reactia dintre hidroxidul de calciu si dioxidul de carbon pentru a produce carbonat de calciu precipitat este testul comun pentru dioxidul de carbon.
Hidroxidul de beriliu este obtinut ca si precipitat gelatinos alb, cand ionii hidroxil sunt adaugati la solutia unei sari de beriliu. Este partial solubil in apa, se dizolva in acizi tari pentru a forma ionul de beriliu hidratat, dar se dizolva de asemenea si in solutii continand ioni hidroxil pentru a forma un nou ion de tetrahidroxoberiliu; prin adaugare de acizi, se reprecipita hidroxidul de beriliu (ca si precipitat alb gelatinos hidratat) si apoi se redizolva pentru a forma ioni hidratati. De aici rezulta:
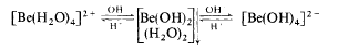
Comportamentul putin diferit al hidroxidului de beriliu, il separa putin de ceilalti hidroxizi ai grupei a II-a, care nu sunt amfoteri; calitati de amfoter avand de asemenea si hidroxidul de aluminiu din grupa a III-a.
Ceilalti hidroxizi ai grupei a II-a sunt partial solubili in apa, iar solubilitatea creste de jos in grupa; hidroxidul de magneziu precipita numai printr-o apreciabila concentratie de ioni hidroxil, iar ceilalti nu sunt precipitati.
Carbonatii si carbonatii acizi
Ca si la hidroxizi, vom afla ca si carbonatii multor metale sunt insolubili, aceia ai metalelor alcaline sunt solubili, astfel ca ei asigura o buna sursa de ion carbonat in solutii. Carbonatii metalelor alcaline, cu exceptia litiului, sunt stabili la caldura. Carbonatii grupei a II-a sunt in general insolubili in apa si mai putin stabili la caldura, pierzand dioxidul de carbon in mod reversibil la temperaturi inalte.

O alta particularitate a carbonatilor grupei I-a si a II-a este abilitatea lor de a forma hidrogenocarbonati sau ionul bicarbonat - HCO-:
![]()
Acest ion este format printr-o trecere prelungita a dioxidului de carbon prin solutii neutre sau alcaline continand ioni ai grupelor I-a si a II-a (cu exceptia litiului si a beriliului, care nu formeaza hidrogenocarbonati).
Hidrogenocarbonatii elementelor grupei I-a, pot fi izolati ca solide, dar aceste solide se descompun relativ repede cand sunt incalzite, pentru a forma carbonati cu eliminare de dioxidului de carbon si a apei, de exemplu:
![]()
Hidrogenocarbonatii grupei a II-a au insuficienta stabilitate termica pentru a putea fi izolati ca solide. Totusi, in zone unde se gasesc depozite naturale de carbonat de calciu si magneziu, reactia dintre carbonat, apa si dioxid de carbon decurge astfel:
![]()
insolubil solubil
Aceasta produce o concentratie suficienta de ioni de calciu si magneziu. Reactia de mai sus este reversibila aproape instantaneu, daca apa este adusa la fierbere, iar ionii de calciu si magneziu sunt retransformati in carbonat insolubil.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3324
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved