| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Echilibrul fizic eterogen gaz-solutie poate fi exprimat cantitativ cu ajutorul a doua legi: legea lui Henry si legea lui Raoult.
Presiunea de vapori a unei solutii este presiunea exercitata de vapori atunci cand atat solventul cat si solvatul sunt in echilibru cu faza de vapori. Daca solventul este volatil atunci presiunea de vapori a solventului din solutie este de fapt presiunea de vapori a solutiei. Faza gazoasa in echilibru cu solutia contine numai vaporii solventului.
Daca solvatul este o substanta solida nevolatila, avand o presiune de vapori neglijabila, experienta arata ca presiunea de vapori a solutiei este mai mica decat cea a solventului pur.
Scaderea relativa a presiunii de vapori a solutiei este egala cu fractia molara a solvatului, conform legii lui Raoult (1886):
![]() (5.30)
(5.30)
unde: ![]() = presiunea de vapori a
solventului pur;
= presiunea de vapori a
solventului pur;
p = ![]() -
- ![]() (5.31)
(5.31)
unde: ![]() = presiunea de vapori a solutiei (a solventului in solutie);
= presiunea de vapori a solutiei (a solventului in solutie);
p1 = scaderea presiunii de vapori a solutiei;
![]() = scaderea relativa a presiunii de vapori a
solutiei.
= scaderea relativa a presiunii de vapori a
solutiei.
Legea lui Raoult poate fi dedusa aplicand conditia de echilibru termodinamic de egalitate a potentialului chimic al solventului in solutie si in faza de vapori:
1s 1g (5.32)
respectiv
![]() (5.33)
(5.33)
Vaporii se considera ca avand comportament de gaz perfect, iar solutia ideala.
Din relatia (5.33) rezulta:
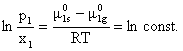 (5.34)
(5.34)
Pentru cazul limita x1 = 1 (solvent pur)
rezulta p1 = ![]() .
.
Adica
![]() (5.35)
(5.35)
Rezulta:
![]() (5.36)
(5.36)
Solutia este formata din doi componenti (solvat si solvent), adica:
x1 = 1 - x2 (5.37)
Relatia (5.36) devine:
![]() (5.38)
(5.38)
De unde:
![]() (5.39)
(5.39)
Relatia (5.39) coincide cu legea lui Raoult (5.30).
Se observa in legea lui Raoult ca nu intervine nici o marime care sa depinda de natura solvatului.
Relatia (5.36) este o alta forma de exprimare a legii lui Raoult si arata ca presiunea de vapori a solutiei este proportionala cu fractia molara a solventului.
Cu ajutorul legii lui Raoult se poate explica fenomenul de distilare izoterma, care se observa cand se introduc doua vase cu solutii de concentratii diferite intr-un spatiu inchis (clopot de sticla). Dupa un timp se constata ca solventul se evapora din solutia mai diluata, condensandu-se in solutia mai concentrata care are o presiune de vapori mai mica. Fenomenul are loc pana la egalarea concentratiilor celor doua solutii.
Pe baza legii lui Raoult (5.30) se poate determina masa moleculara a solvatului (M2).
Relatia (5.30) se poate scrie:
![]() (5.40)
(5.40)
unde: n1 = numarul de moli de solvent;
n2 = numarul de moli de solvat.
Daca solutia este diluata, atunci n2 << n1.
Rezulta:
![]() (5.41)
(5.41)
respectiv
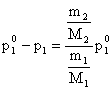 (5.42)
(5.42)
unde: m1, M1 = masa, respectiv masa moleculara a solventului;
m2, M2 = masa, respectiv masa moleculara a solvatului.
Din relatia (5.42) se obtine pentru M2:
![]() (5.43)
(5.43)
Prin aceasta metoda se determina masa moleculara a unor substante nevolatile.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3579
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved