| CATEGORII DOCUMENTE |
| Alimentatie nutritie | Asistenta sociala | Cosmetica frumusete | Logopedie | Retete culinare | Sport |
Activatorii de PPAR-a si aspirina scad expresia MCP-1 indusa de concentratia crescuta de glucoza in celulele endoteliale umane
1. Efectul activatorilor de PPAR-a si aspirinei asupra expresiei MCP-1 indusa de glucoza crescuta. Rolul functional.
a. INTRODUCERE SI OBIECTIVE
Ateroscleroza accelerata este cauza principala a morbiditatii si mortalitatii pacientiilor cu diabet. Acest lucru a fost dovedit de studiile epidemiologice care au aratat ca pacientii diabetici prezinta factor de risc crescut de a dezvolta ateroscleroza comparativ cu pacientii fara diabeti. Nivelul crescut de glucoza in plasma accelereaza formarea placii aterosclerotice printr-o secventa de evenimente comparabile cu cele din hiperlipidemie [Simionescu et al., 1986]. Dupa faza initiala, care presupune acumularea lipoproteinelor modificate in sub-endoteliul arterial, o etapa critica este recrutarea monocitelor. Acest proces include activarea celulelor endoteliale prin producerea genelor inflamatoare ca molecule de adeziune si a factorilor chemoatractanti. Chemokinele sunt activatori puternici si chemoatractanti pentru diferitele subpopulatii de leucocite dar si pentru celulele nonhematopoetice. Ca raspuns la diversi stimuli, chemokinele sunt secretate de celulele proinflamatorii (leucocite, celule endoteliale, etc.) si atrag leucocitele in spatiul extravascular. Recent s-a demonstrat ca pe langa reglarea traficului leucocitar, chemokinele sunt implicate in dezvoltare, angiogeneza si hematopoieza.
MCP-1 (proteina chemoatractanta a monocitelor), prima molecula descoperita a subclasei de chemokine CC, este puternic chemoatractanta pentru monocite si limfocite T. Expresia MCP-1 in leziunile aterosclerotice umane a fost demonstrata prima data in 1991 prin hibridizare in situ. Alte dovezi ce au demonstrat rolul important al MCP-1 in aterogeneza vin de la experimente in care a fost indepartata gena ce codifica MCP-1 in soarecii apoE-/- ceea ce a dus la reducerea semnificativa a leziunilor aterosclerotice, sugerand rolul important al acestei chemokine in aterogeneza. Expresia MCP-1 a fost detectata in monocite, fibroblaste, celule endoteliale, celule musculare netede activate de diferiti stimului [Poddar et al., 2001; Sica et al., 1990; Yamamoto et al., 2001]. Recent s-a demonstrat ca activarea celulelor endoteliale umane cu concentratii crescute de glucoza duce la o expresie crescuta a MCP-1 [Takaishi et al., 2003]. In plus la rolul sau chemoatractant, interactia MCP-1 cu receptorul CCR-2 genereaza expresia moleculelor de adeziune [Lu et al., 1998], citokinelor proinflamatoare [Takaishi et al., 2003; Yamamoto et al., 2001] si metaloproteazelor matriceale [Yamamoto et al., 2000], sugerand ca MCP-1 amplifica procesul inflamator, contribuind la dezvoltarea leziunilor aterosclerotice. Expresia MCP-1 de catre celulele endoteliale poate fi de o importanta particulara in aterogeneza nu numai datorita efectelor MCP-1 asupra chemotaxiei monocitelor, dar de asemenea datorita efectelor MCP-1 descrise recent, de a declansa adeziunea ferma a monocitelor la endoteliul activat, prin cresterea expresiei integrinelor de la suprafata celulelor endoteliale. Aceste efecte arata ca MCP-1 ar putea juca un rol dublu in recrutarea monocitelor, atat prin medierea adeziunii ferme a monocitelor care se rostogolesc, cat si mai ales chemoatractiei monocitelor.
S-a aratat ca aspirina diminueaza evenimentele acute coronariene si cerebrovasculare, trasatura atribuita proprietatii de anti-agregant plachetar datoraita inhibarii tromboxanului [Fuster et al., 1993], dar ulterior s-a aratat ca aceasta poseda si proprietati anti-inflamatoare. Anterior noi am demonstrat ca aspirina imbunatateste homeostazia calciului, scade speciile reactive de oxigen si creste productia de NO in celulele endoteliale umane [Dragomir et al., 2004].
Fibratii, liganzi farmacologici ce activeaza PPARs (peroxisome proliferator-activated receptor) [Forman et al., 1997], exercita efecte anti-aterogenice directe, independent de activitatea lor de a reduce lipidele. Astfel, fibratii scad concentratia plasmatica a citokinelor inflamatoare (interleukina-6 si factorul de necroza tumoral-α) la pacientii cu ateroscleroza [Madej et al., 1998; Staels et al., 1998], reduc expresia VCAM-1 indusa de citokine, limitand aderarea si recrutarea ulterioara a monocitelor [Marx et al., 1999]. Astfel, am presupus ca medicamentele anti-inflamatoare ca aspirina si activatorii de PPARs (receptori activati de peroxizomul proliferator) pot avea efecte benefice in procesul inflamator si prin reducerea expresiei MCP-1.
Asa cum am amintit, nivelele crescute de glucoza asociate diabetului determina disfunctii ale celulelor peretelui vascular si pot declansa reactii inflamatoare ce determina dezvoltarea leziunilor vasculare. Astfel, in acest studiu am investigat efectul aspirinei si activatorilor de PPARa (fenofibrat si clofibrat) asupra expresiei MCP-1 in celulele endoteliale umane expuse la concentratie crescuta de glucoza. De asemenea, am urmarit efectul medicamentelor asupra rolului functional al acestei chemokine, si anume adeziunea si chemotaxia monocitelor la celule activate de glucoza crescuta.
b. MATERIALE SI METODE
Linia de celule endoteliale descrisa la capitolul I si II EAhy926. Celulele au fost cultivate in mediu de cultura DMEM suplimentat cu HT (hipoxantin, timidina) si 10% ser fetal de vitel si au fost folosite in studii dupa postconfluenta.
Protocolul experimental
Pentru a testa rolul aspirinei si activatorilor de PPAR-α asupra expresiei MCP-1 indusa de glucoza crescuta, celulele endoteliale confluente, crescute in conditii normale de glucoza (5mM) au fost supuse diferitelor conditii experimentale: (i) celule expuse la concentratie crescuta de glucoza (33mM), timp de 48 ore (GC); (ii) cellule expuse la 33mM glucoza in prezenta de 1mM aspirina (GC+A); (iii) cellule mentinute in glucoza crescuta timp de 24h si apoi incubate pentru inca 24h cu 100μM fenofibrat (GC+F) sau 100μM clofibrate(GC+C); si (iv) celule mentinute in mediu de cultura cu 5mM glucoza, celule control.
Determinarea expresiei genice prin RT-PCR.
Pentru a determina expresia genica a MCP-1, mai intai am extras ARN din celulele endoteliale , cu ajutorul unui kit de izolare ARN, "High Pure RNA". RT-PCR a fost realizat intr-un singur pas, folosind un kit de la Roche (conform cu instructiunile kitului). Reactia a avut loc la temperatura de annealing de 56C folosindu-se 1μg ARN total/tub si primeri corespunzatori: pentru MCP-1: sense 5′-AGC ATC AAA GTC TCT GCC GCC CTT CTG si antisens 5′-ATT ACT TAA GGC ATA ATG TTT CAC A; pentru GAPDH: sens 5′-ACC ACA GTC CAT GCC ATC AC si antisens 5′-TCC ACC ACC CTG TTG CTG TA. Fragmentul de DNA a fost amplificat 30 de cicluri (30s, 94C; 30s, 56C; 1min, 68C) urmate de pasul final de extensie de 7 minute la 68C. Numarul optim de cicluri a fost ales dupa ce am efectuat experimente RT-PCR cu numar diferit de cicluri 10, 25, 30, 35 si 40 cycles, iar faza exponentiala am obtinut dupa 35 cicluri. Produsii rezultati au fost supusi elecroforezei in gel de agaroza 1.5%, iar rezultatele analizate cu un system analizor de geluri (Image Master VDS-Pharmacia Biotech). Nivelul de ARNm MCP-1 a fost normalizat relativ la ARNm GAPDH, iar rezultatele obtinute de la trei experimente independente au fost analizate statistic.
Determinarea expresiei proteice prin Western Blot
Expresia proteica a MCP-1 a fost analizata in extract total celular prin omogenizarea celulelor in solubilizant Laemmli. Diferitele probe ce contineau 60μg proteina au fost separate in 20% SDS-PAGE si transferate pe membrana de nitroceluloza. Protocolul de imunobloting a fost descris anterior, diferenta consta in folosirea unui alt anticorp (ati-MCP-1) care s-a folosit la dilutia (1:200). Semnalul obtinut a fost vizualizat cu ajutorul substratului chemiluminescent (SuperSignal West Pico chemiluminescent) si cuantificat prin densitometrare cu sistemul de analiza a gelurilor descrie mai sus.
MCP-1 eliberat de celulele endoteliale in mediul de cultura a fost cuantificat cu ajutorul unui kit (Qantikine Human MCP-1 Immunoassay ELISA kit, R&D Systems). Cantitatea de MCP-1 s-a masurat in mediul de cultura al celulelor aflate in diferite conditii experimentale si normalizata la cantitatea de proteina a celulelor de pe godeu.
Chemotaxie
Mediul de cultura conditionat al CE aflate in diferite conditii experimentale, a fost recoltat si adaugat in compartimentele de jos ale camerelor duble cu filtru policarbonat cu pori de dimetru 5mm. In compartimentul de sus au fost adaugate 100 000 monocite marcate cu BCECF-AM si a urmat incubarea placilor la 37 C, timp de 90 minute in admosfera cu 5%CO2. A urmat dezasamblarea camerei si colectarea mediului de cultura din compartimentul de jos, unde au migrat monocitele marcate. Monocitele migrate au fost cuantificate prin masurarea la stectofluorimetru TECAN la lungimea de unda de excitatie 485 si emisie 535nm. Pentru controlul pozitiv, in compartimentul de jos al camerei am pus mediu de cultura proaspat in care s-a adaugat peptidul chemoatractant fMLP (10nM), iar drept control negativ am folosit monocite incubate cu MCP-1 pentru a bloca receptorul acestei chemokine (CCR2) si astfel a urmari rolul MCP-1 in procesul de chemotaxie.
Datele obtinute in diferite conditii experimentale au fost comparate statistic prin analiza variatiilor (one-way ANOVA). Diferentele intre medii au fost considerate semnificative cind P<0.05.
c. REZULTATE
Celule endoteliale vasculare joaca un rol activ in multe boli imune si inflamatorii ca ateroscleroza, vasculitele sistemice, lupusul eritematos sistemic si poliartrita reumatoida [Russel, 1990]. Aceste celule regleaza adeziunea monocitelor la vasele de sange si migrarea ulterioara in spatiul subendotelial. Procesul este facilitat de secretia de molecule de adeziune celulara si chemokine ce sunt supraexprimate de mediatorii inflamatiei [Chapman & Haskard, 1995; Cines et al., 1998]. Chemokinele sunt mediatori ai inflamatiei care, in primul rand, controleaza migrarea leucocitelor si induc cresterea expresiei receptorilor de adeziune. Ca raspuns la diversi stimuli, chemokinele sunt secretate de celulele proinflamatorii (leucocite, CE, etc.) si atrag leucocitele in spatiul extravascular. Recent s-a demonstrat ca pe linga reglarea traficului leucocitar, chemokinele sunt implicate in dezvoltare, angiogeneza si hematopoieza.
1) Aspirina si activatorii dePPAR-α reduc expresia genica a MCP-1 in celule endoteliale umane activate de glucoza crescuta
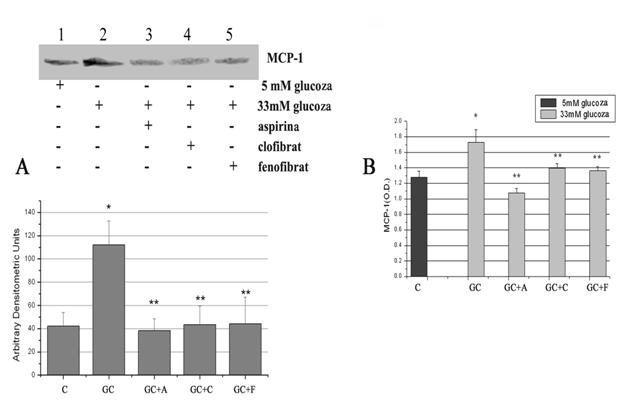
Inainte de a testa efectul medicamentelor asupra expresiei de MCP-1, am urmarit daca concentratia crescuta de glucoza creste expresia de ARNm a MCP-1 in celulele endoteliale (CE). Astfel, CE confluente au fost tinute timp de 48 ore in mediu de cultura cu 33mM glucoza sau in 5mM glucoza (control) si am masurat expresia genica a MCP-1 cu RT-PCR. Rezultatele obtinute arata o crestere semnificativa a expresiei genice a MCP-1 (p<0.05) in CE activate de glucoza crescuta, comparativ cu celulele control (Figura 1, A si B). De asemenea, in cele doua figuri se observa ca tratarea CE atat cu aspirina cat si cu fenofibrat si clofibrat are ca efect scaderea expresiei genice a chemokinei MCP-1.
Figura 1. Aspirina si activatorii de PPARa scad expresia genica a MCP-1

Aspirina si activatorii de PPAR-α reduc expresia proteica a MCP-1 in celule endoteliale umane activate de glucoza crescuta
Rezultatele obtinute la nivel de expresie genica au fost confirmate la nivel de expresie proteica. In acest scop am determinat expresia proteica a MCP-1 in omogenate celulare cu ajutorul tehnicii Western Blot si MCP-1 eliberat in mediu de cultura cu ajutorul unui kit ELISA. Rezultatele arata ca in CE umane, glucoza creste semnificativ (P<0.05) atat expresia proteica a MCP-1 in lizat celular cat si nivelul de MCP-1 eliberat in mediu de cultura (figura 2 A si B). Acest rezultat este foarte important pentru ca rolul functional al MCP-1 este dat de MCP-1 eliberat de endoteliu, prin formarea unui gradient de MCP-1 care se leaga apoi la receptori specifici de pe monocite, atragandu-le in subendoteliu sau in placa. Aspirina, fenofibratul si clofibartul au efect de scadere a MCP-1 si la nivel de expresie proteica. Astfel, medicamentele au scazut semnificativ atat MCP-1 din omogenatul celular cat si MCP-1 eliberat in mediul de cultura (figura 2 A si B).
Figura 2. Expresia proteica a MCP-1 in celulele endoteliale umane
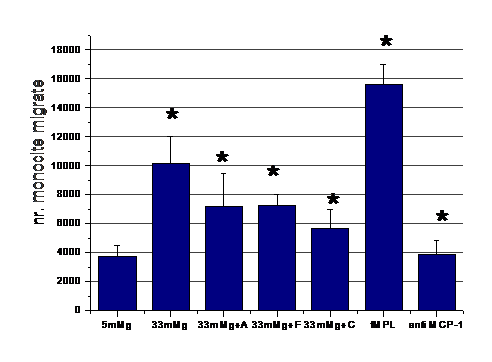
) Reducerea expresiei MCP-1 de catre aspirina si activatorii de PPAR-α se reflecta, la nivel functional, prin reducerea chemotaxiei monocitelor
In continuare am urmarit rolul functional al MCP-1, de chemoatractant pentru monocite. Celulele endoteliale au fost activate cu concentratie crescuta de glucoza, in prezenta sau absenta de medicamente. La sfarsitul perioadei de incubare mediul conditionat de la diferitele probe a fost recuperat si pus in compartimentul de jos al camerelor de chemotaxie. In compartimentul de sus au fost puse monocitele. A urmat o perioada de incubare de 90 minute la 37 C. Control pozitiv a fost realizat prin adaugarea in compartimentul de jos de mediu simplu cu peptidul chemotactic fMPL, iar control negativ prin adaugarea mediului conditionat de la celulele activate de glucoza de anticorp anti MCP-1, care sa anihileze MCP-1. Rezultatele obtinute arata ca procesul de transmigrare al monocitelor prin filtrul camerei de chemotaxie este crescut in conditii de activare cu glucoza (figura 3). Efectul de reducere a expresiei MCP-1 de catre medicamentele folosite se reflecta in numarul redus de monocite care au suferit procesul de chemotaxie. De asemenea, putem observa ca anihilarea MCP-1 de anticorpul monoclonal specific, implica numar redus de monocite care transmigreaza prin camera de chemotaxie.
Figura 3. Chemotaxia monocitelor catre mediul conditionat al CE aflate in diferite conditii experimentale
d. DISCUTII SI CONCLUZII
Ateroscleroza accelerata este un proces caracteristic pentru diabetul mielitus. Nivelele plasmatice crescute de glucoza induc: (i) transcitoza crescuta a particulelor de LDL plasmatic si acumularea lor ca lipoproteine reasamblate si modificate [Simionescu et al., 1996]; (ii) alterarea proprietatilor fizico-chimice ale LDL plasmatic duce la cresterea aterogenicitatii particulelor de LDL si ulterior la preluarea lor de catre macrofage [Dobrian et al., 1995]; si (iii) o recrutare crescuta a monocitelor plasmatice datorita cresterii expresiei endoteliale a moleculelor de adeziune si a MCP-1.
Asa cum am aratat anterior, nivelele crescute de glucoza induc cresterea procesului de recrutare al monocitelor prin cresterea moleculelor de adeziune celulara. In afara de moleculele de adeziune, un rol deosebit de important in procesul de adeziune si transmigrare al monocitelor il au chemokinele, in particular MCP-1 si fractalkina.
Cresterea procesului de adeziune al monocitelor la celulele endoteliale activate de glucoza este o componenta a unui proces inflamator complex care are loc in timpul formarii ateromului. In acest capitol am obtinut ca hiperglicemia induce expresiea crescuta a chemokinei MCP-1 care are un rol cheie in dezvoltarea leziunilor cardiovasculare si ne-am intrebat daca aceasta expresie poate fi influentata de medicamente anti-inflamatoare. Astfel, prin efectuarea diferitelor experimente de expresie proteica dar si expresie genica a MCP-1 am obtinut ca aspirina, fenofibratul, clofibratul reduc expresia MCP-1, in celulele endoteliale umane activate de concentratie crescuta de glucoza. Rezultatele obtinute la nivel de expresie a MCP-1 sunt reflectate la nivel functional, numarul monocitelor care sufera procesul de chemotaxie fiind crescut in conditii de glucoza crescuta. Numarul crescut de monocite transmigrate este datorat cresterii expresiei MCP-1, pentru ca in conditiile in care MCP-1 a fost anihilat prin incubare cu anticorp anti-MCP-1, numarul monocitelor ce sufera procesul de chemotaxie catre mediul de cultura al celulelor activate de glucoza crescuta a scazut dramatic. Medicamentele folosite au redus numarul monocitelor transmigrante.
Aceste rezultate sugereaza ca nivelele crescute de glucoza pot contribui la initierea si promovarea bolilor vasculare si prin crestera procesului de recrutare a monocitelor datorata expresiei crescute de MCP-1. De asemenea, efectele anti-inflamatoare ale aspirinei si activatorilor de PPARa pot conduce la o noua strategie farmacologica in ateroscleroza acelerata datorita diabetului.
2. Rolul factorilor de transcriptie NF-kB si AP-1 in modularea expresiei MCP-1 de medicamente
a. INTRODUCERE
Literatura de specialitate a acordat un interes deosebit modularii expresiei chemokinelor in diverse conditii de activare (TNK-a, LPS, IL-1b, lipide oxidate, etc) asociate bolilor inflamatorii [Cushing et al., 1990; Rollins et al., 1990]. Mai putina importanta a fost acordata modularii acestor factori chemotactici in conditii asociate diabetului, la nivelul caruia exista complicatii cardiovasculare.
Nivelele crescute de glucoza induc disfuncii in vasculatura datorita cresterii speciilor reactive de oxigen (ROS), eveniment care candideaza la patogeneza vasculara si daunele endoteliale in diabet. Anterior am aratat ca nivelul crescut de glucoza creste eliberarea speciilor reactive de oxigen in CE umane (CapII), induce activarea protein kinazei C (CapII), si a factorului de transcriptie NF-kB (CapI). De asemenea, s-a aratat ca speciile reactive de oxigen induc activarea cailor de semnalizare ale NF-kB si AP-1 care joaca un rol important in supra-expresia MCP-1 in CE [Lakshminarayanan et al., 2001; Martin et al., 1997], promotorul genei MCP-1 continand situsuri de legare pentru NF-kB [Collins et al., 1995]. Studiile din literatura au demonstrat ca proteinele NF-kB/Rel actioneaza in acord comun cu AP-1 pentru a induce expresia MCP-1 mediata de citokine [Martin et al., 1997]. Totusi nu se cunoaste daca in conditii de glucoza, inhibarea factorilor de transcriptie NF-kB si AP-1 reduce expresia MCP-1. Astfel, pentru a stabili daca ROS sunt implicate in inducerea MCP-1 in conditii crescute de glucoza, mai intai am urmarit efectul unor inhibitori de specii reactive de oxigen (diphenyleneiodonium, DPI si pyrrolidine dithiocarbamate, PDTC) asupra expresiei MCP-1. Ulterior, am testat efectul aspirinei si activatorilor de PPARa asupra activarii factorilor de transcriptie NF-kB si AP-1.
Alti factori importanti, care ar putea fi implicati in modularea expresiei MCP-1 in conditii de glucoza crescuta sunt PPARs. PPARs sunt receptori nucleari care actioneaza ca factori de transcriptie activati de ligand si sunt de trei feluri: PPARa, PPARg si PPARd. Cand se leaga la ligandul sau (acizi grasi fiind liganzi fiziologici), PPARa formeaza un complex heterodimeric cu receptorul X retinoic (RXR) si regleaza transcriptia diferitelor gene. PPARg este activat de prostaglandine si leucotriene si regleaza expresia genica a proteinelor implicate in stocarea acizilor grasi. PPARd este activat slab de prostaglandine, leucotriene si acizi grasi, liganzii fiziologici ai acestuia necunoscandu-se. S-a aratat ca PPARa interfera negativ cu raspunsul inflamator, antagonizand caile de semnalizare ale NF-kB [Delerive et al., 1999]. In prezent este acceptat ca exista un antagonism bidirectional intre caile de semnalizare ale NF-kB si PPARa, cresterea expresiei PPARa inhiband transcriptia genelor induse de NF-kB [Delerive et al., 2000]. Un studiu care a facut analiza de promotor a aratat ca PPARa, controleaza transcriptia genei interleukinei-6, interferand negativ cu activitatea transcriptionala a NF-kB si AP-1 [Delerive et al., 1999]. Astfel, in studiul noatru am urmarit efectul concentratiei crescute de glucoza asupra expresiei PPARa
a. MATERIALE SI METODE
Linia de celule endoteliale EA 926. Conditiile de crestere a celulelor au fost descrise la inceputul capitolului.
Protocolul experimental
Pentru determinarea mecanismelor de actiune ale medicamentelor protocolul de incubare a celulelor este acelasi cu cel descris in prima parte a acestui capitol. In plus, pentru a determina speciilor reactive de oxigen si a factorului de transcriptie NF-kB in inducerea expresiei MCP-1, CE activate timp de 48 ore cu glucoza crescuta le-a fost adaugat in ultimele 24 ore 10μM tosyl-phenyl-chlromethyl-ketone (TPCK), un inhibitor de NF-kB sau 5μM diphenyleneiodonium (DPI) si 50μM pyrrolidine dithiocarbamate (PDTC), inhibitori de ROS.
Determinarea expresiei genice prin RT-PCR.
Metoda RT-PCR pentru determinarea expresiei genice a MCP-1 a fost descrisa mai sus, in acest capitol. Pentru a determina expresia genice a PPARa s-a folosit acelasi protocol ca pentru MCP-1 cu diferenta ca primerii folositi au fost : sens 5′-GAC GAATGC CAA GAT CTG AGA AG si antisens 5′-CGT CTC TTT GTA GTG CTG TCA GC; Nivelele de ARNm ale MCP-1 si PPARa au fost normalizate relativ la nivelele ARNm GAPDH, iar rezultatele obtinute de la trei experimente independente au fost analizate statistic.
Determinarea expresiei proteice prin Western Blot
Investigarea expresiei proteice a PPAR-α, c-jun and p65 s-a facut in extracte nucleare ale CE. Extractele nucleare au fost obtinute prin omogenizarea celulelor in tampon hipotonic (10mM HEPES, pH 7.9, continand 1.5mM MgCl , 10mM KCl, 0.5mM dithiothreitol si inhibitori de proteaze) timp de 20min si gentrifugare (800 g, 10min, 4C). Peletul nuclear a fost resuspendat in tampon ce contine 20mM HEPES (pH 7.3), NaCl 420mM, MgCl 1.5mM, EDTA 0.2mM, 25% glicerol si inhibitori de protease si centrifugat (10min, 13,000g, 4C) pentru a indeparta resturile nucleare. Proteina nucleara (50μg) a fost analizata in gel de poliacrilamida (10% SDS-PAGE) iar experimentele de Western Blot au fost facute asa cum am descris mai sus, folosind anticorpi specifici fiecarei molecule.
Determinarea speciilor reactive de oxigen
Efectul activatorilor de PPARa (fenofibrat, clofibrat) si aspirinei asupra speciilor reactive de oxigen din celule activate de glucoza crescuta au fost determinat folosind metoda descrisa anterior (CapI.2).
Metoda luminescenta de testare a activitatii NADPH oxidazei
Activitatea NADPH oxidazei in omogenate celulare a fost determinata printr-o metoda chemiluminescenta descrisa anterior de Ungvari et al. (2003). Reactia se face intr-un volum total de 150 ml continand tampon fosfat (50mM), EGTA (1mM), pH 7.0, 5μM lucigenin (5μM) si NADPH (100μM). Reactia a fost declansata prin adaugarea omogenatului celular (100μg proteina). Emisia a fost inregistrata in fiecare secunda, timp de 20 minute la un luminometru (GENios, Tecan). Activitatea NADPH oxidazei a fost exprimata ca unitati relative de lumina (RLU)/ μg proteina.
b. REZULTATE
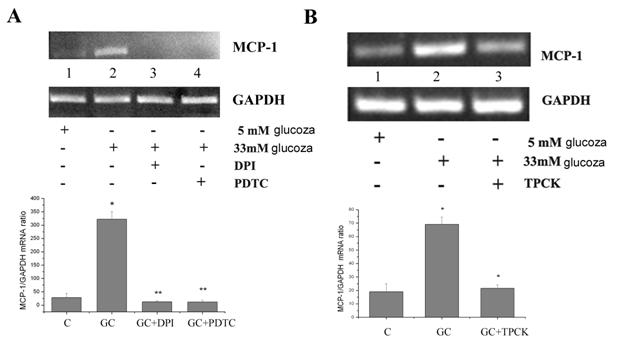
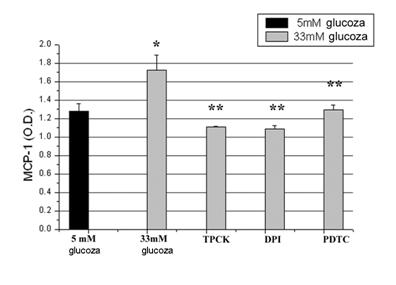
Expresia MCP-1 indusa de glucoza crescuta in celulele endoteliale umane este redusa de inhibitori ai ROS si NF-kB
Inainte de a studia mecanismele implicate in efectele medicamentelor asupra expresiei MCP-1, am incercat sa identificam modul in care glucoza crescuta induce expresia MCP-1. Dat fiind ca anterior am aratat ca celulele endoteliale umane activate cu glucoza crescuta produc nivele crescute de ROS [Dragomir et al 2004] si ca stresul oxidativ activeaza factorii de transcriptie implicati in expresia moleculelor proinflamatoare, ne-am intrebat daca ROS si factorul de transcriptie NF-kB sunt implicati in supra-expresia MCP-1 de catre glucoza. In acest sens am testat efectul unor inhibitorilor de ROS (DPI si PDTC) si a inhibitorului de NF-kB (TPCK) asupra expresiei genice si proteice a MCP-1. Dupa cum putem observa in figura 4, A si B ambii inhibitori de ROS dar si inhibitorul de NF-kB scad semnificativ (p<0.01 in cazul DPI, p< 0.005 in cazul PDTC si p<0.05 in cazul TPCK) expresia genica a MCP-1, validand implicarea speciilor reactive de oxigen si a NF-kB in inducerea expresiei MCP-1.
Figura 4. Efectul inhibitorilor de ROS si NF-kB asupra expresiei MCP-1
Aceste date sunt confirmate de experimentele de expresie proteica eliberata in mediul de cultura. Astfel, atat inhibitorii de ROS cat si cei de NF-kB reduc nivelele de MCP-1 eliberate in mediu (figura 5).
Figura 5. Inhibitorii de ROS si NF-kB scad productia de MCP-1 in mediu de cultura.
2) Aspirina si activatorii de PPAR-α scad nivelele ROS induse de glucoza
In continuare am studiat mecanismele prin care aspirina, fenofibratul si clofibratul reduc expresia MCP-1. In acest scop am testat efectele directe ale acestor medicamente asupra nivelelor de ROS intracelulare si am obtinut ca acestea sunt reduse radical (apropiat de nivelul ROS din celulele control) de toate medicamentele folosite (figura 6).
Figura 6. Efectul medicamentelor asupra nivelelor ROS
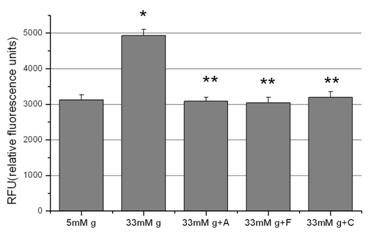
In cazul aspirinei ne asteptam la acest rezultat pentru ca in studiile noastre anterioare am obtinut acelasi efect anti-oxidant al aspirinei [Dragomir et al 2004] iar un alt studiu a aratat ca aspirina previne dezvoltarea hipertensiunii in sobolanii hraniti cu glucoza datorita proprietatilor antioxidante [El Midaoui et al., 2002]. In cazul activatorilor de PPARa, se stia doar ca PPARa are un rol major in controlul stresului oxidativ celular in imbatranire [Poynter and Daynes, 1998] si ca protejeaza impotriva lezarilor cerebrale prin mecanisme anti-inflamatoare si anti-oxidante [Deplanque et al., 2003]. Rezultatele noastre aduc dovezi noi pentru proprietatile benefice ale PPARa asupra endoteliului vascular in conditii hiperglicemice.
3) Aspirina si activatorii de PPARa scad activitatea NADPH oxidazei
Celulele endoteliale produc ROS si prin activarea NADPH oxidaxei (principala sursa de ROS in celulele vasculare). Numerosi stimuli care activeaza NADPH oxidaza vasculara genereaza ROS [Mohazzab et al., 1999]. Astfel, ne-am intrebat daca aspirina, fenofibratul si clofibratul reduc ROS prin actiunea asupra enzimei NADPH oxidaza si am testat efectul acestora asupra activitatii NADPH ozidazei. Rezultatele arata glucoza induce o crestere mare a activitatii NADPH oxidazei (p<0.001) comparativ cu controlul (figura 7). Acest efect a fost mult atenuat atat de aspirina (p<0.01) cat si de fenofibrat (p<0.01) si clofibrat (p<0.01).
Figura 7. Activitatea NADPH oxidazei
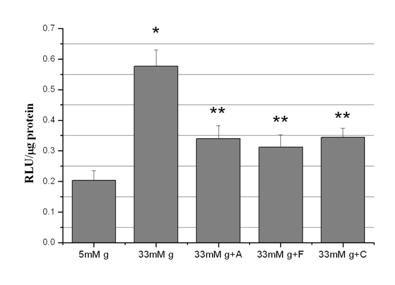
Pentru a determina rolul NADPH oxidazei in producerea de ROS, am facut experimente in care activitatea enzimei a fost masurata in celule control, celule expuse la 33mM glucoza si celule expuse la 33mM glucoza si tratate cu medicamente, dar activitatea enzimei a fost determinata in prezenta de inhibitorul specific al NADPH oxidazei, DPI (10mM). In aceste conditii, in toate cazurile, activitatea NADPH oxidazei a fost redusa la acelasi nivel. In contrast, inhibitori ai altor surse de ROS, ca allopurinol (inhibitor al xantin oxidazei), NG-nitro-L-arginine methyl ester (inhibitor al sintazei oxidului nitric) si rotenona (inhibitor al oxidazei lantului transportor de electroni mitocondrial) nu au avut efect. Aceste date sugereaza ca glucoza a stimulat producerea ROS in CE prin activarea NADPH oxidazei.
4) Expresia NF-kB si AP-1 este inhibata de aspirina, fenofibrat si clofibrat
NF-kB si AP-1 sunt doi factori de transcriptie implicati in reglarea MCP-1 [Martin et al., 1997; Shyy et al., 1995]. Pentru a testa efectul medicamentelor asupra acestor doi factori de transcriptie, am analizat expresia proteica nucleara a subunitatilor p65 (subunitate a NF-kB) si c-jun (subunitate a AP-1). Rezultatele obtinute arata ca expunerea CE la concentratie crescuta de glucoza timp de 48 ore duce la activarea factorilor de transcriptie NF-kB si AP-1, reflectata in cresterea expresiei nucleare a subunitatilor p65 si c-jun (figura 8, A si B). Aspirina, fenofibratul si clofibratul reduc activarea celor doi factori de transcriptie prin scaderea expresiei subunitatilor p65 (p<0.05) si c-jun (p<0.01).
Figura 8. Efectul medicamentelor asupra factorilor de transcriptie NF-kB si AP-1
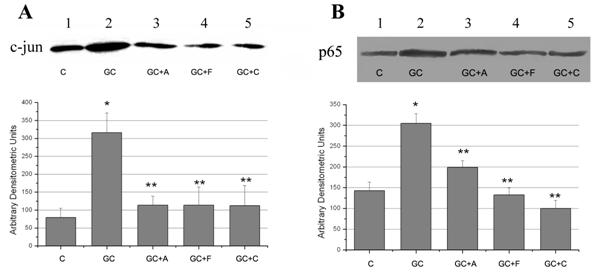
Studiile anterioare au demonastrat ca activitatea crescuta a factorului de transcriptie AP-1 in raspuns la diferiti stimuli este datorata cel putin partial sintezei subunitatii c-jun si doar eventul subunitatii c-fos [Karin, 1995]. Rezultatele noastre arata o crestere semnificativa (de aproape 3 ori) a expresiei c-jun in celulele stimulate cu glucoza crescuta, reflectand astfel o crestere a activitatii AP-1. Corespunzator, scaderea expresiei nucleare a c-jun si p65 de catre aspirina, clofibart si fenofibrat sugereaza ca aceste medicamente reduc expresia MCP-1 prin scaderea activitatii factorilor AP-1 si respective, NF-kB.
5. Concentratia crescuta de glucoza scade expresia PPARa in CE umane
Celulele endoteliale exprima toate cele trei izoforme de PPAR. S-a aratat ca PPARa interfera negativ cu raspunsul inflamator, antagonizand calea de semnalizare a NF-kB [Delerive et al 1999]. Ulterior s-a aratat ca exista un antagonism bidirectional intre PPARa si calea de semnalizare a NF-kB [Delerive et al 2001]; supra-expresia PPARa inhiba expresia genelor tinta ale NF-kB. Analiza promotorului a aratat ca PPARa controleaza transcriptia interleukinei-6, interferand negativ cu NF-kB si AP-1. Pentru ca datele noastre demonstreaza ca glucoza creste expresia subunitatilor NF-kB si AP-1 si data fiind legatura dintre PPARa si acesti factori, ne-am gandit sa ne uitam la efectul glucozei crescute asupra expresiei PPARa
Figura 9. Modularea expresiei genice si proteice a PPARa de catre glucoza crescuta
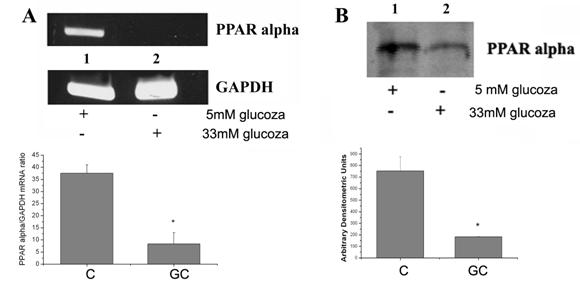
Interesant, datele noastre arata in celulele endoteliale expuse la glucoza crescuta expresia genica (p<0.05) si proteica (p<0.05) a PPARa este redusa semnificativ (figura 9).
Aceste date arata ca, in CE, glucoza crescuta reduce expresia PPARa, eveniment care poate face parte dintr-un mecanism celular complex care are ca efect cresterea activarii NF-kB si AP-1, si ulterior, inducerea moleculelor pro-inflamatoare.
c. DISCUTII SI CONCLUZII
S-a aratat ca NF-kB actioneaza ca reglator critic al expresiei induse a multor gene inflamatoare. In plus, anterior am aratat ca glucoza crescuta creste activitatea NF-kB [Manduteanu et al., 2003].
In acest studiu am obtinut ca concentratia crescuta de glucoza creste expresia genica si proteica a MCP-1 prin activarea cailor de semnalizare NF-kB si AP-1 in celulele endoteliale umane. Aceste date confirma datele obtinute de un alt grup care demonstreaza de asemenea ca expresia MCP-1 este crescuta de glucoza, insa prin calea p38MAPK [Takaishi et al., 2003]. Informatiile noi aduse de acest studiu sunt ca medicamentele anti-inflamatoare aspirina si activatorii de PPAR-a reduc semnificativ expresia genica is proteica a MCP-1 si ca expresia factorului nuclear PPAR-a, ale caror proprietati anti-inflamatoare sunt dovedite, este redusa de concentratiile crescute de glucoza.
Asa cum am amintit, efectele benefice ale aspirinei sunt atribuite rolului sau anti-agregant. Totusi acest medicament este larg folosit ca anti-inflamator [Kopp si Ghosh, 1994]. Studii recente arata ca aspirina are proprietati biologice asupra vasculaturii independente de prostaglandine, contribuind la reducerea evenimentelor cardiovasculare ischemice la pacientii cu hipertensiune si ateroscleroza [Monobe et al., 2001]. Printre aceste efecte se numara reducerea mediatorilor pro-inflamatori [Cyrus et al., 2002], imbunatatirea disfunctiei endoteliale, sau scaderea activarii factorului de transcriptie NF-kB [Kopp si Ghosh, 1994].
Activatorii de PPAR-a reduc efectele pro-inflamatoare ale citokinelor asupra celulelor vasculare si scad concentratiile citokinelor la pacientii cu ateroscleroza si hiperlipoproteinemie [Madej et al., 1998]. Fenofibratul si Wy 14649 blocheaza inducerea MCP-1 de catre proteina reactiva C (Pasceri et al., 2001). In experimentele noastre fenofibratul si clofibratul reduc expresia MCP-1 in conditii de glucoza crescuta.
De asemenea, datele noastre arata ca inhibitorul de NF-kB si inhibitorii de specii reactive de oxigen reduc expresia genica si proteica a MCP-1 indusa de glucoza in celulele endoteliale umane. In incercarea noastra de a elucida mecanismele implicate in efectele benefice ale aspirinei si activatorilor de PPARα asupra expresiei MCP-1 indusa de glucoza am gasit speciile reactive de oxigen sunt reduse sever de aceste medicamente. Activitatea NADPH oxidazei a fost inhibata de aspirina si activatorii de PPARα, ceea ce explica efectul acestor medicamente asupra speciilor reactive de oxigen. Dat fiind ca anterior am demonstrat ca aspirina inhiba activarea PKC [Dragomir, 2004], putem afirma ca aspirina reduce activitatea NADPH oxidazei prin inhibarea activarii PKC. In cazul activatorilor de PPARα, s-a artat ca Wy 14643 reduce partial activarea PKC indusa de LDL oxidat in celulele endoteliale [Martin-Nizard et al., 2002]. Astfel, este posibil ca si in cazul nostru, efectul fenofibratului si clofibratului asupra NADPH oxidazei sa fie prin intermediul reducerii PKC. Un alt posibil mecanism de reducere a activitatii NADPH oxidazei de catre activatorii de PPARα este prin actiunea directa a acestora asupra subunitatii esentiale a NADPH oxidazei, p22phox. In acest sens exista controverse, grupul lui Inoue demonstrand ca activatorii de PPARα si PPARg scad expresia p22phox [Inoue, 2001], iar grupul lui Staels a demonstrat va agonistii de PPARα induc expresia genica a subunitatilor p47phox, p67phox, si gp91phox [Teissier et al., 2004]. Datele noastre preliminare (rezultatele nu sunt prezentate aici) arata ca fenofibratul si clofibratul scad expresia proteica a subunitatilor p67phox si p47phox in CE activate de glucoza crescuta.
Se stie ca ROS induc activarea factorilor de transcriptie inflamatori NF-kB si AP-1, care joaca un rol important in cresterea expresiei MCP-1 in celulele endoteliale [Lakshminarayanan et al., 2001; Martin et al., 1997]. Promotorul chemokinei MCP-1 contine situsuri de legare pentru NF-kB. Aspirina, fenofibratul si clofibratul reduc activarea NF-kB si AP-1 indusa de glucoza crescuta. Astfel, putem concluziona ca efectele benefice ale acestor medicamente, de a reduce expresia MCP-1 in conditii de glucoza crescuta sunt datorate reducerii activitatii factorilor de transcriptie NF-kB si AP-1, prin scaderea nivelului speciilor reactive de oxigen care sunt inerente conditiilor hiperglicemice.
Este de asemenea foarte interesant este ca datele noastre demonstreaza ca in celulele endoteliale activate de glucoza crescuta expresia genica si proteica a PPARa este redusa. Cunoscandu-se efectele benefice, anti-inflamatoare ale PPARa, scaderea expresiei acestuia in conditii hiperglicemice poate constitui unul din evenimentele care contribuie la disfunctia endoteliala in diabet. Privind din punct de vedere al mecanismului prin care scaderea PPARa afecteaza endoteliul, putem presupune ca o scadere a PPARa implica activarea factorilor de transcriptie inflamatori NF-kB si AP-1 si ulterior disfuncie endoteliala.
Impreuna, toate aceste date demonstreaza ca: (1) aspirina, fenofibratul si clofibratul diminueaza expresia crescuta a MCP-1 in CE activate de concentratia crescuta de glucoza; (2) mecanismul de actiune implica reducerea ROS endoteliale prin reducerea activitatii NADPH oxidazei si ca urmare, reducerea activarii subunitatilor p65 si c-jun ale factorilor de transcriptie NF-kB, respectiv AP-1, de catre aceste medicamente.
Faptul ca activatorii de PPARa si aspirina reduc expresia moleculei inflamatoare MCP-1, dovedeste indirect rolul al acestor medicamente in hiperglicemie si poate conduce la o noua strategie farmacologica in ateroscleroza acelerata datorita diabetului.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1469
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved