| CATEGORII DOCUMENTE |
| Agricultura | Asigurari | Comert | Confectii | Contabilitate | Contracte | Economie |
| Transporturi | Turism | Zootehnie |
UNIVERSITATEA DE STIINTE AGRICOLE SI MEDICINA VETERINARA CLUJ-NAPOCA
ROLUL MICROORGANISMELOR IN CIRCUITUL ELEMENTELOR IN NATURA
1. Microorganismele
Notiunea de microorganism se refera la un grup vast si eterogen de organisme, diferite din punct de vedere morfologic, al activitatii biologice sau al pozitiei sistematice (Zarnea, 1970, p. 11), reunite de cateva caractere comune:
- dimensiuni reduse (microscopice), care le fac invizibile cu ochiul liber, si vizibile doar la microscopul optic (fotonic) sau electronic;
- organizarea in general unicelulara, rar cenocitice sau pluricelulare (Morari, 2003, p.11);
- structura interna relativ simpla;
- ocuparea unei pozitii inferioare pe scara filogenetica.
Micoorganismele ca obiect de studiu apartin microbiologiei, stiinta care studiaza urmatoarele grupuri taxonomice, in ordinea relativa a complexitatii lor structurale:
- prionii: entitati proteice infectioase, lipsite de material genetic propriu;
- viroizii: entitati infectioase alcatuite din ARN liber;
- virusi: entitati corpusculare infectioase, incapabile de existenta autonoma in afara unei celule vii;
- bacteriile: organisme unicelulare fara nucleu clar diferentiat;
- archaea: organisme similare bacteriilor, diferentiate de acestea pe baza structurii genetice si a unor particularitati de organizare, specifice, in general, mediilor extreme;
- alge microscopice;
- ciuperci microscopice: drojdiile (levurile) si mucegaiurile;
- protozoarele.
Desi nu sunt organisme propriu-zise, fiind lipsite de atributele structurale si functionale ale organizarii celulare (Zarnea, 1970, p. 11), prionii, viroizii si virusii sunt incadrati in categoria microorganismelor (Balasoiu et al., 2004, p. 5), datorita respectarii celorlalte caractere comune mentionate anterior.
2. Ciclurile naturale ale elementelor
Notiunea de ciclu natural al unui element este frecvent utilizata in ecologie si stiintele naturii sub titulatura de ciclu biogeochimic sau ciclu de nutrienti (www.wikipedia.org). In definitie, un astfel de ciclu este o cale prin care un element chimic sau o molecula circula prin compartimentele biotice (biosfera) si abiotice (litosfera, pedosfera, atmosfera si hidrosfera) ale ecosistemului planetar. In esenta, elementul este reciclat, dar, in anumite cicluri exista compartimente (denumite rezervoare) unde elementul respectiv se acumuleaza si este stocat pentru o perioada indelungata de timp. In acest context, se vorbeste de rezervoare propriu-zise, in care elementul respectiv este stocat, el fiind disponibil intr-o masura mai mare sau mai mica, si asa numitele "imperfectiuni accidentale" (Zarnea, 1994, p. 796), respectiv cantitati de materie scoase din circuit prin depunere in forme stabile, pentru intervale mari de timp (cum este cazul carbonului din humus, combustibili fosili, etc.).
Elementele chimice, compusi chimici, precum si alte forme de materie sunt transmise de la un organism la altul si de la o parte a biosferei la altul prin intermediul acestor cicluri biogeochimice.
Cele mai cunoscute si studiate cicluri biogeochimice trateaza circuitul apei, carbonului, oxigenului, sulfului, azotului, fosforului si hidrogenului in ecosistem, datorita dimensiunilor mari si a cantitatii mari de materie si energie implicate, dar si a utilitatii informatiei din punct de vedere al societatii umane. Activitatea microorganismelor este in legatura cu toate aceste cicluri, poate doar cu exceptia celui al apei, independent in mare masura de activitatea biologica a acestui grup.
Ciclul carbonului implica participarea atmosferei, hidrosferei, pedosferei, litosferei si biosferei, fiind, probabil, cel mai complex circuit natural. Schematic vorbind, carbonul este eliberat in atmosfera in mare parte sub forma de dioxid de carbon, provenit din arderea combustibililor fosili, respiratie animala si vegetala, reactii de descompunere a materiei vii, reactii chimice naturale sau provocate antropic ale rocilor calcaroase, eruptii vulcanice si fenomene metamorfice, sau eliberare la suprafata apelor incalzite, de unde este preluat fie de organisme fotosintetizante si prelucrat pentru procese metabolice, fie de apele oceanice si cele interioare si stocat, majoritar in forma de ion bicarbonat (in jur de 90% stocat sub aceasta forma, www.wikipedia.org), sau, in cantitati mici, la suprafata rocilor calcaroase, prin reactie chimica. In cadrul acestui ciclu, cantitati mari de carbon sunt stocate in patru forme: in masa organica vegetala si animala, in rezerve de carbon din sol, sub forma de combustibili fosili, sau sub forma ionica in masa apelor oceanice si continentale.
Ciclul oxigenului (fig. 1) cuprinde, de asemenea, componente ale tuturor geosferelor, dar este desfasurat predominant prin intermediul atmosferei si biosferei, si poate fi descris schematic prin doua procese antagonice: fotosinteza (producere de oxigen) si respiratie (consum de oxigen). Oxigenul este stocat in trei rezervoare: litosfera si mantaua (99,5% din oxigen, blocat in roci care contin silicati sau alti oxizi), biosfera (oxigen cuprins in molecule componente ale sistemelor vii) si hidrosfera (oxigenul din compozitia moleculei de apa).
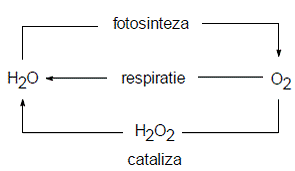
Figura 1. Circuitul simpificat al oxigenului in biosfera (dupa Duca si al., 2002, p. 58)
Ciclul azotului este de o importanta majora in procesele biologice, datorita prezentei acestui element in componenta aminoacizilor si, deci, a proteinelor, precum si in bazele care constituie structura acizilor nucleici. Ciclul este initiat de la azotul atmosferic, prezent in cantitate foarte mare (79,05% din compozitia atmosferei), de unde este preluat si fixat in sol si plante, prin mecanisme specifice, pentru a fi, ulterior, eliberat in atmosfera de procese antagonice celor mentionate anterior. Majoritatea etapelor acestui ciclu sunt mediate de microorganisme, fie in mod direct, fie indirect (prin simbioza, de exemplu).
Ciclul fosforului este, de asemenea, de mare importanta biologica, datorita prezentei acestui element in structura acizilor nucleici, dar si in cea a elementelor generatoare de energie in organisme (adenozin fosfatii). Datorita formei solide sub care se gasesc, de obicei, compusii acestui element, atmosfera nu participa la acest ciclu (www.enviroliteracy.org). Fosforul este preluat de producatorii primari din sol sau apa, de obicei sub forma de ioni (ortofosfatul fiind cel mai frecvent, www.wikipedia.org), este incorporat in materia organica, urmeaza lanturile trofice, pentru a fi eliberat de actiunea descompunatorilor, si a reajunge in sol sau apa.
Ciclul sulfului (fig. 2) in natura este complicat si nu este cunoscut in intregime. Sulful este raspindit in sistemele biologice, el intrind in componenta a doi aminoacizi: metionina si cisteina. Rolul biologic al sulfului este legat de facilitarea transformarilor oxidoreducatoare, care joaca rolul principal in formarea structurilor cuaternare ale proteinelor si in restructurarea lor conformationala, dar si de importanta acestui element in lantul transportor de electroni. Ciclul cuprinde eliberarea sulfului in atmosfera, fie ca hidrogen sulfurat, eliberat din procese de descompunere, fie ca oxizi de sulf, emisi de catre instalatiile industriale, fie ca dimetilsulfit si dimetildisulfura sau alti compusi eliminati de organismele vii, de unde este preluat de catre organismele capabile de procesare fie din aer, fie de pe sol sau din apa.
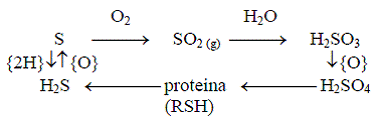
Figura 2. Circuitul simplificat al sulfului (dupa Duca si al., 2002, p. 67):
- echivalentul oxidant (acceptor de 2 electroni, atomi de H); - echivalentul bielectronic reducator
Ciclul hidrogenului este denumirea sub care este cunoscuta reactia scindarii si reformarii apei, avand ca produs intermediar hidrogenul, folosit, de regula, ca sursa energetica. Definirea este incompleta, dat fiind faptul ca exista si alte modalitati de reactie ce implica prezenta acestui element (cum ar fi metanogeneza, spre exemplu), modalitati care contribuie la circulatia generala a hidrogenului in ecosistem si care sunt duse la indeplinire prin intermediul unor grupe de microorganisme. Pentru evitarea confuziilor, traseul biogeochimic al acestui element va fi numit circuitul hidrogenului. In cadrul acestui circuit, rezervorul principal de hidrogen este apa.
Cicluri biogeochimice similare fosforului si sulfului sunt proprii si altor elemente chimice (K, Na, Mg, Fe, Mn, Co, Zn, Cu) care se afla in compozitia oricarui organism. Datele oferite de geochimie si biologia contemporana nu sunt insa in aceeasi masura de bogate pentru aceasta categorie de elemente.
Ciclurile biogeochimice insumeaza caile de circulatie ale elementelor in natura, si, desi in mod conventional sunt prezentate separat, ele sunt interconectate si interdependente, realizand, in ansamblu circuitul global al materiei in natura. In cadrul fiecarui circuit deosebim doua compartimente: rezervorul si compartimentul de ciclare. Un model simplificat al unui circuit biogeochimic surprinde, in general, alternanta organic anorganic. In realitate exista numeroase etape intermediare, reactii fizice (solubilizari, precipitari, volatilizari), chimice (oxidari, reduceri, hidrolize) si activitati biologice (mineralizari, biosinteze), care concura la realizarea circuitelor biogeochimice complexe (Simion-Gruita, 2003).
3. Influenta microorganismele asupra ciclurilor biogeochimice
Organismele vii preiau constant din litosfera, sol, apa si atmosfera cantitati mari de elemente pe care le folosesc pentru sinteza de constituenti celulari sau pentru obtinerea energiei necesare manifestarilor vitale (Zarnea, 1970, p. 578). Organismele fototrofe (plante si bacterii fototrofe), ca punct de pornire al ciclului, au capacitatea de a sintetiza substante organice, avand ca baza doar dioxidul de carbon atmosferic si apa cu substante minerale din sol; o parte dintre aceste minerale au rol biologic primordial (N, S, P, Fe si K), altele fiind necesare doar in cantitati reduse (Mn, As, Al, Mo, B, Cu, Zn sau Co). Aceste substante incorporate in forme organice traverseaza lanturile si retelele trofice, si se reintorc in sol dupa moartea ocupantilor diferitelor nivele, dar intr-o forma care le face inutilizabile de catre fototrofe. In acest mod, se produce o saracire constanta a mineralelor din sol, care completeaza pierderile produse de eroziune, prin intermediul carora materia ajunge final in mediile oceanice, unde e depusa dupa procesare ca sediment (idem).
Reglarea acestui proces este conditionata de activitatea microorganismelor, capabile sa mineralizeze materia organica, si, prin aceasta, sa redea substantele circuitului, impiedicand acumularea mineralelor in structuri organice si mentinand un echilibru intre materia organica si cea anorganica. In plus, microorganismele impiedica epuizarea rezervelor de azot din sol si ape, prin fixarea acestui element (idem, p. 579), si au roluri bine determinate si in circuitul carbonului si al oxigenului. Chiar si in mediile acvatice, unde un rol important in remineralizare il are zooplanctonul, rolul microorganismelor este esential datorita unor particularitati, cum sunt caracterul ubicuitar, activitatea metabolica intensa, capacitatea extraordinara de multiplicare si activitatea degradativa asupra unor substante dificile, cum sunt moleculele complexe (celuloza, lignina, chitina), neobisnuite (hidrocarburi, fenoli) sau "recalcitrante" (substante de sinteza) (Zarnea, 1994, p. 796).
Dintre organismele cuprinse in conceptul de microorganism, bacteriile, arheele, algele microscopice si microfungii au rolul predominant. Rolul virusilor, prionilor, viroizilor si protozoarelor in circuitul general al materiei este de amploare redusa: ei joaca rol de reglare a populatiilor bacteriene in anumite conditii, influentand indirect ciclurile elementelor; protozoarele stau la baza lanturilor trofice detritivore, prin calitatea lor de bacteriofagi, reintroducand in circuitul natural substante acumulate in celulele bacteriene; virusii sunt principali responsabili de liza celulara in conditii extreme, cand protozoarele bacteriofage nu mai supravietuiesc (la salinitate peste 20%, Gunde-Cimerman, 2005, p. 560), astfel ca rolul lor este important in functionarea acestui tip de sisteme.
3.1. Rolul bacteriilor, arheelor, algelor microscopice si microfungilor in circuitul azotului
Circuitul azotului (fig. 3) este mult mai complex decat al celorlalte elemente biogene, si este influentat de rezerva uriasa de azot liber din atmosfera. Fitofiziologii impart ciclul biogeochimic al azotului in doua sectiuni (Bran si Ildiko, 2004):
- ciclul mare, in care se utilizeaza si se inscrie in circuit fondul urias de rezerva (79,05% din compozitia atmosferei);
- ciclul mic, in care circulatia azotului se desfasoara intre organisme si sol, fara participarea fondului de rezerva.
Implicarea bacteriilor si a celorlalte microorganisme se refera, in special, la ciclul mic al azotului, dar acesta nu poate fi tratat in afara circulatiei generale a acestui element. Se presupune ca microorganismele sunt responsabile pentru circa 90% din transformarile substratelor organice din sol, iar comunitatile lor pot cuprinde sute de mii de specii diferite pe suta de grame de sol, cu o biomasa estimata la ordinul a sute de kilograme la hectar (Buscot, 2005, p. 291).
In atare conditii, microorganismele participa predominant la doua categorii de procese: descompunerea materiei moarte si utilizarea substantelor rezultate pentru formare de substante humice, ambele cu participanti bacterieni si fungici specifici (idem, p. 142).
In plus, hifele ciupercilor din sol ofera suport pentru formarea agregatelor de sol, care contribuie determinant la fertilitatea solurilor (si implicit la disponibilitatea azotului), iar activitatea lor metabolica ofera produsi de tipul polizaharidelor, glomalinului sau lipidelor, cu rol in stabilitatea acestor agregate (idem, p. 108-113).
In mod natural, azotul se gaseste in cantitati mari in atmosfera, dar sub forma inaccesibila a azotului molecular N2, a carei tripla legatura plantele nu o pot desface. Fixarea biologica a oxigenului este realizata de organisme denumite diazotrofe, dupa reactia:
N2 + 8H+ + 8e− + 16ATP → 2NH3 + H2 + 16ADP + 16Pi (idem, p. 160).
Azotul fixat biologic reprezinta 65% din azotul fixat total, restul provenind din surse antropice (sub forma de NH3) sau naturale (indeosebi in urma descarcarilor electrice, sub forma de NO-). (idem, p. 168).
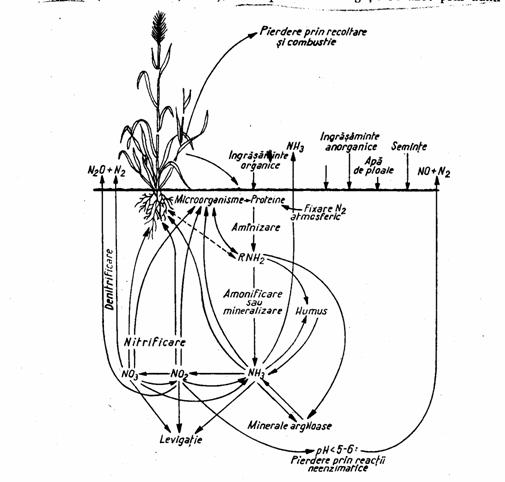
Figura 3. Circuitul azotului in natura cu indicarea rolului proceselor microbiene din sol
(dupa Zarnea, 1970, p. 580)
In ceea ce priveste acest aport, el este puternic modificat recent, prin cresterea semnificativa a aportului de azot antropogenic, de la un total de aproximativ 15 109 kg/an, in 1890, la circa 140 109 kg/an in 1990 (Widdison si Burt, 2007).
Organismele implicate in fixarea azotului sunt numeroase, ele fiind clasificate in doua categorii:
- organisme care fixeaza liber azotul atmosferic, cum sunt reprezentanti ai genurilor bacteriene Azotobacter, Azospirillum, Beijerinckia, Chromatium, Clostridium, Desulfovibrio, Klebsiella, Paenibacillus, Pseudomonas, Rhodopseudomonas, Rhodosospirillum, Thiobacillus etc. (Buscot, 2005, p. 161-168); dintre arhee fixeaza azot doar membrii grupul Euryarchaeota (Klipp et al., 2004, p. 66); in aceasta categorie sunt incluse organisme care populeaza medii extrem de diverse: sol, apa, suprafata rocilor etc.
- organisme care fixeaza azotul in urma unor procese legate de simbioza cum sunt reprezentanti ai genurilor bacteriene Rhizobium, Bradyrhizobium, Sinorhizobium, Mesorhizobium, Azorhizobium, Allorhizobium, etc., sau al cianobacteriilor din genurile Frankia, Nostoc sau Anabaena (Buscot, 2005, p. 161-168), care fac parte din rizosferele aferente radacinilor plantelor superioare, sau bacterii prezente in nodozitatile de pe frunze, cum este cazul cu Mycobacterium rubiaceum la Rubiaceae (Bran si Ildiko, 2004).
Procesul de fixare a azotului este strans legat de enzima denumita nitrogenaza (care este enzima fixatoare de azot), productia ei fiind coordonata de un set de gene denumite gene nif, identificate la peste o suta de specii (Masepohl, 2007), izolata prima data la clostridii (C. acetobutylicum, C. beijerinckii, C. butyricum, si C. pasteurianum) (Klipp et al., 2004, p. 53). Cercetarile in domeniu au aratat ca circa 10% din genurile bacteriene chemotrofe contin nitrogenaza, avind, deci, capacitatea de a fixa azot atmosferic (Zarnea, 1994, p. 801), iar dintre cele fototrofe, 92% contin enzima (idem, p. 803). Marele dezavantaj al acestei enzime este sensibilitatea ei la actiunea oxigenului (oxigenul inactiveaza ireversibil hidrogenaza, fiind inhibitor pentru aceasta, probabil ca rezultat al interactiei proteinelor Fe, Klipp et al., 2004, p. 73), astfel ca microorganismele diazotrofe sunt, in mare parte anaerobe si sunt incapabile de fotosinteza, cele doua functii - fixarea azotului si fotosinteza - fiind considerate incompatibile.
Totusi, un grup de cianobacterii (membrii ai genurilor Anabaena, Nostoc, Anabaenopsis, Aphanizomenon, Nodularia, Cylindrospermum, Cylindrospermopsis, Scytonema, Calothrix, Chlorogloeopsisa, Fischerella etc.) pot realiza ambele procese, fiind printre putinii reprezentanti ai lumii vii capabili de acest fenomen: speciile respective formeaza, in lipsa azotului extern fixat, celule denumite heterochisti, folositi pentru fixarea azotului, in timp ce celulele normale vor asigura functia fotosintezei; aceasta metoda este folosita tocmai pentru a proteja nitrogenaza de actiunea oxigenului (idem, p. 74). Un mecanism similar apare la cianobacterii filamentoase (genurile Oscillatoria, Plectonema, Spirulina etc.), care diferentiaza anumite celule ale filamentului pentru fixarea azotului, eliminand din aceste celule reactiile producatoare de oxigen ale fotosintezei (Zarnea, 1994, p. 809).
Anumite cianobacterii fara heterocisti, cum sunt unii membrii ai genurilor Trichodesmium sau Katagnymene, sunt capabile, de asemenea, de ambele procese (Klipp et al., 2004, p. 111): dat fiind ca oxigenul si nitrogenaza sunt incompatibile, cianobacteriile opereaza alternativ cele doua aspecte, fotosinteza si fixarea azotului, ultima in absenta luminii (idem, p. 112). In fine, streptomicetul Streptomyces thermoautotrophicus dispune de o nitrogenaza speciala, puternic oxid-dependenta, toleranta la oxigen, fiind singura specie la care a fost identificata o astfel de substanta. (idem, p. 292).
Acest dezavantaj este rezolvat usor de microorganismele "asociate" cu plantele (Zarnea, 1994, p. 804), care sunt prezente in nodozitati care ofera izolare fata de mediul extern, protejandu-le de concurenta cu speciile prezente in sol, dar protejand si nitrogenaza de actiunea oxigenului. Din cauza eficientei ridicate, fixarea azotului prin acest mecanism are o pondere mult mai ridicata, fixarea libera a azotului fiind considerata sporadica, dificila si cu rol extrem de redus in fertilitatea solului (idem, p. 803).
Azotul din materia organica moarta (proteine, aminoacizi, acizi nucleici) este degradat de microorganisme la amoniac, proces denumit amonificare sau mineralizare, valabil si pentru alte substante organice cu continut de azot ajunse pe sol (in majoritate uree si acid uric excretate de animale). La acest aspect contribuie un larg numar de microorganisme (bacterii, arhee si microfungi), denumite in mod generic saprofite sau descompunatori, care au importantul rol in circuitul elementelor de a mineraliza toate categoriile de elemente chimice, pentru a le face accesibile din nou organismelor fototrofe. Rolul acestor organisme nu se reduce la circuitul azotului, ele fiind in egala masura importante si pentru circuitul celorlalte elemente chimice.
Amonificarea are doua faze sau etape, ambele cu participanti caracteristici:
- etapa nespecifica (proteoliza) este efectuata de microrganisme heterotrofe banale: Pseudomonas sp., Arthrobacter sp., Proteus sp., diferite specii de Bacillus, Clostridium sau Flavobacterium, fungi din genurile Aspergillus, Mucor, Penicillium, Alternaria etc., prin intermediu enzimelor de tip proteinaze si peptidaze, carora li se adauga efectul proteinazelor de origine vegetala si animala (Zarnea, 1994, p. 812); in aceasta faza, compusii organici complecsi sunt hidrolizati la molecule ce pot patrunde in celule, fiind fie utilizate de alte microorganisme, fie degradate ulterior in etapa specifica de amonificare;
- etapa specifica a amonificarii consta in eliberarea amoniacului, sub actiunea microrganismelor din sol, din compusii rezultati din etapa nespecifica, dar si din uree, acid uric, glucide aminate etc.; au fost descrise mai multe cai metabolice de dezaminare, cum ar fi dezaminarea oxidativa, la Proteus sp., Aspergillus niger, Escherichia coli, Pseudomonas aeruginosa, dezaminarea reductiva, specifica bacteriilor anaerobe, descrisa la genul Clostridium, dezaminarea desaturata, la Escherichia coli, Proteus sp., Clostridium sp., Neurospora sp., dezaminarea prin deshidratare, descrisa la Escherchia coli si Neurospora crassa, etc. (idem, p. 813).
Amoniacul astfel produs poate fi fixat in argile sau sol, poate fi asimilat ca atare de plante sau microorganisme, se poate evapora, sau poate fi convertit la nitrat printr-un proces in doua faze denumit nitrificare:
- in prima serie de reactii, amoniacul este oxidat la nitrit, cu NH2OH ca produs intermediar:
NH3 + O2 + 2H+ + 2e− → NH2OH + H2O → NO2− + 5H+ + 4e− (Buscot, 2005, p. 160).
- in a doua faza, nitritul este oxidat la nitrat, fara intermediari observabili:
NO2− + H2O → NO3− + 2H+ + 2e− (idem, p. 161).
Microorganismele implicate in aceasta etapa sunt puternic specializate, fiind denumite nitrificatori: membrii genurilor Nitrosomonas, Nitrosococcus, Nitrosospira, Nitrosolobus si Nitrosovibrio sunt cei care oxideaza amoniacul la nitrit (nitrit bacteriile sau nitrosobacteriile), iar bacterii din genurile Nitrobacter, Nitrococcus, Nitrospina sau Nitrospira oxideaza nitriti la nitrati (nitrat bacteriile) (Zarnea, 1994, p. 815). Coaborarea dintre cele doua grupuri este extrem de stransa, impiedicand acumularea in sol a nitritilor, toxici pentru organismele din acest mediu. Aceasta etapa este conditionata de prezenta oxigenului, conditie obligatorie pentru nitrificatori, reactiile specifice desfasurandu-se cu o intensitate direct proportionala cu cantitatea de oxigen (idem).
Nitrificarea este extrem de importanta in circuitul azotului, deoarece aduce substantele azotate din mediu la forma lor cu cea mai mare accesibilitate pentru plante (idem, p. 817).
In ultima etapa a acestui ciclu, azotul este eliberat sub forma moleculara in atmosfera, si ciclul este reluat. Etapa este realizata pe doua cai: o cale aeroba, denumita denitrificare, constand in reducerea nitratilor la azot, si o cale anaeroba, care ocoleste nitrificarea, transformand direct amoniacul in azot molecular, cunoscuta ca oxidare anaeroba a amoniacului sau annamox.
Denitrificarea este un proces chimic de reducere progresiva a nitratilor, dupa schema NO3- → NO2- → NO → N2O → N2, a carei ecuatie redox este:
2NO3- + 10e- + 12H+ → N2 + 6H2O (www.wikipedia.org).
Procesul complet implica mai multe categorii de microorganisme, responsabile pentru diferitele parti ale reactiei (de exemplu, anumiti membrii ai genurilor Streptomyces sau Bacillus au functie doar de reducatori ai nitratului la nitrit). Un grup larg de bacterii, format din Thermoproteaceae, Cytophagaceae, Corynebacteriaceae, Streptomycineae, Bacillaceae, Rhodospirillaceae, Rhodobacteriaceae, Rhizobiaceae, Burkholderiaceae, Nitrosomonadaceae, Neisseriaceae si Pseudomonaceae, pot activa ca denitrificatori, dar aceasta functie este dominant efectuata de grupurile Pseudomonas, Ralstonia-Burkholderia, Xanthomonas-Frateuria, Bacillus si Streptomyces-Arthrobacter (Buscot, 2005, p. 161-168).
Oxidarea anaeroba a amoniacului (annamox) este reactia de reducerea a amoniacului la azot molecular pe cale directa, dupa ecuatia:
NH4+ + NO2- → N2 + 2H2O (www.annamox.com)
Acest tip de reactie a fost pus in evidenta de data recenta, fiind, se pare, responsabil de 50% din cantitatea de azot molecular produsa in oceane (www.wikipedia.org). Doar patru genuri bacteriene au fost identificate pana in prezent: Brocadia, Kuenenia, Anammoxoglobus (cu specii dulcicole), si Scalindua (cu specii marine) (www.annamox.com), dar cercetarile se afla in faza incipienta. Rolul acestor organisme in circuitul general al azotului este important, din cauza reducerii productivitatii primare oceanice, prin eliberarea directa a azotului.
Denitrificarea coexista cu alte doua tipuri de reactii specifice microorganismelor: reducerea asimilatorie a nitratilor (produsa de un numar mare de bacterii, arhee, fungi filamentosi, levuri, dar si de alge si plante superioare, avand ca rezultat amoniac folosit direct pentru biosinteza celulara, deci care nu se acumuleaza in mediu) si reducerea dezasimilatorie incidentala (denumita respiratie nitrat/nitrit, prin intermediul careia nitratul este redus la nitrit sau chiar la amoniac, specifica multor genuri bacteriene), dar aceste modalitati au impact extrem de redus asupra circuitului general al azotului (Zarnea, 1994, p. 818-819).
Dupa cum se observa, rolul microorganismelor, si in principal al bacteriilor si arheelor in circuitul azotului in natura este determinant, in fiecare etapa a acestui ciclul fiind necesare microorganisme, pentru a efectua transferul elementului de la forma organica la cea anorganica sau invers. Rolul acestor organisme este cu atat mai important cu cat ele pot activa in conditii climatice sau de umiditate extreme (Stres et al., 2007), in mediu acvatic, terestru sau in interiorul solului, impiedicand blocarea unor cantitati de substanta in forme care le-ar exclude din circulatia generala.
In mod indirect anumite organisme pot influenta circulatia azotului, cum este cazul bacteriilor din genul Azospirillium, fixatoare de azot, deci cu rol direct in circuit, dar care produc hormoni similari cu ai plantei, influentand cresterea mai puternica a radacinii, si, deci, formarea unui sistem de absorbtie si de fixare a azotului mai eficient (Buscot, 2005, p. 205). In plus, anumite specii de microorganisme (bacterii, arhee, fungi) prezinta mecanisme de rezistenta la poluarea cu metale grele sau alte substante nocive, si isi desfasoara in conditii aproximativ normale functiile, putand mobiliza substantelor din sol pentru consumul plantelor, ceea ce constituie un avantaj pentru acestea din urma in propria dezvoltare (idem, p. 332-340).
3.2. Rolul bacteriilor, arheelor, algelor microscopice si microfungilor in circuitele carbonului, oxigenului si hidrogenului
Circulatia carbonului (fig.4), este strans legata de activitatea energetica a biosferei, reducerea lui chimica la compusii organici constituind modul principal de inmagazinare si transfer ale energiei de catre sistemele vii. Ciclul biogeochimic al carbonului releva faptul ca cea mai mare parte (95%) din acest element se afla depozitat in litosfera, sub forma de carbonat de calciu si alti carbonati, deci intr-o forma mai putin accesibila.
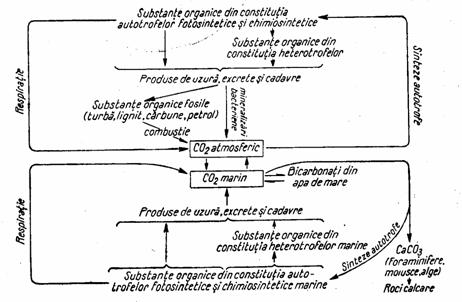
Figura 4. Schema generala a circulatiei carbonului in natura
(dupa Zarnea, 1970, p. 436)
Producatorii primari consuma anual aproximativ 105 miliarde tone de dioxid de carbon, din care 32 miliarde tone (aproximativ 30%) se reintorc relativ repede in atmosfera datorita respiratiei acelorasi organisme (Bran si Ildiko, 2004). Cea mai mare contributie la reintoarcerea dioxidului de carbon in atmosfera o au celelalte categorii de organisme, care elimina anual in atmosfera circa 73 miliarde tone (idem).
Carbonul ocupa un loc deosebit in biosfera deoarece serveste ca material de constructie pentru viata organica si reprezinta o sursa de energie ce se elibereaza in procesul respiratiei. Cantitatea de carbon din biosfera este aproximativ 9% raportat la cel atmosferic (Buscot, 2005, p. 140). La fel de important este si rolul carbonului anorganic: CO2 din atmosfera contribuie la reglarea climei iar sistemul CO2 - carbonat regleaza permanent pH-mediului acvatic (Duca si al, 2002, p.62-63).
Circuitul oxigenului este de importanta majora in contextul functional al ecosistemului planetar. Se considera ca acumularea acestui element in atmosfera, inceputa acum circa 1,8 miliarde de ani (Zarnea, 1994, p. 824) a stat la baza diferentierii organismelor pluricelulare si a inlaturat limitarea posibilitatilor de existenta a organismelor de la mediile acvatice.
In momentul de fata atmosfera contine aproximativ 1,2x1015 t O2. In urma fotosintezei
se formeaza anual 2,3x1011 t substanta organica uscata si 2,5x1011 t O2. Aproape toata aceasta
cantitate de oxigen este folosita in procesele de respiratie si fermentatie a substantelor organice de catre organismele heterotrofe, nefotosintetizatoare, in special bacterii. In urma acestei activitati bioxidul de carbon se intoarce in atmosfera si este folosit de catre plante la fotosinteza (Duca si al., 2002, p.57). Se apreciaza ca cea mai mare parte, daca nu chiar intreaga cantitate de oxigen liber prezent an atmosfera este de origine biogena, iar intreaga cantitate de materie organica din biosfera actuala este rezultatul fotosintezei (Cloud si Gibor, 1970, in Zarnea, 1994, p. 825).
Cantitatea de oxigen nefolosita de organismele heterotrofe se apreciaza dupa masa substantei organice care se depune in roci si iese din circuitul global al compusilor organici. Viteza de acumulare a carbonului organic este de circa 1,4-3,0x107 t/an, ceea ce corespunde la 5-8x107 t O2, adica 0,4% din oxigenul fotosintetic. Rezervele totale de carbon fosil sunt de circa 1,25x1016 t (Duca si al., 2002, p.57). O alta sursa de oxigen atmosferic o constituie procesul de fotodisociere a moleculelor de apa, proces ce influenteaza foarte putin bilantul lui total (idem).
Cele doua mari circuite biogene (al carbonului si al oxigenului) sunt in mare masura interdependente, iar acest lucru este cel mai bine reprezentat de ecuatia reactiei fotosintezei, procesul major la care cele doua elemente participa:
6 CO2 + 6 H2O + energie luminoasa = [CH2O] + 6 O2 (Zarnea, 1994, p. 825)
Prin aceasta reactie chimica se asigura circulatia ambelor elemente si se produc substantele functionale necesare vietuitoarelor. In mod invers, prin procesul de respiratie, dar si prin procesele de descompunere a materie organice moarte, oxigenul si carbonul sunt reunite sub forma de CO2, si ciclul se reia. Intregul proces este mediat de ionii de hidrogen, care fac parte, pe rand, din moleculele organice si din cele de apa, astfel ca cele trei cicluri biogeochimice sunt puternic legate unul de celalalt (fig. 5)
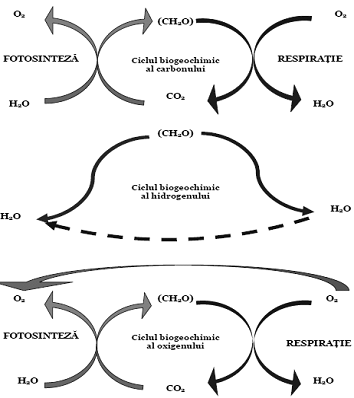
Figura 5. Ciclurile interdependente ale carbonului, oxigenului si hidrogenului
(dupa Soran si Borcea, 1985)
Dintre microorganisme, participantii la acest complex de cicluri biogeochimice fac parte doua mari categorii:
- microorganismele fotosintetizante, cum sunt anumite grupuri bacteriene, o parte dintre cianobacterii, algele microscopice si un grup restrans de protozoare (Fitomastiginele din increngatura Flagellata); desi rolul lor este considerat redus in contextul general al fotosintezei, rolul microorganismelor nu poate fi neglijat, tocmai datorita capacitatii lor de adaptare in conditii extreme (cantitate redusa de oxigen, cantitate redusa de energie luminoasa, cantitate redusa de azot disponibil etc.), unde realizeaza fotosinteza in absenta plantelor verzi (aceste aspecte le ofera avantaje si in competitia cu plantele, fie prin capacitatea sporita de asimiliare si inmultire, fie prin particularitati functionale - capacitatea de fixare a azotului, forme de rezistenta, aerobioza facultativa etc.); cercetari de data recenta par sa schimbe aceasta perceptie: cianobacterii de tip Prochlorococcus realizeaza jumatate din fotosinteza din largul maselor oceanice, cu rol extrem de important in circuitul carbonului, a carui cantitate atmosferica s-ar tripla in absenta acestei activitati (Nadis, 2003).
- microorganismele saprofite, grup din care fac parte arhee, bacterii, fungi, care redau carbonul si oxigenul sub forma de CO2 circuitului natural; activitatea acestor organisme se realizeaza in doua medii principale: pe sol si, mai ales, in sol, unde exista microorganisme capabile sa descompuna materia organica, de la substante simple, de tipul glucidelor sau amidonului, la structuri chimice mai dificile, cum sunt celulozele si hemicelulozele, pectina, cutina sau chitina (Zarnea, 1970, p. 583), si in mediile acvatice, unde o parte importanta din materia organica descompusa este transformata in CaCO3, depozitat pe fundul bazinelor oceanice (echivalentul a 600 milioane de tone pe an CO2), el fiind redat circuitului in proportie redusa prin respiratie sau eruptii vulcanice subacvatice (idem).
In afara de circuitul elementelor legat de fotosinteza, microorganismele participa si la alte aspecte disparate ale circuitului celor trei elemente mentionate.
Bacteriile si microfungii au un rol important in formarea humusului, proces prin intermediul caruia cantitati mari de carbon sunt sustrase din circuitul global pentru perioade relativ indelungate; in plus, ele ofera, prin intermediul diversilor metaboliti produsi, elemente folosite pentru a creea structura solului, accelerand prin aceasta procesul de humificare.
De asemenea, este cunoscut rolul microorganismelor in formarea depozitelor de hidrocarburi, in care sunt cuprinse cantitati impresionante de carbon, oxigen si hidrogen, mai ales in fazele initiale ale genezei acestor hidrocarburi, in asa numita etapa biologica a genezei (Zarnea, 1994, p. 929, 935).
Cu un rol mai restrans in circuitul carbonului si al hidrogenului sunt circa 50 de specii de arhee anaerobe, apartinand grupului Euryarcheota, care sunt cunoscute ca metanogene, din cauza faptului ca au ca produs metabolic metanul, ca urmare a folosirii hidrogenului ca agent reducator si a dioxidului de carbon ca sursa carbonatica (www.wikipedia.org).
Microorganismele sunt cunoscute pentru capacitatea lor de a descompune substraturi dificile chimic. Prin aceasta caracteristica, ele pot reda circuitului natural anumite cantitati de substanta, care altminteri ar fi fost inaccesibila. Un exemplu in acest sens este capacitatea unor microorganisme de a degrada hidrocarburile fosile, activitate importanta in conditiile unor deversari accidentale, cu efecte nocive in mediu. Mai mult, anumite specii pot activa in conditii extrem de vitrege, cum este cazul hipersalinitatatii: archaee din genurile Haloferax si Halorubrum sunt active la 32% concentratie a sarurilor in mediu, streptomicete ca Streptomyces albiaxialis, la 30%, tulpini de Bacillus si Staphylococcus, la 15% (Gunde-Cimerman, 2005, p. 112). Archaee halofile pot avea efect indirect in acest sens, fiind introduse in sol sarat pentru a accelera activitatea biologica, si a cataliza prin asta degradarea hidrocarburilor de catre specii de Pseudomonas si Rhodococcus (idem, p. 113).
Nu in ultimul rind, este cunoscut rolul microorganismelor, in special al cianobacteriilor si arheelor anaerobe, in procesele de legate de eutrofizarea apelor (Bran si Ildiko, 2004).
Dupa cum s-a enuntat, microorganismele au un rol important in circuitul biogeochimic al carbonului, oxigenului si hidrogenului, chiar daca nu este atat de important ca cel jucat in circuitul azotului, numarul mare de aspecte in care sunt implicate, unele chiar necesitand participarea obligatorie a unor grupuri de microorganisme, constituind un argument suficient in acest sens.
3.3. Rolul bacteriilor, arheelor, algelor microscopice si microfungilor in circuitele sulfului si fosforului
Spre deosebire de oxigen, hidrogen si azot, al caror fond de rezerva se afla in atmosfera sau in hidrosfera, in cazul fosforului, fondul de rezerva se afla in litosfera. Principalele rezerve de fosfor sunt reprezentate prin roci de tipul apatitelor si depozitelor de guano, de animale fosilizate. In concentratii diferite sunt dispersate pe toata suprafata uscatului. Prin descompunere si spalare de catre ape, rocile cedeaza fosfor biocenozelor din ecosistemele terestre. Absorbit de catre plante, fosforul intra in alcatuirea compusilor macroenergetici si a acizilor nucleici, conditionand desfasurarea transferurilor de energie si informatie in sistemele vii. Prin intermediul lanturilor trofice, compusii fosforului sunt transferati animalelor consumatoare si descompunatorilor (Bran si Ildiko, 2004).
Ciclul fosforului este relativ simplu din punct de vedere chimic, elementul fiind preluat ca fosfat anorganic solubil din sol de catre microrganisme si plante, si incorporat in forma organica prin esterificarea ionului fosfat. Dupa moartea organismelor, fosfatul organic eliberat este reconvertit in forma anorganica, pe tot acest parcurs elementul ramanand parte a gruparii fosfat, iar circulatia lui in ecosistem se produce in aceeasi stare de oxidare (Zarnea, 1994, p. 796).
Transformarile se reduc la trecerea de la forma anorganica, insolubila, imbilizata, la cea organica, in care elementul este solubil si mobil.
Rolul microorganismelor in circulatia acestui element este determinant, ele intervenind in mineralizarea, solubilizarea si mobilizarea lui, facandu-l accesibil plantelor, dar si in depozitarea temporara a elementului in interiorul celulei.
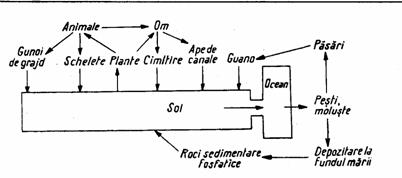
Figura 6. Circulatia fosforului in natura
(dupa Zarnea, 1970, p. 585)
Fosforul mineral (sub forma de fosfati de Na, K, Ca, Mg, Fe) este transformat de microorganisme in patru moduri (Zarnea, 1970, p. 584):
- transformarea metafosfatilor in ortofosfati (ciuperci de tip Aspergillus sau Penicillium);
- reducerea fosfatilor la fosfiti, hipofosfiti si fosfuri;
- disponibilizare fosfatilor naturali, insolubili prin diferite mecanisme: solubilizarea fosfatilor de calciu si mobilizarea fosforului legat de aluminiu si fier, prin eliminarea unor compusi metabolici ai microfungilor si bacteriilor (Thiobacillus sp.); cresterea difuziei fosforului, prin eliberarea de substante cu care acesta concura pentru absorbtie minerala (mucilagii fungale sau mai ales bacteriene); eliberarea de fosfor organic prin descompunerea resturilor organice (Buscot, 2005, p. 179-183);
- utilizarea directa de catre unele microorganisme (Penicillium glaucum, Aspergillus niger) a circa o treime din fosfatul tricalcic prezent in mediu, cu eliberarea fosforului la moartea organismului intr-o forma accesibila plantelor.
Fosforul organic, sub forma de dejectii animale si tesuturi animale si vegetale moarte ajunse pe sol, este redat circuitului biologic printr-un proces in doua faze (Zarnea, 1970, p. 584-585):
- scindarea lui cu formare de acid fosforic, sub actiunea bacteriilor (in principal membrii genului Bacterium) levurilor (Saccharomyces sp., Candida sp.) sau microfungilor (Aspergillus sp., Penicillium sp., Alternaria sp.), acid legat imediat de bazele din sol, trecand in saruri insolubile pentru plante;
- dizolvarea sarurilor de catre bacterii nitrice, thiobacterii si chiar unii amonificatori (Bacillus mycoides), cu formare de fosfati tri-, di- si monocalcic, care inchis ciclul.
Fosforul organic este cel cu importanta majora in circuit, datorita cantitatii reduse a acestui element in scoarta terestra (circa 0,15%, Bran si Ildiko, 2004), astfel ca disponibilitatea fosforului este redusa in sol, datorita, in principal, reactiei rapide a formei organice cu aluminiu, calciu si fier (Buscot, 2005, p. 177), si vitezei reduse de metabolizare a sarurilor formate; din acest motiv, microorganismele pot intra in competitie cu plantele pentru fosfor, in conditii vitrege, pentru a sustine continutului ridicat de acizi nucleici din celula lor (idem, p. 184).
Circuitul sulfului se aseamana, in multe privinte, cu cel al fosforului (fig.7). Sulful parcurge un circuit activ sub forma redusa (H2S) sau oxidata (SO2, SO42-), strabatand cu intensitate variata toate invelisurile exterioare ale Pamantului. Cantitatea antrenata in acest circuit este evaluata la 185 x 106 tone (Bran si Ildiko, 2004). In forma redusa, acest circuit este explicat de transformarile dintre cel mai redus element, sulfura, si cel mai oxidat, sulfatul, transformari in care microorganismele joaca un rol important; in plus, sulful este important in constructia celulara, putand ajunge la 1% din greutatea uscata (Loka Bharathi, 2008).
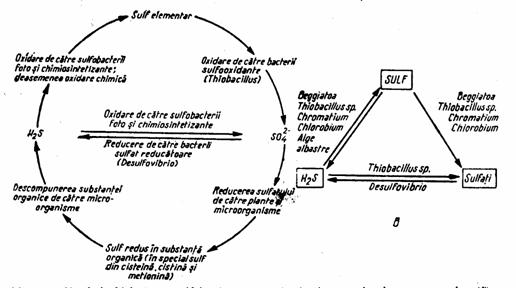
Figura 7. Circulatia biologica a sulfului in natura, cu indicarea microorganismelor care o produc (B)(dupa Zarnea, 1970, p. 588)
Compusii cu sulf existenti in natura (anumiti aminoacizi, vitamine, ca forme organice, sulf elementar, hidrogen sulfurat, sulfuri, sulfati si alte forme anorganice) isi au originea, in cea mai mare parte, in resturi animale, vegetale si microbiene, dar si in produsii metabolici ai unor microorganisme; cu importanta mai redusa pentru circuitul elementului sunt compusii sulfului din atmosfera, proveniti din eruptii vulcanice, arderi sau degajare din sol (Zarnea, 1970, p. 586).
Rolul microorganismelor in circuitul sulfului se refera la mineralizarea acestui element, transformand sulful organic, acumulat din tesuturi animale si vegetale moarte, inaccesibil plantelor, in forma anorganica. Procesul imbraca mai multe forme (idem, p. 586-588):
- degradarea materiei organice, cu formare de H2S, mecaptani si diferiti compusi oxidati ai sulfului, sub actiunea microflorei nespecializate de putrefactie (genurile bacteriene Proteus si Clostridium); acesti compusi pot fi folositi si de microorganisme pentru propriile nevoi metabolice;
- reducerea formelor oxidate (SO42-, SO3-, S2O32-), prin procesele de reducere asimilatorie, realizata pentru folosirea acestora ca sursa de sulf de microorganisme nespecializate (Proteus vulgaris, Escherichia coli, Pseudomonas sp.) si de reducere dezasimilatorie, realizata de bacteriile din genul Desulfovibrio, care utilizeaza compusii sulfului in respiratie, producind cantitati mari de H2S;
- oxidarea sulfului (atat a formelor reduse, cat si a compusilor partial oxidati), fie de catre bacterii sulfooxidante fotosintetizante (Thiocystis sp., Thiocapsa sp., Rhodocapsa sp., Chlorobium sp.), care depun in celula sulf elementar pentru a-l folosi in lipsa elementului din
mediu, fie de catre bacterii sulfooxidante chemosintetizante (genurile Thiobacillus, Thiospirillium, Thiococcus), care folosesc energia eliberata prin oxidarea sulfului pentru reducerea CO2.
Circulatia sulfului in natura este puternic influentata de catre microorganisme, prin mineralizarea acestui element din forma organica, neasimilabila, si reintroducerea formei anorganice in circuit (Zarnea, 1970, p. 588). Aceasta mineralizare este realizata fie prin incorporarea in propria celula, fie prin transformarea lui in sulfati, singura forma asimilabila de catre plantele verzi (idem).
3.4. Rolul bacteriilor, arheelor, algelor microscopice si microfungilor in circuitele metalelor biogene
Cicluri biogeochimice similare fosforului si sulfului sunt proprii si altor elemente chimice (K, Na, Mg, Fe, Mn, Co, Zn, Cu) care se afla in compozitia oricarui organism. Datele oferite de geochimie si biologia contemporana nu sunt insa in aceeasi masura de bogate pentru aceasta categorie de elemente.
Resursele de elemente metalice variaza in limite extrem de largi, reprezentand fie componente esentiale ale masei terestre, fie concentratii infime in alcatuirea acesteia.
Volumul de cationi din organisme si circulatia acestora prin biosfera se limiteaza la cantitati reduse. Ele constituie insa elemente indispensabile vietii, prin rolul lor calitativ. Eliberarea cationilor din sistemele vii are loc prin procesele de excretie sau prin descompunerea materiei organice moarte. In mediul terestru, sursa principala de cationi biogeni este solul, aprovizionat permanent prin descompunerea rocii mama; in cel acvatic cationii sunt prezenti, de regula, in stare disociata si aprovizionarea se face prin antrenarea acestor elemente din substratul mineral.
Datele despre importanta microorganismelor in circuitul acestor sunt reduse si fragmentare, informatii mai detaliate fiind disponibile referitor la circuitul fierului.
Anumite specii bacteriene au capacitatea de a transforma fierul din forma solubila (cel mai adesea Fe2+) in forma insolubila (cel mai adesea Fe3+) si invers (Zarnea, 1970, p. 585). Solubilizarea compusilor organici ai fierului este produsa de o micoflora heterotrofa nespecifica (microorganisme proteolitice si amonificatoare), care duce la precipitarea fierului in forma organica, cu un rol mult mai important decat activitatea microorganismelor specifice (idem). Acestea din urma transforma compusii minerali ai fierului, fiind cuprinse in aceasta categorie forme acvatice ca bacteriile Spaerotilus natans, Leprothrix ochracea sau Crenothrix polispora, care formeaza filamente acoperite de o teaca mucilaginoasa impregnata cu hidroxid feric si hidroxid de mangan, Gallionela ferruginea sau Caulobacter blastocaulis, forme pedunculate, al caror peduncul poate fi impregnat cu hidroxid de fier, sau bacterii anaerobe sau facultativ anaerobe care reduc sau oxideaza succesiv cele doua forme ale fierului (Sporovibrio ferrooxidans oxideaza Fe2+ la Fe3+, in prezenta nitratilor, iar specii de Bacillus si Aerobacter reduc in sens invers) (idem, p. 586).
Rolul fierului in rizosfera este important, datorita cantitatii mici existente, elementul stand la baza unei competitii intre plante si microorganisme, dar si intre diferitele specii de microorganisme, competitie care a dus la crearea unor strategii de absorbtie rapida, care implica acidifieri locale, chelatii, reactii de reducere etc. (Robin si al., 2008)
Microorganismele au un rol important in eliberarea din roci a unor elemente cum sunt Ca, Fe, Mg, K, fie prin mecanisme fizice: hife si filamente introduse in fisuri, fie prin mecanisme chimice: eliberare de enzime, acizi, polizaharide, care slabesc rezistenta rocii (Buscot, 2005, p. 62). In fine, anumite specii de halobacterii acumuleaza KCl pentru a compensa salinitatea (Gunde-Cimerman, 2005, p. 229), avand un rol restrans in mobilitatea K.
Bibliografie
1. Balasoiu, M., Turculeanu, A., Avramescu, C., 2004, "Microbiologie generala", Editura Medicala Universitara, Craiova, 222 p.
2. Bran, F., Ildiko, I., 2004, "Ecologie generala", Editura ASE, Bucuresti, 270 p.
3. Buscot, F., Varma A., (eds.), 2005, "Soil Biology", Volume 3, "Microorganisms in soils: roles in genesis and functions", Springer
4. Cloud, P., Gibor, A., 1970, "The oxygen cycle", Scinetific American, p. 111-120
5. Duca, Gh., 2002, coord., "Chimie ecologica", USM, Chisinau
6. Gunde-Cimerman, N., (edt.), 2005, "Adaptation to life at high salt concentrations in Archaea, Bacteria, and Eukarya", Springer
7. Klipp, W., Masepohl, B., Gallon, J. R., Newton, W. E. (eds.), 2004, "Genetics and regulation of nitrogen fixation in free-living Bacteria", Kluwer Academic Publishers
8. Loka Bharathi, P.A., 2008, "Sulfur cycle", Encyclopedia of Ecology, p. 3424-3431
9. Masepohl, B., Forchhammer, K., 2007, "Regulatory cascades to express nitrogenases", Biology of the Nitrogen Cycle, p. 131-145
10. Morari, I, 2003, "Microbiologie generala", Editura Alma Mater, Sibiu, 392 p.
11. Nadis, S., 2003, "The cells that rule the seas", Scientific American, nov.
12. Robin, A., Vansuyt, G., Hinsinger, P., Meyer, J.M., Briat, J.F., Lemanceau, P., 2008, "Iron dynamics in the rhizosphere: consequences for plant health and nutrition", Advances in Agronomy Volume 99, p. 183-225
13. Simion-Gruita, A., 2003, "Cercetari asupra retelei trofice microbiene din ecosisteme acvatice eutrofe", raport de cercetare, nepublicat
14. Soran, V., Borcea, M., 1985, "Omul si biosfera", Bucuresti, Editura Stiintifica si. Enciclopedica
15. Stres, B., Bonete, M.J., Martnez-Espinosa, R.M., Mahne, I., Bothe, H., 2007, "Organisms of the nitrogen cycle under extreme conditions: low temperature, salinity, ph value and water stress", Biology of the Nitrogen Cycle, p. 369-379
16. Widdison, P.E., Burt, T.P., 2007, "Nitrogen cycle", Encyclopedia of Ecology, p. 2526-2533
17. Zarnea, G., 1970, "Microbiologie generala", Editura Didactica si Pedagogica, Bucuresti, 677 p.
18. Zarnea, G., 1994, "Tratat de microbiologie generala", vol V., Editura Academiei Romane, Bucuresti
19. www.annamox.com
20. www.enviroliteracy.org
21. www.wikpedia.org
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 9667
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved