| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Secretia proteinelor extracelulare la bacterii
Multe proteine raman solubile in citoplasma, iar altele sunt secretate prin membrana citoplasmatica.
Termenul de "secretie" semnifica trecerea unei molecule de la locul sintezei sale (citoplasma), prin membrana, la exteriorul celulei Gram pozitive sau in spatiul periplasmic al celulei Gram negative, iar cel de "translocatie" semnifica transferul extracitoplasmatic al unei molecule care ramane legata de membrana.
Toate celulele, eucariote si procariote secreta (exporta) proteine in spatiul extracelular.
Proteinele pentru export, la bacterii se sintetizeaza pe ribosomii asociati membranei plasmatice. Sinteza incepe cu o secventa semnal, de l8-35 aminoacizi, la capatul N-terminal. Prin secventa peptidica semnal, proteinele pentru export se deosebesc de cele citoplasmatice si se orienteaza spre calea de export. Orientarea este rezultatul legarii peptidului semnal, de membrana, fie direct, fie prin intermediul unei proteine citoplasmatice denumita chaperone (engl. = a insoti, a supraveghea).
Unele proteine destinate exportului nu apar niciodata in citoplasma, ceea ce sugereaza ca eliminarea lor se face pe masura ce sunt sintetizate. Ele sunt molecule relativ mici (20-40 kDa) si sunt flexibile pentru ca nu au legaturi S-S si, de cele mai multe ori, nici componenta glucidica. Pentru aceasta categorie de proteine, translocatia este cotranslationala. Secventa semnal hidrofoba N-terminala se angajeaza in traversarea membranei, inainte ca restul moleculei sa fie sintetizata. Dupa ce secventa semnal ajunge pe suprafata externa a membranei plasmatice, este clivata si digerata, iar proteinele exportate raman asociate membranei, pana ce plierea este completa.
Alte molecule se sintetizeaza complet, inainte de inceperea exportului. Dupa terminarea sintezei, moleculele destinate exportului nu dobandesc configuratia tertiara in citoplasma, deoarece factori proteici denumiti chaperoni*, interactioneaza cu polipeptidele nascente si blocheaza plierea lor, astfel incat proteinele sunt mentinute intr-o configuratie partial nepliata, compatibila cu transferul.
Chaperonii(chaperon, engl = a insoti, a supraveghea) s-au definit ca o familie de proteine celulare care mediaza plierea corecta a altor polipeptide si uneori asamblarea lor in structuri oligomere, dar care nu sunt componente ale structurilor functionale finale. Multe proteine se pliaza spontan, dar plierea initiala a unui numar mare de proteine celulare necesita asistenta chaperonilor. Proteinele care s-au pliat gresit sunt degradate proteolitic.
Circa 20% dintre proteinele sintetizate nu ajung la destinatia finala, datorita erorilor care au aparut in timpul transcrierii, traducerii sau pentru ca nu s-au pliat corect.
La bacterii, sinteza proteinelor are loc cu o rata foarte rapida: 15-20 aminoacizi/ribosom/secunda, ceea ce echivaleaza cu sinteza a 30 000 polipeptide/min. Rata inalta a traducerii necesita un control riguros al calitatii proteinelor. Circa 30% din totalul proteinelor, necesita asistenta chaperonilor. Decizia destinatiei unei proteine (pliere-degradare) trebuie luata rapid.
Chaperonii citoplasmatici participa la cateva cai specifice:
- asamblarea structurilor de suprafata ale celulei: flageli, fimbrii, pili
- asamblarea OMP
- secretia proteinelor in mediu.
Chaperonii asista plierea proteinelor in periplasma, cel mai probabil independenta de ATP, deoarece existenta ATP in periplasma este foarte improbabila.
Prevenirea plierii proteinelor este o etapa esentiala pentru exportul proteinelor, deoarece, dupa ce dobandeste structura tertiara definitiva, proteina nu mai poate fi exportata.
Chaperonii au functii multiple:
asista dobandirea conformatiei corecte a proteinelor care raman in citoplasma. Ele interactioneaza cu polipeptidul nascent si previn adoptarea conformatiei incorecte, pana este sintetizata proteina completa;
moleculele chaperone pot avea rol important in replierea proteinelor denaturate, constituind un mecanism important de protectie fata de agentul termic sau alte conditii de stress. Unele molecule chaperone sunt sintetizate specific in conditiile care duc la acumularea proteinelor denaturate si se numesc proteine de soc termic.
Molecula precursoare este orientata spre situsul sau membranar specific, prin intermediul peptidului semnal, al chaperonului sau al ambelor tipuri de molecule.
Proteinele structurilor de invelis sunt sintetizate de asemenea, pe polisomii atasati membranei citoplasmatice. Pe masura ce sunt sintetizate, catenele peptidice nascente sunt transferate in grosimea membranei. Unele se termina in membrana interna, iar altele in spatiul periplasmic sau in membrana externa.
Chiar si fosfolipidele apar initial in membrana interna si ulterior difuzeaza spre membrana externa.
La bacteriile Gram negative, translocatia este un proces complex, deoarece moleculele trec in spatiul periplasmic, printr-un proces dependent de energie. O proteina de translocatie (Sec A) localizata, se pare in membrana, leaga si hidrolizeaza ATP. Energia eliberata este utilizata pentru initierea translocatiei prin membrana citoplasmatica. Cele mai multe proteine secretate de bacteriile Gram negative raman in spatiul periplasmic si au o semnificatie metabolica (sunt enzime degradative). Majoritatea sunt proteaze si furnizeaza nutrienti asimilabili pentru celula. Membrana externa a peretelui celular nu are sursa de energie necesara excretiei. Din aceasta cauza, o proteina translocata in spatiul periplasmic, printr-un proces dependent de energie nu poate fi translocata printr-un mecanism similar, prin membrana externa. Probabil, intervin proteine specifice de translocatie ale membranei externe.
La bacteriile Gram pozitive, proteinele destinate membranei citoplasmatice si peretelui celular se sintetizeaza fara secvente semnal. Prin analogie cu exportul proteinelor la E. coli, proteinele membranei citoplasmatice sunt integrate spontan, prin interactiuni ionice si hidrofobe.
Tulpinile g. Bacillus sunt cele mai utilizate pentru producerea industriala a exoproteinelor. De aceea, mecanismul sintezei proteinelor s-a studiat la tulpinile acestui gen. Se secreta in special enzime degradative: proteaze, amilaze, RN-aza, levan-sucraza.
Proteinele de export se sintetizeaza cu o secventa semnal, de l8-35 aminoacizi, cu capatul amino incarcat pozitiv, urmat de o secventa hidrofoba. Sinteza exoproteinelor are loc pe ribosomii asociati membranei citoplasmatice. Mecanismul de export al exoproteinelor, la B. subtilis este probabil, asemanator cu cel de la E. coli.
La B. subtilis, proteinele translocate prin membrana sunt supuse clivajului secventei semnal si raman legate de peretele celular sau sunt eliberate in mediul extern.
Mecanismul de export al exoproteinelor este complicat de faptul ca, unele specii de Bacillus (dar nu B. subtilis), la exteriorul peptidoglicanului se gaseste un strat proteic. Un astfel de strat proteic nu este tipic numai celulelor Gram pozitive, deoarece este prezent si la numeroase tulpini Gram negative. Stratul proteic este prevazut cu pori, care permit trecerea proteinelor.
Unele proteine se sintetizeaza cu o secventa suplimentara de aminoacizi, localizata intre peptidul semnal si proteina propriu-zisa, denumita propeptid. Unele propeptide sunt lungi, altele scurte. Cele lungi sunt caracteristice proteazelor. Exoproteazele la B. subtilis sunt sintetizate ca preproenzime, adica au atat secventa semnal, cat si propeptidul. Propeptidul pare a avea mai multe functii:
in excretia moleculei de exoproteaza
impiedica activarea enzimei in timpul secretiei
leaga proteaza de membrana citoplasmatica
Datorita secventei propeptidului, la procariote, proteazele, asemanator celor de la eucariote sunt secretate sub forma inactiva, ca zimogen
Propeptidele scurte sunt formate din cateva resturi de aminoacizi. Functia lor nu se cunoaste. Dupa translocatie, exoproteinele sunt eliberate in mediu cu propeptidele scurte atasate, dar clivajul lor survine imediat.
Analiza genetica si biochimica a bacteriilor si a modelului experimental al culturii celulare infectata cu bacterii au ridicat mult nivelul cunoasterii componentelor moleculare implicate in interactiunile patogen-celula gazda. Progresele au conturat domeniul microbiologiei celulare, ca o zona noua a cercetarii microbiologice.
Agentii patogeni se disting de cei nepatogeni prin prezenta genelor specifice de patogenitate, adeseori organizate in insule de patogenitate, adica aglomerari de gene care par sa fi fost dobandite in evolutie pe calea transferului orizontal. Asa se explica faptul ca bacterii patogene neinrudite, poarta gene de virulenta inrudite.
Interactia bacteriilor patogene cu celula gazda se realizeaza prin factorii localizati pe suprafata sau secretati in spatiul extracelular. Proteinele bacteriene secretate sunt numeroase si diverse si indeplinesc functii multiple: proteoliza, hemoliza, citotoxicitate, fosforilare si defosforilare proteica
La bacteriile Gram negative s-au descris 4 cai de secretie proteica (I-IV). Al V-lea sistem pentru secretia macromoleculelor are rol in transferul conjugal al plasmidelor, in transferul ADN T la A. tumefaciens si in secretia toxinei de B. pertussis.
Caile de secretie sec-dependente de tip II si IV
Caile de secretie de tip II si IV implica o etapa a transportului prin membrana interna, inainte de transportul prin membrana externa. In ambele cazuri, proteinele sunt exportate prin membrana interna, in spatiul periplasmic, prin sistemul de secretie (sec). O caracteristica a exportului sec-dependent al proteinelor este secventa semnal hidrofoba N-terminala a proteinei exportate. Secventa semnal mediaza exportul proteinei si este clivata de o peptidaza specifica (semnal-peptidaza) periplasmica. La E. coli, calea sec cuprinde un numar de proteine ale membranei interne (Sec D, E, F, Y), o ATP-aza asociata membranei (Sec A), care furnizeaza energia de export, un chaperon (Sec B) ce se leaga de proteinele presecretoare si semnal-peptidaza.
In sistemul de secretie de tip II, transportul prin membrana externa necesita un set suplimentar de proteine ale membranei interne si externe. Cel mai studiat sistem de secretie tip II este al pululanazei la Klebsiella oxytoca. Aparatul de secretie cuprinde 14 proteine, dintre care cel putin 7 sunt localizate in membrana interna, iar Pul S si Pul D sunt proteine ale membranei externe.
Secretia de tip II este calea primara pentru sinteza enzimelor extracelulare degradative (enzime pectolitice, celulaze, proteaze) la bacteriile Gram negative.
Calea de secretie de tip IV cuprinde un grup de asa numiti autotransportori: proteazele care cliveaza IgA1 produse de N. gonnorrhoeae, N. meningitidis, H. influenzae, Str. pneumoniae si de reprezentanti ai microbiotei rezidente orale si faringiene, precum si o citotoxina vacuolanta secretata de H. pylori.
Proteazele sunt enzime proteolitice care cliveaza una dintre legaturile peptidice a regiunii balama a catenei H a IgA1.
Ca si in calea de tip II, proteinele sunt exportate din citoplasma pe calea sec si implica clivarea peptidului semnal N-terminal. Informatia necesara pentru transportul prin membrana externa rezida in intregime in proteina secretata. Aparent, proteinele autotransportoare formeaza un por in membrana externa, prin care ies, iar clivajul autoproteolitic elibereaza proteinele in supernatant.
In contrast cu caile II si IV, caile I si III sunt independente de sistemul sec si nu impica prelucrarea N-terminala a proteinelor secretate.
Calea de secretie de tip I este exemplificata de sistemul de secretie al a-hemolizinei la E. coli, al adenilat-ciclazei la B. pertussis, al leucotoxinei la Pasteurella haemolytica, al proteazei la Ps. aeruginosa si Erwinia chrysanthemi.
Calea de secretie de tip I necesita 3 proteine:
o ATP-aza cu rol de transport, din membrana interna (proteina din clasa ABC = ATP binding cassette)., care furnizeaza E pentru secretia proteinelor;
o proteina a membranei externe, care este exportata pe calea sec;
o proteina de fuziune membranara ancorata in membrana interna, ce traverseaza spatiul periplasmic.
Proteinele secretate pe calea de tip I nu sunt supuse clivajului proteolitic, iar semnalul de secretie este localizat in interiorul secventei de 60 de aminoacizi C-terminali ai proteinei secretate.
Secretia proteinei pe calea III se face in mod continuu, fara prezenta distincta a intermediarului periplasmic si este independenta de sistemul sec. Aparatul de secretie de tip III este alcatuit din circa 20 de proteine, majoritatea localizate in membrana interna. Acest sistem necesita o ATP-aza, probabil asociata membranei.
Cele mai multe proteine ale membranei interne sunt omologe cu componentele aparatului de biosinteza flagelara al bacteriilor Gram pozitive si Gram negative. Proteinele secretate pe calea sistemului III nu sunt supuse prelucrarii N-terminale in timpul secretiei. Semnalul pentru secretie este localizat in secventa de 15-20 aminoacizi a regiunii N-terminale a proteinei secretate.
Proteinele secretate pe calea III necesita proteine mici cu functie de chaperon, care protejeaza factorii secretati de interactia cu alte componente ale sistemului de secretie.
In contrast cu calea de scretie de tip I, care este o cale adevarata de secretie, pentru ca enzimele secretate sunt active in spatiul extracelular, sistemul de secretie de tip III pare a fi destinat translocatiei proteinelor de patogenitate, direct in citosolul celulei eucariote. In consecinta, secretia proteica, cel putin uneori, este reglata de contactul cu suprafata celulei tinta.
Unele sisteme de secreie de tip III asambleaza structurile supramoleculare pe suprafata celulei bacteriene (flageli, fimbrii, pili).
Pentru unele bacterii Gram negative, sistemul de secretie de tip III este un determinant de baza al virulentei. Mecanismul secretiei pe calea sistemului III este bine conservat la bacterii neinrudite filogenetic.
Multe dintre proteinele secretate interactioneaza direct cu componentele celulei gazda, alter nd transducerea semnalului celulei gazda si cele mai multe proteine secretate actioneaza in interiorul citosolului eucariot, in care sunt translocate prin mecanisme de scretie de tip III.
Sistemele de secretie de tip III s-au evidntiat la mai multe bacterii patogene: Yersinia pestis, Y enterocolitica, Y. pseudotuberculosis. Toate cele 3 specii inhiba activitatea fagocitelor si in consecinta au localizari extracelulare. Efectul antifagocitar este mediat de o proteina cu activitate tirozin-fosfatazica (Yop H). La contactul cu macrofagul, proteina Yop H este injectata in citosol, unde catalizeaza o defosforilare rapida si specifica a c torva proteine ale macrofagului.
Shigella flexneri are localizare predominant intracelulara si produce dizenteria bacilara, o diaree sanguina originara in colon. Invazia bacteriana a mucoasei colonice este trasatura esentiala a patogenezei cu Shigella.
Ca si alti enteropatogeni, Shigella invadeaza epiteliul la nivelul celulelor M. Dupa transcitoza prin celula M, bacteriile int lnesc macrofagele rezidente ale tesutului limfoid si induc apoptoza. Apoptoza macrofagelor duce la eliberarea IL-1, care determina un influx masiv de neutrofile in tesutul infectat.
Unele bacterii patogene pentru plante folosesc secretia de tip III pentru patogeneza, ca si patogenii animali. Sistemele de secretie de tip III sunt conservate la 4 g. majore: Erwinia, Pseudomonas, Ralstonia, Xanthomonas.
Secretia de tip III este esentiala pentru inducerea reactiei de aparare denumita raspunsul hipersensibil la plantele rezistente, care nu sunt gazde pentru patogen. Raspunsul hipersensibil este caracterizat prin necroza tisulara localizata, producerea fenolilor si a agentilor antimicrobieni la locul contactului bacterian care previne rasp ndirea ulterioara a infectiei in tesuturi.
Raspunsul HR este activ: necesita expresia genica de novo si sinteza proteinelor, fluxul Ca si activitate ATP-azica. In conditii naturale, raspunsul HR este microscopic, dar devine macroscopic prin infiltrarea artificiala a unui numar mare de bacterii fitopatogene.
Proteinele de virulenta ale bacteriilor sunt translocate in celula tinta. Termenul de translocatie semnifica transportul proteinelor din celula bacteriana prin membrana plasmatica a celulei eucariote, in citosol.
Sporul
Sporul este o forma primitiva de diferentiere celulara, care consta in reorganizarea structurala si functionala a celulei vegetative si formarea unui nou tip de celula, cu proprietati noi. Diferentierea celulara este un proces biologic fundamental.
Sporii se formeaza la bacteriile cilindrice: totdeauna la bacilii anaerobi din g. Clostridium si la actinobacterii, facultativ la cei aerobi din g. Bacillus (fig. 28), exceptional la coci (Sporosarcina). Toate bacteriile sporulate sunt Gram pozitive. Sporularea este conditionata de existenta unui perete mureinic gros.
Exista circa l0 tipuri de spori, ce se deosebesc prin modul de formare, prin structura si prin gradul de rezistenta la factorii de mediu. Cel mai caracteristic este endosporul, denumit astfel deoarece se formeaza in interiorul unei celule vegetative.
La actinobacterii se formeaza cateva tipuri de spori: artrospori (prin segmentare), oidiospori (prin fragmentare), aleuriospori (se formeaza apical sau lateral pe sporofori scurti), zoospori (spori mobili), iar aplanosporii se formeaza prin septarea hifelor si sunt mentinuti in interiorul unui invelis. La Azotobacter se formeaza chisti.
Endosporul sau sporul endogen a fost considerat ca unic tip sporal bacterian, pana la descrierea celorlalte tipuri. Are forma sferica sau ovalara. Cei ovalari au dimensiuni cuprinse intre 0,5 - 1 m, pentru axul scurt si 1,2 - 2 m pentru axul lung.
Evidentiere. Endosporul este o structura reringenta si in celula vie, la microscopul optic apare stralucitor. Datorita invelisurilor groase, greu penetrabile pentru coloranti (in special cortexul) si datorita continutului lor chimic particular, sporul se coloreaza prin tehnici speciale.
Pozitia sporului in celula poate fi terminala, subterminala sau centrala. Sporii pot fi deformanti (diametrul lor este mai mare decat al celulei) si nedeformanti (diametrul este mai mic decat al celulei).
Intr-o celula bacteriana sporulanta, sporul este unic, cu rare exceptii: in sol apar bacterii bisporulate, iar in intestinul unor vertebrate aquatice, s-au evidentiat bacterii polisporulate. Probabil ca sporii multipli apar ca rezultat al perturbarii mecanismului de separare a celulelor dupa diviziune. Ei se formeaza in celulele in care materialul nuclear s-a replicat, dar nu s-a format septul de diviziune.
Sporogeneza este declansata in mod obisnuit de lipsa unui nutrient esential in mediu (sursa de azot sau de carbon). Procesul este foarte complex din punct de vedere genetic, biochimic, structural si functional.
Sporularea implica activarea unui numar de peste 50 de gene sporale, inactive in celula vegetativa. Sub aspect biochimic, sporularea este insotita de modificari majore ale componentelor moleculare. Se sintetizeaza un set de proteaze care maresc turnover-ul proteic, furnizand aminoacizii necesari sintezei proteinelor noi.
Celula se divide asimetric, subpolar prin formarea septului sporal si se formeaza doua celule inegale. Septul sporal se initiaza sub forma a doua mici intruzii simetrice ale peretelui mureinic, spre interiorul celulei. Formarea completa a septului corespunde stadiului II.
In timpul diviziunii asimetrice, numai 1/3 din cromosom este prezent in structura presporala. Restul de 2/3 este pompat rapid de o translocaza, rezultand doua celule inegale, dar cu genomuri identice. Dupa diviziunea asimetrica, presporul si celula vegetativa sunt celule adiacente, complet separate.
In stadiul III, septul polar se subtiaza si se lizeaza din zona centrala spre periferie. Membrana citoplasmatica, dupa ce isi pierde punctele de legatura cu septul, incepe sa se plieze si acopera progresiv suprafata sporului. Cand plierea este completa, cele doua pliuri membranare fuzioneaza la polul celulei si celula sporala este complet inglobata in celula vegetativa.
In spatiul dintre cele doua membrane care inconjura presporul se depun cele doua straturi de peptidoglican: peretele celular primordial si cortexul (stadiul IV).
Stadiul V corespunde depunerii unei structuri proteice complexe pe suprafata externa a presporului, denumita invelisul sporal. Maturarea sporului si dobandirea rezistentei la caldura si la radiatiile UV corespunde stadiului VI. Liza celulei si eliberarea sporului matur reprezinta stadiul VII.
Schimbarile morfologice profunde care se produc in timpul sporularii sunt cuplate cu modificarea expresiei genelor, datorita activarii in cascada a factorilor s, care modifica specificitatea de legare a ARN-polimerazei, de promotorii diferitelor gene.
S-au izolat mutante bacteriene care blocheaza sporogeneza in diferite etape.
Diviziunea pentru sporulare se aseamana cu cea vegetativa, dar se deosebeste prin expresia genica diferita. Diviziunea pentru sporulare, fiind asimetrica, necesita relocalizarea aparatului de diviziune celulara. Asimetria morfologica a celor doua celule duce la evolutii ulterioare diferite.
Diviziunea vegetativa si cea de sporulare se deosebesc prin mai multe caracteristici:
septul de diviziune pentru sporulare este mai subtire decat septul diviziunii vegetative;
cele doua celule rezultate nu se separa, iar celula mama inglobeaza presporul;
autoliza peptidoglicanului din septul de diviziune incepe la centrul septului si progreseaza pana la liza completa a materialului septal. In contrast, autoliza materialului parietal al septului diviziunii vegetative incepe la periferia septului si progreseaza spre centru, dar nu e completa, deoarece septul va forma peretele polar al celor doua celule rezultate din diviziune;
dupa diviziunea de sporulare, in cele doua celule se initiaza programe diferite de expresie genica, controlate de factorii s care orienteaza legarea ARN-polimerazei de promotori diferiti.
Transferul ADN in prespor. In stadiul de filament extins in axul lung al celulei, originile celor doi cromosomi sunt situate langa poli. Diviziunea fiind asimetrica, presporul include 1/3 proximala a cromosomului, iar restul de 2/3 ramane in celula vegetativa. Ulterior, restul cromosomului este pompat activ, din celula mama, in prespor. Translocaza ADN este localizata la centrul septului de sporulare, ancorata de cromosom. Translocaza consuma energie, prin hidroliza ATP.
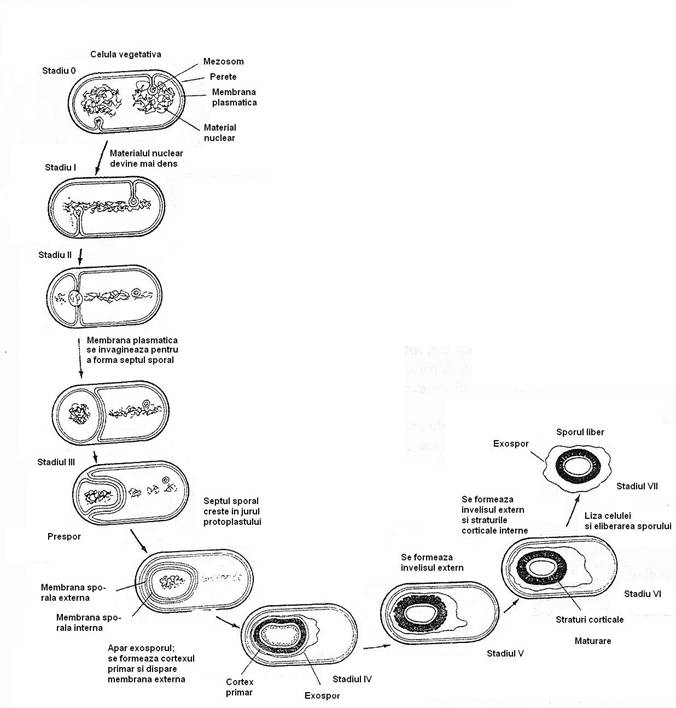
Fig. 31. Reprezentarea schematica a etapelor de formare a endosporului.
Structura interna a endosporului
La diferite grupe de bacterii exista variatii importante ale structurii sporului, in special in privinta invelisurilor, care difera prin numarul si grosimea lor. Exista de asemenea variatii cu privire la relatia sporului cu celula vegetativa in care s-a format: sporul ramane inclus in celula sau se elibereaza curand dupa formare, prin liza acesteia.
Sporul este alcatuit din protoplastul sporal, care contine sporoplasma si materialul nuclear. Protoplastul sporal este acoperit de urmatoarele structuri:
un perete intern subtire, originar din membrana interna a presporului. Dupa germinare, acesta va forma peretele celulei vegetative;
cortexul sporal, cu grosime variabila, electronoclar. Este o structura multilaminara ce se formeaza pe fetele adiacente ale celor doua membrane ale presporului si consta, in general, din peptidoglican si un lactam muramic specific sporului;
stratul extern al cortexului, derivat din membrana externa a presporului;
invelisul sporal intern (intina), un strat dens, de natura proteica;
invelisul sporal extern (exina). Uneori, aceste doua invelisuri sunt pluristratificate;
exosporul, un rest al celulei vegetative, uneori adiacent de celelalte invelisuri sporale, prin intermediul filamentelor "suspensoare".
Invelisurile sporale cuprind o fractie majora a sporului. Aceste structuri sunt de natura proteica, cu o fractie de polipeptide acide solubile in baze, in invelisul intern si o fractie rezistenta la baze, datorata legaturilor S-S.
La unele categorii de spori se gasesc structuri suplimentare denumite apendice sporale. Semnificatia lor functionala nu este certa, dar ar putea fi implicate in dispersarea sporilor in natura sau ar facilita absorbtia substantelor nutritive in perioada premergatoare germinarii sporului.
Particularitatile biochimice ale sporului
Sporularea este initiata ca raspuns la numeroase semnale externe si interne: epuizarea unui nutrient, densitatea celulara. Sporularea eficienta necesita o densitate celulara mare. Scaderea ampla a concentratiei GTP si GDP se coreleaza cu declansarea sporularii. Schimbarea specificitatii ARN-polimerazei este foarte importanta pentru controlul sporularii la B. subtilis. Cand incepe sporularea, multe gene active in celula vegetativa sunt represate si sunt activate genele specifice. Fiecare stadiu al sporularii este marcat de schimbarea expresiei unor gene, mediata de factorul s, care schimba specificitatea legarii de promotor a ARN-polimerazei.
Protoplastul sporal contine toate categoriile de molecule necesare reluarii cresterii: materialul nuclear si cantitati mici ale fiecarui component al aparatului de sinteza proteica (ribosomi, ARNt, enzime). Lipsesc componentele celulare instabile (ARNm si nucleozid-trifosfatii), dar exista precursorii lor mai stabili (nucleozid mono- si difosfati). Aminoacizii si enzimele lor de biosinteza sunt virtual absente, dar la germinare, ambele tipuri vor fi generate prin hidroliza proteinelor de depozit, solubile, cu molecula mica.
Putine enzime sporale deriva din enzimele celulei vegetative prin clivare. Majoritatea enzimelor sporale sunt noi. Sinteza lor este codificata de gene activate in timpul sporularii.
Toate enzimele sporale sunt termorezistente, fapt explicabil prin dimensiunile lor mici, fiind reprezentate numai de situsul activ al moleculei. Lipsesc enzimele fundamentale ale metabolismului celular, ca si sistemele transportoare de electroni.
La cele mai multe bacterii, ionii de Ca2+ lipsesc. In stadiile timpurii ale sporularii se activeaza sistemele de transport activ pentru Ca. Ionii de Ca sunt legati cu o cantitate echivalenta de acid dipicolinic (se formeaza din acidul diaminopimelic - un precursor al peptidoglicanului) (fig 33) si formeaza dipicolinatul, care poate constitui circa l5% din greutatea uscata a sporului.
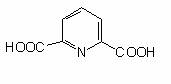
Acidul dipicolinic
S-a considerat ca sporul este rezultatul unui proces de deshidratare profunda. Cercetarile ulterioare au evidentiat ca deosebirile dintre spor si celula vegetativa nu sunt de ordin cantitativ, ci de ordin calitativ si se refera la starea apei. In celula vegetativa, apa libera reprezinta 70% din cantitatea totala, iar in spor oscileaza intre 3-l0%, restul de 90-97% fiind apa legata. Din aceasta cauza, sporul este lipsit de metabolism, sau are un metabolism de intensitate foarte mica, nedecelabila. Celula sporala este vie, dar procesele vietii sunt latente. Fenomenul se numeste criptobioza (viata ascunsa).
Consecinta particularitatilor de compozitie chimica, la care se adauga invelisurile groase multiple si pluristratificate, este rezistenta deosebita a sporului la caldura, la actiunea substantelor chimice (antiseptice, dezinfectanti) si a radiatiilor. Rezistenta termica este conferita de dipicolinatul de Ca. Mutatiile care reduc cantitatea de dipicolinat diminua rezistenta sporului la agentul termic.
Rezistenta termica a sporului impune o metodologie costisitoare de sterilizare, la temperaturi foarte ridicate. Uneori, sporii rezista la temperatura de l80 grade, de la cateva minute, la cateva ore. Fierberea nu este o metoda de sterilizare, deoarece omoara numai formele vegetative, iar sporii raman viabili.
Germinarea este procesul ireversibil in care sporul se activeaza de la starea dorminda, la o stare metabolic activa, intr-un interval scurt. L-alanina se leaga la un receptor specific pe suprafata invelisului sporal si initiaza germinarea, care decurge in trei stadii:
activarea sporului prin deshidratare, asociata cu marirea volumului;
germinarea, adica modificarea localizata prin gelificare a invelisurilor sporale;
emergenta celulei vegetative din invelisuri, delimitata de un perete derivat din peretele sporal intern.
Intr-un mediu nutritiv optim, germinarea este rapida: de la initiere pana la diviziunea celulara, procesul dureaza 90 de minute. In medii favorabile, majoritatea sporilor germineaza, dar o proportie mica raman dorminzi.
Pentru initierea germinarii, sporii necesita un factor suplimentar: un compus cu grupari -SH, pH acid. Dupa circa o ora de la inceputul activarii incepe sinteza ADN.
Semnificatia biologica a procesului de sporogeneza
Sporogeneza reprezinta o forma primitiva de diferentiere celulara si este o modalitate de adaptare a celulei bacteriene la conditiile nefavorabile de mediu, prin criptobioza. Mecanismele criptobiozei sunt necunoscute. Unul dintre ele ar putea fi starea speciala a enzimelor. Ele ar fi inactivate in mod reversibil. La randul ei, inactivarea reversibila poate fi determinata de trei factori:
prin modificari fizico-chimice ale moleculelor enzimatice;
prin actiunea unor inhibitori ai activitatii enzimatice;
prin lipsa unor metaboliti esentiali, care ar conditiona starea normala, activa, a enzimelor.
Endosporul este o structura de conservare a viabilitatii celulelor dotate cu aceasta capacitate de diferentiere. Nu este o forma de multiplicare, exceptand cazurile rare ale bacteriilor bi- sau polisporulate.
Sporogeneza este asociata, la B. subtilis, cu producerea unor enzime proteolitice, iar la B. thuringiensis, cu producerea cristalelor proteice parasporale. Acestea sunt netoxice in stare nativa (pretoxine), dar devin foarte toxice dupa solubilizarea in mediul alcalin intestinal al larvelor de lepidoptere, coleoptere sau de tantar.
Endosporul are o longevitate exceptionala: mii sau chiar sute de mii de ani. Sporii din rocile perioadei quaternare au germinat pe medii nutritive, in vitro.
Actinobacteriile sunt eubacterii care cresc sub forma unei retele de filamente ramificate, denumita miceliu coenocitic (fara pereti transversali).
Sporularea prin fragmentare este caracteristica genurilor Actinomyces, Nocardia etc. In faza stationara a culturii, miceliul filamentos se fragmenteaza prin septuri transversale. Ulterior, fragmentele se elibereaza sub forma unor structuri cilindrice, cu extremitatile taiate in unghiuri drepte. In mediu favorabil, structurile germineaza si regenereaza miceliul. Unele sunt incapabile de germinare, deoarece le lipseste materialul nuclear.
Sporularea prin segmentare s-a studiat la Streptomyces coelicolor. Procesul se desfasoara in cateva faze succesive:
in hifele aeriene ale miceliului, zone succesive de nucleoplasma se condenseaza devenind refringente;
in jurul fiecarei condensari se diferentiaza structuri parietale si rezulta spori. Siragul de spori este mentinut in interiorul hifei parentale, denumita sporangiu;
sporangiul hifal se sparge si elibereaza sporii.
Sporii multipli ai actinomicetelor au rol in diseminarea acestor organisme in mediu. Au invelisuri sporale mai simple si sunt mai putin rezistenti, comparativ cu endosporul.
Sporularea, la actinobacterii este asociata cu producerea substantelor antibiotice.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2330
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved