| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Corelatia dintre structura chimica si unele proprietati ale substantelor
STRUCTURA MATERIEI
Definitia, domeniile si importanta chimiei
Chimia este o stiinta a naturii care cerceteaza acele fenomene in cursul carora are loc o modificare a naturii substantelor, adica fenomenele care produc o transformare a unei anumite substante in alte substante. Aceasta definitie, mai veche a chimiei, astazi nu mai este corecta deoarece nu delimiteaza domeniul chimiei si nici al fizicii. Mai corect s-ar putea defini chimia ca stiinta care se ocupa de studiul compozitiei,structurii, proprietatilor si transformarile substantelor prin regruparea atomilor si modificarea legaturilor. Acest studiu nu este posibil fara ajutorul fizicii si ca atare nu se poate trasa a frontiera neta intre chimie si fizica. Metodele de lucru folosite in chimie sunt in cea mai mare parte folosite in fizica. Dezvoltarea chimiei in zilele noastre se bazeaza mai ales pe introducerea tot mai extinsa a metodelor de cercetare ale fizicii moderne.
Ramurile chimiei
|
Ramura |
Obiectul de studiu |
|
Chimie generala |
Bazele chimiei, care sunt comune tuturor ramurile chimiei; legaturi chimice, proprietati generale ale substantelor, reactiile chimice ale acestora. |
|
Chimie anorganica |
Elementele chimice si compusii acestora (cu exceptia compusilor carbonului care intra in studiul chimiei organice) impreuna cu proprietatile si reactiile chimice la care participa acestia. |
|
Chimie organica |
Compusii carbonului (cu exceptia oxizilor carbonului, acidului carbonic si carbonatilor, carburilor si altor catorva compusi simpli ai carbonului) cu proprietatile si reactiile lor. |
|
Chimie fizica |
Aspectele fizice ale reactiilor chimice si legile care le guverneaza, influentele pe care le au fenomenele fizice asupra reactiilor chimice. Subramuri: termodinamica chimica: schimbul de energie in reactiile chimice; cinetica chimica:viteza si mecanismul reactiilor chimice; electrochimie: schimbul reciproc de energie chimica si electrica. |
|
Chimie tehnologica si tehnologia proceselor chimice |
Aplicarea cunostintelor si tehnicilor de lucru in procedeele utilizate in tehnica si echipamentele necesare pentru aceasta. |
|
Chimia analitica |
Identificarea calitativa si determinarea cantitativa a componentelor unei substante sau a unui amestec de substante precum si explicarea structurii substantei. |
|
Chimia preparativa |
Obtinerea substantelor. |
|
Biochimie |
Reactiile chimice din organismele vii. |
|
Geochimie |
Compozitia chimica si reactiile chimice (modificarile) ale scoartei pamantului. |
|
Chimia mediului |
Influentele substantelor chimice asupra mediului, analiza si metodele de indepartare a acestora. |
Importanta chimiei
Prezenta chimiei este simtita din ce in ce mai mult in toate ramurile economice: 60% din produsele chimice fabricate sunt destinate altor sectoare de activitate.
Aportul chimiei in industrie, consta in:
asigurarea de materii prime si materiale pentru industria de prelucrare;
folosirea de noi procedee chimice pentru obtinerea de produse utile si pentru imbunatatirea tehnologiilor de fabricatie.
Astfel, chimia este importanta in:
metalurgie unde s-au adus imbunatatiri in tehnologia de fabricatie prin aceea ca obtinerea otelurilor din fonta si cocs, a fost in multe locuri inlocuita cu procedee de reducere a minereurilor de fier, cu hidrogen. S-au imbunatatit procedeele de separare a metalelor rare necesare otelurilor speciale;
petrochimie: exploatare si prelucrare moderna a produselor petroliere;
agricultura: datorita chimiei, sporul inregistrat in ultimele decenii se datoreaza in proportie de 60% ingrasamintelor chimice si 40% mecanizarii si altor mijloace agrotehnice;
zootehnie: imbunatatirea compozitiei furajelor, sinteza de stimulatori de crestere;
industria textila: a crescut ponderea utilizarii fibrelor sintetice cu grad ridicat de elasticitate si rezistenta mecanica in raport cu fibrele naturale. Proportia pe plan mondial de utilizare a fibrelor sintetice este de circa 60%;
industria constructoare de masini: utilizarea materialelor plastice, a polimerilor armati cu fibre de sticla, carbon, azbest pentru producerea de piese si subansamble de masini;
produse farmaceutice;
cauciucuri sintetice;
coloranti;
materiale de constructie etc.
Rezulta deci ca prezenta chimiei se face simtita in aproape toate sectoarele de activitate, fiind greu de denumit un domeniu care sa nu fie tributar chimiei.
In paralel cu aceste mari avantaje ale chimiei, industria chimica are si dezavantaje: genereaza o serie de reziduuri, care constituie o sursa de poluare a mediului. Pentru aceasta se impune epurarea apelor reziduale inainte de a fi deversate, a gazelor si compusilor volatili eliminati in atmosfera, utilizarea rationala a ingrasamintelor chimice, pesticidelor si depozitarea corecta a reziduurilor toxice care pot infesta solul. Alaturi de aceste masuri se impune inlocuirea treptata a tehnologiilor poluante, beneficiind de cuceririle stiintifice ale matematicii, fizicii, tehnicii, biologiei si folosind ca model si ceea ce a creat marele "laborator al naturii".
Scurt istoric al chimiei
Primele descoperiri chimice mai importante ale omului primitiv au fost fie intamplatoare, de exemplu focul, fie izvorate din activitati mestesugaresti empirice (cum sunt olaritul sau obtinerea de metale din minereuri). Din cate se stie, primul popor care s-a inaltat la o gandire speculativa despre natura a fost poporul grec. Cea mai veche scoala filozofica greceasca, aceea a filozofilor naturalisti, din secolul al V-lea i.e.n., si-a concentrat atentia asupra cunoasterii lumii materiale. Din scrierile filozofilor naturalisti nu ne-au ramas decat fragmente, citate de autori posteriori. Putinul ce este cunoscut despre gandirea acestor filozofi, dovedeste o intuitie profunda despre structura materiei si legile naturii.
Unul dintre conceptele cele mai importante introduse de filozofii naturalisti este acela de element (in limba greaca stoicheia).
Filozoful Parmenide admitea ca exista doua elemente, focul si pamantul, primul reprezentand agentul creator activ iar al doilea pe cel pasiv. Aceasta conceptie este poate o forma rudimentara a dualitatii moderne energie-materie.
Empedocle (490-430 i.e.n) admitea existenta a patru elemente: apa, aerul, pamantul, focul, care dupa parerea sa nu se pot transforma una in alta. Cele patru elemente reprezinta fara indoiala cele patru stari de agregare: lichida, gazoasa, solida si plasma. Fireste desemnarea pamantului, apei, aerului si focului drept elemente este naiva si simplista. Notiune de element s-a pastrat de-a lungul secolelor in amintirea oamenilor. Adevaratele elemente nu puteau fi descoperite decat pe cale experimentala, ceea ce s-a intamplat mult mai tarziu.
Filozofii Leucip (circa 450 i.e.n.) si elevul sau Democrit (circa 460-370 i.e.n.) au mers mai departe. Dupa Democrit toate "lucrurile" sunt compuse din atomi. Chiar focul, aerul, apa si pamantul sunt "lucruri compuse", conglomerate de mai multi atomi. Atomii exista in numar infinit si sunt neschimbatori. Atomii sunt antrenati in "vartejuri" prin care iau nastere toate "lucrurile compuse". Prin cuvantul vartej filozofii atomisti greci sugerau poate existenta unor forte chimice care unesc atomii intre ei. Democrit formuleaza clar legea conservarii materiei in termenii: "nimic nu se naste din ceea ce nu este, nici nu piere in nefiinta". Filozofii atomisti considera ca "toate transformarile din natura au loc prin necesitate". Termenul necesitate (ananghi), intalnit si la alti filozofi naturalisti, trebuie inteles probabil in sensul ca fenomenele naturale nu sunt intamplatoare ci decurg dupa legi imuabile.
Filozofii naturalisti greci nu au depasit niciodata stadiul unor enunturi generale, de felul celor de mai sus. Nefiind fundamentate prin experienta, doctrinele lor (de multe ori contradictorii) nu au influentat decat prea putin dezvoltarea de mai tarziu a stiintei.
Egiptenii utilizau litarga, sarurile de amoniu, aveau cunostinte despre acidul lactic si dizolvarea metalelor in acizi. Inca pe timpul faraonului Sesostris (circa 1800 i.Hr.) existau ateliere de tabacit pielea si se producea berea. Cea mai edificatoare proba a gradului avansat de folosire a substantelor chimice in Egipt constituia arta imbalsamarii mortilor. Nu intamplator zeii funerari - Toth si Anubis - erau si zeii "artei sacre".
Scrierile despre chimie ("arta sacra") se pastrau in templul din orasul Alexandria, unde a fost creata prima biblioteca din lume, numita "Templul zeitei Serapis", care in secolul al IV-lea d.Hr. a fost arsa. Chimia a luat nastere, se crede, in secolul al 2-lea e.n. in Alexandria, un oras de cultura greaca in Egipt. Chimia, cel putin la inceput, isi are originea in unele practici si superstitii populare. Cuvantul chimie apare prima oara, in mod cert intr-un decret al imparatului Diocletian din anul 296 e.n. Prin acest decret se ordona arderea cartilor egiptenilor despre chemeia, sau arta "facerii" aurului sau argintului. Din surse ulterioare se stie ca materia prima a acestei pretinse fabricatii de metale nobile erau metalele comune, in special plumbul. Etimologia cuvantului chimie nu este cunoscuta cu certitudine. Traditia chimica greaca, s-a raspandit in Europa apuseana medievala prin intermediul arabilor, care au transformat termenul chimie in alchimie, prin adaugarea articolului al.
Alchimia nu a fost niciodata o stiinta, in sensul actual al cuvantului, fiindca nu era preocupata de cunoasterea naturii. In afara de "transmutatia" metalelor in aur, alchimistii credeau si in existenta unui medicament universal, piatra filozofala sau elixirul tineretii, capabil sa vindece toate maladiile omului. Dupa cum se vede, alchimia specula sentimentele primare si naive ale omului, in special dorinta de imbogatire rapida sau recapatarea sanatatii pierdute, prin mijloace miraculoase. Nu este surprinzator ca alchimia a fost adesea un pretext pentru inselatorie.
Pe de alta parte alchimia a avut si parti bune. In primul rand alchimistii se foloseau de o metoda de lucru care s-a dovedit mai tarziu extrem de fructuoasa, experienta. Laboratoarele alchimistilor au fost primele locasuri din lume anume destinate cercetarii. Alchimistii au obtinut, mai mult sau mai putin pure, cateva substante importante, ca acidul azotic, alcoolul si cateva saruri. Distilarea, descoperita probabil de sumerieni, a fost mult practicata de alchimisti. Aparatele de distilare, numite de alchimistii greci ambix ne-au parvenit sub denumirea arabizata de alambic. Facand bilantul, aportul alchimiei la cultura omenirii a fost foarte mic, daca tinem seama de lunga perioada de 1500 ani cat s-a perpetuat traditia alchimista. Alchimia constituie un exemplu graitor pentru inutilitatea unei cercetari pur empirice, fara baza teoretica, urmarind numai beneficii materiale imediate.
Arabii au creat importante centre de cultura, dintre care cele mai importante erau: Cordoba, Bagdadul si Cairo.
Chimia a patruns in Europa pe doua cai: prin nordul Africii in Spania (in epoca maurilor, pe la 711) si prin rasaritul Europei (prin Bizant).
Doua progrese marcheaza inceputurile chimiei ca stiinta: descoperirea oxigenului (1774) de catre J.Priestley si elucidarea sensului adevarat al teoriei arderii (flogiston) de catre A.L.Lavoisier.
Treptat chimia se constituie ca stiinta autonoma bazata pe legi, avand drept obiectiv explicarea materiei. La inceputul secolului al XIX-lea, o data cu elaborarea de catre John Dalton a teoriei atomice, incepe era atomica. Descoperirea legilor pe care este bazata combinarea elementelor i-a permis lui Dalton sa elaboreze aspectul cantitativ al atomisticii si sa utilizeze conceptiile despre atomi pentru explicarea unor serii de fenomene chimice.
Prin contributiile unui mare numar de chimisti ca: A. Avogadro (1776-1856), J. Berzelius (1779-1848), S. Cannizzaro (1826-1910), M. Berthelot (1827-1907), A. Butlerov (1828-1886), D. Mendeleev (1834-1907), Van't Hoff (1852-1911) si multi altii, chimia moderna s-a dezvoltat considerabil, remarcandu-se prin metode proprii de cercetare si descoperiri epocale.
In tara noastra, chimia are o veche traditie. Documentele istorice mentioneaza printre ocupatiile primilor locuitori ai acestor meleaguri: prelucrarea aurului, argintului, fierului, obtinerea ceramicii, a unor coloranti s.a. Mult mai tarziu, se semnaleaza preocupari pentru invatarea unor notiuni de chimie (Dimitrie Cantemir 1673-1723) si numai la inceputul secolului al XIX-lea se pun bazele scolii de chimie la Universitatea din Iasi de catre Petru Poni (1841-1925) si Universitatea din Bucuresti de Constantin Istrate (1850-1919). In aceeasi perioada, Nicolae Teclu (1839-1916) se face cunoscut prin cercetari in probleme de combustie, construind aparate de laborator, din care unele se utilizeaza si astazi (becul Teclu), iar Petru Poni si Constantin Istrate prin cercetari in domeniul compozitiei apelor minerale, al titeiului si al colorantilor. Acestora le-a urmat, G.G. Longinescu (1869-1939) cu cercetari in chimia analitica si fizica, P. Bogdan (1873-1944) in chimia fizica si electrochimie, Lazar Edeleanu (1861-1944) in chimia hidrocarburilor, Gheorghe Spacu (1833-1955) in chimia anorganica, analitica si initiator al cercetarii in chimia combinatiilor complexe, C.D. Nenitescu (1902-1977) in chimia organica, Radu Cernatescu (1894-1958) si Raluca Ripan (1894-1975) in chimia anorganica si analitica, Coriolan Dragulescu (1907-1977) in chimia anorganica s.a.
Periodizarea istoriei chimiei
|
Epoca |
Perioada |
Secolele |
|
|
Geneza chimiei |
Chimeotica |
Primitiva |
.-IV i.Hr. |
|
Antica |
IV-I i.Hr. |
||
|
Alexandrina |
I-IV |
||
|
Alchimica |
Araba |
VIII-XII |
|
|
Europeana |
XI-XV |
||
|
Constituirea ca stiinta autonoma |
Iatrochimica |
XVI-XVII |
|
|
Flogistica |
XVII-XVIII |
||
|
Formarea bazelor teoretice |
Atomica |
XIX |
|
|
Diferentierea in ramuri |
Moderna |
XX-XXI |
Clasificarea substantelor
Elementul chimic reprezinta o specie de atomi cu aceeasi sarcina nucleara, deci acelasi numar atomic Z.
Toti atomii elementului carbon au un numar de 6 sarcini nucleare.
Toti atomii elementului bariu au un numar de 56 sarcini nucleare.
Compusul chimic este alcatuit din grupe de mai multi atomi, care sunt uniti prin legaturi chimice.
Din punct de vedere al unei abordari macroscopice, compusul chimic este reprezentat de substanta, in care se leaga unul de altul atomii unuia sau mai multor elemente si intre ale caror mase exista un raport precis (stoechiometric). Atomii pot fi de aceeasi specie (compus monoelementar) sau de specii diferite (compus polielementar).
Compus monoelementar oxigenul O2, fosforul alb P4, azotul N2.
Compus polielementar: hidrogenul sulfurat H2S, etanolul C2H5-OH.
Substanta este un ansamblu de particule (atomi, cationi, anioni, molecule), care stabilesc interactiuni intre ele. O substanta are proprietati tipice, care nu pot fi atribuite unitatilor structurale submicroscopice din care ea este alcatuita (de exemplu densitatea, duritatea, starea de agregare, temperatura de topire) si care nu sunt aditive fata de proprietatile particulelor.
Clasificarea substantelor
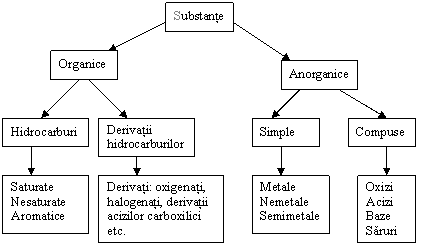
Metalele sunt substante (monoelementare), care au proprietati caracteristice: conductibilitate termica, conductibilitate electrica si luciu metalic si care, de regula, se pot prelucra prin laminare, presare, forjare si intindere.
Aliajele sunt substante polielementare metalice (solutii solide) in componenta carora intra diverse metale; metalele formeaza aliaje si cu unele nemetale.
◘ Fonta, bronz, amalgame.
|
Clasificarea metalelor |
||
|
Principiul de clasificare |
Clasificare |
|
|
Densitate |
Metale usoare (ρ < 5 g/cm3) ◘ Sodiu (ρ=0,97 g/cm3) |
Metale grele (ρ > 5 g/cm3) ◘Fier (ρ=7,86 g/cm3) |
|
Temperatura de topire |
Metale cu puncte de topire scazute (p.t. < 1000C) ◘ Zinc (p.t. = 232ºC) |
Metale cu puncte de topire ridicate (p.t.> 1000C) ◘ Cupru (p.t.=1083ºC) |
|
Stabilitatea chimica |
Metale nobile (nu reactioneaza cu solutiile acide cu degajare de hidrogen) ◘ Argint, aur |
Metale uzuale (reactioneaza cu solutiile acide cu degajare de hidrogen) ◘Sodiu, fier |
|
Aplicatii tehnice |
Metale feroase (metale negre) ◘ Fierul si aliajele lui |
Metale neferoase (si metale colorate) ◘ Cuprul si aliajele lui, staniul |
Nemetalele sunt substante (substante monoelementare), care nu prezinta proprietatile caracteristice metalelor. Ele nu prezinta conductibilitate termica si electrica.
◘ Clor, oxigen, sulf, fosfor, hidrogen.
Semimetalele ( substante monoelementare), care din punct de vedere al proprietatilor se situeaza intre metale si nemetale; conductibilitatea electrica este mai mica decat la metale si creste o data cu cresterea temperaturii.
◘ Bor, siliciu, germaniu, seleniu, arsen.
Oxidul este un compus chimic polielementar, in componenta caruia intra oxigenul si un alt element.
Oxidul cu proprietati bazice: oxid metalic, care cu apa formeaza un hidroxid (o baza).
◘ Oxidul de calciu: CaO+H2O→Ca(OH)2
Oxidul cu proprietati acide:oxid nemetalic care formeaza cu apa un acid.
◘ Dioxidul de carbon: CO2+H2O![]() H2CO3
H2CO3
Oxid cu proprietati amfotere (bazice si acide):oxid, care reactioneaza cu un acid ca o baza si cu o baza ca un acid.
◘ Oxid de aluminiu: Al2O3+3H2SO4→Al2(SO4)3+3H2O
Al2O3+2NaOH → 2Na[Al(OH)4]
Acid
Definitia dupa Arrhenius: compus chimic, care formeaza in solutii apoase ioni de hidrogen cu sarcina pozitiva si ioni radical acid cu sarcina negativa, care se misca liber.
◘ HNO3 →H+ + NO3-
solutie de acid azotic
Definitia dupa Brnsted: substanta (molecula sau ioni), care in interactiunea cu o baza (adesea o molecula de apa) cedeaza ioni de hidrogen (protoni) (donor de protoni).
◘ HNO3 + H2O
![]() NO3- + H3O+
NO3- + H3O+
NH4+ + H2O
![]() NH3 + H3O+
NH3 + H3O+
Acid baza
Definitia dupa Lewis: substanta, care dispune de un deficit de electroni, pe care il poate completa cu o pereche de electroni liberi ai unei baze (acceptor de perechi de electroni).
◘ H+, BF3.
Baza
Definitia dupa Arrhenius:compus chimic, care in solutie apoasa sau in topitura formeaza ioni cu sarcina pozitiva si ioni hidroxil cu sarcina negativa, care se misca liber.
◘ NaOH → Na+ + HO-
hidroxid de sodiu
Definitia dupa Brnsted: substanta (molecula sau ioni), care in interactiunea cu un acid (adesea o molecula de apa) accepta ioni de hidrogen (proton) (acceptor de protoni)
NH3 + H2O ![]() NH4+ + HO-
NH4+ + HO-
CH3COO- + H2O ![]() CH3COOH HO-
CH3COOH HO-
Baza acid
Definitia dupa Lewis: substanta, care dispune de cel putin o pereche de electroni liberi, care poate completa deficitul de electroni al unui acid (donor de perechi de electroni).
NH3
Sare
Compus chimic cu structura cristalina, alcatuit din ioni metalici sau ioni de amoniu cu sarcina pozitiva (cationi) si din ioni radical acid cu sarcina negativa (anioni).
Sarurile, in stare de agregare solida, se prezinta ca retele ionice iar in solutie apoasa sau in topitura formeaza ioni care se misca liber.
◘ Na+NO3- - azotat de sodiu
Numele hidroxizilor si al sarurilor sunt formate in general din:
- numele cationului (metal sau amoniu);
- valenta (numarul de oxidare) cationului metalic, indicata in cifre
romane, trecuta in paranteze;
- numele hidroxidului sau numele anionului.
◘ Hidroxizi
Fe(OH)3 hidroxid de fier (III) (hidroxid feric)
Fe(OH)2 hidroxid de fier (II)(hidroxid feros)
◘ Saruri
CuSO4 sulfat de cupru (II) (sulfat cupric) .
Legile fundamentale ale chimiei
Legea este o relatie generala intre obiecte si fenomene si exprima o generalizare a observatiilor experimentale.
4. Legile combinarii chimice
Legile ponderale (de masa)
|
Legea |
Definitia |
Autorul descoperirii |
Aplicatiile de calcul |
|
Conservarii masei |
Suma maselor substantelor care intra intr-un proces chimic(mi), este riguros egala cu suma maselor substantelor care rezulta din acel proces. |
M.V.Lomonosov L.A.Lavoisier |
|
|
proportiilor constante (proportiilor definite sau a constantei compozitiei |
Indiferent pe ce cale se obtine o combinatie chimica, componentele ce o alcatuiesc, se unesc intotdeauna in proportii de masa constante. |
L.J. Proust |
H2O- raportul de masa H:O=2:16=1:8 |
|
proportiilor multiple |
Daca doua elemente se combina pentru a forma mai multe combinatii ale unuia din elemente, care se uneste cu aceeasi cantitate din al doilea element, se gasesc intre ele in raporturi simple de numere mici si intregi. |
J.Dalton |
Exemplu oxizii azotului: N2O, NO, N2O3, NO2, N2O5. Rapoartele de masa sunt: N:O = 28:16; 14:16; 28:48; 14:32; 28:80 sau 1:1; 1:2; 1:3; 1:4, 1:5. |
|
Proportiilor echivalente |
Elementele si com-binatiile chimice, interactioneaza si se inlocuiesc reciproc, in raporturi stricte de echivalenti-gram, sau raportul de masa in care interactioneaza doua substante, este egal cu raportul echivalentilor-gram al celor doua substante. |
K.F. Wentzel J.B.Richter |
A,B- elemente |
|
Actiunii maselor |
Raportul dintre pro-dusul concentratiilor produsilor de reactie si produsul concen-tratiilor reactantilor este o constanta (care se numeste constanta de echilibru "K" la o temperatura data). |
C. Guldberg P.Waage |
Pentru reactia: aA+bB=cC+dD
|
Legile volumice (de volum)
|
Legea |
Definitia |
Autorul descoperirii |
Aplicatiile de calcul |
|
Legea volumelor constante (combinarii in volume a gazelor) |
La presiune si temperatura constanta, intre volumele a doua gaze care se combina, ca si intre fiecare dintre volumele gazelor care se combina si volumul combinatiei gazoase rezultate, exista un raport simplu de numere intregi si mici. |
Gay Lussac |
1 volum de H2+1 volum de Cl2 = 2 volume de HCl; gazele reactante se afla in raport de 1:1, iar HCl cu fiecare gar care intra in reactie - in raport de 2: |
|
Legea lui Avogadro |
Doua volume egale de gaze, identice sau diferite, in aceleasi conditii de temperatura si presiune, contin acelasi numar de molecule sau moli. |
Amedeo Avogadro |
NA(numarul lui Avogadro) = 6,023∙1023 particule /mol Vm= 22,4 l/mol |
4.2. Legile gazelor
Ecuatiile de stare ale gazului ideal
|
Legea |
Parametrii de stare |
Ecuatia de stare |
Procesul |
|
|
variabili |
constanti |
|||
|
Boyle-Mariotte |
P,V |
T |
PV=const |
Izoterm |
|
Gay-Lussac |
V,T |
P |
Vt=V0 ∙(1+α*T) |
Izobar |
|
Charles |
P,T |
V |
Pt=V0∙(1+β*T) |
Izocor |
|
Klapeyron-Mendeleev |
P,V,T |
PV=νRT | ||
α, β - coeficienti de dilatare liniara
Constanta generala a gazelor in diferite unitati:
|
R |
|
|
J/K∙mol l∙atm/K∙mol l∙bar/K∙mol Pa∙m3/K∙mol l∙torr/K∙mol cal/K∙mol |
|
Diferite unitati de masura pentru presiune
1 Pa = 1N∙m2
1 bar = 105 Pa = 100 kPa
1 atm = 101,325 KPa
1 atm = 760 torr
1 mmHg =133,3 Pa
1 atm =760 mmcol.Hg
Scari de temperatura
Celsius (C)
Kelvin (K) K= C +273
Fahrenheit (F) F =9/5 C + 32
Concepte ale teoriei atomo-molecualre
5. Atom. Masa atomica. Numar atomic.
Atomul reprezinta cea mai mica particula dintr-o substanta, indivizibila prin procedee chimice, dar divizibila prin procedee fizice.
Masa atomica relativa (Ar) este numarul care arata
de cate ori masa unui atom este mai mare decat a 12-a parte din izotopul ![]() .
.
Ar(H) =1 Ar(P)= 31 Ar(S)=32
Masa atomica absoluta (A) se exprima in kg/atom si rezulta din Ar(u/atom) ∙ 1,66 ∙10-27 (kg/u).
Numar atomic (Z)(numar de ordine sau sarcina nucleara) reprezinta numarul protonilor din nucleu = numarul electronilor din invelisul electronic.
Z(N)=7 Z(O) = 8 Z(Na) = 11
5.2. Molecula. Masa moleculara relativa. Masa moleculara
absoluta.
Molecula - cea mai mica particula dintr-o substanta, care poate exista in stare libera si care pastreaza toate proprietatile chimice ale substantelor respective.
Pot fi:
- monoelementare:
- monoatomice: Ne, Ar, Kr, Xe, He, Rn
- biatomice: H2, O2, N2, Cl2
- poliatomice: O3, P4, S8
polielementare: H2SO4, Ca(OH)2
Masa moleculara relativa (Mr) - marimea care arata de cate ori masa moleculei este mai mare decat unitatea atomica de masa (u.a.m.). Nu are dimensiuni. La efectuarea calculelor care nu necesita o precizie inalta valoarea fractionata a masei atomice relative se rotunjeste.
Exemplu masa moleculara relativa pentru Al2(SO4)3:
Mr= 2∙27 + 3∙(32 + 4∙16) =324
Masa moleculara absoluta se exprima in kg/molecula si se obtine inmultind masa moleculara relativa cu 1,66∙10-27 kg.
In practica se utilizeaza masa molara (moleculara) relativa.
Masa reala a atomilor celor mai uzuale elemente chimice
|
Denumirea elementului |
Masa reala a atomului (g) |
Denumirea elementului |
Masa reala a atomului (g) |
|
Hidrogen |
Clor | ||
|
Oxigen |
Sulf | ||
|
Carbon |
Aluminiu | ||
|
Azot |
Magneziu | ||
|
Sodiu |
Fosfor |
Masele atomice relative rotunjite ale elementelor chimice
|
Z |
Denumirea elementului |
Masa atomi-ca relativa rotunjita |
Z |
Denumirea elementului |
Masa atomi-ca relativa rotunjita |
|
Aluminiu |
Hidrogen | ||||
|
Antimoniu (stibiu) |
Iod | ||||
|
Argint |
Kripton | ||||
|
Argon |
Litiu | ||||
|
Aur |
|
Magneziu | |||
|
Azot |
Mangan | ||||
|
Bariu |
Mercur | ||||
|
Bismut |
Nichel | ||||
|
Bor |
Oxigen | ||||
|
Brom |
Platina | ||||
|
Cadmiu |
Plumb | ||||
|
Calciu |
Poloniu | ||||
|
Carbon |
Potasiu | ||||
|
Cesiu |
Rubidiu | ||||
|
Clor |
Siliciu | ||||
|
Cobalt |
Sodiu | ||||
|
Crom |
Staniu | ||||
|
Cupru |
Sulf | ||||
|
Fier |
Titan | ||||
|
Fluor |
Uraniu | ||||
|
Fosfor |
Wolfram | ||||
|
Germaniu |
Xenon | ||||
|
Heliu |
Zinc |
5.3. Substanta. Mol. Masa molara. Volum molar.
Substanta - portiunea de materie omogena, de compozitie bine determinata si constanta.
Exemplu: sare de bucatarie, acid sulfuric, neon etc.
Masa molara (M) - masa unui mol de substanta in stare de atomi sau de molecule, este egala numeric cu masa atomica, respectiv cu masa moleculara si se exprima in g/mol.
Exemplu: M(NH4SCN) =72,12 g/mol.
Mol - cantitatea de substanta care contine 6,023∙1023 particule (atomi, molecule, ioni).
Exemplu: 1 mol de Al2O3 = 102 g; 1 mol CuSO4=160 g.
Volumul molar (Vm) - volumul ocupat de un mol din orice gaz, la 0C si 1 atm, are valoarea medie 22,4 l/m3.
Exemplu: Vm(H2)= Vm(O2) = 22,4 l/mol.
5.4. Teoria atomo-moleculara
Conceptia structurii atomice a materiei a fost formulata pentru prima data de filozoful grec Leucip si continuata de discipolul sau Democrit, generalizand doctrinele filozofice.
Aceasta ipoteza a fost reluata in anul 1808 de catre chimistul englez John Dalton. In anul 1833 chimistul italian A. Avogadro completeaza teoria atomo-moleculara. Cel care a fost considerat drept "reformatorul" ei este chimistul italian Stanislao Cannizzaro, care demonstreaza, in anul 1858, teoretic si experimental importanta unei teorii atomo-moleculare complete.
In anul 1860, la Congresul International din Karlsruhe, Germania, au fost expuse tezele de baza ale teoriei atomo-moleculare:
Substantele sunt alcatuite, din molecule. Molecula este particula cea mai mica ce intra in componenta substantei, posedand proprietati chimice.
Moleculele sunt formate din atomi, care se combina unii cu altii in anumite raporturi.
Atomii si moleculele se afla in continua miscare; intre atomi si molecule actioneaza forte de atractie si de respingere.
Moleculele substantelor simple se compun din acelasi fel de atomi (O2, O3, N2), moleculele substantelor compuse - din atomi diferiti (HCl, NaOH, CuSO4).
In decursul reactiilor chimice componenta moleculelor se modifica cu schimbarea ordinii atomilor, ceea ce duce la formarea substantei noi.
Proprietatile moleculelor depind nu numai de componenta lor, dar si de modalitatea in care se leaga atomii.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3272
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved