| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Aplicatiile termodinamicii cuprind si studiul conditiilor de echilibru pentru schimbari fizice ca topirea, dizolvarea, vaporizarea, transformarea alotropica numite transformari de faza sau de stare de agregare.
Echilibrul fizic dintre faze este guvernat de legea fazelor a lui Gibbs (1876).
Faza este o portiune dintr-un sistem, omogena si distincta din punct de vedere fizic, separata de restul sistemului prin suprafata de separare. Faza este formata din una sau mai multe substante fara suprafata de separare intre ele, cu aceleasi proprietati fizice si chimice in intreaga masa, aflata la aceeasi temperatura si presiune. Apa lichida, gheata, vaporii de apa sunt exemple de faze.
Sistemele omogene sunt monofazice, ca de exemplu: amestecurile de gaze, lichidele miscibile, aliajele.
Un sistem eterogen este compus din mai multe faze. Fazele unui sistem eterogen sunt separate intre ele prin suprafete nete si se deosebesc prin proprietatile lor macroscopice.
O tranzitie de faza sau conversia spontana a unei faze in alta are loc la o temperatura caracteristica, pentru o presiune data. Temperatura de tranzitie este temperatura la care cele doua potentiale chimice devin egale.
Orice sistem eterogen este format dintr-un numar de componenti (c) care este numarul minim de specii independente necesare pentru a exprima compozitia tuturor fazelor existente in sistem. Prin constituent al unui sistem se intelege o specie chimica prezenta in acesta.
Daca nu au loc reactii chimice, numarul de componenti este egal cu numarul de constituenti.
O notiune esentiala in analiza echilibrului de faze este gradul de libertate. Prin grad de libertate se intelege parametrul de stare intensiv (p, T, c - presiune, temperatura, concentratie), care poate fi modificat independent si arbitrar fara sa se modifice starea de echilibru a sistemului, adica numarul de faze in echilibru din sistem. Numarul total al gradelor de libertate constituie varianta sistemului (l).
Legea fazelor lui Gibbs stabileste relatia dintre numarul de faze in echilibru (f), numarul de componenti (c) si numarul gradelor de libertate. Legea fazelor arata ca la echilibru, varianta (l) a sistemului este data de egalitatea:
l = c - f + n (5.1)
unde: c = numarul de componenti;
f = numarul fazelor in echilibru;
n = numarul variabilelor intensive care influenteaza echilibrul dintre faze.
De cele mai multe ori intervin numai presiunea si temperatura, iar relatia (5.1) devine:
l = c - f + 2 (5.2)
Pentru ilustrare se considera cazul echilibrului de faza a unui corp pur (apa), adica a unui sistem monocomponent. In conformitate cu legea fazelor, cand c = 1, pot apare urmatoarele cazuri:
f = 3; l = 0; sistemul este invariant;
f = 2; l = 1; sistemul este monovariant;
f = 1; l = 2; sistemul este bivariant.
Deoarece varianta maxima este 2, orice sistem monocomponent poate fi reprezentat printr-o diagrama bidimensionala cu variabile presiunea si temperatura.
Aceasta diagrama se numeste diagrama de faza a unei substante si indica regiunile de presiune si temperatura in care diferitele sale faze sunt stabile termodinamic.
Daca se face abstractie de formele polimorfe ale ghetii, diagrama de faze a apei are forma prezentata in fig. 5.1.
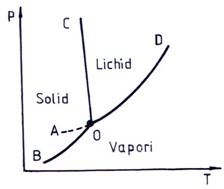
Fig. 5.1. Diagrama de faze a apei
Diagrama de faze a apei este formata din trei curbe:
curba de sublimare - condensare (BO):
H20(s) ![]() H2O(g)
H2O(g)
curba de vaporizare - condensare (OD):
H2O(l) ![]() H2O(g)
H2O(g)
curba de topire - solidificare (OC):
H2O(s) ![]() H2O(l)
H2O(l)
Curbele de echilibru se intersecteaza in punctul triplu O unde coexista toate cele trei faze in echilibru. Sistemul trifazic monocomponent aflat in starea O este invariant (l=1-3+2=0), iar variabilele p si T au valori unice. Frontierele intre regiuni numite frontiere de faza arata valorile p si T la care doua faze coexista in echilibru.
Modificand una din aceste variabile sau ambele, echilibrul trifazic se distruge si sistemul devine bifazic pe curbe sau monofazic intre curbe.
Apa poate fi racita sub temperatura de solidificare mentinandu-se in stare metastabila (instabila termodinamic) de lichid subracit, in portiunea OA.
Curbele reprezinta locul geometric al punctelor care corespund sistemului monovariant (l=1-2+2=1).
Pentru apa, punctul triplu are valorile de 273,16 K si 4,58 mmHg.
Intr-un sistem cu mai multi componenti, conditia de echilibru pentru componentul i este dat de egalitatea potentialului chimic al acestuia in fazele sistemului:
iA iB (5.3)
Pentru ca intregul sistem sa fie in echilibru, este necesar ca conditia (5.3) sa fie indeplinita pentru toti componentii in toate fazele.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3347
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved