| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Modele atomice
Modelele atomice reprezinta concepte prin care autorii care le propun incearca sa explice proprietatile atomilor. Au fost propuse mai multe modele atomice, care s-au perfectionat de-a lungul timpului. Modelele pot fi impartite in modele atomice precuantice si modele atomice cuantice.
Modele atomice precuantice
Modelul atomic Thomson sau modelul atomic static a fost elaborat in anul 1898 de catre J. J. Thomson. In conformitate cu acest model, atomul are forma sferica. Sarcina electrica pozitiva este uniform distribuita in tot volumul sau, iar electronul, incarcat negativ, oscileaza in interiorul atomului, datorita campului electric care se creeaza.
Modelul atomic Rutherford sau modelul planetar, a fost elaborat in anul 1911 de catre Ernest Rutherford si propune o structura planetara pentru atom. In conformitate cu aceasta teorie, atomii constau dintr-un nucleu central mic, dens, incarcat pozitiv, inconjurat de electroni incarcati negativ care se misca pe orbite circulare.
Modele atomice cuantice
Modelul atomic Bohr a fost enuntat in anul 1913 de Niels Bohr. Acest prim model cuantic are la baza conceptia nucleara a atomului, elaborata de Rutherford, si conceptia cuantica asupra emisiei radiatiei electromagnetice, elaborata de Max Planck.
Prin experimentele sale, Bohr a incercat sa gaseasca explicatii pentru faptul ca electronii, in miscarea lor, nu cad pe nucleul situat in centrul modelului, precum si pentru liniile spectrale, proprii fiecarui element, pe care le-a observat cand atomii sunt excitati intr-un tub cu descarcare in gaz.
Teoria lui Bohr propune un model de tip "planetar", presupunand ca:
in stare stationara, electronii se misca pe orbite specifice presupuse circulare, permise, care au energii restrictionate la anumite valori, adica sunt cuantificate. Energiile exacte ale orbitelor permise depind de atomul studiat. In miscarea pe orbitele permise, electronii nu emit si nu absorb energie. Electronul se mentine pe orbita datorita compensarii fortei centrifuge cu forta de atractie coulombiana.
cand un electron face un salt de pe o orbita pe alta, nu se aplica legile mecanicii clasice. Diferenta de energie dintre orbita cu raza mai mare si cea cu raza mai mica este cedata sau acceptata prin intermediul unei singure cuante de energie. Aceasta va avea o frecventa direct proportionala cu diferenta de energie dintre cei doi orbitali:
ΔE = hν
ν = ΔE/h
unde: ν = frecventa radiatiei emise;
ΔE = diferenta de energie dintre cei doi orbitali;
h =
constanta de proportionalitate, cunoscuta sub numele de
constanta lui Plank
(6,6256 10-34J s).
Diferenta de energie este pozitiva cand un electron face saltul de pe o orbita inferioara pe una superioara, fenomen care se petrece cu absorbtie de energie, si este negativa cand un electron trece intr-o stare energetica mai joasa, prin emiterea de energie radianta.
Nivelurile energetice spectrale corespund, conform teoriei lui Bohr, energiei electronului care se misca pe orbite cu raze din ce in ce mai mari.
In miscarea sa pe orbite circulare, electronul are un moment cinetic (cantitatea de miscare x raza orbitei). Pentru o particula de masa m, care se roteste cu viteza v, pe o traiectorie circulara (orbita) cu raza r, momentul cinetic L este:
L = mvr
Pentru intreaga orbita circulara valoarea devine:
L = 2πmvr
in conformitate cu postulatul lui Bohr, sunt permise numai acele orbite ale caror momente cinetice sunt multipli ai constantei lui Plank:
L = nh
in care n = 1, 2, 3,....,n si este denumit numar cuantic principal, numar care este atribuit fiecarui nivel energetic. Numarul cuantic principal indica, prin urmare, rangul orbitei.
2πmvr = n h, sau
mvr = n h/2π
Definind ħ = h/2π drept constanta redusa a lui Plank sau cuanta de actiune se poate scrie:
mvr = n ħ
Momentul cinetic al electronilor trebuie sa fie un numar intreg de cuante de actiune si, prin urmare, o marime cuantificabila.
Cea mai mica valoare a numarului cuantic principal n este 1. Aceasta valoare corespunde celei mai mici raze posibile, cunoscuta sub numele de raza Bohr 0.0529nm), si explica de ce electronul, in miscarea sa, nu cade pe nucleu si ca urmare atomii sunt stabili.
Modelul atomic Sommerfeld
Acest al doilea model atomic cuantic reprezinta o dezvoltare a modelului atomic Bohr si a fost realizat in anul 1915 de catre Sommerfeld care a incercat sa explice structura fina a liniilor spectrale, admitand ca electronul parcurge in jurul nucleului nu numai traiectorii circulare, ci si traiectorii eliptice.
In cazul in care electronul (e-) se deplaseaza pe o orbita circulara, stationara, variaza numai pozitia sa in raport cu nucleul, care este data de variatia unghiului j (figura 2.1.).

Fig. nr. 2.1. Reprezentarea deplasarii unui electron pe o orbita circulara
In aceasta situatie regula de cuantificare este:
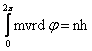 , unde: dφ = variatia unghiului φ.
, unde: dφ = variatia unghiului φ.
Cand deplasarea electronului se face pe o orbita eliptica permisa, in jurul nucleului situat in unul din focarele elipsei (F1, F2), exista doua variabile. Pe de o parte, pozitia electronului pe orbita, exprimata prin unghiul φ, pe care raza focala il face cu axa mare a elipsei (a-axa mare a elipsei, b-axa mica a elipsei) si, pe de alta parte, distanta dintre electron si nucleu care, egala cu raza focala (r) (figura ):

Fig. nr. Reprezentarea deplasarii unui electron pe o orbita eliptica
Datorita acestor doua variabile, Sommerfeld a introdus doua numere cuantice, numarul cuantic azimutal (nφ) si numarul cuantic radial (nr), stabilind conditiile de cuantificare:
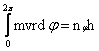 , in care nφ este numarul cuantic azimutal.
, in care nφ este numarul cuantic azimutal.
![]()
![]() , in care, nr = numarul cuantic radial
, in care, nr = numarul cuantic radial
Intre numerele cuantice principal, azimutal si radial exista relatia: n=nφ+nr. Prin urmare, nφ ≥ n.
Daca nr = 0, rezulta ca nφ = n, si orbita permisa este circulara. In mecanica cuantica, numarul cuantic azimutal este inlocuit cu numarul cuantic orbital sau secundar l = nφ-1). Numarul cuantic secundar are valori cuprinse intre 0 si n-1 (0, 1, 2, ...n-1) si determina forma geometrica a unui set de orbitali.
Un orbital
reprezinta o regiune specifica dintr-un subnivel, regiune care
contine maximum 2 electroni cu spin opus. Subnivelurile energetice se
desemneaza prin urmatoarele simboluri:l = 0 → s;
l = 1 → p; l = 2 → d; l = 3 → f. Energia orbitalilor din acelasi strat creste de la
subnivelul s la subnivelul f (s<p<d<f).
Subnivelul s contine un singur orbital, subnivelul p contine 3 orbitali, subnivelul d contine 5 orbitali, iar subnivelul f contine 7 orbitali. Fiecare dintre orbitali poate sa fie ocupat sau nu cu electroni. Toti orbitalii unui subnivel au aceeasi energie.
Teoria atomica a lui Sommerfeld admite ca electronii se deplaseaza in jurul nucleului pe traiectorii circulare si eliptice. Pentru o anumita valoare a numarului cuantic principal, exista o singura traiectorie circulara si n-1 traiectorii eliptice. Toate orbitele cu acelasi numar cuantic principal au aceeasi energie si formeaza un strat electronic, iar electronii un invelis electronic. Energia electronilor depinde numai de numarul cuantic principal. Cele n-1 subniveluri determinate de numarul cuantic secundar au aceeasi energie.
In miscarea sa in jurul nucleului, electronul genereaza camp magnetic, capatand el insusi proprietati magnetice. Acest camp magnetic poate fi pus in evidenta prin interactiunea sa cu un camp magnetic aplicat din exterior sau in relatie cu campul altui electron, cand se constata aparitia mai multor subniveluri energetice rezultate prin scindarea liniilor spectrale. Aceste niveluri energetice nu pot fi caracterizate de cele doua numere cuantice descrise pana acum. Pentru caracterizarea completa a nivelurilor energetice ale electronului a fost necesara introducerea unui al treilea numar cuantic, denumit numar cuantic magnetic (m). Numarul cuantic magnetic poate lua 2l + 1 valori care variaza intre -l si +l si da informatii referitoare la orientarea in spatiu a orbitalilor.
In afara de miscarea de rotatie in jurul nucleului, electronul are si o miscare de rotatie in jurul axei sale, miscare de spin, care genereaza un moment magnetic de spin. Pentru caracterizarea acestei miscari, Pauli a introdus al patrulea numar cuantic, denumit numar cuantic magnetic de spin (ms) sau numarul cuantic de spin. Numarul cuantic de spin poate lua valorile 1/2.
Prin urmare, fiecarui electron dintr-un atom i se atribuie patru numere cuantice care definesc energia sa, orientarea in spatiu si interactiunile sale posibile cu alti electroni. Starea energetica a unui atom poate fi descrisa daca se cunosc toate cele patru numere cuantice pentru fiecare electron al sau.
Modelele atomice anterioare nu au putut calcula intensitatea liniilor spectrale si energia atomilor multielectronici.
In anul 1924 Louis de Broglie a emis ideea dualitatii de comportare a microparticulelor. In miscarea sa, o microparticula cum este si electronul, se comporta atat ca particula, cat si ca unda. Fiecarei particule (electron), i se asociaza o unda. Undele sunt caracterizate de lungime de unda si amplitudine. Lungimea de unda este intr-o relatie de inversa proportionalitate cu masa si viteza particulei:
λ = h/mv
in care: λ = lungimea de unda;
h = constanta lui Plank;
m = masa particulei, kg
v = viteza de deplasare a particulei, m/s
Aceasta relatie stabileste legatura intre lungimea de unda, proprietate specifica unei unde, si proprietati specifice unei particule, cum sunt masa si viteza de deplasare.
In anul 1927, W. Heisenberg a aratat ca este imposibil sa se cunoasca simultan, cu precizie absoluta, atat pozitia, cat si viteza de deplasare a unei particule. Acest principiu numit principiul de incertitudine al lui Heisenberg, elimina notiunea de traiectorie a unei microparticule, deci si a electronului.
Toate acestea conduc la ideea unui model care sa ia in consideratie probabilitatea ca un electron sa se afle intr-un anumit punct, la un moment dat.
Schrdinger, avand in vedere natura ondulatorie a microparticulelor, a tratat atomul ca un sistem de unde stationare, elaborand pentru unda tridimensionala asociata electronului o expresie matematica, care este denumita functie de unda (ψ). Functia de unda se obtine prin rezolvarea ecuatiei de unda a lui Schrdinger. Patratul functiei de unda reprezinta probabilitatea de a gasi o particula (electron) intr-o anumita regiune a spatiului.
Ecuatia de unda a lui Schrdinger este ecuatia fundamentala a mecanicii cuantice si coreleaza caracteristicile de corpuscul ale electronului (E, m, v) cu cele ondulatorii date de amplitudinea vibratiei intr-un punct caracterizat de coordonatele x, y, z.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3987
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved