| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Norme de protectie, prevenire a accidentelor si masuri de prim ajutor in laboratorul de chimie
Multe experiente pot deveni periculoase daca experimentatorul nu cunoaste natura reactivilor utilizati, caracteristicile acestora si ale aparaturii sau nu este atent la manipularea, respectiv manevrarea lor.
In vederea protectiei si prevenirii accidentelor din laboratorul de chimie este necesara respectarea unor reguli numite NORME .
Orice accident care survine in laborator trebuie imediat adus la cunostinta cadrului didactic care va aprecia gravitatea lui si va stabili masurile de prim ajutor, o interventie imediata putand preveni o agravare a situatiei.
In cele ce urmeaza se vor prezenta principalele tipuri de accidente care pot surveni in laboratoarele de chimie, normele de protectie precum si masurile de prim ajutor care trebuie luate in legatura cu persoana accidentata. Principalele accidente care se pot produce in laboratoarele de chimie sunt: intoxicatii, arsuri, traumatisme si electrocutari.
Intoxicatiile pot fi:
- acute, produse datorita patrunderii in organism a unor substante toxice, intr-o cantitate care depaseste limita admisa;
- cronice produse in urma patrunderii unor substante toxice in organism in cantitati mici, timp indelungat. Patrunderea substantelor toxice in organism se poate produce: pe cale respiratorie (sub forma de fum, ceata, pulbere), pe cale digestiva, prin piele, de unde, prin difuzie ajung in sange (sulfura de carbon, alcool metilic, mercurul, etc.). In scopul evitarii intoxicatiilor, substantele chimice ca: cianura de potasiu, hidrogen sulfurat, solutie de hidroxid de amoniu concentrat, oxid de carbon, dioxid de sulf, acid cianhidric etc., se vor prepara sau utiliza numai sub nisa.
. Este interzisa testarea substantelor chimice prin gustare.
. Este interzisa pipetarea prin aspirare cu gura a solutiilor corozive sau toxice.
La incheierea sedintei de laborator, studentii sunt obligati sa faca ordine pe masa de lucru, sa predea ustensilele utilizate si sa se spele pe maini.
Masurile de prim ajutor in cazul intoxicatiilor cu substante chimice se aplica diferentiat in functie de natura reactivului care a provocat intoxicatia (tabel I).
Tabel I - Masuri de prim ajutor in cazul intoxicatiilor cu substante chimice.
|
Substanta toxica |
Antidot |
|
F2 |
Hidroxid de amoniu diluat |
|
Cl2; Br2 |
pulverizarea unei solutii de carbonat de sodiu |
|
H2S |
se inspira aer curat si cantitati foarte mici de Cl2 |
|
NO; NO2 |
se recomanda inhalare de oxigen, lapte si repaus complet |
|
P4 |
solutie de sulfat de cupru 2% |
|
As2O3 |
solutie de oxid de magneziu |
Arsurile pot fi:
- termice, provocate de contactul cu corpuri fierbinti sau datorita aprinderii substantelor inflamabile;
- chimice, provocate de contactul cu substante caustice (baze sau acizi concentrati)
Dupa gravitate, arsurile pot fi de gradul I, II si III. Arsurile de gradul III sunt considerate ca fiind cele mai grave deoarece cuprind o suprafata mare de piele.
La manipularea obiectelor si substantelor fierbinti (trunchi de samota, creuzete, capsule, panze de azbest, apa fiarta, etc. se recomanda utilizarea, dupa caz, a clestelui metalic, a mansoanelor de azbest sau cauciuc, a lavetelor etc.
Vasele din sticla se incalzesc treptat, pe sita de azbest, pe bai de apa sau nisip; vasele cu precipitate se incalzesc agitand continuu cu o bagheta pentru a se evita depunerea precipitatului.
.Este interzisa aplecarea capului deasupra vaselor in care fierbe o solutie.
.Eprubeta in care se incalzeste o solutie se tine inclinata intr-o parte, nici spre sine, nici spre vecin, pentru a se evita stropirea in caz de supraincalzire.
.Este interzisa pastrarea substantelor inflamabile si a celor volatile in apropierea aparatelor care produc radiatii termice.
.Lampile si becurile de gaz nu se lasa aprinse fara supraveghere.
In cazul arsurilor termice, trebuie, in primul rand, inchis gazul sau stinsa sursa care arde, cu ajutorul extinctoarelor, nisipului, prelatelor, trecandu-se apoi la acordarea primului ajutor. In cazul arsurilor de gradul I pielea arsa se spala cu o solutie de permanganat de potasiu si apoi se unge cu o crema protectoare, dezinfectanta, sau se spala locul arsurii cu o solutie de tanin 1%. In cazuri mai grave (arsuri de gradele II si III) accidentatul se transporta imediat la spital.
Arsurile cauzate de substante chimice sunt extrem de numeroase si variate. In tabelul II sunt prezentate unele masuri de prim ajutor care se aplica in cazul arsurilor cu substante chimice.
Tabel II - Masuri de prim ajutor in cazul arsurilor cu substante chimice.
|
Substanta toxica |
Antidot |
|
Br2 |
Se spala repede locul cu apa, apoi cu solutie 1/10 NaOH sau NH4OH, din nou cu apa dupa care se pune o compresa cu solutie concentrata de Na2S2O3 (tiosulfat de sodiu). Locul unde s-a produs arsura se unge, cat mai des, cu lanolina sau vaselina. |
|
HF |
Solutie CaCl2 2%, solutie 20% MgO in glicerina. |
|
P4 |
Se tamponeaza si se aplica pe rana pentru scurt timp un pansament cu una din solutiile AgNO3 (1/1), KMnO4 (1/10) sau solutie de CuSO4 5%, dupa care se spala rana cu apa si se aplica un pansament de vaselina cu violet de metil. Pentru arsurile grave obligatoriu ne adresam medicului specialist. |
|
HCl, H2SO4, HNO3 |
Se spala locul cu multa apa, apoi cu o solutie bicarbonat de sodiu 2% pentru neutralizare |
|
NaOH, KOH |
Se spala locul cu multa apa apoi cu o solutie de acid acetic 2% |
Daca un pahar cu o solutie acida sau bazica se rastoarna pe masa, locul trebuie spalat cu multa apa, neutralizat si uscat.
La efectuarea experientelor cu acizi, se pot utiliza acizi concentrati numai daca metoda utilizata prevede special acest lucru. Acizii concentrati se vor manui cu multa precautie numai sub nisa.
Prepararea solutiilor insotita de degajare mare de caldura (de exemplu: diluarea acidului sulfuric, prepararea amestecului sulfocromic din acid sulfuric concentrat si dicromat de potasiu etc.) se efectueaza in vase de sticla cu peretii rezistenti pentru a se evita craparea lor sau in capsule de portelan.
Diluarea acidului sulfuric concentrat cu apa se face intotdeauna prin introducerea acidului sulfuric in apa, in fir subtire, cu agitare continua si racire. Diluarea acidului sulfuric concentrat in apa are loc cu degajare mare de caldura datorita hidratarii ionilor HSO4- si H+. Prin turnarea apei cu d = 1g/cm3 peste H2SO4 concentrat cu d =1,84 g/cm3 procesul de hidratare are loc la suprafata acidului. Caldura degajata nu se transmite masei de acid sulfuric si solutia rezultata poate ajunge la fierbere. Vaporii formati pot antrena H2SO4 concentrat, producand in acest fel o stropire cu acid sulfuric. In schimb, daca se toarna acid sulfuric in apa, picatura cu picatura, acidul sulfuric mai greu, cade la fundul paharului si solutia se incalzeste treptat, evitandu-se accidentele.
Traumatismele prin lovire pot fi provocate in urma manevrarii incorecte a aparatelor grele, buteliilor, la utilizarea necorespunzatoare a sticlariei etc. Cand se introduc tuburi de sticla in dopuri de cauciuc perforate, acestea trebuie infasurate intr-o panza si tinute in apropierea partii solicitate mecanic pentru a se evita plesnirea tevii si ranirea mainilor. Pentru usoara alunecare a tubului de sticla prin dop acesta trebuie umectat cu o solutie de sapun sau detergent.
Este interzisa ungerea ventilelor si manometrelor de la buteliile cu oxigen lichid cu grasimi sau uleiuri precum si atingerea acestora cu mainile unse cu grasimi deoarece se pot produce explozii cu urmari foarte grave.
Electrocutarile pot fi provocate de montarea defectuoasa a aparatelor electrice. Aparatele electrice de incalzit (etuve, cuptoare, bai de nisip si apa) se vor aseza pe mese cu suprafata izolata termic. Astfel, instalatiile si aparatele electrice vor fi legate la priza cu impamantare. Nu se utilizeaza aparate cu conductori neizolati sau montati neregulamentar.
Se interzice manipularea aparatelor si instalatiilor electrice din laborator cu mana umeda.
Studentii care efectueaza lucrari practice in laboratorul de chimie trebuie sa tina cont de urmatoarele:
Studentii au acces in laborator numai in prezenta cadrului didactic si numai daca cunosc lucrarea care urmeaza sa fie efectuata precum si, normele de protectia muncii referitoare la lucrarile practice;
Lucrarile se vor fi demarate numai dupa ce studentul este bine documentat asupra modului de lucru si dupa ce a discutat in detaliu planul lucrarii cu cadrul didactic. Se interzice efectuarea altor lucrari in afara celor stabilite, iar in laborator orice problema neclara studentul este adresata cadrului didactic;
Studentul trebuie sa se prezinte la lucrarile practice cu un caiet de laborator si este obligat sa foloseasca halate de protectie din bumbac pentru protejarea imbracamintii. Inainte de inceperea experimentului studentii trebuie sa stranga parul lung la spate;
Studentii sunt obligati sa poarte ochelari de protectie la toate experientele cu substante agresive si manusi pentru manipularea produsilor corozivi;
Studentii trebuie sa lucreaza de preferinta in picioare si se consulta permanent pictogramele de pe etichetele flacoanelor cu substante chimice utilizate care indica pericolul prezentat de produsul considerat; trebuie respectate masurile de protectie corespunzatoare pictogramelor;
Este strict interzisa gustarea substantelor chimice din laborator, sa preleveze cu mana substantele solide si aspirarea cu gura a substantelor in stare lichida. Pentru preluarea substantelor chimice in stare solida se vor utiliza spatule speciale, iar pentru aspirarea lichidelor se vor folosi fie para de cauciuc, fie pipete automate, fie pentru a lua o cantitate mica de lichid se introduce pipeta in lichid. Astfel, cand lichidul s-a ridicat in pipeta prin capilaritate, se acopera capatul liber al pipetei cu degetul, dupa care se scoate pipeta din lichid, mentinand degetul pe pipeta, pana in momentul pipetarii;
Inainte de a deschide o sticla cu reactivi se va citi cu atentie eticheta si nu se va mirosi niciodata direct o substanta chimica; prin miscarea mainii, cu precautie se indreapta vaporii sau gazele spre nas;
Studentii trebuie sa se asigure intotdeauna ca recipientele pe care doresc sa le incalzeasca (obligatoriu folosind site metalice de azbest) pot fi utilizate fara a produce accidente;; recipientele din sticla fierbinti nu se racesc brusc in apa si nici nu se asaza pe suprafete reci;
Reactivii se manevreaza in asa fel incat sa se evite impurificarea lor. Dupa efectuarea experientelor cu substante care pot fi recuperate (azotat de argint, iod, alcool etilic), acestea nu se arunca ci se depoziteaza in vase speciale;
In cursul lucrarilor fiecare student trebuie sa fie preocupat permanent de economisirea consumului de reactivi, apa distilata, curent electric, gaz, etc;
Este strict interzis fumatul precum si, pastrarea si consumarea alimentelor in laborator; studentul va evita deplasarile inutile prin laborator pentru a se evita producerea accidentelor sau stanjenirea colegilor;
In laborator se va pastra ordine si curatenie perfecte; se interzice ingramadirea obiectelor necesare pentru desfasurarea lucrarii practice pe masa de lucru, acestea punandu-se la loc imediat dupa utilizare.
Observatiile si datele experimentale obtinute in timpul efectuarii lucrarilor practice si calculul rezultatelor se noteaza in caietul de laborator. Inregistrarea rezultatelor experientelor precum si interpretarea lor trebuie astfel facute incat sa fie intelese atat de studentul care le-a efectuat cat si de oricare alta persoana care ar consulta caietul de laborator.
1. Sticlarie si ustensile utilizate in laborator
O problema deosebit de importanta pentru buna organizare a muncii in laboratoarele de chimie, o constituie dotarea cu materiale si cu ustensile adecvate precum si, cunoasterea conditiilor corecte de utilizare a acestora.
In laboratoarele de chimie se utilizeaza vase si ustensile confectionate din sticla speciala termorezistenta (tip Jena, Pyrex, Duran etc), portelan, faianta, metal si lemn sau combinate intre ele.
Sticla se gaseste sub forma de semifabricate (baghete si tuburi de diverse dimensiuni si calitati) sau sub forma de obiecte finite (piese de legatura si vase de laborator). In functie de compozitie si tehnologia de fabricatie se cunosc mai multe tipuri de sticla, care difera in functie de rezistenta mecanica si caracteristicile termice. In experimente se folosesc vase cu pereti subtiri, din sticla usor fuzibila (in special pentru incalzirea lichidelor), vase cu pereti subtiri din sticla greu fuzibila (pentru incalzirea puternica a lichidelor sau variatii bruste de temperatura) precum si vase din sticla cu peretii grosi pentru operatii care nu necesita incalzire. Mentinerea reactivilor odata preparati se realizeaza in vase de sticla cu pereti grosi.
Din sticla se confectioneaza marea majoritate a obiectelor necesare realizarii experimentelor in laborator: eprubete (gradate sau negradate) de diferite dimensiuni, eprubete de centrifuga, sticle de ceas, pahare Berzelius, flacoane conice Erlenmeyer, baloane cu fund plat, baloane cu fund rotund, baloane tip Kjeldahl, baloane cu fund rotund si cu tub lateral tip W rt, cristalizoare, palnii de filtrare, palnii de siguranta, palnii de separare, fiole de cantarire, exicatoare, refrigerente, pisete, termometre etc. Pentru masurarea cu exactitate a unor volume de lichide se intrebuinteaza baloane cotate, cilindri gradati, pipete, biurete etc. (figura 1).
O clasificare a sticlariei utilizate in laboratoarele de chimie se poate face dupa destinatia utilizarii: pentru reactii calitative sau pentru dozaj. Astfel, sticlaria utilizata in reactiile calitative este compusa din: eprubete, capsule, palnii, pahare Berzelius, pisete, spatule, baghete din sticla pentru agitare etc.; pentru dozaje sunt utilizate: biurete, pipete din sticla, agitator magnetic si bara magnetica invelita cu teflon, eprubete gradate, pahare Berzelius, flacoane Erlemneyer, pisete cu apa distilata etc.
Tipul cel mai simplu al unui vas de laborator este eprubeta, care are forma unui tub de sticla inchis la un capat si care se mentine in timpul experimentului in suporturi speciale denumite stative. In cazul in care, intr-un protocol de lucru, eprubeta trebuie incalzita la un bec de gaz, se utilizeaza un cleste de lemn si se evita orientarea capatului deschis spre proprii ochi sau alte persoane.
Pentru executarea reactiilor care nu decurg la temperaturi prea inalte, a operatiilor de dizolvare, fierbere etc., se utilizeaza baloane si pahare de laborator de diferie capacitati. Vasele conice sunt utilizate, in special, pentru efectuarea operatiilor de titrare.
Paharele Berzelius, vasele Erlenmeyer si baloanele cu fund plat sunt confectionate de regula din sticla terorezistenta pentru a rezista la incalzirile repetate. Trebuie mentionat faptul ca vasele de sticla cu pereti grosi sunt mai putin rezistente la incalzire decat cele cu pereti subtiri.
O alta categorie de vase din sticla de importanta deosebita pentru efectuarea lucrarilor de laborator o constituie vasele din sticla care prezinta gradatii, destinate masurarii volumelor de lichide: baloane cotate, biurete, pipete, cilindrii gradati etc.
Pentru masuratori de mare precizie se utilizeaza biuretele (la titrari) care pot masura cu o precizie de 0,1ml la biuretele obisnuite si 0,01-0,02ml la microbiurete. Aceste sunt fixate pe stative speciale cu ajutorul unor cleme, astfel incat biureta sa fie perfect verticala. De mentionat este faptul ca, atunci cand se introduce lichidul in biureta (cu ajutorul unei palnii), acesta se pune incet pentru a se evita formarea bulelor de aer. In cazul in care acestea apar ele trebuie eliminate fie prin inclinarea biuretei, fie prin surgerea brusca a unui jet de lichid.
Masurarea unui volum determinat de solutie se face cu ajutorul pipetelor (care pot fi cu bula sau gradate). Pentru folosirea pipetei din sticla se utilizeaza para de cauciuc.
Cantarirea diverselor substante se realizeaza cu ajutorul fiolelor de cantarire. Pentru uscarea lenta si conservarea substantelor care absorb cu usurinta umiditatea se folosesc aparate etanse care prin substantele componente (clorura de calciu anhidra, anhidrida fosforica etc.) absorb apa numite exicatoare. Acestea prezinta deasupra absorbantului o placa de portelan cu gauri, care permit circulatia aerului in exicator. Pe aceasta placa se asaza produsul destinat uscarii (intr-o fiola, intr-un creuzet etc.). Daca in exicator se introduc pentru racire vase fierbinti, acesta trebuie lasat cateva minute exicatorul intredeschis, pentru a permite iesirea aerului cald, dupa care acesta se inchide.
Frecvent utilizate in laboratoarele de chimie sunt instalatiile denumite refrigerente care servesc la racirea gazelor sau vaporilor precum si, cel mai adesea la condensarea acestora. Pentru asamblarea diferitelor parti componente ale unei instalatii se folosesc diferite piese de legatura, de preferinta prevazute cu slifuri.
► Spalarea si uscarea vaselor de laborator
De modul in care se curata vasele depinde in mare masura rezultatul lucrarilor de laborator, in special al celor analitice.
Vasele de laborator trebuie spalate imediat dupa utilizare pentru a se evita formarea crustelor si a se putea alege cea mai adecvata metoda. De la caz la caz, vasele se spala cu apa, indepartand precipitatele aderente cu ajutorul unor perii cu dimensiuni adecvate (nu cu bagheta, sarma sau spatula care pot zgaria sticla) cu abur sau prin procedee chimice.
Spalarea chmica trebuie executata de obicei cu un amestec cromic (format dintr-un amestec de acid sulfuric si bicromat de potasiu), evitandu-se contactul acestuia cu pielea sau cu imbracamintea. Amestecul cromic se poate folosi la mai multe spalari pana ce culoarea se schimba sensibil trecand spre verde.
Vasele se spala apoi cu multa apa si se clatesc cu pa distilata.Daca vasul este bine spalat, apa distilata se scurge fara a lasa picaturi pe peretii vasului.
Dupa spalare, vasele se usuca, fie asezate cu gura in jos pe un suport, fie in etuva. In nici un caz vasele nu vor fi sterse in interior, deoarece raman scame sau vasele pot fi murdarite din nou prin atingere cu mana; deasemenea, este interzisa uscarea vaselor la flacara.
O modalitate utilizata pentru a grabi uscarea vasele este clatirea dupa spalare cu acetona perfect curata si apoi suflate cu aer cald. In final acetona poate fi colectata separat si recuperata prin distilare.
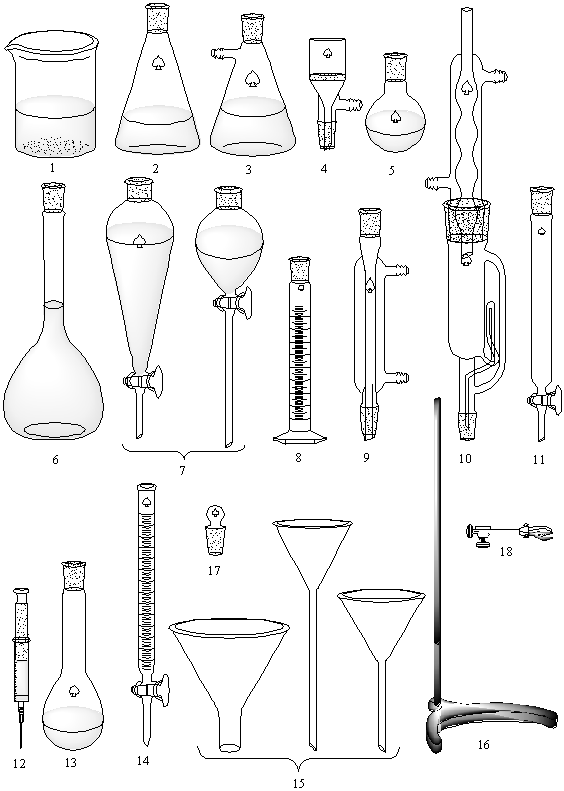
Fig. nr. 1. Exemple de sticlarie si ustensile utilizate in laborator: 1 - pahar Berzelius, 2- flacon Erlenmeyer, 3 - palnie de filtrare in vid, 4 - cartus filtrant, 5 - balon cu fund rotund, 6- balon cotat, 7 - palnie de separare, 8 - cilindru gradat, 9 - refrigerent, 10 - componente Soxhlet, 11 - coloana de separare, 12 - seringa, 13 - balon Kjeldahl, 14 - biureta, 15 - palnii, 17 - dop rodat, 18 - clema cu mufa
2. Solutii
2.1. Determinarea masei substantelor
Determinarea masei substantelor se efectueaza prin operatia numita cantarire cu ajutorul unor dispozitive numite balante.
In functie de metoda de lucru impusa de protocolul experimental si implicit de necesitatea preciziei se folosesc diferite tipuri de balante. Din punct de vedere al sensibilitatii balantele pot fi clasificate in:
balante tehnice, cu sensibilitate de pana la 1x10-2g;
balante farmaceutice, cu sensibilitate de pana la 1x10-3g;
balante analitice, cu sensibilitate de la 1x10-4 pana la 1x10-5g;
balante semimicroanalitice, cu sensibilitate de pana la 1x10-4g;
balante microanalitice, cu sensibilitate de pana la 1x10-6g
balante ultramicroanalitice, cu sensibilitate de pana la 1x10-7g
In cadrul lucrarilor practice de chimie si biochimie se folosesc: balanta tehnica si balanta analitica.
Balanta tehnica, la care se pot executa cantariri de ordinul centigramelor, este compusa din: parghie cu brate egale montata pe un picior central; talere ac indicator; scala gradata.
Pentru efectuarea cantaririi se verifica in primul rand starea de echilibru a balantei. In continuare, obiectul de cantarit se aseaza pe talerul din stanga, iar pe talerul din dreapta se pun greutati, cu ajutorul pensetei, pana la echilibrare. Masa substantei este reprezentata de suma greutatilor de pe talerul din partea dreapta.
Balantele analitice se folosesc pentru cantariri de mare precizie. Din punct de vedere al constructiei se clasifica in:
balante analitice cu oscilatii libere;
balante analitice cu amortizare (sunt prevazute cu un sistem de pistoane care amortizeaza oscilatiile balantei dupa 10 - 15 secunde);
balante analitice cu cutie de greutati;
balante analitice prevazute in interior cu greutati si cu sistem de manevrare a acestora din exterior.
Balantele analitice sunt protejate prin pereti de sticla, pentru a fi izolate de miscarea aerului, de respiratia celui care cantareste etc.
Trusa de greutati
Greutatile analitice se pastreaza in cutii speciale din lemn sau material plastic. Greutatile sunt construite din materiale speciale.
Cantarirea substantelor chimice
Substantele care nu sunt afectate prin expunere la aer pot fi cantarite pe sticla de ceas. In acest scop se cantareste intai sticla de ceas, curata si uscata; se scoate de pe talerul balantei si se adauga pe ea, cu ajutorul unei spatule, portiuni din substanta de cantarit.
Substantele chimice care sunt afectate de umezeala, CO2, sau O2 se cantaresc in fiole de cantarire.
Reguli de cantarire
Balanta nu se incarca niciodata peste sarcina maxima indicata de constructor.
Pe talerul balantei nu se aseaza obiecte calde, fierbinti sau reci. Obiectul de cantarit trebuie sa aiba temperatura camerei.
Inainte de verificarea punctului zero este bine ca talerele balantei sa fie sterse cu o pana degresata, mai ales atunci cand la aceeasi balanta lucreaza mai multe persoane.
Inaintea cantaririi, ca si dupa aceea, trebuie sa se verifice punctul zero.
Asezarea obiectului de cantarit si a greutatilor pe talerele balantei, se face numai dupa ce aceasta a fost blocata cu ajutorul opritorului.
Aducerea substantei de cantarit pe sticla de ceas, sau in fiola, se face numai dupa ce acestea au fost scoase din incinta balantei.
Dupa asezarea obiectului si a greutatilor, usile incintei balantei se inchid si abia dupa aceea se incepe cantarirea.
Deschiderea si inchiderea opritorului balantei se face lent si continuu.
Se evita oscilatia talerelor balantei. Pentru aceasta obiectele se pun pe mijlocul talerelor. Daca, totusi, la deschiderea balantei talerele oscileaza, este necesar sa o inchidem incet, apoi sa o redeschidem. Operatia se repeta de cateva ori pana ce talerele nu mai oscileaza.
Greutatile din trusa se manevreaza numai cu penseta.
Dupa terminarea cantaririi se scot greutatile si se introduc in trusa de greutati, se curata talerele balantei si se inchid usile incintei balantei.
2.2. Prepararea si caracterizarea unor solutii
Se numeste solutie un amestec omogen alcatuit din doua sau mai multe substante, care formeaza o singura faza: gazoasa, lichida, sau solida. Substanta care predomina din punct de vedere cantitativ se numeste solvent (dizolvant), iar substanta care se gaseste in cantitate mai mica se numeste solvat (substanta dizolvata).
Proprietatea unei substante de a se dizolva intr-un anumit dizolvant se numeste solubilitate. Exista o anumita concentratie maxima pana la care poate creste cantitatea de substanta dizolvata intr-un lichid la o anumita temperatura data. O solutie care contine cantitatea maxima de substanta dizolvata, se numeste solutie saturata. Intr-o solutie saturata, la temperatura respectiva nu se mai dizolva o noua cantitate de substanta adaugata.
Concentratia unei solutii reprezinta marimea care exprima raportul dintre cantitatea de substanta dizolvata si cantitatea sau volumul de solvent (dizolvant) sau de solutie obtinuta.
► Concentratia procentuala masica (gravimetrica) (c%) se exprima in grame de substanta dizolvata in 100 grame solutie si se calculeaza dupa formula:
c% = md/ms x 100
unde: md = masa de substanta dizolvata (g)
ms = masa de solutie (g)
Exemplu: sa se exprime in procente concentratia solutiei formata din 240 g apa si 60 g clorura de sodiu.
c%=60/300 x 100=20%
Observatie: la calcularea concentratiei procentuale a sarurilor reprezentand cristalohidrati se tine seama de apa de cristalizare.
► Concentratia procentuala volumica (% vol.) se exprima in ml substanta lichida sau gazoasa la 100 ml solutie. Se exprima prin aceeasi formula, folosind insa marimile Vd (volumul substantei dizolvate) si Vs (volumul solutiei).
Titrul (T) reprezinta masa de substanta dizolvata, exprimata in grame, continuta intr-un mililitru de solutie.
► Concentratia molara (molaritatea) reprezinta numarul de moli (molecule-gram) de substanta dizolvata in 1000 ml solutie. Se calculeaza dupa formula:
m (sau M) = md/M x Vs
unde: md = masa de substanta dizolvata (g)
Vs = volumul de solutie in litri
M = masa moleculara a substantei
Exemplu: o solutie continand 80 g NaOH in 500 ml solutie va avea concentratia molara:
m = 80/40 x 0,5 = 4
► Concentratia normala (normalitatea) reprezinta numarul de echivalenti gram de substanta dizolvata in 1000 ml solutie. Se calculeaza dupa formula:
n (sau N) = md/E x Vs
Exemplu: o solutie continand 20 g NaOH in 2000 ml solutie va avea concentratia normala:
n = 20/40 x 2 =0,25
La acizii monobazici (HCl, HNO3) echivalentul gram este egal cu masa moleculara (de exemplu: EgHCl = 36,6/1; EgHNO3 = 63/1).
La acizii polibazici echivalentul gram se calculeaza dupa numarul atomilor de hidrogen capabili sa reactioneze (de exemplu: EgH2SO4 = 98/2; EgH3PO4 = 98/3).
La baze echivalentul gram se calculeaza facand raportul intre masa moleculara a bazei si numarul gruparilor OH (de exemplu: EgCa(OH)2 = 74/2; EgNaOH = 40/1).
La saruri echivalentul gram este raportul intre masa moleculara si produsul intre valenta metalului si numarul atomilor de metal din molecula respectiva (de exemplu: EgCuSO4 = 160/2x1=80).
In cazul reactiilor de oxido-reducere echivalentul gram se calculeaza din raportul dintre masa moleculara si numarul de electroni cedati respectiv acceptati.
Regula amestecurilor este utilizata la prepararea solutiilor de o anumita concentratie, pornind de la doua solutii de concentratii diferite, una de concentratie mai mare si cealalta de concentratie mai mica, sau pornind de la o solutie de anumita concentratie si o noua cantitate de solvent.
Cantitatile de solutii care se amesteca sunt invers proportionale cu valorile diferentelor dintre concentratiile lor si concentratia solutiei obtinute. Expresia matematica a acestei reguli se poate exprima prin asa numita regula a dreptunghiului. In centrul dreptunghiului, la intersectia diagonalelor, se scrie concentratia solutiei de preparat, c, in varfurile din stanga se inscriu concentratiile solutiilor de plecare (concentratia mai mare, a, sus iar cea mica, b, jos) se scad cifrele de pe diagonala (cifra cea mai mica din cea mai mare) si se inscriu rezultatele obtinute in prelungirea diagonalelor respective, adica in varfurile din dreapta. Cifrele respective reprezinta cantitatile necesare in grame de fiecare solutie.

![]()
![]()
![]()
![]() a gA gA = c - b
a gA gA = c - b
![]()
![]() c
c
![]() b gB gB = a - c
b gB gB = a - c
Prepararea si titrarea unei solutii de hidroxid de sodiu (NaOH) 0,1N
In chimia analitica solutiile normale au concentratii care variaza in functie de metoda pentru care sunt utilizate. Prepararea unei solutii de normalitate aproximativa nu necesita exactitate in efectuarea operatiilor de preparare ca in cazul solutiilor etalon.
Hidroxidul de sodiu nu este o substanta etalon, deoarece nu este stabil, absorbind usor dioxidul de carbon si vaporii de apa din atmosfera. Din aceste motive din NaOH se prepara o solutie de normalitate aproximativa. Masa moleculara a NaOH fiind 40, pentru prepararea unei solutii 0,1N, se cantaresc pe o sticla de ceas, la balata tehnica aproximativ 4,5 - 5 g NaOH care se spala repede de 1-2 ori cu apa distilata (fara CO2), pentru a indeparta stratul de carbonat format pe suprafata granulelor. Granulele se introduc apoi prin intermediul unei palnii intr-un balon cotat de 1 litru (in care se afla aproximativ 500 ml apa distilata), se agita bine pana la completa dizolvare a substantei, apoi se completeaza pana la semn cu apa distilata si se agita pentru omogenizarea solutiei.
Determinarea concentratiei unei solutii de normalitate aproximativa se face prin titrarea ei cu o solutie etalon (o solutie de referinta fata de care ne rapotam si determinam caracteristicile solutiei analizate).
Titrarea este operatia efectuata in vederea determinarii continutului unui component al solutiei de analizat, prin adaugarea treptata a unei solutii de reactiv de concentratie cunoscuta pana la punctul de echivalenta cand se masoara exact volumul de reactiv consumat. Stadiul titrarii care corespunde cantitatii echivalente de reactiv adaugat se numeste punct de echivalenta.
In afara de metodele chimice punctul de echivalenta mai poate fi determinat prin metode fizico-chimice.
Operatia de titrare se executa astfel: se masoara intr-un flacon Erlenmeyer, un anumit volum de solutie de concentratie cunoscuta, se dilueaza cu aproximativ 100 ml apa distilata si se adauga cateva picaturi de solutie indicator. Se umple o biureta cu solutia a carui titru (concentratie) urmeaza sa fie stabilita apoi din aceasta, se adauga treptat la solutia pregatita in flaconul conic, sub agitare, pana la schimbarea culorii indicatorului. La inceputul titrarii adaugarea solutiei se face mai repede, iar catre sfarsitul acesteia, cu picatura. Daca raman picaturi pe gatul sau peretii flaconului, acestea se spala imediat cu apa distilata, introducandu-se in solutie. Titrarea se considera exacta daca schimbarea de culoare a solutiei titrate la sfarsitul determinarii, are loc la adaugarea unei singure picaturi in plus din solutia de concentratie cunoscuta, peste punctul de echivalenta. La titrarea fiecarei solutii se fac cel putin trei determinari, intre care nu trebuie sa existe o diferenta mai mare de 0,05 ml, dupa care se face media aritmetica, pentru calcularea factorului solutiei aproximative.
Materiale necesare: NaOH, acid oxalic, solutie alcoolica de fenoftaleina 1%, flacoane Erlenmeyer pentru titrare, sticla de ceas, balon cotat de 1l, biureta, piseta etc.
Modul de lucru
Substanta etalon este in acest caz acidul oxalic, care se cantareste la balanta analitica in cantitate cuprinsa intre 0,1-0,2 g dupa care se preia cantitativ in 25-30 ml apa distilata. Se adauga 2-3 picaturi de fenoftaleina 1% si se titreaza cu NaOH aproximativ 0,1 N pana ce coloratia roz pal se mentine (persista). Se citeste pe biureta, cu precizie, volumul de NaOH utilizat pentru titrare si se vor face cel putin 3 determinari.
Pentru a calcula titrul solutiei de NaOH se tine seama de reactia ce a avut loc si de faptul ca un echivalent gram de acid oxalic este M/2 = 63,034, care neutralizeaza un echivalent gram de NaOH (40,005g).
Notand cu "a" cantitatea de acid oxalic cantarita si cu "n" numarul de mililitri de solutie NaOH utilizati la titrare rezulta:
H2C2O4 + 2 NaOH = Na2C2O4 + 2 H2O
63,034g C2O4H2 x 2H2O..........40,005g NaOH
a...................x
unde:
x reprezinta cantitatea in grame de NaOH care se afla in n ml solutie
in n ml solutie NaOH...........x g NaOH
1ml.............Tr
Tr = x/n
Pentru calcularea titrului teoretic (Tt) al NaOH 0,1N procedam astfel:
0,1x40,005 g . 1000 ml apa distilata
Tt 1 ml
Tt = 40,005 . 0,1/1000 = 0,004 g/ml
Factorul unei solutii este numarul care ne arata de cate ori solutia aproximativa este mai concentrata sau mai diluata decat solutia de normalitate exacta. Aceasta se poate determina prin titrare sau prin calcul:
F = Treal/ Tteoretic
Factorul solutiei este un numar care se situeaza in jurul valorii de 1. La solutiile de normalitate aproximativa, F > 1 sau F < 1, se recomanda ca factorul F sa apartina domeniului: 0,8 < F < 1,2 si sa calculeze cu patru cifre zecimale.
Aplicatii
Dupa determinarea titrului si factorului, solutia de NaOH se poate folosi pentru stabilirea concentratiilor unor solutii de acizi prin titrare cu solutia alcalina. Cunoscand volumul de solutie acida luat in lucru, volumul de NaOH consumat la titrare si factorul solutiei alcaline, se poate calcula concentratia solutiilor acide utilizate.
2.2.2. Prepararea si titrarea unei solutii de acid clorhidric (HCl) 0,1N
Pentru prepararea unei solutii de HCl 0,1 N se foloseste acid clorhidric 37,23% a carui densitate este de 1,19g/cm3. Cantitatea de HCl 37,23% in care se afla 3,6457g HCl, se calculeaza in modul urmator:
37,23g HCl ......100g solutie HCl
3,6457g HCl ......x g solutie HCl
x = 9,7923 g solutie HCl
V=m/ = 9,79523/1,19 = 8,23 ml solutie HCl
Materiale necesare: HCl concentrat, HCl 0,1N, NaOH 0,1N, fenoftaleina 1%, flacoane Erlenmeyer pentru titrare, balon cotat de 1l, biureta etc
Intr-un balon cotat de 1 litru se introduc, cu o pipeta gradata, 8,23 ml solutie HCl 37,23% (pentru ca erorile in minus sa fie evitate deoarece HCl este volatil) si apoi amestecul solutiilor din balonul cotat se completeaza cu apa distilata pana la semn. Balonul se agita pentru omogenizare.
● Stabilirea titrului solutiei de HCl 0,1N
Titrul solutiei de HCl aproximativ 0,1N poate fi determinat cu ajutorul unei solutii titrate de NaOH aproximativ 0,1N.
Modul de lucru
In trei flacoane Erlenmeyer se masoara 10-20 ml solutie de HCl 0,1N, se adauga 2-3 picaturi de fenolftaleina 0,1% in alcool etilic. Se titreaza cu solutie de NaOH 0,1N pana cand continutul flaconului se coloreaza in roz-pal persistent.
Se noteaza cu V volumul solutiei de NaOH cu titru cunoscut, consumat la titrare.
Calcularea titrului solutiei de HCl se face pe baza reactiei de neutralizare:
HCl + NaOH = NaCl + H2O
40,005 g NaOH.........36,465g HCl
VNaOH TNaOH gNaOH......x g HCl
x = VNaOH TNaOH 36,465/40,005 gHCl ce se gasesc in solutia de HCl luata in lucru:
Vml solutie HCl ...........x g HCl
1ml solutie HCl.............THCl
THCl = VNaOH TNaOH 36,465/40,005 VHCl
Se calculeaza titrul solutiei de HCl pentru fiecare determinare in parte, apoi se face media aritmetica a rezultatelor obtinute. Titrul mediu rezultat, este titrul solutiei aproximativ 0,1N de HCl.
Pentru stabilirea factorului solutiei de HCl se foloseste fie relatia:
F = Treal/T teoretic = Treal/0,0036465
Fie pornind de la relatia echivalentei pentru fiecare determinare:
VHCl FHCl = VNaOH FNaOH
FHCl = VNaOH FNaOH/VHCl
Cu solutia astfel preparata se pot doza volumetric solutii de borax, amoniac, NaOH etc.
Aplicatie: Determinarea duritatii apei
Duritatea totala a unei ape este data de totalitatea bicarbonatilor de calciu si magneziu din apa care formeaza duritatea temporara precum si de totalitatea sarurilor de calciu si magneziu ale acizilor minerali (cloruri, sulfati) care formeaza duritatea totala.
Prin fierbere, duritatea temporara a apei dispare, deoarece bicarbonatii de Ca si Mg trec in carbonati greu solubili in apa ce se pot inlatura disparand astfel ca generatori de duritate.
Ca(HCO3)2 = CaCO3+CO2+H2O
Mg(HCO3)2 = MgCO3+CO2+H2O
Pentru determinarea duritatii temporare a apei, se dozeaza volumetric bicarbonatii de Ca si Mg cu un acid tare, de obicei HCl 0,1N, dupa reactiile:
Ca(HCO3)2+2HCl = CaCl2+2CO2+2H2O
Mg(HCO3)2+2HCl = MgCl2+2CO2+2H2O
Se ia un volum de 100ml din apa de analizat, masurat precis cu biureta, care se titreaza, la rece, in prezenta de metilorange, cu HCl 0,1N pana cand culoarea indicatorului vireaza de la galben la portocaliu. Rezultatul determinarii se poate exprima in grade franceze (g CaCO3 la 100 000 ml apa) sau in grade germane (g CaO la 100 000ml apa).
CaCO3+2HCl = CO2+CaCl2+H2
50,035g CaCO3.......36,465g HCl
xg CaCO3..........nT
x = nT50,035/36,465
daca la 100ml apa.......xg CaCO3
la 100 000ml apa......yg CaCO3
y = 1 000 x grade franceze
Calcularea duritatii temporare in grade germane
CaO+2HCl = CaCl2+H2O
28gCaO.......36,465gHCl
x'g CaO.............nT
x' = nT28/36,465
daca la 100ml apa....... x'g CaCO3
la 100 000ml apa...... y'g CaCO3
y' = 1 000 x' grade germane
Se precipita ionii de Ca si Mg cu un volum, in exces, cunoscut de solutie titrata ce contine NaOH si Na2CO3 (lesie). Sarurile de Ca sunt precipitate de catre Na2CO3, iar cele de Mg de catre NaOH.
CaCl2+ Na2CO3 = CaCO3+2NaCl
MgCl2+2NaOH = Mg(OH)2+2NaCl
Se filtreaza precipitatul si se titreaza excesul de lesie cu HCl 0,1N.
Se prepara o solutie decinormala care trebuie sa contina, in echivalenti, de cca 3 ori mai mult Na2CO3 decat NaOH:
3 . 0,1 mol Na2CO3/4 2=3 10,6/4 2= 3,97g, cca 4g Na2CO3
1 0,1 mol NaOH/4 1=4/4=1g NaOH
Aceste cantitati le dizolvam intr-un litru de apa distilata, intr-un balon cotat. Pentru titrarea lesiei folosim HCl 0,1N in prezenta de metilorange ca indicator, pana cand culoarea vireaza de la galben la portocaliu-roz. Se va stabili in acest fel corespondenta intre 1ml lesie si n ml HCl, respectiv CaO stiind ca 1 echivalent gram de HCl corespunde la 1 echivalent gram CaO.
20ml lesie s-a titrat cu 18ml HCl cu T=0,004025
20ml lesie......18ml HCl
1ml lesie..........x x=0,9ml HCl
1ml lesie.........0,9.0,004025=0,003623g HCl
36,465g HCl......28g CaO
0,003623g HCl.......x1g CaO
x1 = 0,002782g CaO corespunde la 1ml lesie
Se masoara 100ml din apa de analizat exact neutralizata (folosim proba in care s-a determinat duritatea temporara) si se trateaza cu un exces de lesie (cca 30ml), fierbandu-se cateva minute. Vor precipita CaCO3 si Mg(OH)2. Dupa racire se aduce suspensia, cantitativ, intr-un balon cotat de 200-250ml, se aduce la semn, se agita bine si se filtreaza. Din filtrat se masoara 50ml si se titreaza excesul de lesie cu HCl 0,1N in prezenta de metilorange. Se fierbe putin solutia si dupa racire se continua titrarea pana la punctul de echivalenta.
x ml lesie..........3ml HCl x = 3,3ml lesie exces
in total, in balonul de 250ml, avem 5 x3,3=16,5ml lesie in exces. Stiind ca initial s-au pus 30ml lesie, au reactionat cu sarurile de Ca si Mg 30-16,5=13,5ml lesie.
Atunci 13,5ml lesie.........yg CaO
y=0,03756g CaO la 100ml apa
Vom avea, prin urmare, 37,56 grade germane. Apa este deci foarte dura.
Dupa duritatea totala apele se clasifica astfel:
|
Nr. crt. |
Tipuri de ape |
Duritate totala (grade germane) |
|
Foarte moi | ||
|
Moi | ||
|
Mijlocii | ||
|
Relativ dure | ||
|
Dure | ||
|
Foarte dure |
Peste 30 |
Determinarile volumetrice prin aceasta metoda au la baza o reactie de oxidoreducere. Reactiile de oxidoreducere, numite prescurtat redox, sunt reactii de transfer de electroni. Oxidarea poate fi definita ca o pierdere de electroni, iar reducerea ca un castig sau o acceptare de electroni.
Dupa reactia care are loc si reactivul care se intrebuinteaza se deosebesc permanganometria, iodometria, bromatometria, bicromatometria.
In mediu puternic acid anionul MnO4- in care manganul este heptavalent accepta 5 electroni trecand in Mn divalent:
![]() CaCl2+
Na2CO3 CaCO3+2NaCl
CaCl2+
Na2CO3 CaCO3+2NaCl
![]() MgCl2+2NaOH Mg(OH)2+2NaCl
MgCl2+2NaOH Mg(OH)2+2NaCl
MnO4- + 5e- + 8H+ ![]() Mn2+ + 4H2O
Mn2+ + 4H2O
In acest caz echivalentul gram al permanganatului este raportul intre greutatea moleculara si 5:
Modul de lucru
Pentru prepararea unei solutii 0,1N se cantaresc la balanta tehnica aproximativ 3,1-3,2g KMnO4 pentru un litru de solutie, se completeaza cu apa distilata pana la 1000ml, se omogenizeaza si se pastreaza la intuneric 7-8 zile pentru stabilizare. In acest interval de timp impuritatile organice sau alte substante reducatoare sunt oxidate.
● Stabilirea titrului solutiei de KMnO4 aproximativ 0,1N
Se cantaresc la balanta analitica 0,1-0,2g acid oxalic si se aduc cu ajutorul pisetei cu apa distilata intr-un pahar. Se adauga 10ml acid sulfuric diluat (1:1) si se incalzeste solutia la 70-800 C pentru accelerarea procesului de oxidare. Continutul paharului se titreaza cu solutie de permanganat de potasiu pana la obtinerea unei coloratii roz-pal persistente. Daca solutia din paharul de titrare nu este suficient de acida, in decursul titrarii se formeaza un precipitat de MnO2 care trebuie dizolvat. In acest scop se mai adauga acid sulfuric diluat pana la dizolvarea completa a precipitatului. La titrare are loc reactia:
2KMnO4 + 5C2H2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 8H2O + 10CO2
![]() C2O4
-2e- 2CO2 /
5
C2O4
-2e- 2CO2 /
5
![]() Mn7+
+ 5e- Mn2+ /
2
Mn7+
+ 5e- Mn2+ /
2
Daca VKmnO4 este volumul solutiei de permanganat aproximativ 0,1N folosit la titrare, a este cantitatea de acid oxalic cantarita, titrul solutiei de permanganat de potasiu se calculeaza pe baza urmatorului rationament:
63,034 g acid oxalic reactioneaza cu.........31,606g KMnO4
a g acid oxalic reactioneaza cu..............x g KMnO4
x = a.31,606/63,024.VKMnO4
Pentru determinarea titrului real cantitatea in grame de permanganat se imparte la volumul solutiei de permanganat de potasiu utilizata la titrare:
VKMnO4.x g KMnO4
1ml..Tr
Tr = x/VKMnO4
Practic se fac trei determinari, se calculeaza titrul pentru fiecare determinare si apoi titrul mediu. Din valoarea titrului mediu se calculeaza factorul care este raportul dintre titrul real si titrul teoretic. Utilizand valoarea titrului mediu se poate calcula normalitatea solutiei de permanganat de potasiu dupa formula:
Aplicatie: Dozarea permanganometrica a cationului Fe2+
Cationii Fe2+ se titreaza cu solutie de permanganat de potasiu in mediu de acid sulfuric. Are loc urmatoarea reactie redox:
2KMnO4 + 10FeSO4 + 8H2SO4![]() 2MnSO4
+ 5Fe2(SO4)3 + K2SO4 +
8H2O
2MnSO4
+ 5Fe2(SO4)3 + K2SO4 +
8H2O
![]() 2Fe2+
- 2e- 2Fe3+ /
5
2Fe2+
- 2e- 2Fe3+ /
5
![]() Mn7+
+5e- Mn2+
/ 2
Mn7+
+5e- Mn2+
/ 2
Materiale necesare: proba de analizat (FeSO4 sau alta sare de Fe2+), H2SO4 20%, H3PO4 90%, solutie de KMnO4 0,1N titrata, flacoane Erlenmeyer pentru titrare, biureta.
Modul de lucru
Intr-un flacon de titrare se introduce cantitativ proba de analizat (0,15-0,2g) cantarita exact la balanta analitica, se dizolva in 80-100ml apa distilata, apoi se aciduleaza cu 15ml acid sulfuric 20%. Se adauga, in continuare, 5ml acid fosforic 90% (are rolul de a complexa cationii Fe3+, colorati in galben, formand complecsi incolori care nu impiedica observarea virajului), se agita bine pentru omogenizare si se titreaza cu solutia de permanganat 0,1N cu titru cunoscut, sub agitare puternica pana cand continutul paharului de titrare devine roz-pal.
Echivalentul gram al fierului in aceasta reactie este 55,84/1g.
Notand cu V volumul de solutie de permanganat de potasiu utilizat la titrare, cu V1 volumul de solutie de analizat, cu F factorul solutiei de permanganat de potasiu, se face urmatorul rationament pentru calculul cantitatii de Fe din proba de analizat:
31,606g KMnO4..............55,84g Fe2+
VTKmnO.................xg Fe2+
xg Fe2+ se afla in V1ml luati pentru analiza
V1ml solutie de analizat........ xg Fe2+
100ml................yg Fe2+
Concentratia fierului se poate exprima si in g% cand substanta de analizat este solida
2.2.4. Prepararea si titrarea unei solutii de tiosulfat de sodiu (Na2S2O3) aproximativ 0,1N (Iodometria)
Dozarile iodometrice au la baza actiunea oxidanta a iodului elementar care actioneaza conform reactiei:
I2 + 2e-![]() 2I-
2I-
Deoarece solubilitatea iodului in apa este mica, se lucreaza in solutii de iodura de potasiu. Prin dizolvarea iodului in solutie de KI se formeaza combinatia complexa, instabila, numita triiodura de potasiu, K[I3]. De aceea in solutii de ioduri unde exista anionul de triiodura, I3-, reactia redox este:
I3- + 2e-![]() 3I-
3I-
Se cantaresc, la balanta tehnica, 25g Na2S2O3x 5H2O (echivalentul gram al tiosulfatului este egal cu masa sa moleculara conform reactiei de mai jos iar al iodului cu masa sa atomica) si se dizolva intr-un litru apa distilata fiarta si racita pentru eliminarea dioxidului de carbon si oxigenului care ar putea descompune tiosulfatul de sodiu conform reactiilor:
Na2S2O3 + CO2 + H2O = NaHCO3 + NaHSO3 +S
Na2S2O3 + O2 = 2Na2SO4 + S
Solutia de tiosulfat de sodiu preparata se lasa 8 zile pentru stabilizare si apoi se filtreaza sulful depus. Titrul se determina cu o solutie titrata de iod sau cu ajutorul unor alte solutii titrate de oxidanti.
● Stabilirea titrului tiosulfatului de sodiu cu ajutorul iodului se bazeaza pe reactia:
2 Na2S2O3 + I2 = Na2S4O6 + 2NaI
I2 + 2e-![]() 2I-
2I-
2S2O32- - 2e-![]() S4O62-
S4O62-
Intr-un flacon Erlenmeyer se masoara cu biureta 10-15ml solutie de iod 0,1N, se adauga apa distilata pana la 100ml si se titreaza cu solutie de tiosulfat pana la culoarea galben-pai. Se adauga 3-4 picaturi solutie de amidon si se continua titrarea pana la disparitia culorii albastre. Se noteaza volumul total de tiosulfat utilizat. Calculul titrului solutiei de tiosulfat se face dupa urmatorul rationament:
126,92g iod............248,19g tiosulfat
nTiod..............mTtiosulfat
Ttiosulfat=248,19nTiod/126,92m
unde: n reprezinta ml solutie iod si
m ml solutie tiosulfat.
In mediu acid dicromatul de potasiu elibereaza iodul din iodura:
K2Cr2O7 + 6KI + 14HCl = 2CrCl3 + 3I2 + 8KCl + 7H2O
Cr2 6+O72- + 6e- +
14H+![]() 2Cr3+
+ 7H2O / 1
2Cr3+
+ 7H2O / 1
2I- - 2e- ![]() I2 /
3
I2 /
3
Deoarece viteza de oxidare a iodurii este mica, titrarea iodului eliberat din iodura cu tiosulfat trebuie efectuata dupa 10-15 min. de la amestecarea reactantilor. Pentru a evita pierderile de iod prin volatilizare determinarea se face in flacoane iodometrice. Titrarea se face pana la galben-deschis, se adauga solutia de amidon si se continua titrarea pana la disparitia culorii albastre.
Intr-un flacon iodometric se introduc 10ml solutie de bicromat de potasiu 0,1N (cu concentratie cunoscuta) exact masurati si se adauga 10ml iodura de potasiu 20% si 10ml acid clorhidric 4N. Se astupa flaconul iodometric si se lasa la intuneric 10-15 min. Se spala cu atentie dopul si peretii interiori ai flaconului iodometric cu apa distilata (care se culege in flacon), se dilueaza apoi cu apa distilata si se titreaza cu tiosulfat de sodiu pana la culoarea galben deschis. In continuare se adauga amidon 1% si se continua titrarea pana la disparitia culorii albastre.
Ttiosulfat = nNEtiosulfat/1000V
unde:
n reprezinta ml solutie bicromat;
N reprezinta normalitatea bicromatului;
Etiosulfat reprezinta echivalentul gram al tiosulfatului de sodiu
V reprezinta ml solutie tiosulfat.
Aplicatie: Dozarea iodometrica a apei oxigenate
Dozarea iodometrica a apei oxigenate se bazeaza pe reactia:
H2O2 + 2I- + 2H+ = I2 + 2H2O
H2O2 + 2H+ + 2e- = 2H2O
Intr-un balon cotat de 100ml se introduc 5ml solutie apa oxigenata 30% si se completeaza cu apa distilata pana la semn. Se introduc in flaconul de titrarea 2, 3, 4, 5ml din solutia astfel preparata, se aciduleaza cu 5-10ml acid sulfuric 2N, se adauga 1-2g iodura de potasiu in 10ml apa si dupa 5-10 min. se titreaza iodul rezultat din reactie, in prezenta amidonului ca indicator. Viteza reactiei poate fi marita prin adaugarea a 2-3 picaturi de molibdat de amoniu 1M drept catalizator. Reactiile care au loc sunt:
H2O2 + 2KI + H2SO4 = 2H2O + K2SO4 + I2
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Presupunand ca la titrare s-au utilizat n ml solutie tiosulfat de sodiu cu titrul T stabilit, pentru a calcula concentratia apei oxigenate in proba de analizat, se face urmatorul rationament:
1 ml solutie tiosulfat..........Ttiosulfat
n ml solutie tiosulfat...........x g iod
x = nTtiosulfat
126,92 g iod............17,008 g H2O2
x g iod.................y
y = x 17,008/126,92
Daca in volumul V.............y g H2O2
100 ml...........z
z = 100 y/V = g H2O2%
Analiza chimica calitativa organica are drept scop identificarea elementelor care intra in compozitia substantei de analizat (analiza elementara calitativa) precum si identificarea grupelor functionale prezente (constituind analiza functionala calitativa).
3.1. Identificarea carbonului
In timp ce substantele anorganice nu ard, cele organice, incalzite treptat pe o lama de platina sau pe un capac de creuzet de portelan, se carbonizeaza si ard cu o flacara mai mult sau mai putin fumegatoare (indicand in acest fel prezenta carbonului in molecula), ard linistit sau se aprind cu explozie, se topesc mai greu sau mai usor. In cazul in care substanta organica analizata sublimeaza prin incalzire, prezenta carbonului nu poate fi pusa in evidenta prin aceasta metoda. In acest caz se foloseste oxidul de cupru prin intermediul caruia se pun in evidenta atat carbonul cat si hidrogenul.
Materiale necesare: substanta de analizat, Ba(OH)2, CuO, eprubete, dop de pluta prevazut cu un tub recurbat, pahar Berzelius.
Modul de lucru
Pentru aceasta se amesteca 0,1-0,2 g substanta de analizat cu aproximativ 1-2 g (in exces) oxid de cupru (II) perfect uscat prin calcinare. Amestecul se introduce intr-o eprubeta greu fuzibila astupata cu dop de pluta prin care trece un tub de sticla recurbat. Intreg sistemul se fixeaza in pozitie orizontala pe un stativ. Varful liber al tubului se introduce intr-o eprubeta care contine solutie de hidroxid de bariu sau calciu. Amestecul se incalzeste treptat, cu atentie. Daca substanta este organica, se va dezvolta dioxid de carbon care in prezenta hidroxidului de bariu sau calciu va forma un precipitat de carbonat de bariu sau calciu. Pe peretii reci ai eprubetei sau pe tubul abductor se depun picaturi de apa rezultate din oxidarea hidrogenului continut de substanta organica cu ajutorul oxidului de cupru (oxidul de cupru trebuie calcinat pentru a nu contine urme de apa sau substante organice). Oxidul de cupru se reduce pana la cupru metalic de culoare rosie. Au loc urmatoarele reactii:
2CuO + C = CO2 + 2Cu
CuO + H2 = H2O + Cu
CO2 + Ba(OH)2 = B aCO3 + H2O
3.2. Identificarea azotului prin metoda Lassaigne
Pentru identificarea acestor elemente substanta de analizat este supusa dezagregarii cu sodiu metalic care se combina cu carbonul, azotul, sulful si halogenii din molecula organica rezultand cianura de sodiu, sulfura de sodiu si, respectiv, halogenura de sodiu. Punerea in evidenta se realizeaza prin reactii specifice ale ionilor respectivi.
Materiale necesare: substanta de analizat, sodiu metalic, tub de sticla (6-8 cm cu diametrul interior de 8-10 mm), sticla de ceas, pahar Berzelius, cleste de lemn.
Modul de lucru
Intr-un tub de sticla de 6-8 cm cu diametrul interior de 8-10 mm, inchis la unul din capete, se introduc 0,02-0,05 g substanta de analizat si apoi un graunte de sodiu metalic (uscat cu hartie de filtru si curatat de stratul de oxid). Se tine tubusorul inclinat cu un cleste si se incalzeste treptat la flacara mica a unui bec de gaz, mai intai in partea unde se gaseste sodiul (pana cand acesta se topeste) si apoi unde se gaseste substanta in asa fel incat vaporii substantei sa treaca peste sodiul topit. Dupa ce substanta este calcinata complet, tubusorul incandescent se introduce intr-un flacon conic ce contine 15-25 ml apa distilata. Pentru ca sodiul metalic nereactionat sa nu sara afara din apa, flaconul se acopera cu o placa de sticla, tubul se sparge iar continutul se dizolva in apa. Solutia rezultata se filtreaza si se imparte in trei:
din solutie pentru identificarea azotului
din solutie pentru identificarea sulfului
din solutie pentru identificarea halogenilor
Identificarea azotului din solutia rezultata se realizeaza prin metoda Lassaigne
Materiale necesare: solutie concentrata de sulfat feros proaspat preparata, FeCl3, HCl, eprubete.
Modul de lucru
Solutia pastrata pentru identificarea azotului se trateaza la rece, intr-o eprubeta, cu 2-3 picaturi dintr-o solutie concentrata de sulfat feros, proaspat preparata, 1-2 picaturi clorura ferica, se incalzeste la fierbere, se raceste si se adauga cateva picaturi de acid clorhidric. Daca substanta contine mult azot apare imediat un precipitat albastru (albastru de Berlin) iar daca substanta contine putin azot apare o coloratie care variaza intre verde si albastru. Au loc urmatoarele reactii:
N + Na + C = NaCN
Cianura de sodiu reactioneaza cu sulfatul feros rezultand cianura feroasa:
2NaCN + FeSO4 = Fe(CN)2 +Na2SO4
Cianura feroasa reactioneaza cu un exces de cianura de sodiu si rezulta ferocianura de sodiu:
Fe(CN)2 + 4NaCN = Na4[Fe(CN)6]
Ferocianura de sodiu, in prezenta ionilor ferici, da nastere la o combinatie complexa de culoare albastra (albastru de Berlin):
3Na4[Fe(CN)6] +4FeCl3 = Fe4[Fe(CN)6]3 + 12NaCl
Este absolut necesar ca in solutie sa existe un exces de ioni ferici. In caz contrar se formeaza complecsi de forma NaFe[Fe(CN)6] ce dau solutii coloidale.
Modul de lucru
Solutia pastrata pentru identificarea sulfului se imparte in doua:
► In prima portiune se introduce o solutie proaspat preparata de nitroprusiat de sodiu (Na2[Fe(CN)5NO]x2H2O) (reactia Vohl). In cazul in care in proba exista sulf, in prezenta ionilor S2- (din Na2S care a rezultat din calcinarea substantei organice supusa analizei cu Na metalic) apare o coloratie violet care dispare in timp. Aceasta coloratie este datorata formarii unui complex:
Na2[Fe(CN)5NO] + Na2S = Na4[Fe(CN)5NOS]
In situatia in care concentratia de S este mare coloratia violeta devine rosie.
► A doua portiune de solutie se trateaza cu acetat de plumb. Formarea unui precipitat negru de sulfat de plumb indica prezenta sulfului:
Pb(CH3-COO) + Na2S = PbS + 2 CH3COONa
3.4. Identificarea halogenilor prin diferite metode
Prezenta sau absenta halogenilor in solutia de dezagregare se poate realiza in mod diferit, in functie de tipul halogenului.
Identificarea halogenilor prin metoda cu azotat de argint
Materiale necesare: solutie de nitroprusiat de sodiu proaspat preparata, FeCl3, HCl, acetat de plumb, eprubete.
Modul de lucru
Daca substanta contine in molecula azot, sulf sau ambele elementele, solutia obtinuta dupa dezagregare se aciduleaza cu acid sulfuric si se fierbe cateva minute pentru a indeparta ionii CN- si S2- (sub forma de acid cianhidric si hidrogen sulfurat). Solutia obtinuta se dilueaza (un exces de acid sulfuric ar conduce la obtinerea precipitatului de sulfat de argint, greu solubil) si se trateaza cu o solutie de azotat de argint. Formarea halogenurii de argint indica prezenta halogenilor in molecula.
Identificarea halogenilor prin metoda cu oxid de calciu
Materiale necesare: solutie de nitroprusiat de sodiu proaspat preparata, FeCl3, HCl, acetat de plumb, eprubete.
Modul de lucru
Intr-o eprubeta speciala, cu pereti subtiri, se introduce o cantitate mica de substanta de analizat fin pulverizata si se amesteca cu CaO uscat si liber de halogeni. Prin incalzire la incandescenta se formeaza halogenura de calciu. Eprubeta inrosita se introduce intr-un pahar cu apa distilata si se sparge. Solutia obtinuta se filtreaza de resturile de sticla, se aciduleaza cu acid azotic si se trateaza cu azotat de argint. Formarea unui precipitat indica prezenta halogenilor in substanta de analizat.
Identificarea halogenilor prin metoda Beilstein
Materiale necesare: substanta de analizat, fir de cupru.
Modul de lucru
Aceasta metoda de identificare a halogenilor pe cale uscata presupune existenta unui fir de cupru care se arde in flacara oxidanta pana cand aceasta este incolora dupa care firul se raceste. Se depun cateva mg substanta de analizat pe capatul curatat al firului de cupru si se introduc in flacara. La inceput substanta se topeste, apoi se aprinde cu flacara luminoasa. Daca substanta contine halogeni flacara becului de gaz se coloreaza in verde sau verde albastrui datorita formarii halogenurii de cupru care prin incalzire devine volatila.
Analiza functionala calitativa organica se ocupa cu identificarea grupelor functionale prezente intr-o molecula organica.
Combinatiile simple, care contin in molecula numai carbon si hidrogen (hidrocarburi saturate) au o reactivitate mica. Introducerea unei legaturi duble, a altor atomi (oxigen, azot, sulf etc.) sau grupe de atomi conduce de cele mai multe ori la cresterea reactivitatii.
Grupa functionala reprezinta fragmentul dintr-o molecula care poseda proprietati chimice specifice pe care le transfera compusilor chimici care o contin.
Proprietatile substantelor organice sunt determinate de natura radicalului organic, de grupa sau grupele functionale prezente in molecula compusului analizat precum si de influentele reciproce care apar.
Legǎtura dubla
Compusii nesaturati cu una sau mai multe legaturi duble in molecula prezinta reactivitate chimica marita datorita tendintei de desfacere a dublei legaturi participand la reactii de aditie, oxidare, polimerizare etc.
4.1.1. Reactii de aditie
Reactiile de aditie sunt caracteristice compusilor cu legatura dubla in molecula. Halogenii se aditioneaza usor la dubla legatura. Clorul se aditioneaza cel mai usor fiind urmat de brom si apoi de iod. Din punct de vedere analitic cel mai usor se urmareste aditia bromului datorita faptului ca viteza de reactie este convenabila precum si datorita faptului ca acesta este colorat.
Materiale necesare: acid fumaric, acid cinamic, tetraclorura de carbon, triclormetan, eprubete, solutie de brom 5%.
Modul de lucru Intr-o eprubeta se introduc o cantitate mica de substanta organica cu dubla legatura (acid fumaric, acid cinamic) si 2 ml dintr-un solvent potrivit, inactiv fata de brom (tetraclorura de carbon, triclormetan). Eprubeta se agita pentru dizolvarea substantei organice si apoi se introduce, cu picatura, solutie de brom 5% preparata in acelasi solvent ca mai sus. Decolorarea solutiei indica prezenta dublei legaturi in molecula. Are loc aditia bromului la dubla legatura, proces in urma caruia rezulta compusi dibromurati saturati.
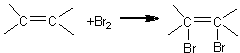
alchena compus dibromurat
Reactia de aditie a bromului la dubla legatura serveste in scopuri analitice pentru dozari calitative sau cantitative.
4.1.2. Reactii de oxidare
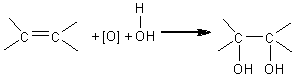
Prin oxidarea legaturilor duble are loc aditia oxigenului la dubla legatura. Mecanismul acestei reactii nu se poate preciza intotdeauna dar, se pare ca, de multe ori, reactia se desfasoara prin faza intermediara de glicol:
alchena diol
Daca agentul oxidant este puternic oxidarea merge mai departe rezultand cetone sau chiar acizi, acestia din urma rezultand prin scindarea legaturii duble.
Reactia WAGNER-BAYER permite identificarea legaturii duble. In prezenta dublei legaturi o solutie alcalina de permanganatul de potasiu in mediu bazic (reactiv Bayer) se decoloreaza.
Aceasta reactie se bazeaza, in principiu pe eliberarea oxigenului, necesar oxidarii legaturii duble, din permanganat de potasiu care, in mediu slab bazic, se reduce la dioxid de mangan (precipitat brun). In aceste conditii, la temperatura normala alchenele se oxideaza la dioli:
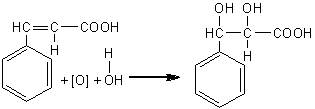
acid cinamic diolul acidului cinamic
Materiale necesare: acid cinamic, Na2CO3 5%, KMnO4 0,5%, eprubete.
Modul de lucru
Se introduc intr-o eprubeta 2ml hidrocarbura nesaturata lichida (acid cinamic) care se alcalinizeaza cu 1ml solutie de Na2CO3 5%. Peste acest amestec se introduce, cu picatura, sub agitare solutie de KMnO4 0,5%. Initial culoarea roz a permanganatului dispare, pentru ca apoi sa apara precipitatul brun de MnO2.
4.2. Hidrocarburi aromatice
Hidrocarburile aromatice participa cu usurinta la reactii de substitutie.
4.2.1. Reactia de sulfonare
Sulfonarea este un proces chimic care conduce la obtinerea de acizi sulfonici a caror tarie este comparabila cu a acizilor minerali. Sulfonarea se poate realiza direct cu acid sulfuric concentrat:
Ar-H + H2SO4 = Ar-SO3H + H2O
Sulfonarea benzenului sub actiunea acidului sulfuric concentrat conduce la acid benzensulfonic, a doua grupare sulfonica va intra in pozitia m, iar a treia, in conditii energice, in m'.
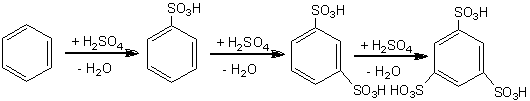
benzen acid benzen acid m dibenzen acid m, m tribenzen
sulfonic sulfonic sulfonic
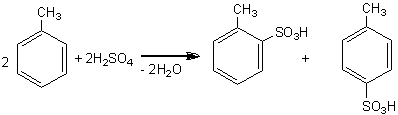
toluen acid o toluen sulfonic acid p toluen sulfonic
Materiale necesare: benzen, toluen, acid sulfuric concentrat, eprubete, pahare Berzelius.
Modul de lucru
In doua eprubete se introduc 0,1-1ml benzen si, respectiv, toluen peste care se adauga cate 3ml acid sulfuric concentrat (se introduce acid sulfuric in exces deoarece la incalzire se produce dilutie datorita apei de reactie). Eprubetele se incalzesc timp de 10 min. pe o baie de apa in fierbere, sub agitare, fara ca amestecurile din eprubete sa fiarba. Eprubetele se racesc apoi intr-un pahar cu apa. Se observa ca amestecul care contine acid benzensulfonic se separa in doua straturi, un strat de acid sulfuric si un altul de acid benzensulfonic, greu solubil in acid sulfuric diluat de apa de reactie. Sulfonarea toluenului conduce la obtinerea unui amestec de acid o-toluensulfonic (in proportie mai mica) si acid p-toluensulfonic solubili in amestecul rezultat.
Se trece continutul fiecarei eprubete in cate un pahar in care se afla 10-15ml apa distilata rece. Se vor face observatii si comentarii.
4.2.2. Reactia de nitrare
Reactia de nitrare directa cu acid azotic decurge usor in seria aromatica. In anumite cazuri este utilizat pentru nitrare amestec nitrant (amestec de acid azotic si acid sulfuric in proportii si concentratii care variaza de la caz la caz).
Benzenul reactioneaza cu acidul azotic concentrat conducand la formarea nitrobenzenului.
Materiale necesare: benzen, acid azotic concentrat, acid sulfuric, eprubete, pahare Berzelius.
Modul de lucru
Intr-o eprubeta se introduc 0,5g benzen si 5ml acid azotic concentrat. Dupa incalzirea amestecului timp de cateva minute, continutul eprubetei se introduce intr-un pahar in care se afla 15ml apa distilata. Se observa separarea nitrobenzenului, lichid slab galbui, mai dens decat apa, cu miros de migdale amare.
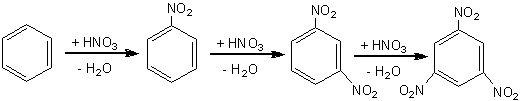
benzen nitrobenzen m dinitrobenzen m, m', trinitrobenzen
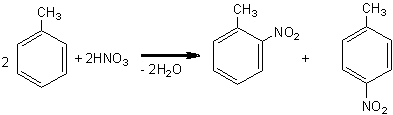
toluen o nitro toluen p nitro toluen
Grupa nitro este un substituent de ordinul II. Introducerea unei a doua grupe nitro necesita conditii mai energice de nitrare. Se foloseste amestec nitrant si un timp mai mare de incalzire a amestecului de reactie.
Amestecul nitrant se prepara din 1,5ml acid azotic si 2ml acid sulfuric. Imediat, fara ca amestecul nitrant sa se raceasca, se adauga peste acesta 1ml nitrobenzen. Amestecul de reactie rezultat se incalzeste pe baie de apa timp de 15 min., dupa care se raceste si se introduce intr-un volum de apa rece de patru ori mai mare (aproximativ 20ml). Se observa separarea m-dinitrobenzenului care cristalizeaza.
Compusii hidroxilici sunt substante organici care rezulta prin inlocuirea unuia sau mai multor atomi de H din hidrocarburi cu grupe -OH. Dupa starea de hibridizare a atomului de carbon de care se leaga gruparea functionala compusii hidroxilici pot fi: alcooli, enoli si fenoli.
4.3.1. Reactia cu metalele alcaline este una din reactiile de identificare a compusilor hidroxilici. Alcoolii, fenolii si enolii reactioneaza cu metalele alcaline care inlocuiesc hidrogenul functional conducand la formarea de alcoxizi (alcoolati), fenoxizi (fenolati), enolati (toate sunt substante cu caracter ionic) si hidrogen usor identificabil.
R-OH + Na = R-O-Na+ + 1/2H2
R-O-Na+ + H2O = R-OH + NaOH
Materiale necesare: alcool etilic sau metilic, sodiu metalic, eprubete, pahare Berzelius.
Modul de lucru
Intr-o eprubeta uscata se introduc 4 ml alcool absolut, metilic sau etilic, si o bucatica de sodiu metalic, proaspat taiata, curatata de oxid si uscata cu hartie de filtru. Reactia este puternic exoterma si se observa degajarea bulelor de hidrogen. Sub agitare continua metalul se consuma treptat in reactie. Dupa terminarea reactiei, solutia de alcoxid rezultata se raceste cu apa de la robinet. Daca solutia este concentrata, alcoxidul, greu solubil in alcool anhidru, va precipita. Solutia se dilueaza in continuare cu 5-6ml apa distilata constatandu-se dizolvarea alcoxidului (se regenereaza alcoolul initial si mediul capata caracter bazic din cauza hidroxidului format). Cu ajutorul fenolftaleinei se pune in evidenta alcalinitatea solutiei datorata hidrolizei alcoxidului.
4.3.2. Reactia cu reactivul Nessler (K2HgI4 - tetraiodomercuriat de potasiu este iodura de mercur, 1,4%, in solutie apoasa de iodura de potasiu si hidroxid de potasiu) este o reactie de identificare a alcoolilor primari, secundari si tertiari. Alcoolii primari si secundari reduc reactivul Nessler la mercur metalic, comportare care nu se manifesta la alcoolii tertiari.
Materiale necesare: tetraiodomercuriat de potasiu (iodura de mercur), reactiv Nessler, eprubete.
Modul de lucru
In doua eprubete se introduc 1-2ml alcool primar si respectiv alcool secundar . Se adauga apoi cate 1-2ml reactiv Nessler si se aduce continutul ambelor eprubete la fierbere timp de 2 min. Se observa aparitia precipitatului negru de mercur metalic.
4.3.3. Reactiile de oxidare pot servi pentru identificarea alcoolilor primari, secundari si tertiari. Alcoolii primari se oxideaza, in conditii blande, la aldehide. In conditii mai energice reactia poate sa conduca la obtinerea de acizi carboxilici.
Reactia de oxidare cu dicromat de potasiu
Materiale necesare: alcool etilic, dicromat de potasiu, acid sulfuric diluat, reactiv Schiff, eprubete.
Modul de lucru
Intr-o eprubeta se introduce 1ml alcool etilic, peste care se adauga cativa ml solutie de dicromat de potasiu si 1ml acid sulfuric diluat. Amestecul se incalzeste treptat, alcoolul transformandu-se in aldehida acetica ce se poate recunoaste dupa mirosul caracteristic de mere verzi sau dupa culoarea roz pe care o da cu reactivul Schiff.
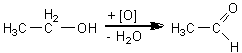
alcool etil acetaldehida
Oxidarea alcoolului la acidul corespunzator este indicata de modificarea culorii portocalii a dicromatului de potasiu in verde, modificare ce indica sfirsitul reactiei de oxidare.
Reactia de oxidare cu oxid de cupru
Alcoolii primari, in prezenta oxidului de cupru (II), se oxideaza conducand la obtinerea aldehidelor corespunzatoare:
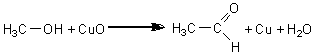
alcool metilic formaldehida
Materiale necesare: alcool metilic, fir de cupru, eprubete.
Modul de lucru
Se introduc intr-o eprubeta uscata 2-3ml alcool metilic. Se inroseste in flacara un fir de cupru care se introduce apoi in alcoolul metilic din eprubeta. Se constata ca firul de cupru se inroseste, din cauza reducerii oxidului de cupru de pe suprafata firului la cupru metalic, iar alcoolul metilic se oxideaza la formaldehida.
Reactia de oxidare cu permanganat de potasiu
In conditii energice de oxidare, in prezenta permanganatului de potasiu in mediu acid, alcoolul etilic se transforma in acid acetic cu formare intermediara de aldehida acetica.
![]()
alcool metilic acid acetic
Materiale necesare: permanganat de potasiu, alcool etilic, acid sulfuric diluat, eprubete.
Modul de lucru
Intr-o eprubeta se introduce o cantitate mica de permanganat de potasiu solid, cativa ml apa distilata si 2-3ml alcool etilic. Se fierbe continutul eprubetei timp de 2-3min. dupa care se adauga 3ml acid sulfuric diluat. Se ataseaza la eprubeta un tub de sticla recurbat si se continua incalzirea. Se va constata degajarea acidului acetic dupa mirosul caracteristic al acestuia sau dupa culoarea rosiatica a hartiei de turnesol.
4.3.4. Reactia de esterificare (acilare)
Aceasta reactie consta in inlocuirea atomilor de hidrogen hidroxilici cu un radical acil conducand la obtinerea de esteri.
Materiale necesare: acetat de sodiu, alcool metilic, alcool etilic, acid sulfuric concentrat, eprubete.
Modul de lucru
Se introduc in doua eprubete cate o cantitate mica de acetat de sodiu solid si 1ml acid sulfuric concentrat. In una din eprubete se introduc 2ml alcool metilic si in cealalta 2ml alcool etilic. Continutul eprubetelor se incalzeste cu atentie si se constata aparitia esterilor metilic si, respectiv, etilic ai acidului acetic, ce se recunosc dupa mirosul placut de fructe. Au loc urmatoarele reactii:
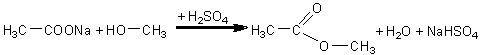
acetat de sodiu alcool metilic acetat de metil
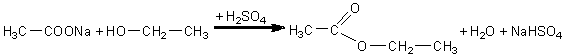
acetat de sodiu alcool etilic acetat de etil
4.3.5. Reactii de culoare
Alcoolii dau reactii caracteristice, in mediu bazic, in prezenta unor substante ca vanilina sau acidul diazobenzensulfonic.
Materiale necesare: Reactiv Rosenthaler I (1g acid sulfanilic dizolvat in 150ml apa distilata si 50ml HCl 5N), reactiv Rosenthaler II (azotit de sodiu 7%), alcool metilic, etilic, propilic, Na OH 20%, eprubete.
Modul de lucru
In 2-3 eprubete diferite se introduc cate 2ml amestec dintre reactivii Rosenthaler I si Rosenthaler II (4:1). Se alcalinizeaza amestecul din eprubete cu NaOH 20% (atentie la pH). In fiecare eprubeta se introduc cate 2-3ml alcool (metilic, etilic, propilic). Continutul eprubetelor se incalzeste timp de 2-3min. Se observa aparitia unei coloratii rosu inchis in cazul alcoolilor usor solubili si roz deschis in cazul celor greu solubili.
4.3.6. Reactii specifice unor compusi hidroxilici
Reactia etanolului cu iodul in mediu alcalin
In solutie alcalina iodul se transforma in hipoiodit, oxidant puternic ce transforma alcoolul etilic in aldehida acetica. In conditiile in care hipoioditul este in exces aldehida acetica se transforma in triiod-acetaldehida care, in mediu alcalin, se scindeaza conducand la iodoform:
![]()
hipoiodit de sodiu
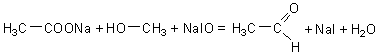
acetaldehida
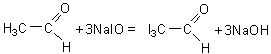
triiodacetaldehida
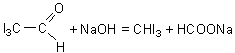
iodoform
Materiale necesare: alcool etilic, etilic, propilic, solutie de iod, NaOH sau KOH 5%, eprubete.
Modul de lucru
Intr-o eprubeta se introduc 2-3ml alcool etilic si 2-3ml apa distilata. Solutia obtinuta se incalzeste usor dupa care se adauga 0,5-1ml solutie de iod (2g iod si 5g iodura de potasiu se dizolva in 100ml apa distilata) si cu picatura, pana la disparitia coloratiei iodului, o solutie alcalina 5% (NaOH sau KOH). Formarea iodoformului se recunoaste dupa aparitia unui precipitat de culoare galbena cu miros specific de medicament.
Reactia de deshidratare a glicerinei
Glicerina se deshidrateaza in prezenta sulfatilor acizi, transformandu-se in acroleina a carei prezenta se recunoaste dupa mirosul caracteristic, intepator.
Materiale necesare: sulfat acid de potasiu, glicerina, azotat de argint amoniacal, eprubete.
Modul de lucru
Intr-o eprubeta sau creuzet se incalzesc aproximativ 1g sulfat acid de potasiu (KHSO4) si cateva picaturi de glicerina, iar dupa scurt timp apare mirosul specific de acroleina. Prezenta acroleinei mai poate fi pusa in evidenta prin plasarea unei hartii de filtru umectata cu azotat de argint amoniacal la gura eprubetei sau deasupra creuzetului. Se va observa aparitia unei pete negre de argint metalic.
Reactia de recunoastere a glicerinei cu hidroxid de cupru
Prin tratare glicerinei cu hidroxid de cupru se formeaza gliceratul de cupru care este un alcoxid de culoare albastra solubil in apa.
Materiale necesare: hidroxid de cupru, sulfat de cupru 5%, hidroxid de sodiu 5%, glicerina, azotat de argint amoniacal, eprubete.
Modul de lucru
Intr-o prima etapa, se prepara hidroxidul de cupru, precipitat de culoare albastra, prin tratarea unei solutii apoase de sulfat de cupru 5% cu un mic exces de solutie apoasa de hidroxid de sodiu sau potasiu 5%. Apoi, se adauga cateva picaturi de glicerina si se agita eprubeta pana la disparitia precipitatului cand se formeaza o solutie colorata in albastru.
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
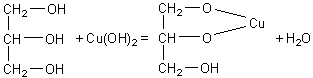
glicerina (glicerol) glicerat de cupru
Fenolii, mai putin raspanditi in natura comparativ cu alcoolii, sunt substante organice care contin gruparea functionala hodroxil grefata pe un nucleu aromatic. Proprietatile chimice ale fenolilor si implicit reactiile lor caracteristice sunt determinate de existenta in molecula a grupelor -OH si a nucleului aromatic ce se influenteaza reciproc. Fenolul si crezolii, precum si -naftolii se gasesc in gudroanele rezultate la distilarea gudroanelor
4.4.1. Evidentierea caracterului acid
Datorita influentei nucleului aromatic, fenolii prezinta caracter acid mai pronuntat decat alcoolii. Este motivul pentru care fenolii reactioneaza nu numai cu metalele alcaline ci si cu hidroxizii alcalini conducand la formarea de fenoxizi. Fiind saruri ale unor acizi slabi cu baze tari, fenoxizii metalelor alcaline sunt hidrolizati in solutie apoasa ce prezinta caracter bazic.
Materiale necesare: fenol, rezorcina, hidrochinona, a-naftol, hidroxid de cupru 5-7%, acid sulfuric diluat 1:5, eprubete.
Modul de lucru
Se introduc in eprubete diferite cantitati mici de fenoli (fenol, rezorcina, hidrochinona, a-naftol). Se adauga apoi, in fiecare eprubeta, cu picatura, solutie apoasa de hidroxid de sodiu 5-7% pana la dizolvare completa. Rezulta astfel fenoxizii corespunzatori, compusi care sunt solubili in apa.
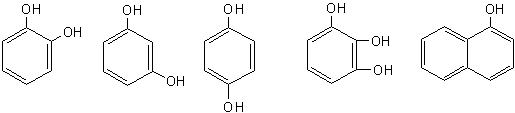
pirocatechina rezorcina hidrochinona pirogalol α-naftol
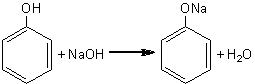
fenol fenoxid de sodiu
Fenolii au caracter de acizi slabi motiv pentru care pot fi pusi in libertate din fenoxizi de catre acizi slabi. Astfel, prin acidularea solutiilor de fenoxizi, limpezi, obtinute mai sus, cu acid sulfuric diluat (1:5) solutiile se tulbura datorita separarii fenolilor sub forma de emulsie sau precipitat, dupa caz.
4.4.2. Reactii de culoare
Reactia de culoare cu clorura ferica
Fenolii, in solutii neutre sau slab acide, dau coloratii intense, caracteristice, cu solutii diluate de FeCl3. Culoarea este datorata formarii unor saruri bazice de fier sau a unor combinatii complexe. Clorura ferica este un oxidant slab, ionul de fier trecand din Fe3* in Fe2*.
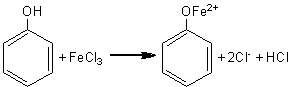
fenol ion complex colorat
Materiale necesare: fenol, rezorcina, pirogalol, a-naftol, solutie apoasa FeCl3 1%, eprubete.
Modul de lucru
In eprubete diferite se dizolva in apa distilata cateva cristale de fenoli (fenol, rezorcina, pirogalol, a-naftol, etc). In fiecare eprubeta se introduc apoi 1-2 picaturi dintr-o solutie apoasa de FeCl3 1%. Se va constata aparitia unor coloratii caracteristice care variaza de la violet (fenol, a-naftol) la rosu-brun).
Reactia cu acidul azotos (reactia Liebermann)
Fenolii, tratati cu azotiti, in mediu de acid sulfuric concentrat reactiv conduc la aparitia unei coloratii specifice in functie de natura fenolului. La adaugare de apa, culoarea vireaza spre rosu intens datorita formarii unor compusi de natura chinonica.
Materiale necesare: fenol, acid sulfuric concentrat, reactiv Liebermann (KNO2 5% in acid sulfuric concentrat), eprubete, pahare Berzelius.
Modul de lucru
Intr-o eprubeta se dizolva putin fenol in acid sulfuric concentrat. Peste aceasta solutie se adauga reactiv Liebermann (KNO2 5% in acid sulfuric concentrat). Apare o coloratie caracteristica fiecarui fenol. Daca se introduce amestecul colorat din eprubeta intr-o cantitate mica de apa se va observa modificarea nuantei culorii care va vira spre rosu datorita formarii unor coloranti din clasa indofenolilor, cu structura chinonica.
4.4.3. Reactia ftaleinelor
Fenolii, tratati cu anhidrida ftalica, in prezenta acidului sulfuric concentrat (agent de condensare datorita efectului sau deshidratant), se transforma in ftaleine. Acestea au o structura trifenilmetanica fiind incolore in mediu acid (forma lactonica) si colorate in mediu bazic (forma chinonica).
Materiale necesare: fenol, anhidrida ftalica, acid sulfuric concentrat, hidroxid de sodiu 5-10%, eprubete, pahare Berzelius.
Modul de lucru
Intr-o eprubeta se introduc cateva cristale de fenol, o cantitate mica de anhidrida ftalica si cateva picaturi de acid sulfuric concentrat. Amestecul se incalzeste cu atentie la flacara unui bec de gaz timp de cateva minute, dupa care se raceste si se adauga, cu picatura, NaOH, 5-10% pana la aparitia coloratiei rosii caracteristice ftaleinei in mediu alcalin.
4.4.4. Bromurarea fenolilor
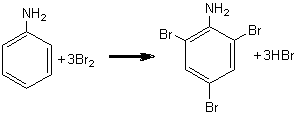
Este o reactie de substitutie la nucleul aromatic care se petrece mai usor in cazul fenolilor comparativ cu alte hidrocarburi aromatice datorita prezentei grupei functionale -OH care activeaza pozitiile o si p ale nucleului aromatic. Bromurarea fenolului decurge aproape instantaneu rezultand compusul tribromurat 2,4,6-tribromfenol.
fenol tribrom fenol
Materiale necesare: solutie apoasa de fenol 2%, apa de brom, eprubete, pahare Berzelius
Modul de lucru
Intr-o eprubeta se introduce 1ml solutie apoasa de fenol 2% si apoi, cu picatura, apa de brom (saturata). Se constata aparitia unui precipitat alb de tribromfenol cu miros caracteristic (excesul de brom conduce la obtinerea derivatului tetrabromurat de culoare galbena, derivat al p-chinonei).
Aminele sunt compusi organici cu caracter bazic care contin in molecula una sau mai multe grupe aminice (-NH2). Pot fi considerate derivati ai amoniacului rezultati prin inlocuirea partiala sau totala a H cu radicali hidrocarbonati.
4.5.1. Evidentierea caracterului bazic
Aminele au proprietatea de a forma, in solutie apoasa, hidroxizi complet ionizati.
R-NH2 + H2O = R-NH3+ + HO-
Caracterul bazic al aminelor variaza in functie de natura si numarul radicalilor din molecula. Astfel, aminele alifatice sunt baze mai tari decat amoniacul, iar aminele aromatice sunt baze mai slabe decat amoniacul. Caracterul bazic se determina prin actiunea acizilor asupra aminelor sau cu ajutorul indicatorilor.
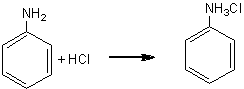
anilina clorhidrat de anilina
Materiale necesare: solutie HCl diluat, metilorange, anilina, eprubete.
Modul de lucru
Intr-o eprubeta se introduc 2 ml solutie de HCl diluat si o picatura de metilorange si se observa colorarea solutiei acide in rosu. La adaugarea catorva picaturi de anilina culoarea va vira in galben din cauza modificarii pH-ului mediului, modificare datorata caracterului bazic al anilinei; in solutie se formeaza clorhidrat de anilina.
4.5.2. Reactia de bromurare
Reactia de substitutie la nucleul aromatic, in cazul aminelor aromatice, are loc in pozitiile o si p. Astfel, bromurarea anilinei conduce la obtinerea compusului tribromurat 2,4,6-tribromanilina.

anilina 2,4,6 tribromanilina
Materiale necesare: anilina, apa de brom, eprubete.
Modul de lucru
Intr-o eprubeta se introduce 1ml anilina peste care se adauga, cu picatura, apa de brom. Se va constata decolorarea apei de brom si separarea 2,4,6-tribromanilinei, compus cristalizat de culoare alba.
4.5.3. Reactii de culoare
Aminele alifatice primare si secundare in solutie acetonica dau cu nitroprusiatul de sodiu, Na2[Fe(CN)5NO].2H2O o coloratie albastra. Aminele aromatice dau coloratii intense cu dioxidul de plumb in solutie acetica.
Materiale necesare: dimetilamina, acetona, solutie de nitroprusiat de sodiu proaspata preparat, acid acetic, PbO2, eprubete.
Modul de lucru
Intr-o eprubeta se introduc 1-2ml amina alifatica (dimetilamina), 1-2ml acetona si 1-2ml solutie de nitroprusiat de sodiu, proaspat preparata. Se constata aparitia unei coloratii albastre a carei intensitate este dependenta de natura aminei utilizate.
Intr-o alta eprubeta se introduc cateva picaturi de amina aromatica (anilina), 1-2ml acid acetic si cateva cristale de PbO2. Se agita continutul eprubetei si se observa aparitia unei coloratii intense brun-negre.
4.6. Compusi carbonilici (aldehide si cetone)
Combinatiile carbonilice sunt substante organice care contin in molecula lor gruparea carbonil care poate fi de tip aldehidic (una din valentele atomului de carbon este satisfacuta cu un atom de hidrogen) sau de tip cetonic (nici una din valentele atomului de carbon nu este satisfacuta cu un atom de hidrogen).
4.6.1. Reactii de culoare caracteristice aldehidelor si cetonelor
Reactii caracteristice aldehidelor
O solutie diluata de aldehida tratata cu fuxina decolorata cu SO2 recoloreaza in violet fuxina.
Materiale necesare: aldehida, reactiv Schiff (fucsina, solutie de NaHSO3 28%, acid clorhidric concentrat), eprubete.
Modul de lucru
Intr-o eprubeta se introduc o cantitate mica de aldehida (2 picaturi) si 1-2ml reactiv Schiff dupa care se agita bine continutul eprubetei; in decurs de cateva minute apare o coloratie rosie violet.
Reactii caracteristice cetonelor
Acetona tratata cu o solutie proaspata de nitroprusiat de sodiu formeaza o coloratie rosu sange.
Materiale necesare: acetona, solutie de NaOH, solutie de nitroprusiat de sodiu proaspat preparata, eprubete.
Modul de lucru
Intr-o eprubeta se introduc cateva picaturi de acetona si o cantitate mica dintr-o de solutie de NaOH apoi se trateaza cu o cantitate mica de solutie de nitroprusiat de sodiu (proaspat preparata). Apare o coloratie rosu sange caracteristica.
4.6.2. Reactii de aditie
Reactia de aditie la dubla legatura a grupei carbonil este caracteristica atat aldehidelor cat si cetonelor. Aldehidele reactioneaza mai usor cu sulfitul de sodiu comparativ cu cetonele.
Materiale necesare: acetona, sulfit de sodiu, fenoftaleina 1%, acid sulfuric diluat, eprubete.
Modul de lucru
Intr-o eprubeta se introduc 1ml de sulfit neutru de sodiu si o picatura de fenoftaleina 1%. Daca apare o coloratie roz, se adauga cateva picaturi de acid sulfuric diluat. Se adauga peste amestecul obtinut cateva picaturi de acetona si se observa aparitia unei coloratii rosu intens a lichidului datorita aparitiei ionilor hidroxil.
acetona
4.6.3. Reactii de condensare
Condensarea aminelor primare, formarea bazelor Schiff
Aldehidele reactioneaza cu aminele primare rezultand produsi de condensare numiti azometine sau baze Schiff. Astfel, aldehida benzoica reactioneaza cu anilina si se obtine benziliden anilina.
aldehida benzoica anilina benzilidenanilina
Materiale necesare: aldehida benzoica, anilina, alcool, eprubete.
Modul de lucru
Intr-o eprubeta se introduc 1ml de aldehida benzoica, 1ml anilina si apoi se incalzeste la flacara timp de 5-10 minute. Continutul eprubetei se raceste, se adauga cateva picaturi de alcooli si apoi se freaca energic peretii eprubetei.
Condensarea cu hidroxilamina. Formarea oximelor
Aldehidele si cetonele se condenseaza usor cu hidroxilamina, formand oxime (substante cristalizate cu punct de topire caracteristice).
Aldehida hidroxil-amina oxima
Prin incalzire cu un acid diluat, oximele se scindeaza in hidroxilamina si aldehida sau cetona initiala.
Materiale necesare: clorhidrat de hidroxilamina, solutie de NaOH 10%, aldehida benzoica, flacoane Erlenmeyer.
Modul de lucru
Intr-un flacon Erlenmeyer mic se dizolva 0,5g clorhidrat de hidroxilamina in 3ml de apa, se adauga apoi 2ml NaOH 10% si 0,2g aldehida sau cetona insolubila in apa. Daca se foloseste aldehida benzoica, amestecul se incalzeste intr-o baie de apa 10 minute, apoi se raceste si se freaca cu o bagheta de sticla peretii vasului pentru a grabi cristalizarea.
Reactia de condensare aldolica
Aldehidele si cetonele se condenseaza intre ele (in mediu alcalin sau sub actiunea acizilor) dand nastere la hidroxialdehide sau hidroxicetone. Astfel, prin condensarea a doua molecule de aldehida acetica se obtine un aldol care elimina apa intramolecular cu formare de aldehida crotonica.
Reactiile sunt urmatoarele:
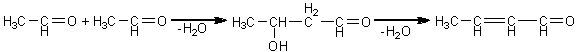
acetaldehida aldehida crotonica
Materiale necesare: aldehida acetica, solutie NaOH, eprubete.
Modul de lucru
Intr-o eprubeta se introduc 2ml aldehida acetica si aproximativ 1ml NaOH. Continutul eprubetei se incalzeste la fierbere si se observa colorarea lui mai intai in galben apoi in brun, dupa care se separa un semilichid care este rasina aldehidica recunoscuta dupa mirosul patrunzator. Daca aldehida acetica se incalzeste cu hidroxizi alcalini concentrati se precipita rasini de aldehide amorfe, colorate in galben.
4.6.4. Reactii specifice aldehidelor
Reactiile specifice aldehidelor, sunt cele in care acestea au proprietatea de a reduce sarurile de cupru (solutia Fehling) sau pe cele de argint (reactivul Tollens) in solutie alcalina. Oxidarea se face fie cu oxigenul molecular (autooxidare), fie cu agenti oxidanti ca permanganatul de potasiu, apa oxigenata, sarurile unor metale grele care in mediu alcalin reduse la metalul liber sau la combinatii cu valenta mica.
Reactii de reducere. Reactia Tollens
Materiale necesare: aldehida formica, reactiv Tollens (se amesteca volume egale de solutie de azotat de argint 10% si NaOH 10%, se adauga cu picatura hidroxid de amoniu, pana cand se va dizolva complet oxidul de argint format la inceput), solutie de NaOH, eprubete.
Modul de lucru
Intr-o eprubeta se introduce o solutie diluata de aldehida formica care se trateaza cu cateva picaturi de reactiv Tollens. Apare o oglinda de argint pe peretii eprubetei care depinde de concentratia aldehidei precum si de gradul de curatenie a eprubetei. Solutiile diluate dau oglinzi mai frumoase. Prin usoara incalzire se poate accelera reactia.
Reactiile sunt urmatoarele:
AgNO3 + 2NaOH = Ag2O + 2NaNO3 + H2O
Ag2O + 4NH4OH = Ag(NH3)2OH + H2O
![]()
Reactii de reducere. Reactia Fehling
Aldehidele reduc solutia Fehling la oxid de cupru (I) de culoare rosie.
Materiale necesare: aldehida formica, reactiv Fehling, se obtine prin amestecarea de volume egale din solutiile de Fehling I (3,4 g sulfat de cupru cristalizat (CuSO4.5H2O)se dizolva in 50 ml apa) si Fehling II (13,7 g tartrat de sodiu si potasiu si 5g NaOH in 50 ml apa) eprubete.
Modul de lucru
Intr-o eprubeta se introduc 2 ml de aldehida, se adauga reactiv Fehling, se fierbe continutul eprubetei si se observa aparitia unui unui precipitat rosu caramiziu de oxid de cupru (II). Reactiile care au loc sunt urmatoarele:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
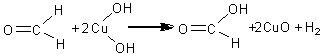
aldehida formica acid formic
4.6.5. Reactii specifice cetonelor (Reactia iodoformului)
Cetonele α-metilate prin tratare cu iod in solutie alcalina formeaza iodoformul (CHI3), conform reactiilor de mai jos:
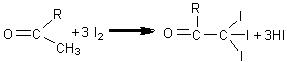
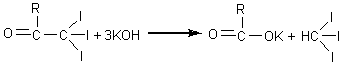
iodoform
Reactia este foarte sensibila, iar urmele de iodoform se recunosc dupa mirosul caracteristic.
Materiale necesare: acetona, solutie apoasa de KOH, solutie de iod, solutie de NaOH, eprubete.
Modul de lucru
Intr-o eprubeta se introduc 1-2 ml de acetona, 2-4 picaturi dintr-o solutie apoasa de KOH si apoi se incalzeste continutul la 50-600C. Se adauga cu picatura solutie de iod pana cand lichidul se coloreaza in galben deschis, apoi excesul de iod se decoloreaza cu hidroxid. Din solutie precipita iodoformul sub forma unui precipitat galben cu miros caracteristic.
4.7. Combinatii carboxilice (acizi organici)
Combinatiile care contin in molecula grupa functionala carboxil se numesc acizi organici sau acizi carboxilici. Cele doua functiuni, hidroxil - OH si C = O, se influenteaza reciproc si dau insusiri caracteristice acestei functiuni.
4.7.1. Reactia cu bicarbonatii
Acizii carboxilici tratati cu carbonati acizi (de sodiu sau potasiu) produc efervescenta datorita degajarii dioxidului de carbon din bicarbonat indicand astfel inlocuirea acidului carbonic in sarea sa cu acizi mai tari.
R-COOH + NaCO3 = R-COO-Na+ +H2O + CO2
Dupa intensitatea cu care se degaja CO2 putem avea indicatii asupra tariei acidului respectiv. Acizii minerali puternic disociati elibereaza la randul lor acizii carboxilici din sarurile lor.
R-COO-Na+ + HCl = R-COOH + NaCl
Materiale necesare: acid acetic, bicarbonat de sodiu si potasiu, sticla de ceas.
Modul de lucru
Pe o sticla de ceas se pun in jur de 2g carbonat de sodiu pulverizat si se adauga o picatura de apa. Se incalzeste usor la flacara dupa care se adauga o cantitate mica de acid acetic si se observa degajarea CO2.
4.7.2. Reactii de culoare
Acizii carboxilici formeaza cu clorura ferica saruri complexe de fier colorate in galben.
Materiale necesare: acizi organici (acetic, oxalic, tartric, lactic), solutie apoasa de fenol, solutie apoasa de clorura ferica 1%.
Modul de lucru
Intr-o eprubeta se introduc cativa ml de solutie apoasa de clorura ferica peste care se adauga cateva picaturi de solutie apoasa de fenol pana la aparitia culorii violete. In mai multe eprubete se pun peste 1-2ml solutie din fiecare acid cercetat (in locul acidului lactic se poate folosi zer de lapte care contine acidul lactic liber) cate 2-3 picaturi solutie de clorura ferica ce contine fenol. Se observa aparitia unei coloratii galbene, uneori cu nuante verzui.
● ACIZI MONOCARBOXILICI SATURATI
Acidul formic, acidul metanoic, HCOOH, este incolor, cu miros intepator, patrunzator si coroziv pentru piele.
4.7.3. Reactia de identificare a acidului formic
Materiale necesare: solutie apoasa de acid formic, solutie de hidroxid de bariu, eprubete
Modul de lucru
Reactia cu bromul si hidroxidul de bariu. Solutia apoasa de acid formic se trateaza cu putin brom si cu o solutie de hidroxid de bariu. Se incalzeste usor amestecul format si se observa ca solutia se tulbura din cauza formarii carbonatului de bariu insolubil.
Acidul formic se mai poate identifica prin reactiile de culoare pe care le da cu furfurolul si cu ferocianura de potasiu.
4.7.4. Reactia de oxidare a acidului formic cu permanganatul de potasiu
Materiale necesare: acid formic, permanganat de potasiu (solutie apoasa 0,5%), acid sulfuric diluat, apa de var sau apa de barita, eprubete.
Modul de lucru
Intr-o eprubeta prevazuta cu un tub de evacuare, se introduc 0,5ml acid formic, 1ml acid sulfuric si 2-3ml permanganat de potasiu. Capatul tubului recurbat se introduce intr-o alta eprubeta ce contine 1-2ml apa de var sau barita. Se incalzeste cu atentie amestecul pana incepe sa fiarba si se observa decolorarea amestecului de permanganat din prima eprubeta si formarea unui precipitat sau o tulbureala de carbonat de calciu sau bariu in a doua eprubeta.
Reactia de oxidare a acidului formic este urmatoarea:
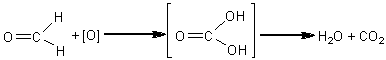
acid formic
CO2 + Ca(OH)2 = CaCO3 + H2O
4.7.5. Reactia de descompunere a acidului formic
Atat acidul formic cat si sarurile sale se descompun in prezenta acizilor tari minerali.
Materiale necesare: acid formic sau formiat de sodiu, acid sulfuric concentrat, eprubete.
Modul de lucru
Intr-o eprubeta prevazuta cu un tub efilat se amesteca cu atentie, 1ml acid sulfuric concentrat cu 0,5ml acid formic anhidru sau 1g formiat de sodiu. Se degaja oxid de carbon, care aprins la capatul arde cu flacara albastra, caracteristica. Oxidul de carbon se formeaza in urma deshidratarii acidului formic sub actiunea acidului sulfuric.
![]() H-COOH H2O + CO
H-COOH H2O + CO
4.7.6. Reactia de formare si descompunere a formiatului de argint
Materiale necesare: formiat de sodiu (solutie apoasa 1%), azotat de argint (solutie apoasa 1-2%), eprubete.
Modul de lucru
Intr-o eprubeta se introduc 1-2ml solutie formiat de sodiu si cateva picaturi de azotat de argint. Rezulta formiatul de argint care se prezinta sub forma unui precipitat alb. Se verifica neutralitatea reactiei cu ajutorul hartiei de turnesol. Se incalzeste amestecul si se constata aparitia unui precipitat negru de argint metalic care se depune pe peretii eprubetei sub forma unei oglinzi metalice, iar solutia capata un caracter acid.
Reactiile care au loc sunt urmatoarele:
H-COONa + AgNO3 = H-COO-Ag+ + NaNO3
formiatul de argint
La incalzire formiatul de argint se descompune dupa reactia:
![]()
La fel se descompune prin incalzire si formiatul de mercur.
Acidul acetic sau etanoic
Acidul acetic, (CH3-COOH), este incolor, fierbe la 1180C si se solidifica la 16,60C, trecand intr-o masa alba cristalina asemanatoare cu gheata.
Cu o solutie de clorura ferica, in mediul alcalin, formeaza complexul triferidiolhexaacetic colorat in rosu.
Acidul acetic formeaza cu alcoolul etilic acetatul de etil cu miros placut.
acid acetic etanol acetat de etil
4.7.7. Reactia de formare si hidroliza a acetatului de fier
Materiale necesare: acetat de sodiu, clorura ferica, ferocianura de potasiu, eprubete.
Modul de lucru
Intr-o eprubeta se dizolva 0,2 g acetat de sodiu in 2-3ml apa, apoi se adauga 5-6 picaturi de solutie de clorura ferica. Se incalzeste amestecul pana la fierbere si se observa aparitia unui precipitat rosu maron. Se opreste incalzirea si se lasa eprubeta pentru a se decanta lichidul. Cu ajutorul unei pipete se ia putina solutie si se introduce intr-o alta eprubeta peste care se adauga cateva picaturi de ferocianura de potasiu. Nu se formeaza albastru de Berlin caracteristic ionilor de fier trivalent in prezenta ferocianurii de potasiu.
Reactiile care au loc sunt urmatoarele:
![]()
Acetatul de fier care se formeaza in urma reactiei hidrolizeaza imediat rezultand ioni complecsi de hexaacetat bazic care coloreaza continutul eprubetei in rosu-brun:
2(CH3-COO)3Fe + 2CH3-COO-Na+ + FeCl3 + 2H2O = Fe(OH)2(CH3-COO)6 + Cl- + 2NaCl + 2CH3-COOH
Acidul benzoic, C6H5 - COOH, se prezinta sub forma de cristale cu punctul de topire la 121,40 C si este solubil in apa fierbinte. Cu clorura ferica formeaza un precipitat de culoare bruna in mediu neutru.
4.7.8. Reactia de transformare a acidului benzoic in acid salicilic
Acidul benzoic se oxideaza usor la acid salicilic cu apa oxigenata sub actiunea catalitica a sulfatului feric. Acidul salicilic se recunoaste dupa coloratia violeta care o da cu ionul de Fe3+.
Materiale necesare: acid benzoic, acid salicilic, permanganat de potasiu, eprubete.
Modul de lucru
In doua eprubete se introduc cate 2ml solutie apoasa saturata de acid benzoic si salicilic dupa care se adauga cate un volum egal de solutie carbonat de sodiu 5% si apoi cateva picaturi de solutie de permanganat de potasiu. Se agita continutul eprubetei pana ce culoarea amestecului ramane neschimbata. Se constata faptul ca solutia de acid benzoic nu mai decoloreaza solutia de permanganat, in timp ce solutia de acid salicilic decoloreaza permanganatul de potasiu chiar dupa adaugarea acestuia in cantitate mare. Proprietatile acidului salicilic sunt determinate de prezenta hidroxilului fenolic in molecula acidului salicilic.
● ACIZI DICARBOXILICI SATURATI
Acidul oxalic (HOOC-COOH) este singura combinatie care prezinta gruparea carboxil in pozitiile 1, 2. Acidul oxalic cristalizeaza cu doua molecule de apa si se prezinta sub forma de cristale cu punctul de topire 101,50C, iar acidul oxalic anhidru are punctul de topire 189,50C.
4.7.9. Evidentierea acidului oxalic
Acidul oxalic se gaseste sub forma de saruri (oxalati) de calciu sau magneziu in foitele externe ale bulbului de ceapa si in petiolul de Begonia.
Materiale necesare: acetat de sodiu 10%, clorura de calciu 10%, eprubete.
Modul de lucru
Pentru obtinerea solutiei se realizeaza la maruntirea frunzelor si incalzirea lor cu apa distilata timp de 10 minute. Dupa decantare se adauga clorura de calciu 10% iar prezenta lui este evidentiata prin formarea unui precipitat alb, dens, de oxalat de calciu.
4.7.10. Reactia de oxidare a acidului oxalic cu permanganatul de potasiu
Acidul oxalic are proprietati reducatoare, fiind oxidat cantitativ de permanganatul de potasiu in solutie acida.
Materiale necesare: acidul oxalic, acidul sulfuric, permanganatul de potasiu.
Modul de lucru
Se introduc intr-o eprubeta 1ml solutie de acid oxalic si cativa mililitri de acid sulfuric diluat. Se incalzeste eprubeta si se adauga cateva picaturi dintr-o solutie de permanganat de potasiu. Se observa decolorarea solutiei de permanganat conform reactiei urmatoare:
2KMnO4 + 3H2SO4 + 5C2O4H2 = 2MnSO4 + 2K2SO4 +8H2O +10CO2
4.7.11. Reactia de formare a oxalatilor din formiati
Materiale necesare: formiat de sodiu, clorura de calciu, eprubete.
Modul de lucru
Se incalzeste intr-o eprubeta uscata 1g formiat de sodiu si se observa degajarea unui gaz, care aprins arde provocand o pocnitura caracteristica amestecului de hidrogen si aer. Se raceste eprubeta si se adauga 3-4ml apa, se agita si apoi se incalzeste usor, pentru accelerarea dizolvarii dupa care se adauga cateva picaturi de solutie de clorura de calciu. Se formeaza un precipitat alb, insolubil in acid acetic si usor solubil in acizi minerali.
Reactiile sunt urmatoarele:
formiat de sodiu oxalat de sodiu oxalat de calciu
4.7.12. Reactia de descompunere a acidului oxalic
Materiale necesare: acid oxalic pulbere, apa de var sau apa de barita
Modul de lucru
Intr-o eprubeta prevazuta cu tub recurbat se introduc 1-2g acid oxalic, iar la capatul tubului recurbat se introduce intr-o eprubeta ce contine 1-2ml apa de var sau apa de barita. Se incalzeste eprubeta cu acid oxalic si se observa degajarea unui gaz care in prezenta apei de var sau barita da nastere unui precipitat. Se scoate apoi tubul recurbat din eprubeta si se aprinde gazul care se degaja. Oxidul de carbon arde cu o flacara albastra caracteristica. Acidul oxalic cristalizat, C2H2O4x2H2O, prin incalzire pierde apa de cristalizare se decarboxileaza si trece in acid formic, care la randul sau se descompune in apa si oxid de carbon.
![]() C2H2O4 CO + CO2 + H2O
C2H2O4 CO + CO2 + H2O
Acid oxalic
Reactia de descompunere a acidului oxalic este accelerata de acidul sulfuric concentrat care absoarbe apa de cristalizare
4.8. Derivati functionali ai acizilor carboxilici - grasimi
Grasimile sunt produse naturale care fac parte din categoria lipidelor. Din punct de vedere chimic lipidele sunt esteri ai glicerinei cu acizii grasi. Esterii glicerinei se numesc gliceride. Alaturi de gliceride in grasimi se mai gasesc si alte substante insa in proportii mai mici, ca de exemplu alcoolii policiclici (colesterolul - prezent in toate grasimile animale si fitosterolul prezent in toate grasimile vegetale.
Proprietatile fizice ale grasimilor sunt determinate in mare masura de proportia si natura acizilor grasi care intra in constitutia lor iar proprietatile chimice sunt sunt determinate de natura lor de esteri cat si de caracteristicile particulare ale acizilor componenti.
Dizolvarea grasimilor.
Grasimile la temperatura camerei sunt solide sau lichide. Ele se dizolva usor in, eter, sulfura de carbon, tetraclorura de carbon, cloroform, benzen, tricloretilena, toluen, benzina etc. In apa grasimile sunt insolubile si formeaza emulsii.
Materiale necesare: solventi diferiti (alcool, benzen, benzina etc.), ulei, ulei de ricin, eprubete.
Modul de lucru
Se iau mai multe eprubete, in care se introduc 1-2ml grasime, peste care se adauga volume egale de solvent organic. Se observa dizolvarea grasimii, in mod diferit, in functie de tipul solventilori adaugati. Daca intr-o eprubeta se adauga ulei de ricin, care are o vascozitate mare in comparatie cu a celorlalte uleiuri vegetale, se observa ca acesta este solubil in alcooli sau alti solventi dar este insolubil in benzina. Grasimile formeaza cu apa dispersii coloidale sau emulsii care, in prezenta unor substante capilar active, emulgatori, cum sunt proteinele, sapunul si unii acizi sulfonici, in special in mediu alcalin, se stabilizeaza.
Materiale necesare: ulei, apa distilata, carbonat de sodiu pulbere, eprubete
Modul de lucru
Intr-o eprubeta se introduc 2-4 ml de apa distilata si cateva picaturi de ulei si se observa separarea a doua straturi distincte. Peste amestecul obtinut se adauga pulbere de carbonat de sodiu, se agita si se formeaza o emulsie stabila (deci straturile formate initial nu se mai disting).
4.8.2. Hidroliza grasimilor (saponificarea)
Hidroliza grasimilor se poate realiza, cu acizi dar si cu baze. Grasimile solide se pot scinda, in anumite conditii, in acizi grasi si glicerina.
grasime glicerina acizi grasi
Hidroliza se poate realiza pe mai multe cai. Astfel, prin incalzire cu hidroxizi alcalini, grasimile se scindeaza ireversibil in glicerina alaturi de sarea alcalina a acidului gras (sapun). Operatia este favorizata de prezenta unei cantitati mici de alcool.
Reactia de obtinere a sapunurilor prin hidroliza grasimilor are loc dupa urmatoarea reactie:
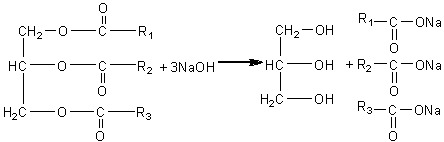
grasime glicerina sapunuri
Materiale necesare: grasimi diferite (ulei comestibil, untura de porc, unt, seu etc.), solutie hidroxid de sodiu 30 -40%, clorura de sodiu, alcool etilic, solutie saturata de clorura de sodiu, capsula de portelan.
Modul de lucru
Se introduc intr-o capsula de portelan 3g grasime, 3ml alcool etilic, 3ml solutii de hidroxid alcalin se amesteca prin agitare cu ajutorul unei baghete si se incalzeste continutul pe o baie de apa pana cand incepe sa fiarba. Dupa cateva minute amestecul devine repede omogen, iar saponificarea grasimii este complet terminata.
La solutia astfel obtinuta se adauga o solutie saturata calda de clorura de sodiu, amestecandu- se cu bagheta. Amestecul se tulbura iar la suprafata lichidului se separa un strat de sapun care pluteste. Dupa ce amestecul s-a depus, prin mentinerea capsulei pe baia de apa, se scufunda capsula intr-un vas cu apa rece cateva minute si se observa formarea unui strat de sapun care se solidifica. Sapunul astfel obtinut se poate utiliza pentru studierea proprietatilor sale. Saponificarea grasimilor mai poate avea loc in solutie apoasa.
Descompunerea grasimilor
Prin descompunere termica grasimile formeaza un amestec complex de produsi, printre care glicerina libera. Aceasta in prezenta unor reactivi deshidratanti (in special bisulfiti) se transforma in acroleina
Materiale necesare: grasimi (vegetale sau animale), sulfat acid de potasiu pulbere, azotat de argint amoniacal eprubete.
Modul de lucru
Se ia o eprubeta uscata in care se introduc aproximativ 0,5g sulfat acid de potasiu sau sodiu pulbere, 1ml ulei si se fierbe. Se obtine un fum cu miros iritant caracteristic acroleinei. Aceasta se poate identifica folosind o hartie de filtru umectata cu azotat de argint amoniacal. Hartia se innegreste, datorita argintului metalic obtinut ca rezultat al actiunii reducatoare a acroleinei.
Reactia de obtinere a acroleinei este urmatoarea:
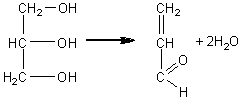
Glicerina acroleina
4.8.4. Reactia grasimilor cu iodul
Legatura dubla in moleculele acizilor grasi din grasimi confera grasimilor posibilitati de aditie. Una din reactiile caracteristice de aditie a acizilor grasi este reactia cu iodul care se bazeaza pe recunoasterea acizilor nesaturati din compozitia grasimilor.
Materiale necesare: ulei, tinctura de iod, solutie de amidon 1% eprubete
Modul de lucru
Intr-o eprubeta se introduc 2ml de ulei si cateva picaturi de tinctura de iod dupa care se agita. Se incalzeste eprubeta si se observa disparitia culorii rosie-bruna a iodului, dupa un timp, deoarece are loc o reactie de aditie, produsul obtinut fiind incolor. Absenta iodului liber se pune in evidenta daca se adauga in solutie de amidon. In acest caz, culoarea caracteristica albastra nu apare. O caracteristica a grasimilor o constitute indicele de iod care reprezinta cantitatea de iod exprimata in grame care se poate aditiona la 100g de grasime.
4.9. Proteine
Proteinele sunt produsi naturali cu structura macromoleculara si masa moleculara mare care prin hidroliza se transforma intr-un amestec de α-aminoacizi; acestia sunt uniti intre ei prin legaturi amidice numite si legaturi peptidice
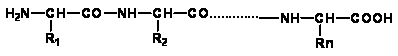
Prepararea solutiilor de proteine se poate realiza folosind produse naturale usor accesibile (oua, lapte, faina de grau, tuberculi de cartofi, etc.).
Proteine din albus de ou
Intr-un balon de 250ml se amesteca albusul unui ou cu 150ml apa distilata si se agita. Lichidul opalescent astfel obtinut se filtreaza printr-o panza umectata cu apa si rezulta solutia de albumina care se intrebuinteaza pentru experienta.
Proteine din lapte
Intr-un flacon Erlenmeyer se introduce o cantitate de lapte proaspat si un volum egal de solutie saturata de sulfat de amoniu. Se constata precipitarea cazeinei si a globulinelor iar suspensia obtinuta se filtreaza si rezulta o solutie limpede care contine albumine.
Proteine din faina de grau
Intr-un flacon Erlenmeyer se amesteca 50g faina de grau cu 200ml apa, se lasa in repaus 30 minute, se filtreaza pe un filtru cret si se obtine o solutie clara de proteina.
Proteine din tuberculul de cartof
Se curata de coaja un cartof, dupa care acesta se razuiesc cateva grame si se introduc intr-un pahar Erlenmeyer, peste care se adauga 100ml apa distilata. Se agita amestecul timp jumatate de ora, apoi se filtreaza si se obtine o solutie de albumina vegetala de cartof.
Identificarea proteinelor din tesuturile vegetale sau animale se realizeaza prin reactii de culoare sau reactii de precipitare.
4.9.1. Reactii de culoare
Proteinele dau o serie de reactii de culoare care sunt utilizate pentru identificarea lor. Dintre acestea, singura reactie a legaturii peptidice este reactia biuretului, celelalte sunt determinate de catenele laterale ale anumitor aminoacizi din macromolecula proteinei.
Reactia biuretului
Tratate cu cateva picaturi dintr-o solutie de sulfat de cupru in mediu puternic alcalin, proteinele formeaza o coloratie rosie-violet sau albastru-violeta caracteristica gruparii peptidice
Materiale necesare: Solutie de proteina, hidroxid de sodiu , solutie sulfat de cupru 1% eprubete.
Modul de lucru
Intr-o eprubeta se introduc 2-3ml solutie de proteina, un volum egal de hidroxid de sodiu 20-30% si 1-2 picaturi dintr-o solutie de sulfat de cupru 1%. Se observa aparitia unei coloratii caracteristice rosu violet.
Reactia Pauly
Aceasta reactie consta in tratarea solutiilor de proteine (alcalinizate cu carbonat de sodiu) cu solutii de acid sulfanilic diazotat si rezulta coloratii rosii.
Materiale necesare: Solutie de proteina, solutie de carbonat de sodiu, reactiv Pauly (2-5 ml acid sulfanilic cu 0,5ml azotit de sodiu 10%), eprubete.
Modul de lucru
Intr-o eprubeta se introduc 2-3ml de solutie de proteina, 1ml solutie de carbonat de sodiu si 8-10 picaturi reactiv Pauly. Se formeaza o coloratie rosie care, dupa acidulare vireaza intr-o coloratie galbena.
Reactia Xantoproteica
Consta in aparitia unei coloratii galbene intense obtinuta prin tratarea unei solutii de proteina cu acid azotic concentrat la rece sau la cald. La adaugarea de hidroxid alcalin culoarea vireaza in portocaliu datorita formarii nitro-fenoxizilor.
Materiale necesare: solutie de proteina, acid azotic concentrat, amoniac, solutie de hidroxid de sodiu sau potasiu 20-30%, eprubete.
Modul de lucru
Intr-o eprubeta se introduc 1ml solutie de proteina si 2-3 picaturi de acid azotic concentrat (d=l,40). Se observa ca lichidul se tulbura sau se formeaza un precipitat galben. Daca se incalzeste amestecul la fierbere 1-2 minute precipitatul se dizolva si se coloreaza in galben viu. Dupa racire, se trateaza solutia cu hidroxid de sodiu sau amoniac si se observa virajul o culorii in oranj viu.
Reactia sulfului din proteine
Sulful din cisteina se recunoaste prin precipitatul negru de sulfura de plumb ce se formeaza la fierberea in solutie alcalina a unei solutii de proteine cu acetat de plumb.
Materiale necesare: proteine (albus de ou - solutie), acetat de plumb, hidroxid de sodiu eprubete.
Modul de lucru
Intr-o eprubeta se introduc 1ml de solutie acetat de plumb 0,5%, cateva picaturi dintr-o solutie de hidroxid de sodiu 20% pana la dizolvarea precipitatului care se formeaza initial. Peste amestecul format se adauga apoi in picaturi, solutie de albus de ou si se incalzeste pe o baie de apa. Se remarca aparitia unei coloratii neagre sau brune in solutie datorita formarii sulfurii de plumb
Reactia Liberman
Prin tratarea solutiilor proteice coagulate cu acid clorhidric concentrat se obtin coloratii violete, datorita reactiei de condensare a nucleelor furfurolice (obtinute prin incalzirea cu acid clorhidric a zaharurilor existente in molecula substantelor proteice) cu fenolii existenti in molecula proteinelor (tirozina).
Materiale necesare: Solutie de proteina, acid clorhidric concentrat eprubete.
Modul de lucru
Se coaguleaza prin incalzire aproximativ ml solutie proteica, se decanteaza cat mai bine lichidul iar coagulatul ramas se introduce in ml acid clorhidric concentrat. Se fierbe cu atentie pana la dizolvarea coagulatului si se observa aparitia dupa un timp scurt a unei coloratii violete cu tendinta spre brun.
Reactia Sakaguchi
Consta in aparitia unei coloratii rosii caracteristice la tratarea proteinelor cu -naftol in prezenta hipobromitului sau hipocloritului de sodiu. Reactia se datoreaza gruparii guanidinice din arginina.
Materiale necesare: Hidrolizat proteic, hidroxid de sodiu 33%, brom, -naftol solutie de hipobromit de sodiu eprubete.
Modul de lucru
Intr-o eprubeta se introduc 6ml solutie de hidroxid de sodiu 33% apoi 12 picaturi de brom obtinandu-se astfel hipobromitul de sodiu. Intr-o alta eprubeta se amesteca 5-6 picaturi hipobromit cu 5-6 picaturi de -naftol 2% si se observa aparitia unei coloratii rosii datorita prezentei argininei.
4.9.2. Reactii de precipitare
Proteinele sunt precipitate din solutiile lor de unii acizi organici (tricloracetic, picric), de unii acizi organici (HCl, H2SO4), de sarurile metalelor grele (cupru, plumb, fier) etc, dar si sub actiunea unor agenti fizici, in special sub actiunea caldurii.
Reactiile de precipitare sunt utilizate pentru a indeparta proteinele nedorite din lichidele biologice.
Acizii minerali concentrati precipita proteinele din solutii apoase datorita deshidratarii moleculei si formarii de proteinate acide.
Materiale necesare: Solutie de albumina, acid clorhidric concentrat, acid sulfuric concentrat, acid azotic concentrat, eprubete.
Modul de lucru
In 3 eprubete se pun cate 3ml dintr-o solutia de albumina, astfel: in prima 1ml se adauga acid clorhidric concentrat, in a doua 1ml acid sulfuric concentrat, iar in a treia 1ml acid azotic concentrat. Acizii se pun cu atentie pe peretii eprubetelor care se inclina in timpul turnarii. La limita de separare a lichidelor apare imediat sau treptat un inel alb de precipitat de proteina. Dupa agitarea eprubetelor se constata ca in primele doua eprubete se dizolva precipitatul, iar in cea de-a treia precipitatul se mareste mult.
Reactia proteinelor cu bazele
Materiale necesare: Solutii de proteine, hidroxid de sodiu sau potasiu 30%, solutie 10% azotat sau acetat de plumb, sare de plumb, eprubete.
Modul de lucru
Intr-o eprubeta se introduc 1-2 ml solutie proteina si un volum de doua ori mai mare solutie concentrata de alcalii. Se observa aparitia unui precipitat care prin fierbere 2-3 minute se dizolva si se degaja amoniac care se identifica foarte clar la unele solutii proteice (albus de ou, cazeina, extractului apos din carne).
In solutia puternic alcalina, fierbinte, obtinuta se adauga 1ml solutie de sare de plumb si se fierbe din nou. Se formeaza un precipitat alb de hidroxid de plumb care se dizolva in excesul de alcalii. Daca proteina sub actiunea alcaliilor, a separat sulful se formeaza sulfura de plumb, iar lichidul se coloreaza in brun sau brun-inchis (sau chiar negru cand continutul in sulf este mare). Reactia poate constitui o metoda de identificare a sulfului din proteine.
Reactia proteinelor cu sarurile metalelor grele
Materiale necesare: Solutie de proteine, sulfat de cupru (solutie apoasa saturata), solutie apoasa 20% acetat de plumb, solutie saturata 43% sulfat de amoniu, eprubete
Modul de lucru
In doua eprubete ce contin 1-2ml solutie de proteina se adauga treptat picatura cu picatura: solutie saturata de sulfat de cupru (in prima) si solutie apoasa 20% acetat de plumb (in cea de-a doua). In prima eprubeta se observa aparitia unui precipitat albastru, iar in a doua are loc formarea unui precipitat de culoare alba. Prin adaugarea reactivilor in exces, precipitatele formate se dizolva.
Intr-o alta eprubeta se adauga peste 2-3 ml solutie de proteina o cantitate egala de solutie saturata de sulfat de amoniu. Se observa imediat aparitia unui precipitat care se dizolva prin adaugare de apa.
Experienta se poate realiza si cu alte solutii: sulfat de magneziu, clorura de sodiu, clorura de potasiu etc.
Reactiile de precipitare a proteinelor prin incalzire
Proteinele prin incalzire la fierbere coaguleaza, transformarea fiind ireversibila. Astfel, proteinele isi pierd proprietatile initiale iar precipitatele obtinute nu pot fi dizolvate. Coagularea proteinelor prin incalzire are loc mult mai usor in apropierea punctului izoelectric, care se afla de obicei, in domeniul unui pH slab acid. Precipitarea in mediu neutru decurge mai greu, iar in mediu acid sau bazic puternic, proteinele nu coaguleaza chiar daca incalzirea se prelungeste.
Materiale necesare: solutie de proteine, acid acetic concentrat, solutie sulfat de amoniu, hidroxid de sodiu 10%, eprubete.
Modul de lucru
Intr-o eprubeta se introduc 2-3ml solutie de proteina, apoi aceasta se incalzeste pana la fierbere timp de 1 minut si se obtine un precipitat sub forma de tulbureala sau flocoane. Produsul obtinut dupa racire se imparte in doua parti si se introduc 1-2 picaturi acid acetic (in prima eprubeta), 1-2 picaturi solutie de sulfat de amoniu (in a doua). Incalzind din nou amestecurile din cele doua eprubete, cantitatile de proteine coagulate se maresc. Daca intr-una din eprubete se adauga un volum egal de apa, precipitatul proteinei coagulate este insolubil. Prin adaugarea unui ml solutie de hidroxid de sodiu, proteina coagulata se dizolva repede. Prin fierberea solutiei alcaline proteinele nu mai coaguleaza.
Reactia de hidroliza a proteinelor
Proteinele au proprietatea de a hidroliza prin fierbere indelungata cu formare de molecule mai mici ca peptone, polipeptide si in final, aminoacizi.
Materiale necesare: solutie de proteina, acid sulfuric 25%, hidroxid de sodiu 10%, sulfat de cupru, refrigerent ascendent, gelatina.
Modul de lucru
Intr-un flacon Erlenmeyer se introduc 2-3ml solutie de proteina (de exemplu ser sanguin) si aproximativ 16-20ml acid sulfuric 25%. Se ataseaza flaconului un refrigerent ascendent si se incalzeste cu ajutorul unui resou electric. Din solutie se ia o cantitate mica cu ajutorul unei pipete care se neutralizeaza cu hidroxid de sodiu 10% si se verifica din cand in cand reactia biuretului caracteristica proteinelor. Hidroliza se considera terminata cand reactia biuretului este negativa.
Un alt exemplu de hidroliza a substantelor proteice din care se obtine o cantitate mare de aminoacizi este hidroliza gelatinei. Gelatina are molecula formata din 16% glicocol. Prin hidroliza gelatinei se obtine o cantitate relativ mare de glicocol prin fierbere un timp indelungat (6-7 ore) a gelatinei cu acid clorhidric concentrat.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 15343
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved