| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
SURSE CHIMICE DE CURENT
Alaturi de curentul electric furnizat industriilor de centralele termo- si hidroelectrice, o cantitate importanta de curent este furnizata tehnicii moderne de sursele chimice de curent. Acestea sint pilele galvanice (elemente galvanice) prin care se inteleg acele dispozitive care transforma energia chimica in energie electrica. Ele reprezinta un lant electrochimie constituit din doi conductori electronici (metale, grafit), reuniti prin unul sau mai multi conductori ionici (electroliti).
Sursele electrochimice de energie se pot clasifica in primare, secundare si pile de combustie.
1. Pile electrochimice primare
Pilele electrochimice primare se caracterizeaza prin faptul ca energia electrica se produce pe seama unor reactanti ce se gasesc in pila in cantitate imitata, iar regenerarea lor prin electroliza, nu are loc.
Pila Leclanche este cea mai raspindita pila primara (uscata): este prezentata, in doua variante, in figura 47. Lantul electrochimie al pilei este:
![]()
Anodul este confectionat dintr-un cilindru de zinc, iar catodul, din carbune^ invelit intr-un sac de pinza, ori introdus intr-un vas de portelan poros, in care se gaseste amestec de MnO2 si negru de fum. Electrolitul este o solutie apoasa de NH4C1 sau KOH, trecuta sub forma de pasta, cu amidon si faina de griu. Pentru a evita consumarea electrodului de zinc, in urma actiunii corosive a atmosferei, el se izoleaza cu un ambalaj de masa plastica. Reactiile care au loc in pila se prezinta prin ecuatiile:
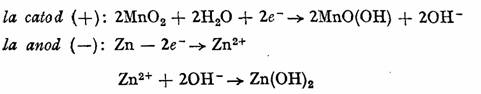
Reactia globala este:
![]()
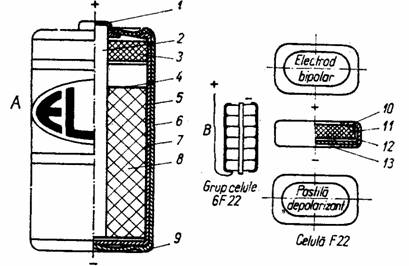
Fig. 47. Structura unor elemente si baterii uscate tip Leclanche:
A - cilindrice; B - plate; 7 - capsa contact pozitiv ; 2 - electrod de carbune (colector); 3 - sistem etansare bitum; 4 - conductor ionic (separator, hirtie speciala); 5 - jacheta; 6 - tub termostrictor; 7 - vas de zinc (electrod negativ) ; 8 - masa activa; 9 - capac contact negativ; 10 - tub PVC izolare celula; 77 - pastila depolarizanta; 12 - hirtie separator cu amidon; 13 - electrod bipolar (placa de zinc).
in realitate, reactiile din pila sint mult mai complexe, dupa cum se demonstreaza prin formarea unor compusi, ca: ZnO-Mn2O3; Mn2O3-H2O; ZnO; ZnCl2. 2NH3 si ZnCl2 . 4Zn(OH)2.
Pila are o f.e.m. de 1,5 - 1,6 V. Capacitatea ei este, pentru cele de buzunar, de 2A/h. Pila Leclancha prezinta o mare importanta economica care provine din simplitatea manipularii si usurinta transportului ei; volumul pilelor aflate in uz, variaza intre 0,1 cm3 si 1 m3, ceea ce corespunde la capacitati disponibile variind intre ordinul mAh si al 104 Ah si la puteri cuprinse intre citiva mW si citiva MW. Aria utilizarii lor este extinsa acoperind domenii extrem de diferite : alimentarea bateriilor de buzunar, a aparatelor de radio si televizoarelor tranzistorizate, a instalatiilor de semnalizare etc.
Pila cu oxid mercurie este pila la care anodul este format din pulbere de zinc amalgamata, iar masa activa la catod, din oxid rosu de mercur si carbune: pila are la baza sistemul:
![]()
Reactiile care se desfasoara la cei doi electrozi sint:
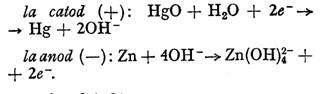
Reactia globala:
![]()
Daca in preajma electrodului de zinc se depaseste produsul de solubilitate, precipitaZnO:
![]()
Aceste pile se comercializeaza in forma de pastila sau in forma de nasture. Costul relativ ridicat si fabricarea mai dificila, limiteaza utilizarea ei pentru domenii foarte restrinse.
Pentru alimentarea unor aparate medicale (dispozitive auditive, stimulatoare cardiace si altele), minicalculatoare, ceasuri fara angrenaje mecanice etc, s-au realizat unele elemente galvanice primare, tip nasture, cu o durata lunga de conservare si functionare, cum sint: pilele Li-Ag2Cr04, care dupa 53 luni pierde 10% din capacitate, pilele Li-CuFe2 cu electrolit organic si pilele cu electroliti solizi de tipul Ag3SI sau MAg4I5, unde M = K, Rb, care au o durata de functionare de 10-20 ani.
2. Pile electrochimice secundare (acumulatoare)
Pilele secundare (acumulatoarele) sint acelea in care partenerii de reactie consumati in timpul producerii energiei electrice (descarcare) se pot reface cu ajutorul unui proces de electroliza, numit incarcare.
Au fost denumite sisteme (pile) conventionale acelea care au o tehnologie traditionala, iar reactia electromotric activa, se desfasoara intre substante comune (electrod-electrolit) si in electrolit apos.
In practica se utilizeaza frecvent, acumulatoarele, intrucat sint capabile de a inmagazina energie electrica care apoi, poate fi utilizata in diferite situatii.
Acumulatorul cu plumb (Plante, 1859) are electrozii confectionati din placi de plumb, sub forma de retea sau cu ochiuri, umplute la polul negativ cu plumb spongios, iar la polul pozitiv, cu dioxid de plumb. Placile de plumb, se pot inlocui cu placi formate dintr-un aliaj Pb-Sb 7,5%, acesta fiind mai rezistent la coroziune decat plumbul pur (fig. 49). Electrolitul consta dintr-o solutie de acid sulfuric, cu densitatea de 1,26 g/cm3 (cind acumulatorul este incarcat). Acumulatorul se simbolizeaza prin urmatorul lant electrochimic:
![]()
Reactiile chimice care se produc in timpul incarcarii si descarcarii, pot fi reprezentate prin reactia globala:
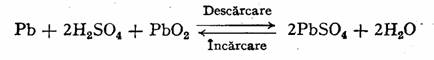
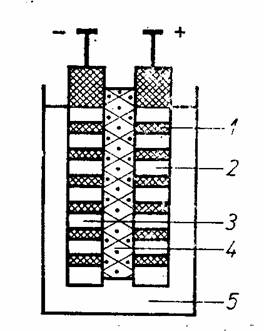
Fig. V.9. - Acumulator cu plumb:
7 - placi din aliaj PbSb: 2 -PbO2; 3 - Pb spongios; 4 - separator perforat;
5 - electrolit H2SO4.
Reactiile care au loc la electrozi, atunci cind acumulatorul furnizeaza energie electrica (se descarca) sint:
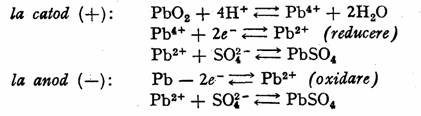
Reactiile sint reversibile, ceea ce permite regenerarea acumulatorului printr-un proces de electroliza.
Parametrii si caracteristici functionale. Functionarea acumulatoarelor cu plumb se manifesta prin tensiunea utila la bornele elementului, prin curentul debitat si capacitatea rezultata la descacare-.
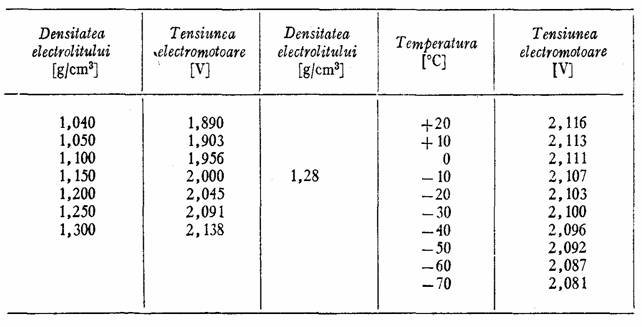
Tensiunea electromotoare a cuplului galvanic Pb-PbO2 depinde de densitatea electrolitului si temperatura acestuia asa dupa cum rezulta din tabelul 11.
Acumulatoarele cu plumb dau o tensiune de 2,01 - 2,06 V, raminind la sarcina normala, aproape invariabila, in timpul functionarii. Cind tensiunea scade (la 1,8 V) acumulatorul trebuie incarcat, altfel se degradeaza.
Capacitatea acumulatorului, definita prin cantitatea de electricitate restituita de un acumulator incarcat in anumite conditii, se masoara in amperore (Ah). Capacitatea este influentata de toti factorii determinanti in functionarea acumulatorului: cantitatea de materie activa; porozitatea materiei active; difuziunea; cantitatea, concentratia si temperatura electrolitului; intensitatea curentului care strabate elementul; gradul de formare electro-chimica a materiei active etc.
Autodescarcarea acumulatoarelor cu plumb. Acumulatorul este sediul unor procese, in permanenta manifestare, independente de circuitul de utilizare, in timpul incarcarii, al descarcarii si chiar in repaus. Aceste procese poarta numele de autodescarcare, efectul lor fiind in primul rind o pierdere continua din incarcarea electrica a acumulatorului. in al doilea rind, uzura pricinuita de aceste procese se-adauga uzurii normale a acumulatorului si-i micsoreaza durata de functionare. Cauzele autodescarcarii sint de natura chimica si electrochimica.
Tabelul 11.
Variatia tensiunii electromotoare a elementului cu plumb, cu densitatea si temperatura electrolitului
Scurtcircuitele in interiorul acumulatorului provoaca descarcarea inutila a ambelor feluri de placi. Diferitele actiuni locale, chimice, ca atacarea placilor de catre impuritatile aflate accidental in electrolit, atacarea plumbului de catre acidul sulfuric din electrolit, densitatea si temperatura necorespunzatoare ale electrolitului, provoaca procesul de autodescarcare a acumulatorului. Exista si actiuni locale cu caracter electrochimie, prin constituirea de elemente galvanice parazitare care produc curenti locali si duc la autodescarcari (sulfatari, coroziune etc).
Exploatarea acumulatoarelor cu plumb. Un element de acumulator se compune totdeauna dintr-un vas (din sticla, ebonita, materiale termoplastice, ceramica-smaltuita, lemn captusit cu plumb) continind un electrolit in care se gasesc doi electrozi sub forma de placi. Acestea se compun din suport si materia activa. Suportul asigura forma si rezistenta electrica a placii, de asemenea, constituie reteaua conductatoare a curentului electric intre circuitul exterior si materia activa a placii. Materia activa intretine fenomenele electrochimice la incarcare si descarcare.
Electrolitul folosit in exploatarea diferitelor tipuri de acumulatoare, are densitatea cuprinsa intre 1,080 si 1,300 g/cm3, in functie de starea de incarcare in timpul exploatarii. Pentru acumulatoarele complet incarcate, densitatea electrolitului are urmatoarele valori:
- acumulatoare stationare 1,200 la 1,230 g/cm3
- acumulatoare de tractiune 1,240 la 1,260 g/cm3
- acumulatoare pentru pornire
(auto, tractoare, moto) 1,260 la 1,280 g/cm3
- acumulatoare pentru aviatie . . . 1,270 la 1,290 g/cm3
- acumulatoare pentru iluminat . . 1,210 la 1,240 g/cm3.
Adeseori densitatea electrolitului se da in grade Baume (oBe). Valoarea numerica exprimata in Be difera de cea a densitatii exprimata in g/cm3 sau kg/dm3. Convertirea se face dupa formula:
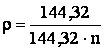
in care:
- r este densitatea electrolitului [g/cm3] ;
n - densitatea electrolitului [Be].
Observatie: Electrolitul imobilizat sub forma de gel, realizat prin diferite retete, reprezinta o solutie tehnica mai noua, pentru a se impiedica iesirea electrolitului din element in pozitii inclinate sau rasturnate, precum si de a elimina atmosfera corosiva produsa de gazele acide emanate la incarcare. Aceasta solutie s-a adoptat pentru elementele mici si mijlocii cu solicitari reduse de curent si in special pentru echiparea aparaturilor portabile cu sursa independenta. Materialul cel mai potrivit pentru realizarea acestui electrolit, este silicatul de sodiu (sticla solubila), prepararea facindu-se dupa retete speciale.
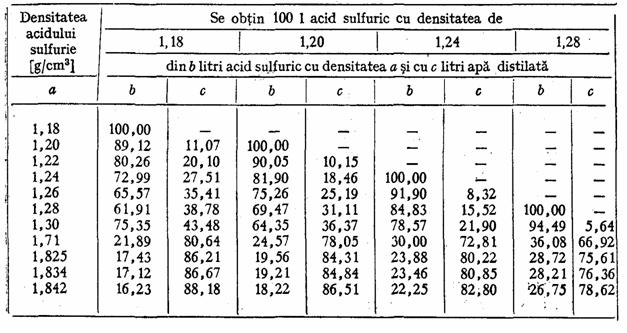
La prepararea solutiilor de acid sulfuric de diferite densitati, valorile din tabelul 12 pot fi de real folos.
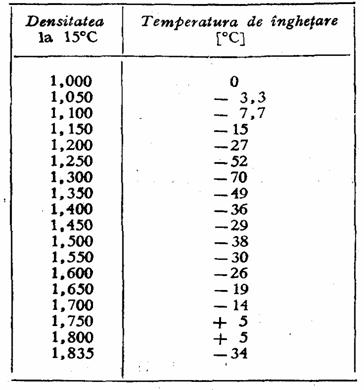
Temperatura de inghetare a solutiilor apoase de acid sulfuric are un rol foarte important, ea variaza cu densitatea dupa cum rezulta tabelul 13.
Sulfatarea placilor este un proces de formare, pe placi, a unui exces de sulfat de plumb (sub forma de cristale mari) greu de eliminat. Adaugarea de acid sulfuric in loc de apa distilata si descarcarile lente, prelungite, urmate de lunga inactivitate, cu variatii de temperatura, sint cazurile cele mai frecvente care provoaca procesul de sul/atare. In acest caz, cristalele formate impiedica reactivitatea placilor, iar incarcarea obisnuita nu are nici un efect; acumulatorul poate fi scos din functiune, daca sulfatarea este excesiva. Stabilirea fenomenului de sul-fatare se face de catre o persoana cu experienta.
Tabelul 12
Prepararea electrolitului
Tabelul 13
Temperatura de inghetare a solutiilor apoase de acid sulfuric
Eliminarea sulfatarii este, in prin cipiu, posibila. in cazurile mai putin grave, dupa completarea electrolitului cu apa distilata, acumulatorul s-pune la incarcat. Daca din primele momente, apare fierberea, curentul inie tial trebuie coborit pina ce fierberea inceteaza. Eliminarea sulfatarii este terminata, cind tensiunea si densitatea ajunse la valori normale, nu mai cresc timp de 4 ore. Se corecteaza densitatea.
In cazurile mai grave de sulfatare, se inlocuieste tot electrolitul, cu apa distilata, si se pune acumulatorul la incarcare, timp de circa 24 ore. Daca densitatea electrolitului a ajuns la 1,12 g/cm3, se goleste din nou elementul, se umple cu apa distilata si se reincarca. Repetind operatia de doua sau de trei ori, se regenereaza o baterie de pornire, foarte sulfatata. Daca operatia reuseste, ultimul electrolit trebuie inlocuit cu acid sulfuric de densitate normala. Se incarca apoi doua ore.
Incarcarea acumulatoarelor, trebuie facuta imediat dupa constatarea unei descarcari importante. O intirziere de doua, trei zile poate aduce neajunsuri starii substantelor active ale placilor, in special celor pozitive.
Pentru incarcare, se utilizeaza diferite surse. Generatorul de curent continuu cu excitatie in derivatie sau mixta, este una din sursele obisnuite de incarcare; de asemenea, redresoarele prevazute cu dispozitive de reglare. Cele mai moderne si economice surse de incarcare folosite in prezent pe o scara tot mai larga, sint redresoarele cu teristoare (diode cu siliciu sau germaniu, comandate), care au un randament ridicat.
In procesul de incarcare, se leaga polii acumulatorului, cu bornele de aceeasi polaritate, la redresor, cind au loc reactiile:
![]()
Conducerea incarcarii este efectuata prin control si masurari. Sfirsitul incarcarii este aratat de densitatea electrolitului si tensiunea elementului, care nu mai cresc. In acelasi timp la ambele feluri de placi, se observa o vie degajare de gaze, ceea ce denota ca procesul de regenerare a maselor active s-a terminat si incepe electroliza apei. O incarcare completa insa, nu trebuie oprita indata dupa aparitia acestor semne, ci se prelungeste timp de inca 1-4 ore, pentru a se ajunge la omogenizarea starii placilor si la. aceeasi concentratie a electrolitului. Este necesar acest lucru, pentru a se obtine valori reale, atit ale tensiunii elementului cat si a densitatii electrolitului. Omogenizarea este un efect al agitatiei produse de gaze. Termenul de supraincarcare indica de obicei o operatie abuziva si daunatoare.
Imbunatatirile de perspectiva aduse acumulatoarelor de plumb, formeaza obiectul unor cercetari aplicative cu importante implicatii economice. Aceste imbunatatiri ale acumulatoarelor din fabricatia curenta se axeaza pe diferite directii, ca:
- perfectarea unei tehnologii pentru turnarea aliajelor Pb-Ca;
- asimilarea aliajelor Pb-Ca
pentru gratare si realizarea unor acumula
toare de tip inchis fara intretinere si de mare energie
specifica (50-80 Wh/
kg);
- folosirea electrolitului imobilizat;
- inlocuirea acidului
sulfuric in electrolit cu perclorat de potasiu care
permite obtinerea de valori mai mari de energie specificasi
performante bune
la temperaturi scazute;
- ultrasonarea
electrolitului (tratarea cu ultrasunete de frecventa 1 MHz
si intensitate 1,9 W/cm2),
avind ca efect facilitarea procesului de difuzie
datorita intirzierii aparitiei fenomenului de polarizare a
electrozilor, permi-
tind o incarcare completa a celulei si o crestere cu
30-35% a capacitatii
acumulatorului;
- imbunatatirea
performantelor placilor electrodice pozitive si corespun
zator, prelungirea duratei de serviciu, marindu-se capacitatea acestora prin
adaugarea unor substante de activare (adaosuri de porozitate), ca: grafit,
caolin, sulfat de magneziu, sulfat de aluminiu, carbonat de; sodiu (cu
efecte asupra texturii dioxidului de plumb din placa pozitiva) introduse fie
In masa activa, fie in aliajul Pb-Sb pentru gratare, fie in
electrolitul acumu
latoarelor deja montate.
Toate aceste solutii de modernizare a acumulatoarelor cu plumb sint impuse de faptul ca acestea au o pondere in fabricatie de 75-80%.
Acumulatorul
alcalin fero-nichel (
Acumulatorul Fe-Ni, cind este incarcat formeaza pila reversibila:
![]()
Mecanismul functionarii acestui acumulator are la baza o serie de reactii complicate, care se pot rezuma prin urmatoarea reactie globala:
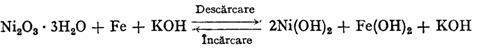
Reactiile la electrozi in timpul functionarii pot fi reprezentate schematic astfel:
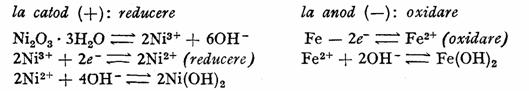
Fiecare acumulator cuprinde un numar de placi negative, intre care se gasesc intercalate placile pozitive, legate in paralel.
Electrolitul este format dintr-o solutie 21% de KOH, cuprinzind 5% LiOH; prezenta acestuia mareste tensiunea, capacitatea si durata acumulatorului. Spre deosebire de acumulatorul de plumb, electrolitul nu ia parte la reactiile de descarcare si incarcare.
Tensiunea acestui acumulator, initiala este de 1,65 V, medie de 1,2 V si minima de 1,1 V; el suporta un numar mare de incarcari si o intretinere simpla. Se utilizeaza in special, acolo unde exista conditii grele de lucru, cum ar fi, la iluminatul trenurilor si la actionarea locomotivelor din mine. Sint semnalate si unele dezavantaje, ca: tensiune mica la borne, ceea ce necesita un numar mare de elemente pentru a forma o baterie de aceeasi forta electromotoare; randament de curent mai mic (82%); randament de energie (60%) mai scazut fata de acumulatorul de plumb; cost mai ridicat.
Acumulatorul alcalin cadmiu-nichel a fost realizat cu scopul de a fi utilizat in orice conditii de lucru. Realizindu-se inchis ermetic, sint inlaturate unele operatii de intretinere si unele pericole legate de acestea (varsarea eleotroli-tului agresiv). Acumulatorul este format din lantul electrochimie:
![]()
Reactia principala de incarcare-descarcare este urmatoarea:
![]()
Electrolitul este tot o solutie de KOH, 21% cu LiOH, 5%.
Acest acumulator are capacitatea cuprinsa intre 4 mAh si 30 Ah si se utilizeaza in tehnica satelitilor si la alimentarea unor aparate independente de reteaua de curent electric.
Avantajele pe care le prezinta sint urmatoarele: conserva mai bine sarcina decat acumulatorul Fe-Ni; cadmiul nu se pasiveaza cind acumulatorul se descarca foarte repede la temperatura scazuta; potentialul de incarcare este mai mic. Ca si acumulatorul Fe-Ni este rezistent la incarcari si descarcari rapide sau la scurtcircuitari.
Sisteme electrochimice neconventionale. Studiile intreprinse in scopul realizarii surselor electrochimice de mare densitate de energie, au dovedit ca folosirea apei ca solvent al electrolitului nu permite realizarea acestor surse de mare densitate de energie. Aceasta, din cauza ca apa, avind o tensiune de descompunere de 1,23 V, nu poate servi ca solvent in pilele dotate cu anozi din metale foarte active cum sint, alcalinele si alcalino-pamintoasele. in sistemele neconventionale se utilizeaza un solvent organic ceea ce face posibila confectionarea anodului dintr-un astfel de metal, puternic reducator. Asociat cu o sare a unui metal tranzitional, permite realizarea surselor1 electrocbi-mice ale caror densitati de energie depasesc mult performantele celor ce folosesc apa ca solvent.
Alegerea anodului este o problema relativ usor de rezolvat. El este constituit dintr-un metal care se comporta ca un donor de electroni. Studiile efec-tuatej au demonstrat ca litiul este metalul cel mai avantajos ca anod in pilele cu solvent organic. Avind in vedere ca aceste pile lucreaza si la temperaturi apropiate de 70C unde apar fenomene de coroziune, se utilizeaza numai litiu de inalta puritate (99,97%).
Alegerea catodului este mai dificila, el joaca rolul acceptorului de electroni, in general, catozii se formeaza prin comprimarea sau precipitarea substantei active, pe un electrod-suport, avind rezistenta mecanica si o buna conducti-bilitate electronica.
Metalele ale caror saruri se studiaza in calitate de catod sint metale tran-zitionale, ca: V, Cr, Mo, W, Mn, Fe, Co, Ni, Cu si altele, dar sint luate in discutie numai sarurile corespunzatoare din punct de vedere termodinamic si care, cuplate cu anodul de litiu, dau o densitate masica practica, mai mare de 200 Wh/kg.
Alegerea solventului organic in pilele electrice este semnalata din 1952. El trebuie sa prezinte in primul rind, inertie chimica fata de litiu. Solutia obtinuta trebuie sa aiba o buna conductibilitate ionica pentru a se reduce la minimum posibil caderile chimice de tensiune. Acestor cerinte corespund in primul rind solventi cum sint: carbonatul de etilena; carbonatul de propilena; sulfatul de dimetil. Amestecul primilor doi solventi este preferat in multe pile, deoarece dau solutii cu o buna conductibilitate, reduc visco-zitatea sistemului si opresc corodarea substantelor utilizate drept catozi, si deci, viteza de autodescarcare.
Electrolitul este o sare anorganica dizolvata in solventul organic.
Functionarea pilelor cu solvent organic a fost cercetata de Chilton, pentru pila care foloseste ca solvent carbonatul de propilena (CP) si este simbolizata prin urmatorul lant electrochimie:
![]()
Reactiile la cei doi electrozi sint:
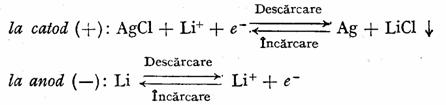
inlocuirea clorurii de argint cu clorura cuprica, constituie un progres fata de prima pila prezentata la care catodul este clorura de argint. Lantul electrochimie ce simbolizeaza aceasta pila este urmatorul: (-) Li | sare de litiu intr-un solvent organic |CuCl2| Cu(+), iar procesele potential active sint urmatoarele:
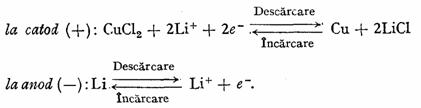
In ultimii ani au fost studiate si realizate mai multe tipuri de sisteme neconventionale, utilizindu-se multe materiale catodice care, asociate cu electrodul de litiu, solventul fiind organic, sint capabile de mari densitati de energie.
3. Pile de combustie
Pila de combustie se defineste ca fiind un generator de energie electrica, alimentata continuu cu specia activa la electrozi. La electrodul de combustibil are loc oxidarea acestuia din urma cu oxidantul alimentat la celalalt electrod. Printre cei mai obisnuiti combustibili se mentioneaza H2, CH3OH, N2H4, hidrocarburi, CO si altii; oxidantul este oxigenul pur sau diluat (aer atmosferic).
Clasificarea pilelor de combustie se face dupa multe criterii. Unele iau in considerare temperatura de functionare; altele, electrolitul utilizat, natura combustibilului (lichid sau gazos) sau procesul de alimentare cu combustibil (pile directe sau indirecte).
Pila hidrogen-oxigen (H2-O2). este cea mai bine studiata si mai raspindita; a servit ca sursa de energie electrica si apa, pe capsulele trimise in cosmos in cadrul proiectelor Gemini si Apollo.
In aceasta pila prezentata in figura 50, procesul electromotric activ, invers electrolizei, consta in sinteza apei din elementele constitutive. Reactia controlata, elibereaza energie electrica si caldura in cantitate echivalenta cu entalpia libera a reactiei de formare a apei.
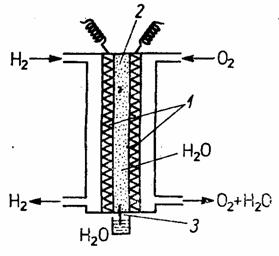
Fig. 50 - Schema pilei de combustie H2-O2: 1 - electrozi de Ti cu catalizator de Pt; 32 - membrana schimbatoare de ioni; a - mesa pentru mentinerea cotei de epa in membrana schimbatoare de ioni.
Se precizeaza ca hidrogenul care ocupa primul loc printre combustibilii utilizati in aceste pile, prezinta dezavantajul (in afara de pericolul inflamabilitatii) legat de imposibilitatea lichiefierii lui, ceea ce ridica probleme destul de dificile. in unele aplicatii militare, acest dezavantaj a fost rezolvat prin folosirea hidrurii de litiu, care degaja hidrogen sub actiunea apei. Reactiile care au loc in pila sint urmatoarele :
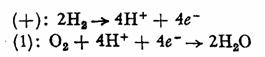
Pilele se folosesc asamblate in baterii. Pe nava cosmica Gemini s-a folosit o baterie ce putea asigura 900-2000 W si furniza apa 0,56 //kWh de energie electrica.
Pila Bischoff la care electrolitul este din Na2CO3 topit, anodul din carbune, iar catodul din magnetita poroasa, inbibata cu oxigen sau aer (functioneaza ca un electrod de oxigen), are un domeniu de utilizare mai restrins, fig. 5l.
Folosirea de electrozi porosi este justificata prin aceea ca acestia ofera o suprafata de reactie, mult marita, pe unitatea de volum. Reactiile care au ioc la electrozi, sint:
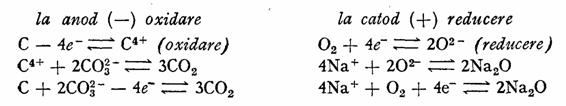
Fig. 61. Pila Bischoff:
1 - anod; 2 - catod; 3 - magnetita;
4 - cilindru poros ; 5 - pulbere de
carbune; 6 - cilindru de sirma.
Regenerarea electrolitului are loc in masa poroasa, conform reactiei:
2Na2O + 2CO2 4Na+ + 2CO3
Forta electromotoare a acestei pile este de 1,95 V, iar randamentul se pretinde a fi 98%.
Pila de combustie biochimica (PCB) se bazeaza pe procese biochimice insotite de degajare de energie, care decurg in mai multe etape controlate de anumite enzime, putind functiona cu substante biologice naturale existente in organism (PBC directa) sau produse de anumite microorganisme (PBC indirecta). Astfel de convertizoare electrochimice de energie sint destinate pentru alimentarea unor stimulatoare cardiace sau pentru prelucrarea reziduurilor umane intr-o ecologie izolata ca cea din navele cosmice.
PCB indirecta, recomandata pentru a fi folosita in zborurile spatiale, capabila de a recupera apa sau oxigenul din unele deseuri, este sistemul ce contine bacteriile Chlorella pyrenoidosa la catod si Micrococus ureae la anod.
PCB directa (fig. 52), bazata pe conversia directa a energiei glucozei din organism in prezenta oxigenului si utilizata la alimentarea stimulatoarelor cardiace, fiind implantata prin operatie chirurgicala, foloseste ca materiale de electrod, de obicei, pentru anod Pt pura sau aliaje platinice (Pt-Ru), iar pentru catod Pt sau aliaje de aur (Au-Pd). Electrolitul dintre cei doi electrozi este, de cele mai multe ori, o solutie tampon de bicarbonat (pH=l,4) caruia i se adauga combustibil, O2 si CO2 de concentratii apropiate de cele fiziologice. in afara de glucoza drept combustibil se poate folosi si glucozamina, acidul gluconic, fructoza si manoza. O astfel de pila, la 37C, genereaza un curent de ordinul mA.
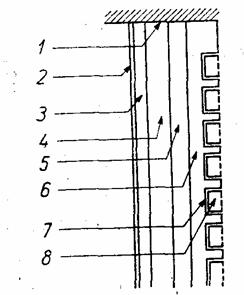
Fig. 52 - Sectiune transversala intr-o
pila de combustie biochimica destinata
la alimentarea, stimulatoarelor cardiace
(PBC directa):
1 - izolare electrica; 2 - membrana permeabila selectiva pentru glucoza; 3 - anod poros hidrofil, de glucoza (combustibil); 4 - electrolitul, conjinut intr-o matrice de membrana schimbatoare de electroni^ - electrod poros hidrofob, de oxigen; 6 - membrana permeabila, selectiva pentru oxigen; 7 -strat limita; 8 - canal de aer;
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 5027
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved