| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Teoria clasica a legaturii colvalente. Majoritatea substantelor în stare moleculara existente în natura, cum sunt moleculele organice, nu se formeaza prin cedare-captare de electroni asa cum se formeaza bazele si sarurile (combinatiile ionice). Ele nu conduc curentul electric deoarece au moleculele alcatuite din atomi puternic legati printr-un alt tip de legatura mai stabila decât legatura ionica si care poarta numele de legatura covalenta sau atomica. Formarea legaturii covalente se realizeaza prin punerea în comun de catre ambii atomi a unor perechi de electroni din stratul de valenta astfel încât fiecare atom sa-si formeze un dublet sau un octet stabil. Ca exemplu se da formarea moleculelor de hidrogen, clor si acid clorhidric (electronii ambilor parteneri de legatura se reprezinta diferit pentru a scoate mai bine în evidenta participarea ambilor atomi la formarea perechii de electroni de legatura):
![]()
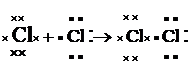
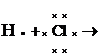
![]()
![]()
În cazul moleculelor de H2 si Cl2, perechea de electroni de legatura apartine în mod egal ambilor atomi, în timp ce la HCl apartine mai mult clorului, acesta având electronegativitate mai mare decât hidrogenul. De aceea, legatura covalenta în moleculele homoatomice (formate din acelasi fel de atomi) s-a numit nepolara, în timp ce în moleculele heteroatomice (formate din atomi diferiti-HCl), polara.
În timp ce combinatiile ionice se formeaza din atomi electropozitivi si electronegativi, combinatiile covalente se formeaza din atomi având acelasi caracter electrochimic. Datorita însa diferentei de electronegativitate dintre atomii ce compun moleculele heteroatomice, acestea formeaza dipoli electrici. Produsul dintre sarcina electrica si distanta dintre cei doi poli poarta numele de moment electric μ sau dipolmoment: μ = er si se exprima în Debye (D) (1D = 10-20 u.e.s.m).
Molecula de apa are momentul
electric μ = 1,84 D dovedind structura sa unghiulara (![]() = 104o30’):
= 104o30’):
S-a convenit ca perechea de electroni de legatura sa se reprezinte printr-o liniuta numita liniuta de valenta (H-Cl). Valenta elementelor în astfel de combinatii este data de numarul de perechi de electroni pusi în comun. Astfel, azotul este tricovalent în molecula sa (N2).
Electronii care nu iau parte la legaturi se numesc electroni neparticipanti. Acesti electroni se pot reprezenta fie prin puncte, fie prin liniute:
![]()
![]()
![]() .
.
Tendinta de a forma octetul prin punere în comun de electroni nu se aplica riguros decât la elementele din perioada a 2-a (Be, B, C, N, O, F) deoarece stratul de valenta poate contine maxim 8 electroni. Începând de la perioada a 3-a, elementele pot forma combinatii covalente cu participarea a 10, 12, 14 sau chiar 16 electroni datorita existentei orbitalilor d disponibili (PCl5, SCl6).
Spre deosebire de legatura ionica, legatura covalenta este orientata în spatiu. Atomii sunt legati rigid între ei si la distante precise unii de altii. În cazul moleculelor cu mai mult de doi atomi, acestea se caracterizeaza prin unghiuri constante între directiile de legatura.
Prezenta unei polaritati în moleculele covalente înseamna în realitate prezenta în aceste molecule, în mod partial, a legaturii ionice, datorita atractiei electrostatice dintre dipoli.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 300
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved