| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Viteza de transformare si de reactie - definire si masurare
Pentru a defini viteza de transformare chimica si viteza de reactie este necesar sa cunoastem complexitatea sistemului reactant. Pentru aceasta trebuie sa stabilim daca in sistemul urmarit se produce o reactie singulara sau o retea de reactii.
Discriminarea intre cele doua posibilitati poate fi facuta cu ajutorul unui
studiu stoichiometric. Un astfel de studiu implica identificarea tuturor
componentilor sistemului - reactanti, intermediari si produsi finali - urmata
de verificarea legii proportiilor definite, in diferite stadii de desfasurare a
procesului global. Daca rapoartele numerelor de moli, ![]() , sau rapoartele unor proprietati corelate cu numerele de
moli, raman constante pe intregul parcurs al reactiei, rezulta ca in sistem are
loc o reactie singulara, descrisa de o singura ecuatie stoichiometrica
, sau rapoartele unor proprietati corelate cu numerele de
moli, raman constante pe intregul parcurs al reactiei, rezulta ca in sistem are
loc o reactie singulara, descrisa de o singura ecuatie stoichiometrica ![]() si de avansarea
corespunzatoare a reactiei
si de avansarea
corespunzatoare a reactiei ![]() sau
sau ![]() .
.
Se poate astfel stabili stoichiometria reactiei, adica valorile coeficientilor
![]() .
.
Daca unele dintre rapoartele ![]() variaza in
timp, rezulta ca in sistem au loc mai multe reactii cuplate intr-o retea. Variatia
in timp a compozitiei sistemului poate fi caracterizata prin una sau mai multe
curbe cinetice. Curbele cinetice redau variatia in timp a cantitatii unui
component. Este evident ca fara cunoasterea prealabila a stoichiometriei
transformarilor, o curba cinetica nu poate servi la definirea unei viteze de
reactie ci numai la definirea unei viteze de transformare a componentului
studiat. Daca acesta este implicat numai intr-o singura reactie, curba cinetica
poate servi la definirea vitezei de reactie.
variaza in
timp, rezulta ca in sistem au loc mai multe reactii cuplate intr-o retea. Variatia
in timp a compozitiei sistemului poate fi caracterizata prin una sau mai multe
curbe cinetice. Curbele cinetice redau variatia in timp a cantitatii unui
component. Este evident ca fara cunoasterea prealabila a stoichiometriei
transformarilor, o curba cinetica nu poate servi la definirea unei viteze de
reactie ci numai la definirea unei viteze de transformare a componentului
studiat. Daca acesta este implicat numai intr-o singura reactie, curba cinetica
poate servi la definirea vitezei de reactie.
Vom examina mai intai sistemele in care se produce numai o reactie singulara intr-un reactor discontinuu. Compozitia unui astfel de sistem se poate exprima cu ajutorul diferitelor variabile de compozitie.
In cinetica chimica sunt frecvent utilizate numai o parte din aceste variabile,
numite si variabile cinetice: numarul de moli, ![]() avansarea reactiei,
avansarea reactiei, 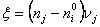 , concentratia molara,
, concentratia molara, ![]() , avansarea volumica,
, avansarea volumica, ![]() si conversia
unui
si conversia
unui
reactant, ![]()
Numarul de moli, si concentratia molara nu necesita cunoasterea reactiilor care au loc in sistem. Aceste variabile servesc la definirea vitezei de transformare a unui component al sistemului. Acest component poate fi implicat in una sau in mai multe reactii chimice.
Viteza de transformare se defineste cu ajutorul curbei cinetice si reprezinta
raportul ![]() sau
sau ![]() , avand semnificatia variatiei numarului de moli sau a
concentratiei in unitatea de timp.
, avand semnificatia variatiei numarului de moli sau a
concentratiei in unitatea de timp.
Se observa ca aceste rapoarte reprezinta pantele curbelor cinetice nj = nj (t) si respectiv Cj =Cj (t) . Cele doua curbe cinetice difera principial intre ele intrucat numarul de moli este o marime extensiva, pe cand concentratia molara este o marime intensiva.
In Figura 1 este ilustrata curba cinetica CR = CR(t), unde CR este concentratia unui reactant.
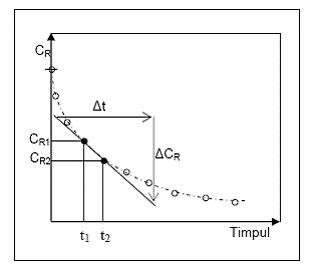
Figura 1
Se observa ca viteza de transformare este data de:
vtr = ΔCR/ Δt (10)
Pentru curba cinetica similara nj = nj (t) se obtine viteza de reactie extensiva, marcata prin bara:
![]()
Intrucat curbele cinetice sunt descrescatoare in timp, vitezele de transformare sunt negative (concentratia reactantului scade in timp). Pentru curbele cinetice ale produsilor de reactie, care sunt crescatoare in timp, vitezele de transformare sunt pozitive.
Derivata intr-un punct oarecare al unei curbe experimentale (de forma analitica in general necunoscuta) se obtine fie prin metode grafice dupa cum se ilustreaza in figura, fie prin metode numerice, disponibile in prezent in numeroase programe destinate prelucrarii datelor experimentale.
Primul procedeu este subiectiv, laborios si aproximativ, in timp ce derivarea numerica este obiectiva si rapida. Mai mult, derivarea numerica da posibilitatea calcularii derivatei intr-un punct oarecare sub forma unui cat diferential, vtr dCj dt , in locul unui cat de diferente finite, vtr DCj Dt , care reprezinta o valoare medie in intervalul t .
Din curba cinetica prezentata se observa ca viteza de transformare ia valori mari la inceputul procesului si scade monoton in timp.
O comparatie intre relatiile de definitie (10) si (11) arata ca viteza
intensiva de transformare, vtr , poate fi obtinuta din cea extensiva, ![]() , prin raportarea la un factor de intensivare, I. In acest caz,
factorul de intensivare este volumul sistemului:
, prin raportarea la un factor de intensivare, I. In acest caz,
factorul de intensivare este volumul sistemului:
![]() (12)
(12)
Transformarea
![]() V in
V in ![]() s-a facut presupunand
ca volumul sistemului ramane constant.
s-a facut presupunand
ca volumul sistemului ramane constant.
Factorul de intensivare nu poate fi ales arbitrar ci trebuie sa reprezinte o masura a spatiului in care are loc reactia chimica.
Sisteme omogene
Pentru reactiile care au loc in sistem omogen, volumul ocupat de sistemul reactant reprezinta o masura adecvata a spatiului de reactie. Pentru reactiile care au loc pe suprafata unui solid (ca in cazul catalizei in sistem eterogen fluid/solid), spatiul de reactie este suprafata solidului catalitic.
Daca in sistemul reactant considerat are loc o singura reactie chimica, atunci se poate defini o viteza de reactie, utilizand ca variabila cinetica avansarea sau avansarea volumica:
![]() (13)
(13)
![]() (14)
(14)
In cel de al doilea caz s-a presupus din nou ca volumul sistemului ramane constant.
Introducerea coeficientilor stoichiometrici cu conventia de semn adoptata
permite definirea unei viteze unice de reactie, indiferent de componentul ales.
Mai mult, viteza de reactie este totdeauna o marime pozitiva, intrucat pentru
reactanti ![]() si
si ![]()
conducand
la vR 0 , iar pentru produsi ![]() si
si ![]() , conducand de asemenea la vR
, conducand de asemenea la vR
Cel mai frecvent sunt utilizate vitezele de reactie intensive, redate in general prin
![]()
in care s-a precizat si existenta factorului de intensivare.
Viteza de transformare se defineste de fapt pentru fiecare pentru fiecare component
al reactiei, pe cand viteza de reactie caracterizeaza intregul sistem. Intre
cele doua exista o relatie simpla: ![]()
![]()
Pentru reactiile singulare in sisteme omogene se utilizeaza cel mai frecvent urmatorii factori de intensivare:
o volumul ocupat de sistemul reactant
![]()
Daca volumul este constant, acesta poate fi introdus sub operatorul derivata si se obtine:
![]()
Relatia de definitie (17) este cea mai des utilizata, dar poate fi aplicata numai sistemelor care evolueaza la volum constant.
Cand volumul este variabil se obtine:
![]() (18)
(18)
Pentru reactiile care au loc in faza gazoasa se substituie nj cu valoarea presiunii partiale, pj, obtinuta din legea gazului ideal.
Exista posibilitatea de utilizare si a altor factori de intensivare cum ar fi numarul de moli de reactant ramas nereactionat, nj, numarul de moli de centri catalitici pentru reactiile catalitice etc.
o numarul de moli dintr-un reactant ramas nereactionat
Daca factorul de intensivare este nj, reprezentand numarul de moli dintr-un reactant care a ramas nereactionat, viteza de reactie are o semnificatie deosebita:
![]()
Prin rearanjarea relatiei obtinute se obtine:
![]()
Relatia obtinuta evidentiaza raportul (dnj nj ) care are semnificatia unei probabilitati de reactie (reprezentand raportul dintre numarul cazurilor favorabile, dnj si numarul cazurilor posibile, nj). Raportarea la intervalul de timp dt conduce la definirea probabilitatii de reactie in unitatea de timp, care va fi numita mai scurt probabilitatea de reactie. Se poate verifica usor ca intre viteza (17) si viteza (20) exista o relatie simpla:
![]()
Ultima relatie arata ca viteza de reactie vR/v este data de produsul dintre probabilitatea de reactie a unui reactant si concentratia acestuia.
Uneori
este util sa se defineasca viteza de reactie cu ajutorul conversiei unui
reactant, corelata cu numarul de moli prin relatia de definitie: ![]()
Sisteme eterogene
In sistemele eterogene in care reactia chimica are loc la suprafata de separatie dintre doua faze, viteza de reactie intensiva se poate defini utilizand suprafata ca masura a spatiului de reactie:
![]() (22)
(22)
Daca se defineste concentratia
superficiala ca ![]() , se obtine o relatie
de definitie analoga cu cea pentru sisteme omogene, (17):
, se obtine o relatie
de definitie analoga cu cea pentru sisteme omogene, (17):
![]() (23)
(23)
Pentru reactiile catalitice fluid/solid aceasta viteza este numita activitate intrinseca a catalizatorului.
Cand nu se cunoaste suprafata S, se poate utiliza ca factor de intensivare masa catalizatorului, m, o proprietate mai putin relevanta pentru viteza de reactie, intrucat aceeasi masa poate avea suprafete diferite, in functie de gradul de divizare a solidului:
![]()
Pentru reactiile catalitice fluid/solid aceasta viteza este numita activitate specifica a catalizatorului.
Reactoare continue cu amestecare
Definirea vitezei de reactie pentru reactorul continuu cu amestecare necesita si cunoasterea vitezelor de alimentare si de evacuare. Acestea se exprima cu ajutorul debitelor molare. Prin definitie, debitul molar al componentului j este dat de:
DM, j (dnj /dt (25)
Pentru determinarea debitului molar, (nemasurabil direct), este necesara corelarea acestuia cu marimi masurabile direct. Conform relatiei de definitie a concentratiei molare, rezulta nj = v Cj, care, prin derivare in raport cu timpul conduce la:
DM, j (dnj /dt) v(dCj /dt) Cj (dv/ dt) (26)
Daca se pastreaza constanta concentratia, se obtine:
DM, j Cj (dv/ dt) Cj//Dv
unde Dv este debitul volumic, o marime determinabila experimental. Astfel, debitul molar poate fi determinat masurand concentratia si debitul volumic. Definirea si masurarea vitezei de reactie intr-un reactor continuu cu amestecare perfecta se bazeaza pe bilantul
molar al unui component si pe conditiile specifice ale acestui reactor.
Bilantul molar pentru un component oarecare se poate scrie in forma:
(dnj /dt total (dnj /dt al (dnj /dt ev (dnj /dt R
in care indicii al, ev si R se refera la alimentare, evacuare si reactie chimica, iar suma din membrul al doilea este considerata in sens algebric (debitul molar la evacuare este negativ, iar termenul referitor la reactia chimica este negativ pentru reactanti si pozitiv
pentru
produsi. Inlocuind ![]() si introducand
debitele molare cu semnele corespunzatoare se gaseste:
si introducand
debitele molare cu semnele corespunzatoare se gaseste:
![]()
unde v este volumul ocupat de fluidul din reactor.
Reactorul continuu cu amestecare poate functiona in doua moduri distincte: un regim
trazient, cand (dnj dt total si un regim stationar, cand (dnj /dt total 0 . In regimul stationar viteza de reactie este data de:
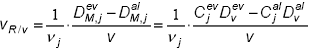
Pentru solutii, debitul volumic la
evacuare este practic egal cu cel de la alimentare si se noteaza cu ![]() , rezultand:
, rezultand:
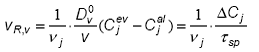
unde ![]() reprezinta o caracteristica a regimului de functionare si este numit timp
spatial, iar
reprezinta o caracteristica a regimului de functionare si este numit timp
spatial, iar ![]()
Deoarece in regim stationar acest tip de reactor functioneaza fara modificarea compozitiei sistemului reactant a fost numit si chemostat. Realizarea transformarii chimice fara schimbarea compozitiei are mari avantaje in reactiile biochimice.
Retele de reactii
S-a vazut ca o retea de reactii este descrisa de un sistem de ecuatii stoichiometrice de forma:
![]()
iar legea de conservare pentru fiecare component este data de:
![]() (9)
(9)
in care indicele j se refera la componentii sistemului, iar indicele i se refera la reactiile din sistem.
Daca se deriveaza legea de conservare in raport cu timpul se obtine:
![]() (32)
(32)
Derivata ![]() reprezinta viteza
extensiva a reactiei i. Daca se raporteaza la volumul ocupat de
amestecul de reactie (ca factor de intensivare) se obtine:
reprezinta viteza
extensiva a reactiei i. Daca se raporteaza la volumul ocupat de
amestecul de reactie (ca factor de intensivare) se obtine:
![]() (33)
(33)
Ultima relatie arata ca viteza de transformare a unui component, vtr,j dCj /t , este data de suma contributiilor acestui component la toate reactiile la care acesta participa.
Pentru determinarea tuturor vitezelor de reactie este necesar sa se masoare vitezele de transformare pentru i componenti.
Consideram o retea cu trei reactii si cu noua componenti
1. A + B = C + D
2. E +C = F + G
3. A = H + K
Pentru determinarea vitezelor celor trei reactii trebuie sa masuram vitezele de transformare pentru trei componenti. Numarul de componenti este mai mare si se pune intrebarea daca toti acestia sunt echivalenti.
O analiza atenta arata ca nu toti componentii pot fi utilizati in orice combinatie.
Daca se masoara de exemplu B, C si D, nu putem sa masuram decat viteza primelor doua reactii. Rezulta ca putem sa alegem acei componenti care apartin tuturor reactiilor. Acestia se numesc componenti cheie. Daca exista mai multe solutii (mai multe seturi de componenti cheie) se aleg cele mai convenabile din punct de vedere experimental. Un set posibil de componenti cheie este: A, B, si C. Vitezele lor de transformare sunt date de:
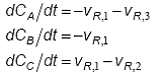
Se observa ca in sistemul de ecuatii apar toate trei vitezele de reactie, care pot fi obtinute prin rezolvarea sistemului de ecuatii liniare.
Analiza cinetica a retelelor de reactii este mai complexa decat cea a reactiilor singulare, dar rezolva probleme mai apropiate de realitate, intrucat cele mai multe dintre reactiile intalnite in practica sunt de fapt retele de reactii. Uneori, prin alegerea adecvata a conditiilor de reactie, unele retele pot fi reduse la reactii singulare.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2253
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved