| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
BAZELE TERMODINAMICII
Postulatele termodinamicii
Primul postulat:
Un sistem termodinamic izolat ajunge intotdeauna, dupa un interval de timp oarecare, intr-o stare de echilibru termodinamic, din care nu poate iesi niciodata de la sine
De aici rezulta: procesele termodinamice se desfasoara intotdeauna de la stari de neechilibru spre stari de echilibru termodinamic.
Postulatul al doilea
Doua sisteme termodinamice A si B care pot schimba caldura caldura intre ele se afla in contact termic. Daca 2 sisteme sunt aduse in contact termic si nu schimba caldura intre ele, se spune ca ele sunt in stare de echilibru termic.
Echilibru termic este tranzitiv.
Scari de temperatura
Consideram ca starea termodinamica a substantei este complet determinata de un parametru extern x , un parametru intern y si temperatura empirica Θ
![]()
![]()
![]()
Termometrul = sistem standard
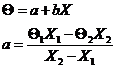
![]()
![]()
1. Scara Celsius - ![]()
2. Scara Fahrehheit - ![]()
3. Scara Reaumar - ![]()
![]()
Punctul triplu al
apei - ![]()
Masurarea temperaturii se bazeaza pe proprietatile reproductibile ale sistemelor termodinamice:
-Dilatarea termica a corpurilor solide, lichide, gazoase;
-Dependenta de temperatura a tensiunii electrice de contact dintre doi conductori (termocuple);
-Dependenta de temperatura a rezistentei electrice pentru conductori si semiconductori;
-Emisia luminii de catre corpurile solide la temperaturi inalte ( pirometre ).
Ecuatiile termice de stare:
![]()
![]()
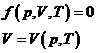
![]() daca V=Ct
daca V=Ct ![]()
![]()
![]()
![]()
Coeficientul de
dilatare termica: ![]()
Coeficientul
termic al presiunii :![]()
Coeficientul de
compresie izoterma : ![]()
![]()
![]()
Legile gazelor
Legea Boyle-Mariotte ( transformari izoterme )
![]()
Presiunea unui gaz aflat la temperatura constanta variaza invers proportional cu volumul gazului
pV = ct
Legea Gay-Lussac ( transformare izobara )
p = ct, m = ct
![]()
![]()
![]()
Legea lui Charles (transformare izocora )
V= ct, m = ct
![]()
presiunea unui gaz ideal mentinut la volum constant variaza liniar cu temperatura
![]()
![]()
![]()
Principiul intai al termodinamicii
-pentru sisteme
incluse: ![]()
![]() variatia energiei interne a sistemului in
proces L1-2
variatia energiei interne a sistemului in
proces L1-2
Q - Caldura
primita ![]()
Caldura cedata ![]()
L - lucru mecanic - efectuat de sistem ![]()
- efectuat
asupra sistemului ![]()
![]()
![]() = energia
de transport
= energia
de transport
![]()
Lucrul mecanic efectuat pentru polarizarea unitatii de volum a unui dielectric omogen este :
![]() E =
intensitatea campului electric
E =
intensitatea campului electric
P = vectorul polarizarii
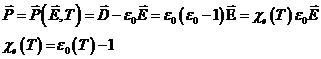
Daca procesele termodinamice sunt ciclice ![]()
![]()
![]()
![]()
Este imposibil de realizat o masina termica care ar putea sa efectueze lucru mecanic, intr-un proces ciclic, fara sa primeasca caldura din exterior (perpetuum mobile sp I ):
![]() si
si ![]()
Capacitatile calorice ale sistemelor termodinamice simple
Capacitatea calorica- caldura necesara ridicarii temperaturii unui sistem termodinamic cu
un grad.
![]()
![]()
![]() =JK
=JK
In procesele adiabatice , capacitatea calorica este c = 0 ,deoarece Q = 0 ,iar pentru procesele izoterme dT = 0, C = 0.
Caldura specifica masica:
![]()
![]()
![]()
Caldura specifica molara:
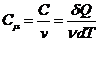
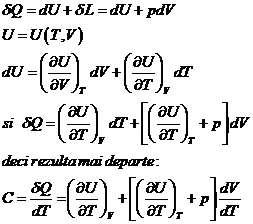
![]()
![]()
Energia interna este suma dintre energia cinetica a moleculelor in raport cu sistemul de referinta al centrului de masa si energia potentiala de intractiune.
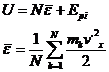
Fiecarui grad de libertate al unei molecule ii corespunde energia cinetica medie egala cu
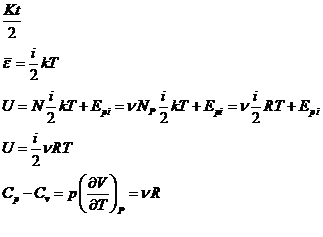
Procese termodinamice politropei
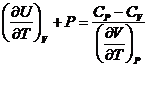
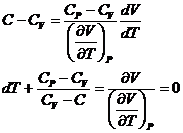
Procesele politropei sunt transformarile termodinamice in
care capacitatea calorica ramane
Integrarea politropei se face in felul urmator:
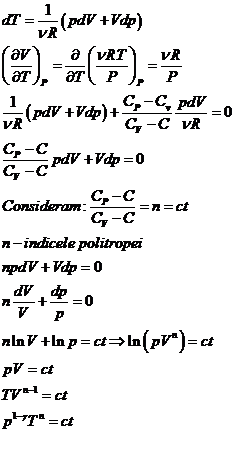
Generalizam
1. Procesele pentru care C = C![]() si n = 0 - procese izobare
si n = 0 - procese izobare
2. Procesele pentru care C =![]() si n =
si n =![]() - procese izocore
- procese izocore
3. In transformarile izoterme C =![]() , n =1
, n =1
Sistemele termodinamice pentru care capacitatile calorice ![]() se numesc termostate.
se numesc termostate.
4. In transformarile adiabatice capacitatea calorica C = 0
si ![]()
![]()
![]() - indicele adiabatei
- indicele adiabatei
![]() in orice punct din
planul (V,P) adiabata este mai inclinata decat izoterma.
in orice punct din
planul (V,P) adiabata este mai inclinata decat izoterma.
Lucrul mecanic efectuat de gazul ideal in transformarile politropei
Daca volumul gazului ideal variaza de la ![]() , lucrul mecanic efectuat de gazul ideal va fi:
, lucrul mecanic efectuat de gazul ideal va fi:
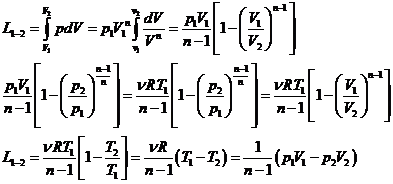
Obtinem expresiile pentru lucrul mecanic pentru toate procesele termodinamice cvasistatice si reversibile.
1. Transformari izobare 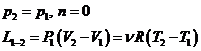
2. Transformarile izoterme n = 1
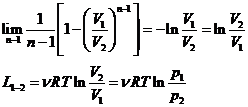
3. Transformarile izocore n =![]() ,
, ![]()
![]()
4. Transformarile adiabatice n =![]()
![]()
![]()
![]() si
si
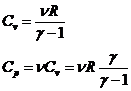
![]()
![]()
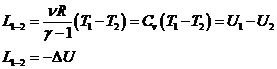
Lucru mecanic este efectuat cand energia termica a gazului ideal scade.
Caldura primita sau cedata de gazele ideale in procesele politrope
![]() - calduri specifice molare
- calduri specifice molare
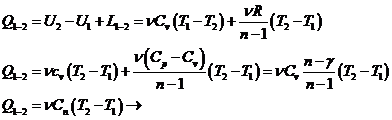
![]() Caldura specifica molara in proces politropic
Caldura specifica molara in proces politropic
Daca procesul este izobar n = 0 ![]()
![]()
Daca transformarea este izocora ![]()
![]()
Pentru tranformari izoterme n=1, ![]()
![]()
Pentru ![]() gazul care se
destinde in astfel de transformari efectueaza un lucru mecanic mai mare decat
caldura furnizata gazului.
gazul care se
destinde in astfel de transformari efectueaza un lucru mecanic mai mare decat
caldura furnizata gazului.
Principiul al doilea al termodinamicii
Daca este
satisfacuta relatia ![]() (conservarea
energiei), inseamna ca exista posibilitatea trecerii de la un corp cu
temperatura mai mica la un corp cu temperatura mai mare.
(conservarea
energiei), inseamna ca exista posibilitatea trecerii de la un corp cu
temperatura mai mica la un corp cu temperatura mai mare.
Intr-un proces
1-2, corpul primeste caldura ![]() efectueaza lucrul
mecanic
efectueaza lucrul
mecanic ![]()
![]()
Pentru procesul
2-1 ![]()
![]()
Randamentul ![]()
Nu exista
posibila realizarea unei masini termice care sa efectueze un lucru mecanic fara
sursa rece de caldura : ![]() (practic nu se poate realiza acest lucru )
(practic nu se poate realiza acest lucru )
Lucru mecanic poate fi integral transformat in caldura, iar caldura nu poate fi niciodata transformata integral in lucru mecanic
![]()
Principiul - enunt: este imposibil de realizat o transformare al carui unic rezultat final sa fie transformarea in lucru mecanic a caldurii primite de la o sursa de temperatura uniforma.
Intr-o destindere izoterma a gazului ideal, lucru mecanic efectuat este egal cu caldura primita.
In apropierea oricarei stari termice de echilibru a unui sistem termodinamic omogen, exista alta stare , care se deosebeste putin de prima si care nu poate fi atinsa niciodata, plecand din prima stare intr-un proces cvasistatic , reversibil si adiabatic.
Orice sistem
aflat in echilibru termodinamic este caracterizat de o noua functie de stare ![]() entropie empirica , care nu variaza in timpul proceselor cvasistatice
si adiabatice ( analogie cu Q - temperatura empirica, care nu variaza in
procesele cvasistatice si izoterme.
entropie empirica , care nu variaza in timpul proceselor cvasistatice
si adiabatice ( analogie cu Q - temperatura empirica, care nu variaza in
procesele cvasistatice si izoterme.
Entropia absoluta a gazului ideal
Exista o functie de stare de stare, ce ramane constanta pentru orice proces termodinamic care are loc intr-un termostat denumita temperatura empirica
![]()
daca un proces
cvasistatic are loc fara schimb de caldura, exista o marime de stare - entropia
empirica ![]() - care ramane
constant
- care ramane
constant ![]()
Intr-un astfel de sistem termodinamic :
Izotermele nu se interesecteaza
Diabatele nu se intersecteaza
O adiabata si o izoterma corespunzatoare ??
Intre ![]() exista o legatura univoca , adica unei perechi de valori
exista o legatura univoca , adica unei perechi de valori ![]() ii corespunde o
singura pereche de valori
ii corespunde o
singura pereche de valori ![]()
![]()
![]()
exprimam legatura
dintre aria elementara dpdv in functie de aria elementara ![]()
dpdv ![]() unde
unde
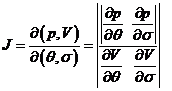
J= Jacobianul transformarilor de variabile
Conditii ![]()
![]()
Se pot alege scarile parametrilor Q si ![]() , astfel incat
jacobianul J sa fie egal cu 1
, astfel incat
jacobianul J sa fie egal cu 1
Notam ![]() unde T -
temperatura absoluta si S - entropia absoluta
unde T -
temperatura absoluta si S - entropia absoluta
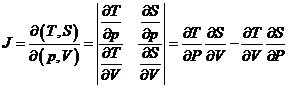
pentru gazul ideal
avem ![]() si
si ![]()
![]()
![]()
![]()
![]()
![]()
Legatura intre caldura elementara si variatia entropiei
Intre caldura elementara si variatia entropiei exista o legatura.
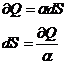
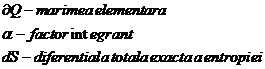
Proces izobar:
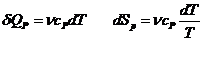
Proces izocor:
![]()
Proces izoterm:
![]()
Proces adiabatic:
![]()
Din compararea primei relatii cu relatiile corespunzatoarea
diverselor procese rezulta: ![]()
Obtinem ecuatia fundamentala a termodinamicii pentru procesele cvasistatice si reversibile dU = TdS - pdV.
Din punct de vedere geometric, caldura are aceeasi reprezentare in planul (S, T ) ca si lucru mecanic in planul (p , V)
Proprietati ale entropiei
S- functie de stare
dS - diferentiala totala exacta
![]() - indiferent de tipul procesului ciclic
- indiferent de tipul procesului ciclic
2. In procesele
cvasistatice si adiabatice se conserva ![]()
3. Entropia
absoluta este o functie de stare adiabatica ![]()
4. Entropia este
definita numai pana la o constasnta arbritrara aditiva ![]() , care nu poate fi
determinata din pr II , Dar variatia de entropie este bine definita
, care nu poate fi
determinata din pr II , Dar variatia de entropie este bine definita
![]()
Principiul al treilea al termodinamicii
Din datele experimentale, concluzionam ca la T = entropia sistemelor termodinamice tinde spre o valoare ![]()
![]()
Pentru ![]() ,
, ![]() entropia absoluta a unui sistem termodinamic tinde catre 0 ,
cand temperatura absoluta tinde catre
entropia absoluta a unui sistem termodinamic tinde catre 0 ,
cand temperatura absoluta tinde catre ![]() (Max Plank )
(Max Plank )
![]()
Consecinte:
1. Indiferent de procesul efectuat, capacitatea calorica a sistemului termodinamic se anuleaza o data cu temperatura
![]()
in particular: ![]()
![]() sau
sau ![]()
![]() pentru temperaturi
de Ok nu este valabila nici ecuatia de stare.
pentru temperaturi
de Ok nu este valabila nici ecuatia de stare.
2. Pentru ![]() , coeficientul de
dilatare termica
, coeficientul de
dilatare termica ![]() si coeficientul
termic al presiunii
si coeficientul
termic al presiunii ![]() , tind la zero.
, tind la zero.
3. Pentru ![]() , entropia nu
poate fi modificata prin nici un fel de actiune izoterma de zero absolut ;
coincide cu adiabata.
, entropia nu
poate fi modificata prin nici un fel de actiune izoterma de zero absolut ;
coincide cu adiabata.
Semnificatia fizica a anularii capacitatii calorice la ![]() este urmatoarea :
este urmatoarea :
Temperatura de ok reprezinta acea stare in care sistemul nu mai poate ceda caldura, deoarece este atinsa starea de energie minima .
Temperatura Ok este principal inaccesibila
Potentiale termodinamice
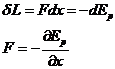
Daca energia potentiala este minima, sistemul se afla in echilibru stabil.
Potentialele termodinamice satisfac urmatoarele conditii:
1. Derivata lor in raport cu o cordonata generalizata este o forta generalizata
2. Cand potentialul termodinamic este minim sistemul se afla in stare de echilibru termodinamic
Energia interna U
Ecuatia fundamentala 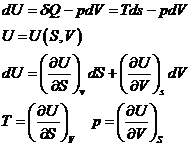
Energia libera F se defineste astfel
![]() , adica F este
functie de T si V
, adica F este
functie de T si V
![]()
![]()
![]()
![]() - prima relatie Gibbs Helmiholtz
- prima relatie Gibbs Helmiholtz
Energia libera este aceea parte din energia interna pe care
sistemul o poate schimba cu mediul exterior, iar marimea ![]() se numeste energie legata, deoarece nu poate fi cedata de
catre sistem.
se numeste energie legata, deoarece nu poate fi cedata de
catre sistem.
In procesele izoterme :
![]()
![]() rezulta
scaderea energiei libere reprezinta lucrul mecanic efectuat de catre sistemul
termodinamic in procesele izoterme.
rezulta
scaderea energiei libere reprezinta lucrul mecanic efectuat de catre sistemul
termodinamic in procesele izoterme.
Entalpia H:
H=U+pV
dH=TdS+Vdp H=H![]()
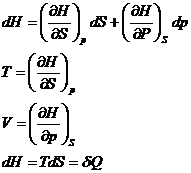
![]()
![]() pentru procese izobare
pentru procese izobare
Variatia entalpiei in procese termodinamice izobare reprezinta caldura primita sau cedata de catre sistem
![]()
Entalpia libera G - este functia termodinamica
G= H-TS = U+pV-TS
dG=Vdp-SdT ![]() G=G(P,T)
G=G(P,T)
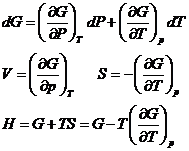 - a doua relatie Gibbs
- a doua relatie Gibbs
G-se mai numeste potential termodinamic Gibbs
Relatiile termodinamice ale lui Maxwell
Pentru o marime exprimata ca functie cu doua variabile avem z=f(x,y)
![]()
![]() - diferentiala
totala exacta
- diferentiala
totala exacta
![]() valoarea unei
derivate mixte nu depinde de ordinea derivarii
valoarea unei
derivate mixte nu depinde de ordinea derivarii
Pornim de la ecuatia fundamentala a termodinamicii ![]()
(x, y)- pot fi orice pereche de parametrii P, V, T, S
![]()
![]()
U- energia interna este o functie de stare
![]()
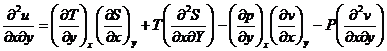
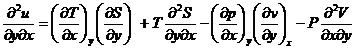
dar![]() si
si ![]()
![]() obtinem relatiile
termodinamice ale lui Maxwell
obtinem relatiile
termodinamice ale lui Maxwell
unde x=P , y=S
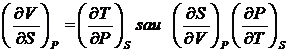
pentru x = V, y = S
![]()
pentru x = P, y = T
![]()
pentru x = V, y =T
![]()
din care rezulta
![]()
![]()
Probleme de termodinamica
Problema rezolvata:
Rezolvare:
a) Din 50kg carbune, 15 Kg(30%) se consuma pentru a acoperi pierderile de caldura prin tavan, iar restul de 35Kg (70%) pentru a acoperi pierderile prin perete. Daca se dubleza grosimea peretilor, pierderea se reduce la jumatate, ecomonisindu-se 17.5Kg de carbune
b) Diferenta de temperatura creste de la 15sC la 18sC, deci consumul de carbune creste si el in raportul 18/15: in primul caz cu 10Kg, iar in cazul doi cu 7.5Kg.
Probleme propuse
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2721
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved