| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
CINETICA SISTEMELOR ETEROGENE - ADSORBTIA. TENSIUNEA SUPERFICIALǍ
Cinetica unui proces eterogen (F>1) comporta mai multe etape. Pentru un sistem format din doua faze: solid (S) si gaz (G) la interfata caruia se produce o reactie chimica aceste etape sunt urmatoarele:
Transportul de masa al moleculelor de gaz catre suprafata (de reactie) a solidului.
Adsorbtia - reprezentand retinerea pe suprafata a moleculelor de gaz -are loc pe anumite portiuni ale suprafetei solidului numite centri activi.
Reactia chimica superficiala (de suprafata, eterogena) care poate fi unilaterala (de ordinul 1 sau 2) sau complexa (reactii opuse, paralele, succesive).
Desorbtia (proces invers adsorbtiei) moleculelor de produsi de reactie (si a reactantilor adsorbiti).
Transportul moleculelor de produsi de la suprafata catre masa de reactie (indepartarea lor de pe suprafata de reactie).
Din punct de vedere cinetic etapele 1-5 sunt etape succesive. Viteza procesului global este determinata de viteza celei mai lente etape, care este numita etapa determinanta de viteza. Oricare din etapele 1-5 poate deveni in anumite conditii etapa determinanta de viteza (EDV).
Adsorbtia este fixarea moleculelor de fluid (G sau L) pe suprafata solidelor (apare si la suprafata lichidelor).
De regula se studiaza pe solide, procesul simbolizandu-se astfel:
![]()
![]() , unde s-au utilizat notatiile:
, unde s-au utilizat notatiile:
![]()
![]() - centri activi;
- centri activi;
![]()
![]() - molecule in faza de
gaz;
- molecule in faza de
gaz;
![]()
![]() - specia A
adsorbita.
- specia A
adsorbita.
![]() este entalpia de
adsorbtie, introdusa prin analogie cu cea de reactie.
este entalpia de
adsorbtie, introdusa prin analogie cu cea de reactie.
Fenomenul se explica prin aparitia unor legaturi de valenta intre centrul activ si molecula din faza gazoasa, conducand la o specie adsorbita. Aceste forte de legatura pot fi:
mai slabe, conducand la o
adsorbtie fizica ![]() ;
;
mai tari, conducand la o
adsorbtie chimica ![]() .
.
Experimental se constata ca adsorbtia este
insotita de o degajare de caldura (apare un fenomen de
stabilizare a lui A din faza gazoasa prin fixarea pe
suprafata): ![]() .
.
Demonstratie:
![]() , cum
, cum ![]() , pentru ca
, pentru ca ![]() trebuie ca
trebuie ca ![]() .
.
Tabel 1. Entalpii observate de adsorbtie fizica
|
Substanta |
Entalpia (kJ/mol) |
|
CH4 | |
|
H2 | |
|
H2O | |
|
N2 |
Entalpia de adsorbtie fizica poate fi masurata experimental inregistrand variatia temperaturii la o proba cu capacitate calorica cunoscuta. Variatia de entalpie de circa 20 kJ/mol este insuficienta pentru a duce la ruperea legaturilor, astfel ca o molecula fiziosorbita isi pastreaza identitatea sa, desi ar putea fi distorsionata de prezenta suprafetei adsorbantului.
In cazul chemosorbtiei particulele se retin la suprafata formand o legatura chimica (obisnuit covalenta) si tind sa gaseasca acele pozitii care maximizeaza cifra lor de coordinare cu substratul. Entalpia de chemosorbtie este mult mai mare decat cea pentru adsorbtia fizica, fiind de ordinul a 200 kJ/mol~50 kcal/mol.
Tabel 2. Entalpii de chemosorbtie
|
Substanta adsorbita (adsorbat) |
Substrat (adsorbant) |
||
|
Cr |
Fe |
Ni |
|
|
CH4 | |||
|
CO | |||
|
H2 | |||
|
NH3 |
| ||
Se obisnuieste ca testul principal prin care se distinge intre chemosorbtie si fiziosorbtie sa fie valoarea entalpiei de adsorbtie.
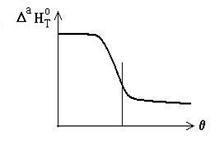
Entalpia de adsorbtie depinde de gradul de acoperire al suprafetei, in principal din cauza interactiunii dintre particulele adsorbite. Daca particulele se resping (ex: CO pe paladiu) entalpia de adsorbtie devine mai putin negativa pe masura ce creste acoperirea.
Se
considera ca in chemosorbtie adsorbtia are loc pana la
acoperirea suprafetei cu un strat monomolecular dupa care are loc
adsorbtia fizica. Aceasta ipoteza este confirmata
si de scaderea caldurii de adsorbtie in functie de
cantitatea adsorbita, dupa cum rezulta din figura ![]() .
.
(A.1.) 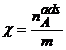 ;
;![]()
![]() = numarul de moli
de substanta adsorbita de unitatea de masa de adsorbant.
= numarul de moli
de substanta adsorbita de unitatea de masa de adsorbant.
(A.2.) 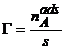 ;
; ![]()
![]() = numarul de moli
de substanta adsorbita pe unitatea de suprafata de
adsorbant.
= numarul de moli
de substanta adsorbita pe unitatea de suprafata de
adsorbant.
Ex: 1 g carbune poate adsorbi 440 mL COCl2 sau 330-2000 mL SO2.
Suprafata carbunelui este de 500-2000 m2/g.
(A.3) 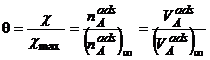
![]()
![]() absenta
adsorbtiei ;
absenta
adsorbtiei ; ![]() acoperire maxima cu molecule.
acoperire maxima cu molecule.
Gazul liber si gazul adsorbit sunt intr-un echilibru dinamic iar gradul de acoperire a suprafetei depinde de presiunea gazului in contact cu adsorbantul, de temperatura si de natura adsorbantului si a adsorbitului.
Variatia lui θ cu presiunea la o temperatura constanta reprezinta izoterma de adsorbtie.
S-au stabilit numeroase ecuatii pentru izotermele de adsorbtie atat pe cale teoretica cat si empiric. Dintre izotermele teoretice cea mai importanta si relativ simpla este izoterma Langmuir, care se bazeaza pe trei ipoteze:
adsorbtia nu se mai produce dupa acoperirea cu un strat monomolecular;
toate pozitiile sunt echivalente energetic si suprafata este uniforma;
capacitatea unei molecule de a adsorbi o pozitie este independenta de ocuparea pozitiilor invecinate.
Echilibrul dinamic este:
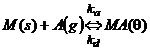
avand constantele ka pentru adsorbtie si kd pentru desorbtie.
Viteza de variatie a acoperirii suprafetei datorita adsorbtiei este proportionala cu presiunea partiala p a lui A si cu numarul de pozitii vacante, care este proportional cu (1- θ):
![]() .
.
Viteza de variatie a lui θ datorita desorbtiei este proportionala cu numarul de specii adsorbite, care este proportional cu gradul de acoperire θ:
![]() .
.
La
echilibru viteza neta de adsorbtie este zero iar rezolvarea cu
explicitarea expresiei lui ![]() da izoterma
Langmuir:
da izoterma
Langmuir:
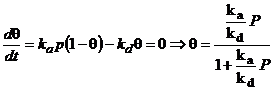 .
.
Notand
![]() , avem
, avem
(A.4) ![]() . Din (A3)
rezulta :
. Din (A3)
rezulta :
(A.4') ![]() .
.
Reprezentare grafica:
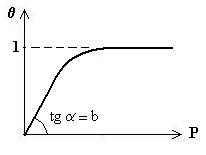
La valori mici ale lui p: ![]() , dependenta liniara de panta b.
, dependenta liniara de panta b.
La valori mari pentru p: ![]() .
.
Alte izoterme
Izoterma Brunauer-Emett-Teller (BET) admite ca adsorbtia se face in straturi polimoleculare. Pe suprafata exista zone libere (θ0), acoperite cu un strat (θ1), acoperit cu doua straturi (θ2) etc.
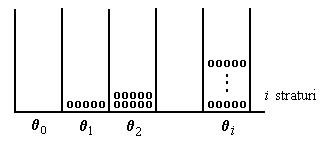
(A.5) ![]() ,
,
cu ![]() - adsorbtie monostrat pe solid;
- adsorbtie monostrat pe solid; ![]() - adsorbtie pe un strat adsorbit.
- adsorbtie pe un strat adsorbit.
Izoterma lui Langmuir pentru amestecuri de gaze:
![]()
![]()
![]() ;
;
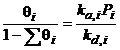
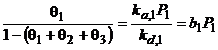
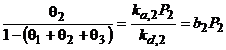
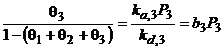
![]()
![]() (A.6)
(A.6)
Ecuatia (A.4) se mai poate scrie si sub forma :
![]() . Rezulta:
. Rezulta:
(A.7) ![]() Izotropa Langmuir
Siskovski.
Izotropa Langmuir
Siskovski.
Adsorbtia din solutii pe adsorbanti solizi
Exista mai multe ecuatii:
(A.8) ![]() ,
, ![]()
(A. 8') ![]() , CA
- concentratia substantei care se adsoarbe.
, CA
- concentratia substantei care se adsoarbe.
![]() ;
; ![]() .
.
Acest tip de adsorbtie (pe adsorbanti solizi) este mai complicat datorita adsorbtiei suplimentare a solventului si datorita interactiunii solvent-solvent.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2183
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved