| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Soarele constituie sursa naturala de lumina si de caldura radiata catre suprafata Pamantului, prin care genereaza conditiile necesare existentei vietii biologice. Sursele luminoase artificiale sunt de regula corpuri solide sau gazoase incandescente excitate pentru emisie de radiatie. Faptul experimental constatat ca radiatia receptionata de la diferite surse de lumina, inclusiv de la Galaxii din Univers are aceeasi compozitie spectrala, argumenteaza ca Universul este format din aceleasi elemente chimice ca si Pamantul nostru.
Sa vedem care este originea emisiei de lumina?
In
conceptia teoriei cuantice a atomilor, chiar in formularea ei initiala data de
fizicianul danez N. Bohr (1916)
pentru atomul de hidrogen, in centrul atomilor se afla nucleul atomic de masa M si de sarcina +Ze, iar in jurul acestuia graviteaza electroni de masa m si de sarcina negativa -e. Conform teoriei electrodinamice
clasice, miscarea stationara accelerata a electronului este guvernata de echilibrul
fortelor ![]() electrostatice
care actioneza drept forta centripeta
electrostatice
care actioneza drept forta centripeta ![]() (fig. 1):
(fig. 1):
![]()
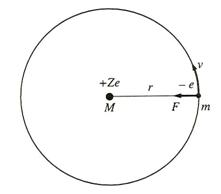
Fig.1. Orbita stationara a electronului in atomul de hidrogen dupa modelul clasic a lui
Bohr (1916)
Conform presupunerii lui Bohr sunt posibile pentru miscarea electronilor numai acele orbite circulare pentru care momentul impulsului electronului ![]() este egal cu un numar intreg al cantitatii
elementare
este egal cu un numar intreg al cantitatii
elementare ![]() ,
numita "cuanta de actiune":
,
numita "cuanta de actiune":
![]()
Aceasta afirmatie se traduce prin faptul ca, electronii pot avea doar orbite cuantificate cu raza:
![]()
respectiv viteze cuantificate exprimate prin relatia:
![]()
unde constantele au
urmatoarele valori: ![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Ipoteza lui Bohr referitoare la emisia luminii postuleaza tranzitia intre starile energetice cuantificate si identifica energia cuantei numita energia "fotonului" cu diferenta energiilor corespunzatoare orbitelor cuantificate
![]()
Pentru atomul de hidrogen in urma evaluarii calculelor prin inlocuirea constantelor mentionate, obtinem urmatoarea expresie pentru frecventa radiatiei electromagnetice:
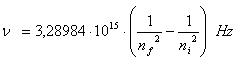
unde numerele intregi ![]() si
si ![]() reprezinta numerele
cuantice ale orbitelor intre care are loc tranzitia electronului.
reprezinta numerele
cuantice ale orbitelor intre care are loc tranzitia electronului.
Experientele de observare a spectrului atomului de hidrogen studiata de catre T. Lyman a confirmat corectitudinea ipotezelor lui Bohr, conform schemei de pe figura 2. (vezi si fotografia spectrului seriei Lyman respectiv seriei Balmer al atomului de hidrogen, emis la tranzitia electronilor de pe nivele energetice superioare pe primele doua nivele energetice inferioare).
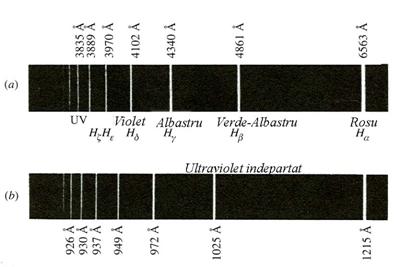
Fig. 2 Prezentarea primelor doua serii spectrale din spectrul atomului de hidrogen
corespunzatoare seriei a) Balmer si b). Lyman
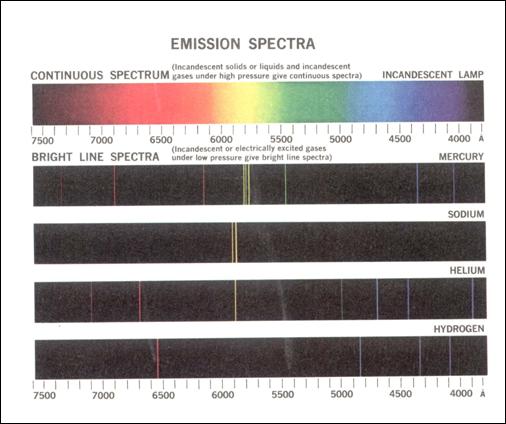
Spectrele optice de emisie ale diferitelor surse de radiatie sunt prezentate pe figura 3.
Energia totala a electronilor pe orbite Bohr este suma energiei potentiale electrostatice si a energiei cinetice:
![]()
in care figureaza doar
constantele atomice ale atomului de hidrogen, respectiv numarul intreg n numit numar cuantic principal. Constantele grupate sub termenul ![]() ,
permite sa scriem pentru energia electronului expresia cuantificarii energiei
,
permite sa scriem pentru energia electronului expresia cuantificarii energiei ![]() .
.
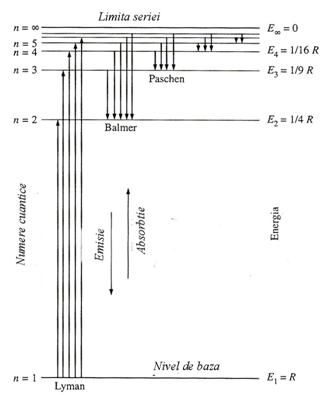
Reprezentarea
nivelelor energetice ale atomului de hidrogen (fig. 4) dupa ecuatia
cuantificarii prin linii distantate pe scara energiilor stationare,
simbolizeaza posibilitatea emisiei sau
absorptiei energiei fotonilor la tranzitia electronilor intre nivelele
energetice respective: 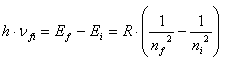
spectrale caracteristice
Modelul paturilor electronice a fost ulterior dezvoltat si extins pentru atomii cu mai multi electroni, in conformitate cu principiul de excluziune a lui W. Pauli, pentru care 2n2 este numarul electronilor maximi pe o patura electronica. Dezvoltarea modelului atomic initial a fost realizata de catre fizicianul german Sommerfeld prin presupunerea orbitelor eliptice cuantificate ale electronilor. Orbitele apartinand unei stari energetice En caracterizate printr-un numar cuantic principal n sunt distinse prin numarul cuantic secundar l, cu n valori diferite pentru fiecare valoare data a numarului cuantic principal n. Exemplu, pentru n=4 avem l=0 (numita starea s), l=1 (starea p), 1=2 (starea d), l=3 (starea f), patru subpaturi electronice cu aceeasi energie En, respectiv patru orbite electronice din care trei eliptice (l=1,2 si 3) si una circulara corespunzatoare pentru l=0. Astfel, in modelul Bohr-Sommerfeld electronii vor ocupa subpaturile respective prin completarea la un numar maxim de electroni 2(2l+1) in conformitate cu principiul lui Pauli:
Subpatura (l): 0 1 2 3 4
Denumirea starii s p d f g
Ipoteza
formulata de catre fizicianul francez Louis
de Broglie (1924) privind existenta unei unde asociate (astazi numite unde
de Broglie) particulelor in miscare, numita unda de materie cu lungimea de unda exprimata prin relatia ![]() a fost dovedita experimental pentru
microparticule masice aflate in miscare. Unda de materie poate fi asimilata cu
o unda stationara in temeiul faptului ca circumferinta orbitelor electronice
stationare cuprinde aceasta lungime de unda intr-un numar intreg de ori.
a fost dovedita experimental pentru
microparticule masice aflate in miscare. Unda de materie poate fi asimilata cu
o unda stationara in temeiul faptului ca circumferinta orbitelor electronice
stationare cuprinde aceasta lungime de unda intr-un numar intreg de ori.
Mecanica matriciala dezvoltata de catre fizicianul W. Heisenberg (1925) si mecanica ondulatorie dezvoltata de catre Schr dinger (1926) au condus la extinderea conceptiei orbitelor stationare ale atomilor cu imaginea undelor stationare de Broglie. Solutionarea ecuatiei de unda a lui Schr dinger furnizeaza valorile starilor energetice, care concorda cu valorile obtinute dupa teoria lui Bohr. Numerele cuantice n si l sunt solutii naturale ale ecuatiei undelor:
![]()
unde energia potentiala V si energia totala W constituie functii proprii,
avind valori proprii ale functiei de unda electronice ![]() cu semnificatie de unda de probabilitate.
cu semnificatie de unda de probabilitate.
Ecuatia de unda a lui Schr dinger putem interpreta prin amplitudinea undei electronice, care este expresia densitatii de probabilitate pentru existenta electronilor din vecinatatea nucleului atomic. Starile electronice ale atomului de hidrogen pot fi interpretate prin solutiile ecuatiei Schr dinger pentru functia de unda. Solutionarea problemei atomilor mai multi electroni a necesitat un aparataj de calcul performant, care a devenit posibil doar prin dezvoltarea tehnicii de calcul.
Emisia si absorptia radiatiei
electromagnetice rezonante demonstreaza natura cuantica a
procesului, pe care putem exemplifica in cazul atomilor de sodiu. Atomii de
sodiu 11Na aflati in stare excitata emit radiatia
caracteristica cu lungimile de unda ![]() Å si
Å si ![]() Å corespunzatoare tranzitiei intre
starile excitate nivelelor energetice superioare ale dubletului 3 2P catre nivelul fundamental 3 2S.
Daca aceasta radiatie cade pe atomii de sodiu aflati in starea fundamentala se
produce absorptia prin care electronul de valenta al atomului de sodiu va fi
ridicat pe nivelul energetic 3 2P.
Å corespunzatoare tranzitiei intre
starile excitate nivelelor energetice superioare ale dubletului 3 2P catre nivelul fundamental 3 2S.
Daca aceasta radiatie cade pe atomii de sodiu aflati in starea fundamentala se
produce absorptia prin care electronul de valenta al atomului de sodiu va fi
ridicat pe nivelul energetic 3 2P.
Starile excitate ale atomilor dupa un timp de cca. 10-8 secunde vor elibera
energia lor prin emisia fotonilor in conformitate cu regulile de selectie, care
guverneaza tranzitiile posibile si emisia liniilor spectrale in cazul atomilor
monovalenti pentru ![]() si
si ![]() .
.
La temperaturi reduse atomii ocupa stari energetice inferioare, iar cu cresterea temperaturii creste populatia atomilor aflati in stari energetice superioare. La temperaturi constante se stabileste un echilibru dinamic intre numarul atomilor ce se excita termic pentru un nivelul energetic dat, respectiv numarul atomilor care se dezexcita din starea data catre starile energetice inferioare.
In
situatia in care atomii poseda stari
energetice metastabile este posibil ca populatia electronica pe starile
energetice metastabile sa depaseasca cu multe ordine de marime numarul
electronilor din alte stari energetice excitate. Inversarea de populatie prin absorbtia fotonilor avand energie ![]() mai mare decat diferenta de energie intre
starea fundamentala si energia starii metastabile a atomilor realizeaza un
efect de pompaj optic, respectiv prin
dezexcitarea stimulata putem genera efecte
cuantice amplificate pentru eliberarea de radiatii electromagnetice coerente amplificate, valorificate in
efectul laser.
mai mare decat diferenta de energie intre
starea fundamentala si energia starii metastabile a atomilor realizeaza un
efect de pompaj optic, respectiv prin
dezexcitarea stimulata putem genera efecte
cuantice amplificate pentru eliberarea de radiatii electromagnetice coerente amplificate, valorificate in
efectul laser.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2216
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved