| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Sa recapitulam.
|
|
Prima transformare simpla a gazului ideal pe care am invatat-o a fost transformarea izoterma. Ea este caracterizata de: n = const T = const. Legea transformarii izoterme este:
|
|
|
Salut! Sunteti cumva doctor? Nu stiti de ce sufar? De transformare izobara? Ce e asta? Transformarea izobara este caracterizata de: n = const p = const. iar legea ei este:
|
|
|
Ati spus ca sunteti doctor? Sufar de transformarea izocora? Asta ce mai este? Transformarea izocora este caracterizata de: n = const V = const. Legea transformarii izocore este:
|
|
|
Transformarea adiabata am invatat-o ultima. Ea este caracterizata de: n = const Q = 0. Legea transformarii adiabate este data de Poisson: pVg = const, unde |
Ei bine, aceste transformari fac parte din aceeasi familie .

Transformarea politropa este transformarea
gazului ideal in care coeficientii calorici raman constanti:
n = const
C = const.
. iar legea in "familie" este data de:
pVn = const. (#1),
unde ![]() (*) este exponentul politropic.
(*) este exponentul politropic.
Folosind ecuatia de stare a gazului ideal ![]()
si (#1), putem obtine alte doua forme ale ecuatiei politrope:
TVn-1 = const. (#2)
P1-nTn = const. (#3)
Variatia energiei interne![]() , caldura
, caldura![]() si lucrul
mecanic
si lucrul
mecanic![]() in
transformarea politropa
in
transformarea politropa
Deoarece energia interna este o marime de stare, ea nu depinde de transformarea efectuata si deci avem:
DU = nCVDT (#4),
deoarece in transformarea izocora L = 0 si
din principiul I al termodinamicii Q = L + DU si definitia caldurii molare la volum constant ![]() rezulta (#4).
rezulta (#4).
Din definitia caldurii molare![]() si (*)
deducem:
si (*)
deducem:
![]() (#5)
(#5)
![]() (#6),
(#6),
iar din (#4, #6) si principiul I al termodinamicii:
![]() (#7)
(#7)
Exemplificare pe membrii cunoscuti ai familiei
Transformarea izoterma
Din definitia caldurii molare ![]() cu
conditiile DT = 0 si
cu
conditiile DT = 0 si ![]() rezulta: C = ∞. Deci
rezulta: C = ∞. Deci ![]() (*); pV = const (#1); T = const (#2, #3);
(*); pV = const (#1); T = const (#2, #3);
DU = 0 (#4); Q si L fiind nedeterminate (in
#6, #7 intervine nedeterminarea ![]() ).
).
Transformarea izobara
Evident caldura molara in acest caz este C = Cp, iar din (*) rezulta: n = 0.
Din (#1, #3) p = const.; (#2) ![]() ;
;
(#6) Q = nCpDT; (#7 + ecuatia termica de stare)
L = nRDT = pDV.
Transformarea izocora
Caldura molara este C = CV si din (*) rezulta ca n = -¥. Din (#1, respectiv #2) avem:
![]() ; Din (#3) rezulta :
; Din (#3) rezulta :
![]() (#6) Q = nCVDT, iar din (#7) L = 0.
(#6) Q = nCVDT, iar din (#7) L = 0.
Transformarea adiabata
In acest caz avem C = 0 ceea ce conduce la: ![]() si de aici: (#1)
si de aici: (#1)![]() - legea
lui Poisson; (#2)
- legea
lui Poisson; (#2) ![]() ;
;
(#3) 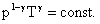 ;
;
(#6)![]() ; (#7 +
relatia lui Robert Mayer Cp = CV + R)
; (#7 +
relatia lui Robert Mayer Cp = CV + R)
![]()
Exemple de probleme
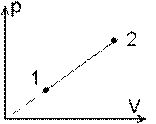
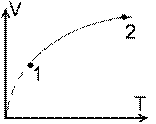
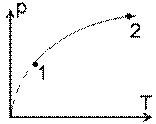
1. O masa m de gaz perfect cu masa molara μ sufera un proces descris de legea T ~ p2, de la T1 la T2. Aflati lucrul mecanic efectuat de gaz si caldura molara in aceasta transformare. Reprezentati procesul in diagramele p-V, V-T, p-T. (probl.2.2.45/pag.33 - A. Hristev, Probleme de Fizica **, 1992)
Rezolvare
T ~ p2 → p2 T-1 = const. → n = - 1 → (#7) L = ν R ( T2 - T1 ) / 2; ν =m / μ si (#5) C = ( CP + CV ) / 2. Din (#1) si (#2) avem pV-1 = const., TV-2 = const. sau p ~ V si T ~ V2. Deci:
2. Sa se determine caldura molara a unui gaz ideal in timpul procesului pentru care p2V = const. Se cunoaste caldura molara a gazului respectiv la volum constant (CV). (Tabara nationala de fizica - Pitesti - 1988)
Rezolvare
In acest caz din ecuatia data si (#1) deducem ca
n = ½. Cu aceasta, cu (*) si cu relatia lui Robert Mayer gasim: C = CV+2R.
3. Sa se determine semnul caldurii molare in transformarea politropa AD, stiind ca: AB - transformare izoterma, AC - transformare adiabatica, BC - transformare izobara. (Tabara nationala de fizica - Sinaia - 1986)
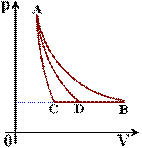
Legile celor trei transformari sunt:
AB: pAVA = pBVB (1)
AC: pAVγA = pCVγC (2)
AD: pAVnA = pDVnD (3)
Pentru transformarea BDC avem pB = pD = pC (4)
Din (3), (1) si (4) avem
![]()
iar din (3), (2) si (4) avem
![]()
Din (#5), (5) si (6) rezulta ca C < 0. In aceasta transformare (AD) gazul care se destinde produce un lucru mecanic mai mare decat caldura primita, energia sa interna micsorandu-se (∆T < 0). In plus avem o "curiozitate": desi sistemul primeste caldura, temperatura lui scade!
Deducerea ecuatiei politrope
Din primul principiu al termodinamicii Q = DU + L si din definitia caldurii molare![]() rezulta:
rezulta:
nCDT = L + DU (1)
Avand o transformare infinitezimala, adica parametri de stare variaza foarte putin, putem scrie: L = pDV si impreuna cu (#4) obtinem:
nCDT = pDV + nCVDT (2)
In cele ce urmeaza vrem sa scriem ecuatia (2) in functie de doar doi parametri de stare. Pentru aceasta ne folosim de ecuatia de stare, pe care o scriem starea initiala si in starea finala si apoi le scadem:
pV = νRT → ∆p V + p ∆V = νR∆T (3)
Din (2) si (3) si relatia lui Robert Mayer (CP = R + CV) rezulta:
( C - CV ) ∆p V = ( CP - C ) p ∆V →
( C - CP ) / ( C - CV ) p ∆V + ∆p V = 0 (4)
Cu notatia (*) rezulta: n p ∆V + ∆p V = 0. Aceasta ecuatie se imparte cu "pV":
n ∆V / V + ∆p / p = 0 → n
∑∆V / V + ∑∆p / p = 0 ![]() n ln( Vf / Vi ) + ln( pf
/ pi ) = 0 → n
lnVf + ln pf = n lnVi + ln pi
→ n lnV + ln p = const. → pVn = const. (q.e.d.)
n ln( Vf / Vi ) + ln( pf
/ pi ) = 0 → n
lnVf + ln pf = n lnVi + ln pi
→ n lnV + ln p = const. → pVn = const. (q.e.d.)
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2793
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved