| CATEGORII DOCUMENTE |
| Bulgara | Ceha slovaca | Croata | Engleza | Estona | Finlandeza | Franceza |
| Germana | Italiana | Letona | Lituaniana | Maghiara | Olandeza | Poloneza |
| Sarba | Slovena | Spaniola | Suedeza | Turca | Ucraineana |
DOCUMENTE SIMILARE |
|
ALIFATINIAI IR AROMATINIAI ANGLIAVANDENILIAI
Alkanų struktūra ir savybės
Fizikinės savybės
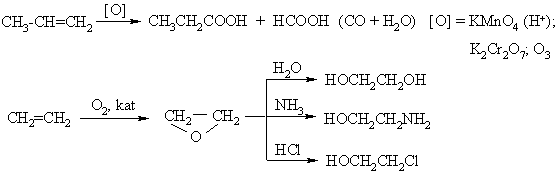
Angliavandeniliai, kuriems būdinga linijinė C atomų grandinė ir s ryiai tarp atomų, vadinami sočiaisiais angliavandeniliais, pagal sisteminź nomenklatūr¹ alkanais.
Alkanų molekulės nepolinės, kadangi jas sudaro nepoliniai C-C ir C-H ryiai. Tarp alkanų molekulių s¹veika nedidelė. C1-C4 dujos, C5-C17 skysčiai, C18 - - kietos mediagos. Alkanai yra lengvesni u H2O ir nesimaio su juo. Tarp alkanų ir H2O molekulių vyrauja atostūmio jėgos hidrofobinė tarpmolekulinė s¹veika, kuri yra alkanų ir H2O isisluoksniavimo prieastis. Alkanų C atomų grandinės yra gyvosios materijos hidrofobinių savybių neėjos.
Nedidelių matmenų alkanų molekulės (iki C8)
gali įsiterpti į vandens asociatų ertmes ir
Cheminės savybės
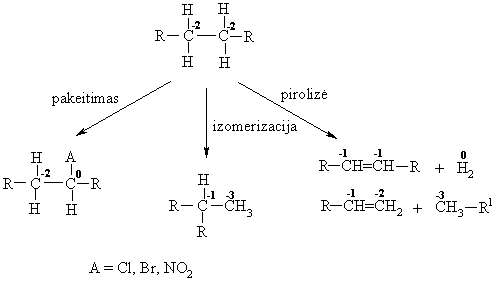
Schemoje pateiktos reakcijos yra oksidacijos redukcijos reakcijos, kadangi kinta C atomų oksidacijos laipsnis
Radikalinės pakeitimo reakcijos (SR)

Alkanų nitrinimas

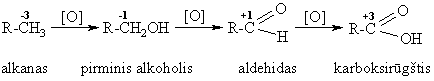
![]()
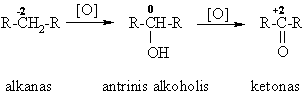
Biologinis alkanų oksidavimas
Heterolizinis oksidavimas (mitochondrijose)
alkanų dehidrogenazinis oksidavimas
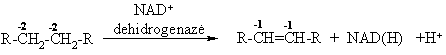
monooksigenazinis oksidavimas (hidroksilinimas)
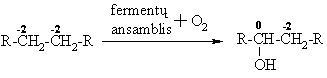
i reakcija yra organinio svetimkūnio, turinčio alkilų radikalų, paalinimo i organizmo pirmoji stadija(didina jo hidrofilikum¹).
Homolizinis (laisvaradikalinis) oksidavimas
Pagrindinis radikalų altinis organizme yra molekulinis O2. Dalinai redukuojant deguonį susidaro įvairios aktyviosios (toksinės) jo formos:
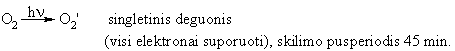


![]()
Esant radiaciniam poveikiui, aktyviosios deguonies formos organizme susidaro ir i H2O:
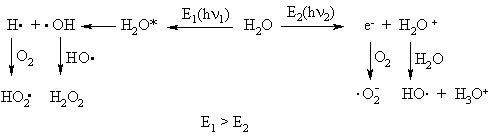
Be to, deguonies radikalai gali susidaryti i metaloproteinų ir deguonies:
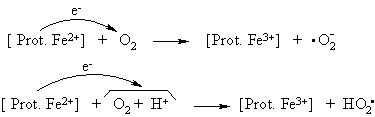

Normalaus intensyvumo laisvaradikalinis oksidavimas yra būtinas metabolizmui.
Kai radikalų susidarymo greitis ir jų koncentracija l¹stelėje virija tam tikr¹ rib¹, laisvaradikalinį oksidavim¹ lėtina organizmo daugiakomponentė antioksidacinė buferinė sistema, kuri radikalus paverčia maai aktyviais junginiais (nutraukiama grandininė reakcija).
ias funkcijas atlieka:
antioksidatoriniai ir antiperoksidiniai fermentai: superoksiddismutazė, katalazė, gliutationperoksidazė;
antioksidatoriai pasiymintys redukcinėmis savybėmis organiniai junginiai: įvairūs tioliai (glutationas, cisteinas, dihidrolipo rūgtis), askorbo rūgtis (vitaminas C), b-karotinas, vitaminai E (tokoferolis), K, P ir steroidiniai hormonai.
Antioksidacinė sistemos buferinė talpa ribota. Perengus kritinź rib¹ atsiranda oksidacinis stresas.
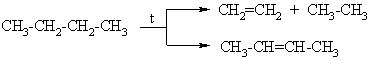
Alkanų izomerizacija
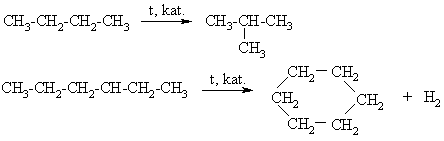
2.2. Cikloalkanų cheminių savybių ypatumai
Cikloalkanams kaip ir alkanams būdinga SR. Maieji cikloalkanai (ciklopropanas ir ciklobutanas) dėl kampų įtampos dar dalyvauja ir AR.
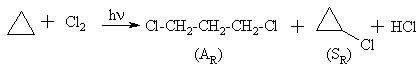
Alkanų ir cikloalkanų taikymas medicinoje:
maos molekulinės masės alkanai taikomi vietinėje anestezijoje;
ciklopropanas bendroje narkozėje;
tirpikliai gamtinių mediagų (riebalų ir eterinių aliejų) ekstrakcijoje;
vazelino pagrindu ruoiami ioriniam naudojimui vaistai (alkanai gerai tirpsta riebaluose ir lengvai difunduoja per od¹).
2.3. Alkenų struktūra ir savybės
Alkenams būdingas dvigubasis ryys tarp anglies atomų.
Alkenai turi daugiau struktūrinių izomerų, negu to paties anglies atomų skaičiaus alkanai, nes jų kiekį lemia ne tik anglies atomų grandinės akotumas, bet ir dvigubojo ryio padėtis joje. Be to, alkenams būdinga ir stereoizomerija (p-diastereomerija).
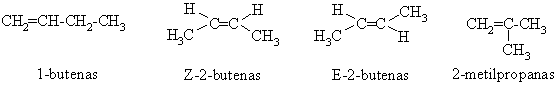
Alkenų fizikinės savybės, įskaitant ir hidrofilikum¹, panaios į alkanų. Maos molekulinės masės alkenai gyvame organizme sukelia narkotinį efekt¹.
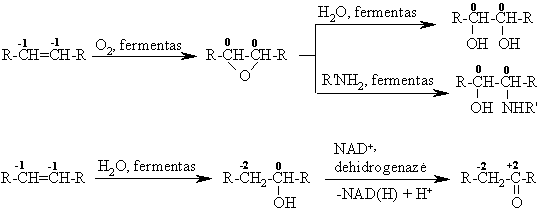
Jungimosi reakcijos

Alkenų cheminį aktyvum¹ lemia dvigubasis ryys, kuris pasiymi elektronų donorinėmis savybėmis ir yra lengvai poliarizuojamas. Be to, jis daro įtak¹ alilo padėties C-H ryių aktyvumui. Kadangi C=C ryys yra nukleofilinis, jis dalyvauja elektrofilinio (AE) ir radikalinio (AR) prijungimo reakcijose. Alilo padėties C-H ryys lengvai homolizikai disocijuoja, todėl jis dalyvauja radikalinio pakeitimo (SR) reakcijose.
Alkenų elektrofilinio jungimosi reakcijos (AE)
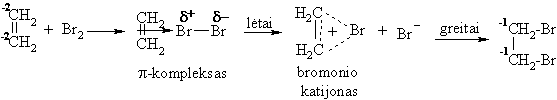
Hidrinimas
![]()
Hidrohalogeninimas
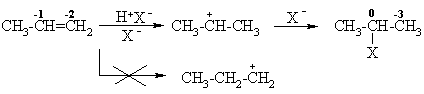
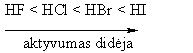
Hidratavimas

Tokia reakcija yra viena i organizme vykstančio riebalų rūgčių b-oksidavimo stadijų.
Alkenų radikalinio jungimosi reakcijos (AR)
Hidrobrominimas
![]()

itas pavyzdys rodo, kad biocheminė jungimosi prie dvigubojo ryi reakcija gali vykti kita linkme, jei dėl radiacinio vitinimo arba laisvaradikalinio oksidavimo organizme atsirastų laisvųjų radikalų.

Alkenų polimerizacija gali vykti pagal joninį (elektrofilinį-nukleofilinį) bei laisvaradikalinį mechanizm¹.
Laisvaradikalinis oksidavimas

Jei
oksiduojama atmosferos oro deguonimi autooksidacija.
2.4. Konjuguotų dienų struktūra ir savybės
Jungimosi reakcijos
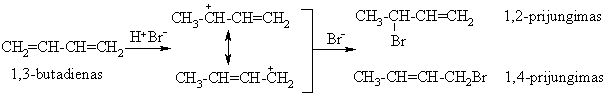
Polimerizacija
Polimerizacija gali vykti pagal joninį arba laisvaradikalinį mechanizm¹.

(C5H8)2n terpenai, izopreno (C5H8) di-, tetra- arba heksamerizacijos produktai.
Terpenai būna neciklinės ir ciklinės (di-, tri- ir policiklinės) struktūros.
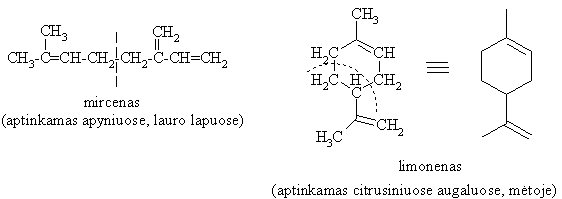
Terpenai aptinkami augaluose, spygliuočių dervoje, kaučiukinių augalų sultyse.
Terpentinas terpenų miinys.
Terpenoidai terpenų dariniai, turintys OH, -CHO, =C O funkcines grupes.
Terpenų grupuotės (izoprenoidinės grandinės) įeina į sudėtingų biologikai aktyvių junginių (vitamino A, abieto rūgties, skvaleno, karotinoidų) sudėtį.
2.5.Aromatiniai angliavandeniliai (arenai)
Turtingi anglimi cikliniai angliavandeniliai su būdinga jiems cikloheksatrieno ryių sistema ir pasiymintys ypatingomis fizikinėmis bei cheminėmis savybėmis vadinami arenais (aromatiniais angliavandeniliais).
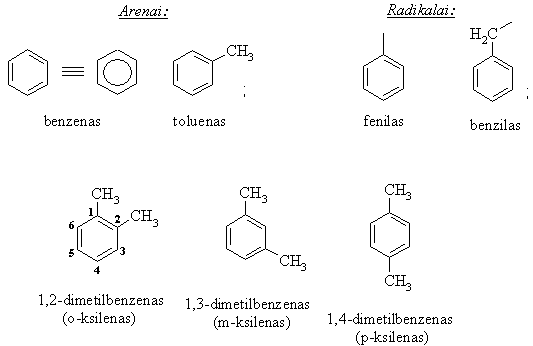
Benzeno iedas - p elektronų donoras, todėl reaguoja su elektrofilais. Benzeno p elektronų sistema sunkiai poliarizuojasi bei blogai poliarizuoja reagent¹, todėl aktyvinti reagent¹ danai naudojami katalizatoriai.
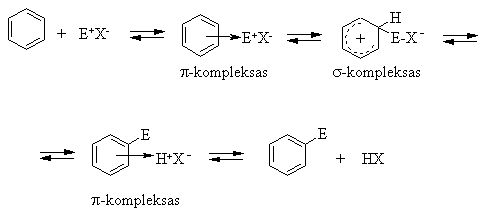
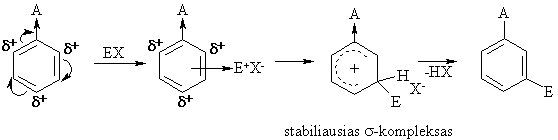
Elektrofilinės pakeitimo reakcijos (SE)
Bendrasis mechanizmas:
Pakaitų įtaka
Pakaitų elektroniniai efektai veikia elektronų tankio pasiskirstym¹ nereaguojančioje substrato molekulėje (statinis faktorius), taip pat elektronų tankio pasiskirstym¹ junginyje reakcijos metu, t.y. susidarančių tarpinių kompleksų stabilum¹ (dinaminis faktorius). Reakcijai daug didesnź reikmź turi dinaminis faktorius.
Aromatinio iedo elektronų donoriniai pakaitai reakcij¹ greitina, o elektronų akceptoriniai lėtina.
Benzeno iede elektronų donoriniai pakaitai nukreipia nauj¹ pakait¹ į orto- ir parapadėtis (pirmos eilės pakaitai), o elektronų akceptoriniai į metapadėtį (antros eilės pakaitai).
Pirmos eilės pakaitai (elektronų donorai, o- ir p-orientantai):
![]()

Pavyzdiai:
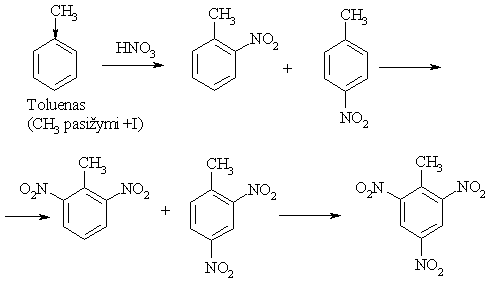
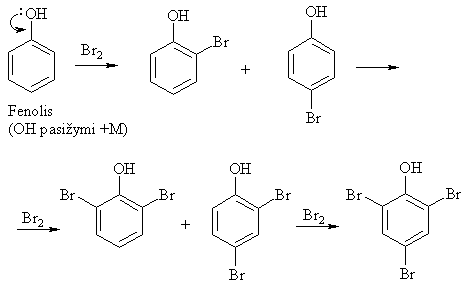
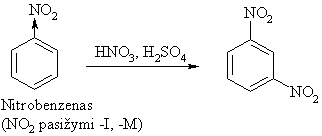
Antros eilės pakaitai (elektronų akceptoriai, m-orientantai):
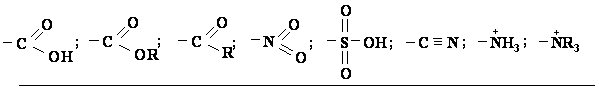
Pavyzdiai:
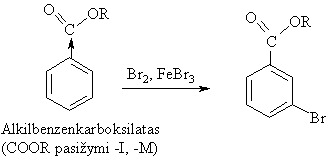
Radikalinės jungimosi reakcijos (AR)
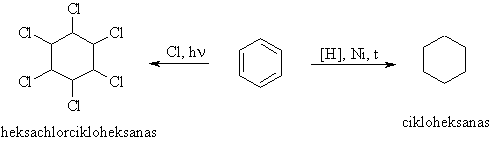
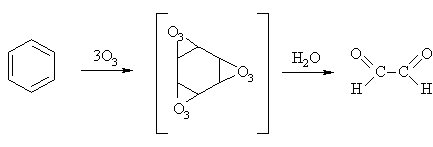
Benzeno homologams būdingos SE ir SR reakcijos.

Organizme biocheminių reakcijų mechanizmas gali kisti dėl UV spinduliavimo, radiacijos arba perteklinio laisvaradikalinio oksidavimo.
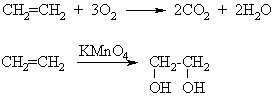
Oksidavimas deguonimi, biologinis oksidavimas
Benzenas, skirtingai negu artimiausi homologai (toluenas, ksilenas), be galo atsparus ne tik cheminiam, bet ir biologiniam oksidavimui. Dėl tos prieasties jis kaupiasi organizme, yra kumuliacinis nuodas ir labai toksikas, ypač moterims.
Cheminio ir biologinio oksidavimo reakcijose dalyvauja su benzeno iedu susijungź anglies atomai.
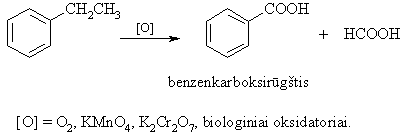
i benzeno homologų savybė apsprendia ma¹ jų toksikum¹.
Kondensuotų arenų (naftaleno, benzpireno) cheminių savybių ypatumai
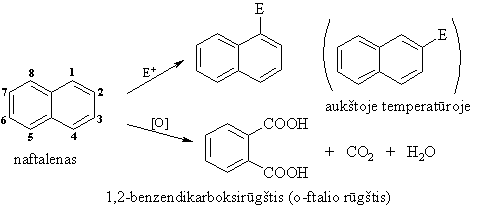
Gebėjimu lengvai oksiduotis aikinamas benzpireno kancerogenikumas.
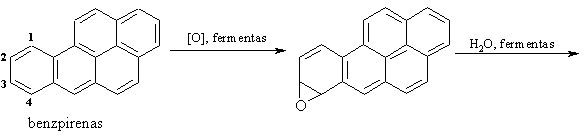
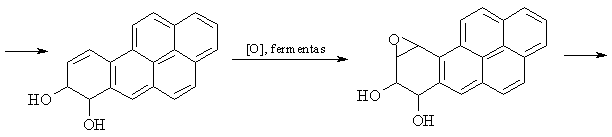
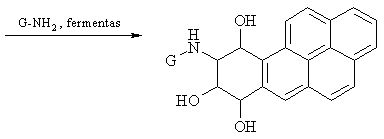
Benzpireno oksidacijos produktai, reaguodami su DNR esančio guanino aminogrupe (G-NH2), padaro DNR molekulėje negrįtamus pokyčius, skatinančius vėinių l¹stelių susidarym¹.
Imokź į skyrių turite inoti:
alkanų, alkenų ir arenų struktūr¹, izomerij¹, nomenklatūr¹ bei jiems būdingus cheminius ryius;
alkanų ir alkenų fizikines bei chemines savybes, jų biologinio oksidavimo ypatumus;
konjuguotų alkadienų struktūr¹ ir cheminių savybių ypatumus, mokėti apibūdinti terpenus;
arenų chemines savybes, pakaitų orientuojam¹jį poveikį ir arenų biologinio oksidavimo ypatumus.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 5014
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved