| CATEGORII DOCUMENTE |
| Alimentatie nutritie | Asistenta sociala | Cosmetica frumusete | Logopedie | Retete culinare | Sport |
CONTROLUL PURITATII SUBSTANTELOR MEDICAMENTOASE
Verificarea puritatii este una dintre cele mai importante probe prin care se apreciaza calitatea unei substante medicamentoase si dependent de aceasta se decide valabilitatea utilizarii sale pentru elaborarea de medicamente.
Calitatea substantei medicamentoase trebuie sa corespunda gradului de puritate pe care-l reclama administrarea sa in terapeutica.
In stabilirea exigentelor fata de calitatea unei substante medicamentoase se iau in vedere urmatoarele criterii:
Natura impuritatii
Toxicitatea sa
Actiunea farmacodinamica intrinseca
Gradul de influentare a conservabilitatii substantei medicamentoase
Interferenta cu alte substante in cadrul asocierilor
Impuritatile care se prevad pentru control sunt impuritatile provenite din procesul tehnologic de fabricatie (materii prime neintrate in reactie, produsi secundari ai reactiei, poluanti ai reactivilor utilizati, impuritati cedate de mantaua reactoarelor) sau degradarile ulterioare sub actiunea factorilor de mediu.
Etapele controlului de puritate
1. Prepararea solutiei de analizat (solutia A si B)
Controlul puritatii, dependent de natura reactiei de identificare a impuritatilor se efectueaza in solutie sau direct pe substanta ca atare.
Intrucat majoritatea reactiilor de control a impuritatilor decurg in solutie, se acorda o importanta deosebita prepararii solutiei de analizat (aducerea impuritatilor in solutie).
In cazul in care mai multe reactii de control decurg in solutie si in aceleasi conditii, FRX prevede prepararea unei solutii de analizat denumita solutia A.
Daca in cadrul reactiilor de control se disting doua grupuri de impuritati, care se deceleaza in conditii diferite, se prevede prepararea a doua tipuri de solutii de analizat (A si B), care difera intre ele prin natura solventului, concentratie sau pH.
Procedee de preparare
Procedeele aplicate pentru prepararea solutiilor de analizat A sau B depind de:
- solubilitatea substantei de controlat
- solubilitatea impuritatilor
- interferentele substantei de controlat in cadrul reactiei de control
Se disting urmatoarele cazuri:
a) Substanta medicamentoasa este foarte usor solubila (1:1), usor solubila (1:10) , solubila (1:10- 1:30), putin solubila in apa (1:30- 1:100) si nu deranjeaza reactiile de control, iar impuritatile sunt solubile in apa.
Solutia se prepara prin dizolvarea substantei medicamentoase de controlat in apa la rece sau la cald. Solutia se filtreaza dupa racire numai in cazul solutiilor saturate ale substantelor putin solubile care se dizolva prin fierbere.
Reactiile de control ale impuritatilor dizolvate in solutie se executa in prezenta substantei de controlat.
b) Substanta medicamentoasa este putin solubila in apa, foarte putin solubila (1:100- 1:500), greu solubila (1:500-1:1000), foarte greu solubila (1:1000-1:10000) si practic insolubila in apa (peste 1:10000) si nu deranjeaza reactiile de control in concentratia rezultata, iar impuritatile sunt solubile in apa.
Solutia se prepara prin agitarea substantei de controlat cu apa la rece sau la cald un timp determinat, urmata de filtrare. Solutia de analizat este reprezentata de filtrat in care s-au dizolvat impuritatile si partial substanta de controlat.
c) Substanta medicamentoasa este solubila in apa acidulata cu acid clorhidric, acid azotic sau acid acetic si nu deranjeaza reactiile de control, iar impuritatile sunt solubile in acizi.
Solutia se prepara prin dizolvarea substantei medicamentoase in apa acidulata cu acid clorhidric, acid azotic sau acid acetic. Solutia de analizat, cu reactie acida se utilizeaza numai pentru reactiile de control care nu sunt deranjate de pH si de natura acidului. Astfel, nu se vor controla impuritatile de cloruri intr-o solutie acidulata cu acid clorhidric sau impuritatile de azotat intr-o solutie acidulata cu acid azotic.
d) Substanta medicamentoasa este greu solubila in apa acidulata cu acid clorhidric sau azotic si nu deranjeaza reactiile de control in concentratia respectiva, iar impuritatile sunt solubile in apa, solubile in acizi.
Solutia se prepara prin agitarea substantei medicamentoase cu apa acidulata cu acid clorhidric 10% sau acid azotic 10% la rece sau la cald, urmata de filtrare. Reactiile de control se executa in filtrat.
e) Substanta medicamentoasa este insolubila in apa dar solubila in alcool sau cloroform. Impuritatile se dizolva in alcool sau cloroform. Prezenta substantei medicamentoase nu deranjeaza reactiile de control. Solutia se prepara prin dizolvarea substantei medicamentoase in alcool sau cloroform.
f) Substanta medicamentoasa este practic insolubila in apa si in alcool, dar solubila in alcalii. Impuritatile sunt solubile in alcalii. Substanta medicamentoasa nu deranjeaza reactia de control. Solutia se prepara prin dizolvarea substantei in hidroxid de sodiu 1N.
g) Substanta de controlat deranjeaza reactiile de control prin culoare, actiune oxidanta, reducatoare, complexanta etc. In acest caz se procedeaza la:
- indepartarea cantitativa a substantei de controlat din solutia initiala prin precipitare, urmata de filtrare. Ex: sarurile solubile ale acizilor sau bazelor organice insolubile care deranjeaza reactiile de identificare a impuritatilor. Controlul puritatii se executa in filtrat dupa ce s-a verificat daca s-a indepartat cantitativ substanta de controlat.
- descompunerea cantitativa a substantei de controlat din solutia initiala in compusi gazosi sau substante solide volatile, urmata de evaporare. Reactiile de control se executa pe solutia reziduului de la evaporare.
Acest procedeu se aplica in cazul substantelor: Magnesii peroxydum, Natrii fluoridum, Natrii nitris, Natrii thiosulfas. Principiile pe care se bazeaza descompunerea si tehnica reactiilor vor fi redate in cele ce urmeaza.
Magnesii peroxydum- Solutia A
Principiu Descompunerea substantei cu acid clorhidric
2 MgO2 + 4 HCl = 2 MgCl2 + 2 H2O +O2
Tehnica:
3g de substanta se dizolva in 20ml acid clorhidric (R), se evapora la sicitate pe baia de apa; reziduul se dizolva in 15ml de apa. In solutia reziduului se executa reactiile de control pentru ionii de arsen, fier, metale grele si sulfati.
Natrii nitris- Solutia A
Principiu Descompunerea nitritului de sodiu cu clorura de amoniu si indepartarea nitritului de amoniu volatil prin evaporarea solutiei.
NaNO2 + NH4Cl = NaCl + NH4NO2
Tehnica:
1g substanta se amesteca intr-o capsula de portelan cu 1g clorura de amoniu (R), se adauga 5ml apa si se evapora la sicitate pe baia de apa; se adauga 5ml de apa si se evapora din nou. Reziduul se dizolva in 20ml apa. In solutia reziduului se executa reactiile pentru ionii metalelor grele si sulfati.
Kalii permanganas- Solutia A
Principiu Reducerea si in consecinta decolorarea permanganatului de potasiu cu alcool:
4 KMnO4 + 3 C2H5OH = 4 MnO2 + CH3CHO + KOH + 4 H2O
Tehnica:
0.7g permanganat de potasiu se dizolva in 30ml apa, se adauga 30ml alcool si se incalzeste pana la decolorarea solutiei. Dupa racire se completeaza cu apa la 35ml si se filtreaza. In filtrat se executa controlul impuritatilor de cloruri, ioni ai metalelor grele si sulfati.
2. Aspectul, coloratia si limita de aciditate- alcalinitate a solutiei
Aspectul solutiei, coloratia si pH-ul releva date importante in aprecierea calitatii substantei medicamentoase. Acesti parametri sunt prevazuti de FRX la majoritatea monografiilor substantelor medicamentoase.
Aspectul si coloratia solutiilor
Substantele dizolvate in concentratia si solventii mentionati, pot da dependent de proprietatile substantei de controlat si de puritatea acesteia, solutii limpezi, transparente, opalescente sau tulburi, incolore sau colorate. Pentru aprecierea aspectului si coloratiei solutiei, incadrarii in limitele de tolerabilitate admise de FRX, se recurge la compararea solutiilor de analizat cu solutii etalon de: transparenta, opalescenta, tulbureala si culoare.
Comparatia se face in eprubete incolore si de acelasi diametru, a unor volume egale din solutia de analizat si solutia etalon, privind straturile de lichid prin transparenta pe un fond negru pentru proba de transparenta, opalescenta sau tulbureala si pe un fond alb pentru proba de culoare.
Cand in monografie nu se precizeaza volumele pentru proba de culoare, comparatia se face pe 10ml solutie.
O solutie se considera corespunzatoare daca nu depaseste intensitatea etalonului. Pentru solutiile la care se precizeaza "trebuie sa fie limpede" se foloseste ca si etalon de comparatie un volum egal din dizolvantul folosit.
Pentru solutiile la care se admite sa fie "cel mult transparente" respectiv "opalescente" sau "tulburi", se vor folosi urmatoarele etaloane:
Etalon de transparenta (E.tr.) : 0.01g caolin in 1000ml apa
Etalon de opalescenta (E.o.) : 0.03g caolin in 1000ml apa
Etalon de tulbureala (E. Tb.) : 0.05g caolin in 1000ml apa
Tehnica de preparare: Cantitatea prevazuta de caolin (R) exact cantarita se tritureaza cu 2ml apa intr-un mojar. Amestecul se aduce cantitativ intr-un balon cotat de 1000ml si se completeaza la semn.
Solutiile etalon de transparenta, opalescenta si tulbureala se prepara la nevoie, se agita inainte de intrebuintare si se pot folosi timp de 5-6 ore de la preparare.
Pentru solutiile la care se admite o eventuala coloratie, se folosesc ca etaloane de comparatie, etaloanele de culoare:
- solutie de clorura de cobalt (cobalt-E.c.)
- solutie de clorura de fier (III) (fier-E.c.)
-solutie de sulfat de cupru (cupru-E.c.)
-solutie de dicromat de potasiu (dicromat de potasiu-E.c.)
Acestea se amesteca in proportiile indicate la fiecare proba in monografie.
Limita de aciditate si alcalinitate
In cadrul controlului de puritate expresiile "aciditate", "alcalinitate", "aciditate-alcalinitate" sau "reactia solutiei" sunt intalnite la majoritatea monografiilor de substante medicamentoase. Frecventa lor mare este datorata faptului ca urmarirea parametrilor mentionati este de o importanta deosebita, deoarece prin prezenta unei impuritati care intervine prin modificarea pH-ului pot aparea consecinte nedorite ca:
- reactii de hidroliza, prin care sa fie prejudiciata stabilitatea si/sau actiunea biologica a substantei active (betalactamine, esteri, amide, etc.)
- modificari ale solubilitatii substantelor active, care se pot rasfrange negativ asupra posibilitatilor de conditionare
- incompatibilitati cauzate de pH-ul neadecvat, in conditiile asocierii cu alte substante medicamentoase sau cu adjuvanti.
Verificarea acestor conditii de puritate se executa pe probe limpezi, obtinute in mod obisnuit cu ajutorul solutiilor apoase, preparate in concentratiile prevazute in monografii. In cazul substantelor cu o solubilitate necorespunzatoare in apa, este prevazuta:
- utilizarea suspensiei apoase
- utilizarea unor solventi adecvati, in functie de solubilitatea substantelor respective
- agitarea substantelor cu apa sau alti solventi, urmata de filtrare. Filtratul obtinut serveste la efectuarea determinarii.
Ca metodologie de investigare a parametrilor mentionati, FRX prevede, cel mai adesea, utilizarea solutiilor de indicatori.
Determinarea cu ajutorul solutiilor de indicatori:
Metoda se bazeaza pe verificarea acestor parametri in functie de coloratia unor indicatori adecvati. Indicatorii mai frecvent utilizati in acest scop sunt prezentati in cele ce urmeaza.
Tehnica: Solutia de cercetat se trateaza cu cateva picaturi de solutie indicator, prevazuta in monografie. De la caz la caz se examineaza coloratia obtinuta direct de solutia de analizat si/sau dupa adaugarea in cantitati bine determinate a unor solutii de hidroxid de sodiu, de acid clorhidric sau de acid sulfuric, avand concentratiile prevazute in cadrul fiecarei monografii. Acest din urma caz permite aprecierea limitei de aciditate, alcalinitate, respectiv aciditate-alcalinitate.
Indicatori utilizati pentru verificarea limitelor de aciditate-alcalinitate
Indicator Interval de pH corespunzator virajului
Albastru de bromfenol 3.0- 4.6 galben-- albastru-violet
Albastru de bromtimol 6.0- 7.0 galben-albastru
Albastru de timol 1.2- 2.8 rosu-galben
8.0- 9.6 galben-- albastru
Fenolftaleina 8.2- 10 incolor-rosu
Metiloranj 3.0- 4.4 rosu-galben
Rosu de metil 4.2- 6.2 rosu-galben
Timolftaleina 9.3- 10.5 incolor-- albastru
Controlul impuritatilor
Controlul impuritatilor, dependent de natura substantei si a impuritatilor, de conditiile necesare reactiei aplicate, se efectueaza in solutia de analizat, preparata in prealabil pentru mai multe reactii de control, sau separat, pentru fiecare reactie in parte. Pentru decelarea impuritatilor se utilizeaza reactiile cele mai sensibile si specifice pentru fiecare impuritate.
In aprecierea puritatii se disting doua conditionari si anume:
a) Absenta impuritatii. Reactia de decelare trebuie sa fie negativa. Impuritatile nu se admit decat sub limita de sensibilitate a reactiei de control.
b) Prezenta impuritatii in anumite limite de tolerabilitate. Reactia de decelare este pozitiva. Aprecierea concentratiei, a incadrarii in limita de tolerabilitate admisa, se face prin comparatie cu solutii etalon sau, in unele cazuri, direct prin dozarea impuritatii.
In cazul in care nu se admite prezenta impuritatii, mentionata in monografie prin expresia " nu trebuie sa dea reactia" pentru o anumita impuritate, controlul se executa astfel: solutia de analizat se trateaza cu reactivii indicati in monografie respectand o anumita succesiune. Mai intai se adauga reactivii secundari necesari pentru crearea conditiilor favorabile reactiei. Uneori la adaugarea reactivilor secundari pot aparea unele modificari datorate substantei de analizat sau prezentei altor impuritati. Solutia se imparte in doua parti, iar reactivul principal (care pune in evidenta impuritatea controlata) se adauga numai unei parti. Cele doua probe se compara intre ele; nu trebuie sa se observe nici o diferenta.
Decelarea impuritatilor admise intr-o oarecare limita si aprecierea concentratiei in raport cu limita de tolerabilitate precizata de FRX se efectueaza prin comparatie cu solutii-etalon. Solutiile-etalon contin o anumita cantitate din impuritatea cercetata (0.1- 0.001mg/ml) si servesc ca probe martor. Solutiile-etalon se prepara la nevoie.
La controlul limitelor de tolerabilitate pentru impuritati trebuie respectate urmatoarele conditii generale:
- eprubetele in care se executa reactiile trebuie sa fie incolore si de acelasi diametru;
- volumul probei de control si al solutiei-etalon trebuie sa fie egal; in general se lucreaza pe 10ml;
- reactivii se adauga in acelasi timp, in cantitati egale, atat in solutia de analizat, cat si in solutia-etalon, in ordinea indicata;
- observarea modificarilor care au loc in solutii (proba si etalon) se face privind prin transparenta pe un fond negru (tulbureala, opalescenta) sau pe un fond alb (coloratiile).
Descrierea modului de efectuare a reactiilor pentru evaluarea limitelor de tolerabilitate a impuritatilor nu se prezinta in FRX in cadrul monografiilor, ci numai la capitolul "Controlul limitelor de impuritati". In cadrul monografiei se specifica volumul solutiei de controlat si a solutiei-etalon care se completeaza la 10ml si, in paranteza, continutul solutiei-etalon in mg impuritate. De asemenea, se indica pentru substanta controlata limita de tolerabilitate exprimata in grame, calculata procentual.
Aprecierea rezultatului se exprima in termenii:
- "la limita" cand reactia prezinta intensitati egale cu solutia de controlat si cu solutia-etalon
- "sub limita" cand reactia solutiei de controlat este mai slaba
- "peste limita" cand reactia solutiei de controlat este mai intensa.
Controlul impuritatilor de ioni de aluminiu
Impuritatile de ioni de aluminiu se controleaza la un numar restrans de monografii (3%). In majoritatea cazurilor decelarea are loc, in bloc, alaturi de alte impuritati.
Reactia cu amoniac
Principiu: Ionii de aluminiu formeaza cu amoniac hidroxidul de aluminu, precipitat alb gelatinos, partial solubil in exces mare de reactiv, solubil in acizi minerali si hidroxizi alcalini. Prin fierberea solutiei, pana la disparitia mirosului de amoniac, hidroxidul de aluminiu depune cantitativ:
Al+3 + 3 NH4OH = Al(OH)3 + 3 NH4+
Tehnica Solutia de analizat de concentratia prevazuta in monografie se agita cu 2ml clorura de amoniu (R) si se trateaza cu 2ml amoniac 25% (R); solutia trebuie sa ramana limpede.
Impuritati de ioni de aluminiu, in bloc, alaturi de alti ioni care reactioneaza cu amoniac se prevad de FRX la monografiile: Calcii carbonas (ioni de aluminiu, fier, fosfat si substante insolubile in acid clorhidric, cel mult 0.15%), Calcii chloridum (ioni de aluminiu, fier si fosfati), Natrii hydrogencarbonas (ioni de aluminiu, calciu si substante insolubile cel mult 0.01%), Zinci chloridum si Zinci oxydum ( ioni de aluminiu, fier si cupru).
Ex. 1: Identificarea si determinarea cantitativa a ionilor de aluminiu, fier, fosfati si " substante insolubile in acid clorhidric" in Calcii carbonas
Principiu: Carbonatul de calciu se dizolva in acid clorhidric prin fierbere pana la indepartarea totala a dioxidului de carbon
CaCO3 + 2 HCl = CaCl2 + CO2 + H2O
Impuritatile de aluminiu, fier si fosfati se precipita cu amoniac. Se formeaza hidoxid de aluminiu, hidroxid de fier si fosfat tricalcic.
Este importanta indepartarea dioxidului de carbon deoarece numai in absenta lui, ionii de calciu din solutia de analizat nu precipita cu amoniac carbonatul de calciu, care ar conduce la erori in aprecierea concentratiei impuritatilor.
pH-ul mediului se verifica prin utilizarea indicatorului rosu de metil (4.2-6.2).
Determinarea cantitativa a impuritatilor respective se efectueaza gravimetric prin uscarea si calcinarea precipitatului pana la pondere constanta. Nu se admite decat cel mult 0.15%.
Tehnica: 2g substanta se dizolva in 75ml de apa si 5ml de acid clorhidric (R), se fierbe pana la indepartarea dioxidului de carbon, se alcalinizeaza cu amoniac 10%(R) in prezenta rosului de metil (I), se fierbe din nou 1min si se filtreaza cantitativ. Precipitatul se spala cu o solutie calda 2% de clorura de amoniu (R). Se dizolva precipitatul de pe filtru cu 20ml solutie calda de acid clorhidric 10% (R), se spala filtrul cu apa calda pana se obtin 50ml solutie, se fierbe, se alcalinizeaza cu amoniac 10% (R) in prezenta rosului de metil (I), se fierbe din nou 1min si se filtreaza prin acelasi filtru.
Precipitatul si filtrul se spala cu o solutie calda de azotat de amoniu 2% (R), pana cand apele de spalare nu mai dau reactia pentru ionul clor; se usuca si se calcineaza pana la greutate constanta.
Ex.2: Identificarea ionilor de aluminiu, fier, cupru in Zinci chloridum si Zinci oxydum
Principiu Ionii de aluminiu, fier si cupru precipita cu amoniac hidroxizii respectivi.
Hidroxidul de cupru formeaza, in exces de reactiv, complexul solubil tetraaminocupru (II) de culoare albastra.
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
Ionii de zinc ai substantei de analizat nu deranjeaza reactia deoarece in exces de amoniac formeaza complexul solubil tetraaminozinc (II) incolor.
Zn2+ + 4NH3 = Zn(NH3)42+
Tehnica: 5ml clorura de zinc 10% sau 4ml oxid de zinc 5% (solubilizat in acid acetic 30%) se trateaza cu 3ml amoniac 25%(R) ; solutia trebuie sa fie limpede si incolora. O tulbureala sau un precipitat brun denota prezenta ionilor de fier si eventual de aluminiu. Un precipitat alb indica prezenta ionilor de aluminiu si o coloratie albastra prezenta ionilor de cupru.
Controlul impuritatilor de amoniu
In ciuda toxicitatii reduse, urmarirea impuritatilor de ioni de amoniu este indicata de FRX deoarece pot interfera cu diferite substante medicamentoase cu care se asociaza frecvent, generand o serie de incompatibilitati.
Reactia cu alcalii
Principiu: Sarurile de amoniu in mediu alcalin se descompun cu eliminare de amoniac. Acesta se pune in evidenta prin mirosul caracteristic si/sau prin colorarea in albastru a indicatorului universal de pH.
NH4+ + OH- = NH3 + H2O
Tehnica Cantitatea de substanta sau de solutie A prevazuta in monografie, adusa pe o sticla de ceas sau intr-o capsula de portelan, se trateaza cu 3.5ml hidroxid de sodiu 10% (R). Se acopera cu o palnie. In tija palniei se introduce putina vata, iar la capat hartia indicator umectata cu apa. Se incalzeste pe baia de apa. Nu trebuie sa se perceapa miros de amoniac si hartia indicator nu trebuie sa se coloreze in albastru.
In monografia Natrii sulfas se prevede utilizarea oxidului de calciu in locul alcaliilor.
- 1g de substanta se tritureaza cu 2g oxid de calciu(R), se introduce intr-o eprubeta, se umecteaza cu 5 picaturi de apa si se incalzeste; nu trebuie sa se degaje vapori care albastresc hartia rosie de turnesol sau indicator universal de pH.
In monografiile Kalii iodidum si Natrii iodidum se prevede urmarirea impuritatilor de amoniu cu alcalii, in bloc, alaturi de cele de azotati si azotiti, dupa prealabila reducere a acestora la amoniac.
Reactia Nessler
Principiu: Ionul de amoniu formeaza cu reactivul Nessler (tetraiodomercuriatul de potasiu in mediu alcalin), dependent de concentratie, o coloratie galbena sau un precipitat galben-brun. Limita de sensibilitate a reactiei este de 0.0003mg/ml.
NH4+ + KOH = NH3 + K+ + H2O
NH3 + 2 [HgI4]-2 + OH- = Hg2NH2I3 + 5I- + H2O
Tehnica Cantitatea de solutie de analizat de concentratia indicata in monografie se neutralizeaza daca este necesar cu hidroxid de sodiu 10%. Se adauga 0.15ml-1ml reactiv Nessler si se agita. Nu trebuie sa se obtina un precipitat de culoare galben-bruna sau o coloratie si eventual o tulbureala mai intensa decat pentru o proba martor preparata din apa distilata si reactiv Nessler in cantitatile mentionate in monografie.
Evaluarea impuritatilor de ioni de amoniu in raport cu limita de tolerabilitate admisa
Pentru aprecierea concentratiei impuritatilor de ioni de amoniu in raport cu limita de tolerabilitate admisa se aplica reactia Nessler mentionata mai sus.La concentratiile mici admise se obtine numai o coloratie galbena.
Tehnica: 10ml solutie de analizat de concentratia indicata in monografie se neutralizeaza daca este necesar cu hidroxid de sodiu 10% (R). Intr-o eprubeta identica se introduce solutia-etalon, in cantitatea indicata de farmacopee si se aduce la acelasi volum cu proba de analizat. In ambele eprubete se adauga 0.15ml reactiv Nessler, se agita si se compara dupa 5minute. Solutia de analizat nu trebuie sa prezinte o coloratie galbena, mai intensa, decat aceea a probei-etalon.
Observatii:
Alcalinitatea reactivului deranjeaza reactia in cazul sarurilor metalelor alcalino-pamantoase, in prezenta impuritatilor de ioni ai metalelor alcalino-pamantoase, metalelor grele si ionilor de fier in concentratie peste 0.03%. Pentru executarea reactiei se recomanda precipitarea acestor ioni din solutie sau complexarea lor in solutie.
In cazul ionilor metalelor alcalino-pamantoase si ai metalelor grele se procedeaza la precipitarea lor cu hidroxid de sodiu (R) , urmata de filtrare.
Tehnica: Solutia de analizat in cantitatea mentionata in monografie se trateaza cu 2ml hidroxid de sodiu (R) si 2ml carbonat de sodiu (R); se dilueaza cu apa la concentratia indicata, se agita si se filtreaza. Reactia cu reactivul Nessler se executa pe 10ml filtrat dupa tehnica prezentata anterior.
In cazul impuritatilor de ioni de fier peste 0.03% se procedeaza la complexarea acestora cu tartrat de sodiu si potasiu, cand se obtine un complex solubil.
Tehnica: 10ml solutie de analizat se trateaza cu 2 picaturi hidroxid de sodiu 10% (R), 3ml tartrat de sodiu si potasiu (R) solutie 20% si se agita; se adauga 0.15ml reactiv Nessler (R) si se compara cu solutia-etalon dupa 5minute.
Controlul impuritatilor de ioni de arsen
Prezenta ionilor de arsen foarte toxici se controleaza in majoritatea substantelor nedicamentoase. Acestia provin, in general, din materiile prime si, mai ales, din reactanti poluati cu ioni de arsen.
Reactia cu reactivul hipofosforos (reactivul Bougault)
Principiu Ionii de arsen (III si V) sunt redusi de acidul hipofosforos, in mediu de acid clorhidric, la cald, pana la arsen. In functie de concentratie se obtine o coloratie bruna sau un precipitat brun.
4 AsCl3 + 3 H3PO2 + 6 H2O 4 As + 3 H3PO4 +12 HCl
4 AsCl5 + 5 H3PO2 + 10 H2O 4 As + 5 H3PO4 + 20 HCl
Viteza de reactie este mica, acidul hipofosforos actionand intr-o forma tautomera mai activa, care rezulta in urma unui proces lent:

Ionii H+ deplaseaza echilibrul spre dreapta dar pentru a accelera viteza de reactie este necesara incalzirea pe baia de apa 20-30 de minute.
Tehnica: Cantitatea de substanta indicata in monografie se dizolva, dupa caz, in 3ml apa sau 3ml acid clorhidric 25% (R); se adauga 5ml reactiv hipofosforos (R) si se incalzeste 20-30 de minute pe baia de apa in fierbere. Nu trebuie sa apara o coloratie bruna sau sa se formeze un precipitat brun.
Daca substanta de controlat este insolubila in apa si in acizi sau precipita din solutia apoasa la tratare cu acidul hipofosforos (R), atunci, conform prevederilor din farmacopee, proba se trateaza direct cu 5ml reactiv hipofosforos (R) intr-o capsula de portelan si se incalzeste 20 de minute pe baia de apa in fierbere, amestecand cu o bagheta de sticla. Lichidul decantat nu trebuie sa fie colorat in brun.
Observatii Reactia cu reactivul hipofosforos este deranjata de unii anioni oxidanti sau reducatori (NO3-, NO2-, S2O32-, C6H4(OH)COO-, C6H2(OH)COO-), de fier, sulf. In aceste cazuri se procedeaza la indepartarea substantei de controlat din solutie.
Tehnica de decelare a impuritatilor ionilor de arsen, in aceste cazuri particulare, se bazeaza pe urmatoarele principii privind indepartarea substantei de controlat din solutie:
Bismuthi subnitras; Natrii nitris
Principiu: Descompunerea substantei cu acid sulfuric. Decelarea ionului de arsen in reziduul obtinut dupa evaporarea solutiei la sicitate.
Tehnica: 1g substanta se trateaza cu 5ml acid sulfuric 10% (R), se incalzeste pana la indepartarea dioxidului de azot si se evapora la sicitate. Reziduul se dizolva in 10ml reactiv hipofosforos si se mentine 30 de minute in baia de apa la fierbere. Nu trebuie sa apara o coloratie bruna sau sa se formeze un precipitat.
Natrii thiosulfas
Principiu Distrugerea tiosulfatului de sodiu cu acid azotic. Decelarea ionilor de arsen in reziduul obtinut prin evaporarea solutiei la sicitate.
Tehnica: 1g de substanta se trateaza cu 3ml acid azotic 25% (R) si 3ml de apa intr-o capsula de portelan; amestecul se evapora la sicitate pe baia de apa sub nisa; reziduul se trateaza cu 5ml acid clorhidric 25% (R), se incalzeste 20 minute pe baia de apa si se filtreaza dupa racire. Filtratul se trateaza cu 5ml reactiv hipofosforos (R) si se mentine in baia de apa 15 minute. Nu trebuie sa apara o coloratie bruna sau sa se formeze un precipitat.
Sulfur precipitatum
Principiu: Oxidarea sulfului la sulfat de amoniu cu perhidrol in prezenta amoniacului:
2 S + 6 H2O2 + 4 NH4OH = 2(NH4)2SO4 + 8 H2O
Tehnica: 2g de substanta se amesteca cu 10ml amoniac (R), 10ml perhidrol (R) si se evapora la sicitate pe baia de apa. Dupa racire, reziduul se trateaza cu 10ml acid clorhidric (R) si se filteaza. 5ml de filtrat se trateaza cu 5ml reactiv hipofosforos (R) si se mentine 15minute pe baia de apa in fierbere. Nu trebuie sa apara o coloratie bruna.
Evaluarea impuritatilor de ioni de arsen in raport cu limita de tolerabilitate admisa
Reactia Fluckiger- Lehmann
Principiu: Reducerea compusilor de arsen la hidrogen arseniat cu hidrogen in stare nascanda (rezultat din reactia dintre zinc si acid clorhidric) si evidentierea hidrogenului arseniat, purificat de hidrogenul sulfurat (prin retinere pe hartie de filtru imbibata cu acetat de plumb), cu clorura de mercur(II), utilizand hartie indicator pentru arsen imbibata cu clorura de mercur(II). In functie de concentratie, hartia indicatoare pentru arsen se coloreaza de la galben la galben-portocaliu pana la rosu-brun.
AsCl5 + 8 H = H3As + 5 HCl
2 H3As + HgCl2 = Hg(AsH2)2 + 2 HCl
H3As + HgCl2 = AsH2HgCl + HCl
H3As + 2 HgCl2 = As(HgCl)2 + 2 HCl
H3As + 3 HgCl2 = As(HgCl)3 + 3 HCl
Pentru favorizarea reducerii arsenului(V) la arsen(III) se adauga catalizator clorura de staniu(II) (reactiv pentru arsen).
Limita de sensibilitate a reactiei este de 0.001mg.
Reactia Fluckiger-Lehmann se aplica in cazul monografiilor de substante organice la care FRX admite limite de tolerabilitate foarte mici, mai mici decat acelea care pot fi depistate, pe cantitatile luate in lucru, cu reactivul hipofosforos, respectiv sub limita de sensibilitate a reactiei cu reactivul hipofosforos. In aceste cazuri, in monografia respectiva, se precizeaza ca determinarea se face ca la "Controlul arsenului in substante organice", tehnica fiind descrisa la capitolul "Controlul limitelor de impuritati".
Reactia se executa intr-un aparat special de determinare a arsenului prin comparatie cu o proba etalon (vezi capitolul "Controlul limitelor de impuritati").
Controlul impuritatilor de ioni de azotat si azotit
Importanta urmaririi impuritatilor de azotati deriva din proprietatea oxidanta care poate genera o serie de incompatibilitati sau poate altera insasi substanta medicamentoasa. Impuritatile de azotat sunt prevazute la un numar restrans de substante medicamentoase de natura chimica oficinale(6.4%).
Decelarea impuritatilor de azotati si azotiti
Decelarea impuritatilor de azotati se executa prin mai multe reactii specifice.
Reactia inelului feros
Principiu: Oxidarea ionului de fier(II) partial la fier(III) in mediu de acid sulfuric si reducerea acidului azotic sau azotos pus in libertate din azotati sau azotiti, la oxid de azot, care in prezenta unui exces de ioni de fier(II) formeaza o combinatie bruna solubila. Reactia se executa cu sulfat de fier(II).
8 FeSO4 + 2 HNO3 + 3 H2SO4 = 2 FeSO4.NO + 3 Fe2(SO4)3 + 4 H2O
4 FeSO4 + 2 HNO2 + H2SO4 = 2 FeSO4.NO + Fe2(SO4)3 + 2 H2O
Tehnica: Solutia de analizat in cantitatea si concentratia prevazuta in monografie se trateaza cu 0.5 sau 1ml sulfat feros(R). Se inclina eprubeta si se toarna cu precautie, pe peretii eprubetei, 2ml acid sulfuric(R). Se indreapta eprubeta, fara agitare si se observa zona de contact a celor doua lichide. In prezenta azotatilor si azotitilor apare un inel brun.
Observatii: Reactia decurge mai bine cu o solutie de sulfat feros 20%. Reactivul prevazut in farmacopee are o concentratie de 5%.
Reactia cu difenilamina
Principiu: Reactia este datorata caracterului oxidant al azotatilor si azotitilor, care in mediu de acid sulfuric formeaza cu difenilamina un colorant semichinonic de tip Wurster, de culoare albastra. In prima etapa are loc o dehidrogenare ducand la obtinerea tetrafenilhidrazinei. Aceasta, in mediu acid, se izomerizeaza la difenilbenzidina, care in continuare prin dehidrogenarae, formeaza colorantul semichinonic.
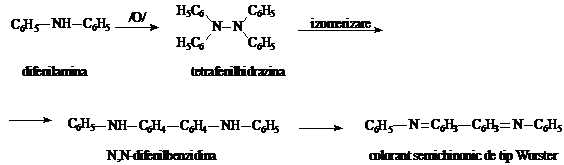
Reactia nu este specifica, fiind comuna si altor oxidanti.
Tehnica: 1ml solutie A se trateaza cu 1 sau 2ml difenilamina in acid sulfuric(R), adaugata cu precautie pe peretii eprubetei; la zona de contact a celor doua lichide nu trebuie sa apara o coloratie albastra.
Reactia de reducere la amoniac
Principiu: Reducerea azotatilor si azotitilor la amoniac cu amestec cu pulbere de zinc si de fier, in mediu alcalin. Amoniacul rezultat se evidentiaza cu ajutorul indicatorilor.
NO3- + 7 OH- + 4 Zn = NH3 + 4 ZnO22- + 2 H2O
NO3- + 5 OH- + 3 Zn = NH3 + 3 ZnO22- + H2O
Tehnica: 1g de substanta se trateaza cu 5ml hidroxid de sodiu 10%(R), 0.5g pulbere de zinc(R) si 0.5g pulbere de fier(R); se astupa eprubeta cu un tampon de vata peste care se asaza o hartie-indicator universal de pH, umectata, si se incalzeste 15minute pe baia de apa.; hartia indicator nu trebuie sa se coloreze in albastru.
Reactia de diazotare a acidului sulfanilic specifica azotitilor si azotatilor numai dupa reducere
Principiu: Reducerea azotatilor la azotiti cu hidrogen in stare nascanda, provenit din reactia dintre zinc si acid azotic. Identificarea prin reactia de diazotare a acidului sulfanilic si cuplarea sarii de diazoniu rezultate cu α-naftilamina.
HNO3 + Zn + 2 CH3COOH = HNO2 + Zn(CH3COOH)2 + H2O
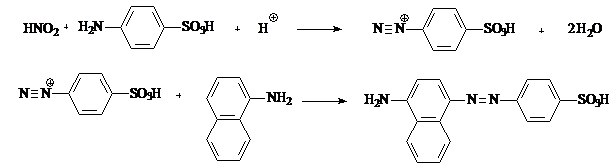
Aceasta reactie se aplica la monografia Aqua destillata pentru decelarea azotatilor in bloc alaturi de azotiti.
Tehnica: 50ml apa distilata se trateaza cu 15ml acid acetic 30%(R) si cu 2ml solutie α-naftilamina-acid sulfanilic(R) la care se adauga 0.12g zinc pulbere(R) si se agita. Dupa 15minute nu trebuie sa apara o coloratie roz. Coloratia roz denota prezenta azotatilor. ! Aparitia unei coloratii roz inainte de adaugarea pulberii de zinc indica prezenta azotitilor ca impuritate.
Reactia de nitrare specifica pentru azotati
Principiu: Nitrarea substantei de analizat de catre impuritatea de azotat in prezenta acidului sulfuric(R) cu formarea unor nitroderivati insolubili si/sau colorati specific.
Reactia de nitrare are loc numai pentru substantele medicamentoase de tip fenol sau amino cu reactivitate marita prin prezenta gruparilor -OH sau -NH2 pe nucleul aromatic.
Ea este prevazuta la monografia Kalii guajacolsulfonas pentru decelarea impuritatilor de azotat.
Tehnica: 0.1g substanta se trateaza cu 1ml acid sulfuric(R); solutia trebuie sa fie limpede si incolora; la incalzire solutia devine verde.
Reactia de reducere a permanganatului de potasiu, specifica azotitilor
Se prevede pentru controlul azotitilor in bloc alaturi de sulfiti si tiosulfati la monografia: Natrii sulfas (vezi " Controlul impuritatilor de sulfiti")
Evaluarea impuritatilor de azotati in raport cu limita de tolerabilitate admisa
Principiu: Nitrarea acidului sulfosalicilic. Azotatii, in mediu de acid sulfuric concentrat, formeaza cu acidul sulfosalicilic acidul nitrosulfosalicilic, a carui sare de amoniu solubila in apa, prezinta o coloratie galbena de intensitate variabila in functie de concentratie. Limita de sensibilitate a reactiei este de 0.062 mg/ml.
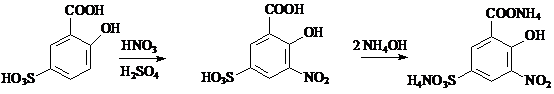
Tehnica: Intr-un balon cotat de 50ml se introduce cantitatea de substanta indicata in monografie, se trateaza cu 5ml reactiv sulfosalicilic(R), se lasa in repaus 10minute si se completeaza cu apa la semn. 10ml din aceasta solutie se aduc intr-un cilindru gradat de 50ml, se trateaza cu 20ml amoniac(R) si 20ml de apa.
In acelasi timp, se pregateste proba-etalon, indicata in monografie, care se evapora la sicitate pe baia de apa. Dupa racire, reziduul se trateaza cu 5ml reactiv sulfosalicilic(R) si se lasa in contact 10minute. Se aduce cantitativ intr-un cilindru gradat de 50ml cu 20ml apa, se adauga 20ml amoniac(R) si se completeaza cu apa la 50ml. Solutiile se compara.
Solutia de analizat nu trebuie sa prezinte o coloratie galbena mai intensa decat aceea a probei etalon.
Controlul impuritatilor de ioni de bariu
Ionii de bariu, deosebit de toxici, nu sunt admisi de FRX in toate cazurile de substante medicamentoase (11.2% care eventual pot fi poluate cu aceste impuritati).
1.1. Reactia cu acid sulfuric 10% sau sulfati solubili
Principiu: Ionul de bariu precipita cu acidul sulfuric diluat sau cu sulfati solubili, sulfatul de bariu, alb, cristalin, insolubil in acizi minerali diluati.
Ba2+ + SO42- = BaSO4
Tehnica: Solutia de analizat, in cantitatea prevazuta in monografie, se trateaza cu 1.5 ml acid sulfuric 10%(R). Nu trebuie sa apara un precipitat alb sau o tulbureala dupa 5-15 minute sau chiar 60 de minute, interval care variaza, fiind precizat la fiecare monografie.
Observatii
a) Reactia este deranjata de ionii de strontiu, care formeaza un precipitat alb, cristalin, de sulfat de strontiu.
Pentru identificarea ionilor de bariu ca impuritati in Strontii bromidum se recomanda reactia cu cromat de potasiu in mediu de acid acetic.
Principiu: Ionii de bariu -precipita cu cromatul de potasiu cromatul de bariu insolubil in acid acetic, spre deosebire de ionii de strontiu care formeaza cromatul de strontiu, solubil in acid acetic:
Ba+2 + CrO4-2 = BaCrO4
Tehnica: 0.5g de substanta se dizolva in 2.5ml de apa, se adauga 2.5ml cromat de potasiu si 0.5ml acid acetic(R); nu trebuie sa apara o tulbureala.
b) Ionii de calciu, de asemenea, interfereaza reactia, mai ales cand se gasesc in concentratii mari.
Pentru inlaturarea acestui inconvenient la unele monografii care pot fi impurificate cu ioni de calciu (Fructosum, Glucosum), se recomanda executarea reactiei in prezenta acidului clorhidric, sulfatul de calciu fiind solubil in acizi minerali, spre deosebire de sulfatul de bariu:
CaSO4 + 2 HCl = CaCl2 + H2SO4
Tehnica: 10 ml solutie de analizat se trateaza cu 0.5 ml acid clorhidric 10%(R) si 0.5 ml acid sulfuric 10%(R); solutia trebuie sa ramana limpede si incolora timp de 5 minute.
c) Impuritatile de ioni de bariu sunt asociate, de obicei, cu ioni de calciu, strontiu, plumb sau oxalati, fosfati. Controlul acestora in unele cazuri se prevede in bloc, aplicand reactia cu acid sulfuric 10%.
Reactia cu sulfat de calciu
Este o varianta a reactiei cu acid sulfuric si sulfati solubili specifica pentru ionii de bariu.
Principiu: Ionii de bariu precipita cu o solutie saturata de sulfat de calciu, sulfatul de bariu:
Ba+2 + CaSO4 = BaSO4 + Ca+2
Tehnica: Solutia de analizat, in cantitatea indicata in monografie, se trateaza cu 1 sau 5ml sulfat de calciu(R). Nu trebuie sa apara o tulbureala fina, alba, in 5-10minute sau 60 de minute.
Controlul impuritatilor de ioni de bromat
Impuritatile de ioni de bromat sunt prevazute de FRX in bromuri medicamentoase: Ammonii bromidum, Kalii bromidum, Natrii bromidum si Strontii bromidum.
Reactia cu acid sulfuric 10%
Principiu: Impuritatile de bromat in mediu acid (H2SO4) oxideaza ionul bromura (substanta de controlat) la brom elementar, care se evidentiaza prin extragere in cloroform:
BrO3- + 5 Br- + 3 H2SO4 = 3 Br2 + 3 SO4-2 + 3 H2O
Tehnica: 10 ml solutie 10% de bromuri oficinale se trateaza cu 1-2ml acid sulfuric 10%(R) si 2ml cloroform; stratul cloroformic nu trebuie sa se coloreze in galben.
Controlul impuritatilor de ioni de bromura
Impuritatile de bromuri sunt prevazute de FRX alaturi de ioduri in cloruri oficinale alcaline: Kalii chloridum si Natrii chloridum.
Decelarea impuritatilor de bromuri alaturi de ioduri
1.1. Reactia cu cloramina in mediu acid
Principiu: Oxidarea impuritatilor de bromuri si ioduri cu cloramina in mediu acid la brom, respectiv iod elementar si identificarea acestora prin extractie cu cloroform.
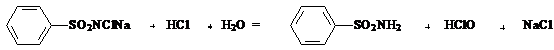
HClO + 2 Br- + H+ = Br2 + Cl- + H2O
HClO + 2 I- + H+ = I2 + Cl- + H2O
Tehnica: 10ml solutie 5% de clorura de potasiu sau de sodiu se trateaza cu 5 picaturi de acid clorhidric 10%(R), se adauga 1ml cloroform, 0.5ml cloramina(R) si se agita; stratul cloroformic nu trebuie sa se coloreze in galben sau violet.
Controlul impuritatilor de ioni de calciu
Cu toate ca ionii de calciu nu prezinta riscul toxicitatii, controlul lor ca impuritate este prevazut destul de frecvent datorita faptului ca ei pot influenta solubilitatea substantelor medicamentoase si pot provoca numeroase incompatibilitati.
Decelarea ionilor de calciu
Reactia cu oxalat de amoniu
Principiu: Ionul de calciu formeaza cu oxalatul de amoniu, oxalatul de calciu, care in functie de concentratie, apare ca o tulbureala sau precipitat alb, microcristalin, insolubil in acid acetic si amoniac, solubil in acid clorhidric si acid azotic.
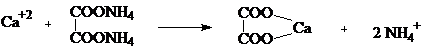
Limita de detectie a reactiei este de 0.0035mg/ml.
Tehnica: 10ml solutie de analizat de concentratia indicata in monografie, se neutralizeaza daca este necesar, se trateaza cu 1ml clorura de amoniu(R) si 1ml amoniac 10%(R). Se controleaza pH-ul care trebuie sa fie slab alcalin. Se adauga 1ml oxalat de amoniu(R), se agita, se incalzeste 10 minute pe baia de apa, apoi se raceste si se observa continutul eprubetei pe un fond negru. Solutia trebuie sa ramana neschimbata deci sa nu apara o tulbureala sau un precipitat alb.
Aparitia unei tulbureli sau a unui precipitat alb, insolubil in acid acetic, solubil in acid clorhidric si azotic, denota prezenta impuritatilor de ioni de calciu.
Observatii
a. Decelarea impuritatilor de ioni de calciu alaturi de ionii de bariu, se executa cu acid sulfuric 10%(R) si este prevazuta de FRX la monografiile: Ammonii bromidum, Kalii bromidum, Natrii bromidum (vezi "Controlul impuritatilor de bariu").
b. Pentru identificarea simultana a ionilor de calciu si magneziu, FRX prevede reactia cu monohidrogenfosfat de sodiu la monografiile: Kalii chloridum, Natrii chloridum si Zincii chloridum (vezi "Controlul impuritatilor de ioni magneziu")
c. Decelarea impuritatilor de ioni de calciu in bloc alaturi de ionii de aluminiu sau aluminiu, fier, magneziu, se executa prin reactia cu amoniac prevazuta de FRX la monografiile: Natrii hydrogencarbonas, Acidum phosphoricum si Acidum phosphoricum dilutum (vezi "Controlul impuritatilor de aluminiu").
Evaluarea ionilor de calciu in raport cu limita de tolerabilitate admisa
Reactia cu oxalat de amoniu
Pentru monografiile in care impuritatile de ioni de calciu sunt admise in anumite limite, se aplica aceeasi reactie cu oxalatul de amoniu, limita de tolerabilitate fiind apreciata comparativ cu solutia-etalon de ion calciu.
Tehnica: 10ml solutie de analizat de concentratia prevazuta in monografie se neutralizeaza, daca este necesar, cu acid acetic 30%(R) sau cu amoniac 10%(R). In acelasi timp se pregateste proba etalon, preparata din cantitatea de etalon indicata in monografie si diluata cu apa la acelasi volum cu proba de analizat. Se adauga in ambele eprubete cate 1ml clorura de amoniu(R), 1ml amoniac 10%(R), 1ml oxalat de amoniu(R), se agita, se incalzeste 10 minute pe baia de apa si se raceste. Solutiile se compara dupa 5 minute. Solutia de analizat nu trebuie sa prezinte o tulbureala mai intensa decat a probei-etalon.
Observatii
a) Ionii de bariu si plumb formeaza precipitate omoloage de oxalat de bariu, solubil in acid acetic la cald, oxalat de plumb solubil in acid azotic, greu solubil in acid clorhidric. La monografiile la care se prevede controlul impuritatilor de bariu si metale grele, se recomanda efectuarea reactiei in mediu de acid acetic, cand precipita numai oxalatul de calciu. Se evita astfel interferarea reactiei de catre impuritatile de bariu sau metale grele eventual prezente.
Tehnica: 10ml solutie de analizat de concentratia indicata in monografie se neutralizeaza daca este necesar. Se adauga 1ml acid acetic 30%(R) si 1ml oxalat de amoniu(R). Se agita, se incalzeste. Nu trebuie sa se obtina o tulbureala sau un precipitat.
b) Pentru controlul impuritatilor de ioni calciu in sarurile de aluminiu (Aluminii et kalii sulfas, Aluminii sulfas) se recomanda executarea reactiei cu oxalat de amoniu in mediu de acid acetic, deoarece in mediul slab alcalin creat de hidroxidul de amoniu poate sa apara o tulbureala datorita formarii hidroxidului de aluminiu.
c) La controlul impuritatilor de ioni calciu in sarurile de magneziu (Magnesii oxydum, Magnesii peroxydum, Magnesii subcarbonas), ionii de magneziu fiind in concentratie mare, se recomanda adaugarea unui exces de amoniac pentru a impiedica precipitarea oxalatului de magneziu. Acelasi exces de amoniac se va adauga si in proba-etalon, impuritatile de ioni de calciu in oxidul de magneziu si sarurile de magneziu fiind tolerate in anumite limite.
Controlul impuritatilor de ioni de carbonat
Avand in vedere toxicitatea redusa a carbonatilor, FRX prevede controlul acestor impuritati la un numar restrans de substante medicamentoase (4,5%).
Decelarea impuritatilor de carbonati
Reactia de efervescenta cu acizi
Principiu: Carbonatii se descompun in mediu acid cu degajare de dioxid de carbon, producand efervescenta.
CO32- + 2 H+ = CO2 + H2O
Tehnica: La cantitatea de substanta sau de solutie de analizat prevazuta in monografie, se adauga picatura cu picatura acid clorhidric 10%(R) sau alti acizi (acid azotic 10%, 25%, acid acetic 30%, acid sulfuric(R)). Nu trebuie sa se produca efervescenta.
Observatii: Prezenta carbonatilor alcalini in Natrii hydrogencarbonas (impuritate des intalnita) se pune in evidenta prin controlul pH-ului solutiei A.
Solutia A (5%) proaspat preparata nu trebuie sa aiba un pH mai mare de 8.6.
Evaluarea impuritatilor de carbonati in raport cu limita de tolerabilitate admisa
Reactia cu hidroxid de bariu
Principiu: Ionul carbonat formeaza cu hidroxidul de bariu in functie de concentratie, o tulbureala sau un precipitat alb de carbonat de bariu, solubil in acid azotic si acid clorhidric:
CO32- + Ba(OH)2 = BaCO3 + 2 OH-
Tehnica: 10ml solutie de analizat de concentratia indicata in monografie, preparata cu apa proaspat fiarta si racita, se neutralizeaza daca este necesar cu amoniac 10%(R).
In acelasi timp se pregateste proba etalon preparata din cantitatea de etalon indicata in monografie si diluata cu apa la acelasi volum cu proba de analizat.
Se adauga in ambele eprubete cate 5ml hidroxid de bariu(R), se agita si se compara dupa 10 minute.
Solutia de analizat nu trebuie sa prezinte o tulbureala mai intensa decat a probei-etalon.
Probele se executa in eprubete cu dop rodat.
Controlul impuritatilor de cianuri, iodcian si dician (cianogen)
Cianurile, iodcianul si dicianul sunt impuritati foarte toxice. Ele provin din materiile prime, reactivi, in general in cadrul procesului tehnologic. FRX prevede controlul cianurilor la monografiile: Carbo medicinalis, Kalii carbonas, Kalii iodidum si Natrii iodidum, conditionand absenta acestor impuritati.
Impuritatile de iodcian si dician se prevad la monografia Iodum.
Decelarea impuritatilor de cianuri, iodcian si dician
Reactia albastrului de Berlin
Principiu: Cianurile in mediu alcalin formeaza cu ionii de fier(II) un complex solubil si stabil de hexacianoferat(II) de potasiu. Acesta, in prezenta ionilor de fier(III) trece in hexacianoferat(II) de fier(III), precipitat albastru.
Fe2+ + 2 OH- = Fe(OH)2
Fe(OH)2 + 6 CN- = /Fe(CN)6/4- + 2 OH-
/Fe(CN)6/4- + 4 Fe3+ = Fe4/Fe(CN)6/3
Precipitatul albastru, cunoscut sub denumirea de albastru de Berlin, este instabil in mediu alcalin, dar stabil in mediu acid.
Fe4/Fe(CN)6/3 + 12 OH- = 4 Fe(OH)3 + 3 /Fe(CN)6/4-
Pentru acest motiv, solutia se aciduleaza cu acid clorhidric. Hidroxidul de fier(III) care se separa trece in solutie.
Tehnica: 5ml solutie 10% (solutia A) completata cu apa la 10ml se trateaza cu 1ml hidroxid de sodiu 10%(R), o picatura sulfat de fier(II) si 2 picaturi de clorura de fier(III). Se incalzeste la fierbere; dupa racire se aciduleaza cu acid clorhidric 10%(R). Solutia nu trebuie sa se coloreze in albastru sau sa depuna un precipitat albastru. La concentratii mici se obtine o solutie coloidala de albastru de Berlin.
Observatii
a) In cazul iodurilor alcaline: Kalii iodidum si Natrii iodidum, dupa adaugarea acidului clorhidric, se mai adauga 1ml tiosulfat de sodiu 0.1N pentru distrugerea iodului eventual format prin reactia de oxidare a iodurii sub actiunea clorurii de fier(III).
b) Decelarea impuritatilor de iodcian si dician in Iodum se bazeaza pe faptul ca iodcianul si dicianul, in mediu alcalin, se descompun si pun in libertate cianura alcalina.
NC-CN + 2 NaOH = NaCN + NaOCN + H2O
ICN + 2 NaOH = NaCN + NaIO + H2O
Cianura rezultata se identifica prin reactia albastrului de Berlin pe baza principiului mentionat anterior. Urmele de iod din solutia de analizat (obtinuta prin agitarea iodului cu apa si filtrare) se indeparteaza cu tiosulfat de sodiu.
Tehnica: 0.25 g iod pulverizat se agita cu 10ml apa si se filtreaza. Filtratul (sol.A) se trateaza cu tiosulfat de sodiu 0.1N pana la decolorare, se adauga o picatura sulfat de fier(II)(R), o picatura clorura de fier(III)(R), 1ml hidroxid de sodiu 10%(R) si se incalzeste la fierbere. Dupa racire se aciduleaza cu acid clorhidric 10%(R). Nu trebuie sa apara o coloratie albastra.
Controlul impuritatilor de ioni de clorura
Controlul impuritatilor de ioni de clorura este prevazut de FRX la 50% din totalitatea monografiilor de substante medicamentoase oficinale. La majoritatea (46.6%) se admite prezenta acestora in anumite limite, ionul clorura nefiind toxic pentru organism.
Decelarea impuritatilor de ioni de clorura
Reactia cu azotat de argint
Principiu: Ionul de clorura formeaza cu azotatul de argint, in functie de concentratie, o opalescenta, tulbureala sau un precipitat alb, floconos, de clorura de argint, practic insolubil in acid azotic.
Cl- + AgNO3 = AgCl + NO3-
Limita de detectie a reactiei este de 0.0005mg Cl-/ml.
Tehnica: Solutia de analizat sau substanta in cantitatea prevazuta in monografie se aciduleaza cu acid azotic 25%(R) sau se dizolva in acid azotic si apoi se adauga 0.5ml azotat de argint(R). Nu trebuie sa apara o opalescenta, tulbureala sau un precipitat alb.
Observatii
Prezenta bromurilor si iodurilor deranjeaza reactia deoarece precipita cu azotatul de argint, bromura de argint alb-galbuie si iodura de argint galbena, care pot masca clorura de argint alba. In acest caz se recomanda metoda de separare a clorurilor de bromuri si ioduri pe baza solubilitatii diferite a halogenurilor de argint in amoniac si carbonat de amoniu. Iodura de argint se separa de bromura de argint si de clorura de argint la tratare cu amoniac 10%. Clorura si bromura de argint se dizolva, formand complecsi solubili diaminoargentici, iar iodura nu se dizolva; se separa prin filtrare.
Din solutia complecsilor se reprecipita clorura si bromura de argint cu acid azotic.
AgX + NH4OH = /Ag(NH3)2/X + H2O X= Cl, Br
/Ag(NH3)2/X + 2 HNO3 = AgX + 2 NH4NO3
Precipitatul de clorura de argint si bromura de argint se trateaza cu carbonat de amoniu (R). Se dizolva numai clorura de argint, iar bromura de argint nedizolvata se separa prin filtrare.
AgCl + (NH4)2CO3 = /Ag(NH3)2/Cl + CO2 + H2O
Evaluarea impuritatilor de cloruri in raport cu limita de tolerabilitate admisa
2.1. Reactia cu azotat de argint
Pentru decelarea si aprecierea concentratiei clorurilor in raport cu limita de tolerabilitate prevazuta de FRX se utilizeaza aceeasi reactie cu azotat de argint in mediu de acid azotic.
Limita de tolerabilitate se apreciaza prin comparare cu solutie-etalon de ioni clorura.
Tehnica: 10ml solutie de analizat de concentratia indicata in monografie, se neutralizeaza, daca este necesar, cu acid azotic 10%(R) sau amoniac 10%(R).
In acelasi timp se pregateste o proba-etalon, preparata din cantitatea de etalon indicata in monografie si diluata la acelasi volum cu proba de analizat adusa la neutralitate. Se adauga in ambele eprubete cate 0.5ml acid azotic 25%(R) si 0.5ml azotat de argint(R), se agita si se compara dupa 5 minute. Solutia de controlat nu trebuie sa prezinte o opalescenta mai intensa decat proba etalon de ion clorura.
Observatii
a) In cazul substantelor medicamentoase care deranjeaza reactia prin precipitare cu azotat de argint: bromuri, ioduri, nitriti, tiosulfati, se prevede in prealabil indepartarea cantitativa a acestora din solutie prin metode specifice.
Kalii bromidum
Principiu: Oxidarea bromurii la brom elementar cu perhidrol in prezenta acidului azotic.
2 KBr + H2O2 + 2 HNO3 = Br2 + 2 KNO2 + 2 H2O
Evaluarea impuritatilor de cloruri prin metoda Vohlhard
Tehnica: 1g de substanta se dizolva in 20ml de apa si se trateaza cu 20ml acid azotic 25%(R) si 5ml perhidrol(R); se incalzeste pe baia de apa intr-o capsula de portelan pana la decolorare si se mentine pe baie inca 15 minute pentru eliminarea totala a bromului. Dupa racire se trece la determinarea cantitativa. Se adauga 5ml azotat de argint 0.1N exact masurati si 1ml toluen(R). Amestecul se agita puternic; se adauga 2ml alaun feriamoniacal 20%(I) si se titreaza excesul de azotat de argint cu tiocianat de amoniu 0.1N pana la culoare roz-rosietica.
1ml AgNO3 0.1N corespunde la 0.003545g ion clorura
Natrii nitris
Principiu: Oxidarea azotitului de sodiu cu acid azotic si evaluarea impuritatilor prin reactia cu azotat de argint in prezenta de acid azotic.
NaNO2 + 2 HNO3 = 2 NO2 + NaNO3 + H2O
Tehnica: 0.05g substanta se dizolva in 3ml apa, se adauga acid azotic 10%(R) si se incalzeste pana la indepartarea vaporilor bruni. Se raceste, se dilueaza cu apa la 10ml si se compara cu 2ml solutie-etalon de ion clorura completata la 10ml cu apa, dupa tratarea ambelor probe cu 0.5ml acid azotic 25%(R) si 0.5ml azotat de argint(R). Nu trebuie sa se obtina o tulbureala mai intensa decat a probei-etalon.
Natrii thiosulfas
Principiu: Descompunerea oxidativa a tiosulfatului de sodiu cu acid azotic si evaluarea impuritatilor de cloruri cu azotat de argint.
Na2S2O3 + 2 HNO3 = 2 NaNO3 + S + SO2 + H2O
S + 6 HNO3 = H2SO4 + 6 NO2 + 2 H2O
Tehnica: 5ml solutie A (10%) se trateaza cu 3ml acid azotic 25% si se evapora la sicitate pe baia de apa sub nisa. Reziduul se agita cu 25ml apa si se filtreaza. 10ml filtrat se compara dupa 5 minute cu 2ml solutie-etalon completata cu apa la 10ml, dupa tratarea concomitenta a ambelor probe cu 0.5ml acid azotic 25%(R) si 0.5ml azotat de argint(R). Nu trebuie sa se obtina o tulbureala mai intensa decat a probei-etalon.
Controlul impuritatilor de dioxid de carbon
Dioxidul de carbon se controleaza in apa distilata si in substante medicamentoase gazoase.
Decelarea impuritatilor de dioxid de carbon
Reactia cu hidroxid de calciu (hidroxid de bariu)
Principiu: Dioxidul de carbon formeaza cu hidroxidul de calciu sau de bariu o tulbureala sau un precipitat alb de carbonat de bariu sau calciu, usor solubil in acizi:
CO2 + Ca(OH)2 = CaCO3 + H2O
CO2 + Ba(OH)2 = BaCO3 + H2O
Reactia se aplica la identificarea dioxidului de carbon din Aqua destillata (FRX).
Tehnica: 25ml apa distilata se agita cu un volum egal de hidroxid de calciu(R) intr-un cilindru de 50ml cu dop rodat: solutia trebuie sa ramana limpede 60 de minute.
Controlul impuritatilor de ioni de fier
Impuritatile de ioni de fier sunt foarte frecvente in substantele medicamentoase. Ele apar in cadrul procesului tehnologic de fabricatie din materiile prime minerale, reactivi, aparatura.
Decelarea ionilor de fier
1.1. Reactia cu hexacianoferat(II) de potasiu
Principiu: Ionul de fier(III) formeaza cu hexacianoferat(II) de potasiu in exces un complex colorat in albastru de hexacianoferat(II) de fier(III) (albastru de Berlin sau albastru de Prusia), insolubil in acid clorhidric. In functie de concentratie, se obtine un precipitat albastru sau o coloratie albastra.
4 FeCl3 + 3 K4/Fe(CN)6/ = Fe4/Fe(CN)6/3 + 12 KCl
Limita de detectie este de 0.0005mg Fe(III)/ml.
Reactia se executa in mediu de acid clorhidric pentru a evita precipitarea hidroxidului de fier(III), care ar putea rezulta in mediu alcalin prin descompunerea complexului:
Fe4/Fe(CN)6/3 + 12 OH- = 4 Fe(OH)3 + 3 /Fe(CN)6/4-
Reactia este caracteristica pentru ionul Fe(III). Ionul de fier(II) se pune in evidenta prin oxidarea la Fe(III). Reactia de oxidare se executa in prealabil cu acid azotic in prezenta acidului clorhidric:
Fe2+ + HNO3 + 3 H+ = Fe3+ + NO + 2 H2O
Tehnica: 10ml solutie de analizat, de concentratia prevazuta in monografie, se neutralizeaza daca este necesar cu acid clorhidric 10%(R) sau cu amoniac 10%(R). Se trateaza cu 0.1ml acid azotic(R) si se fierbe amestecul timp de 5 minute. Se neutralizeaza cu hidroxid de sodiu N, apoi dupa racire se completeaza cu apa la 10ml. Se adauga 0.2ml acid clorhidric 10%(R) si 0.2ml hexacianoferat(II) de potasiu; se agita. Solutia de analizat nu trebuie sa se coloreze in albastru sau sa depuna un precipitat albastru.
Observatii
Reactia cu hexacianoferat(II) de potasiu nu se poate utiliza pentru controlul ionilor de fier in substantele medicamentoase care reactioneaza cu acest reactiv: Argenti nitras, Bismuthi subcarbonas, Bismuthi subgallas, Bismuthi subnitras, Bismuthi subsalicylas, Plumbi oxydum, Zinci chloridum, Zinci oxydum. In aceste cazuri, se recomanda reactia cu amoniac 10%(R) sau 25%(R) prin care se identifica ionul de fier alaturi de alti ioni care reactioneaza cu amoniac.
Decelarea impuritatilor de fier alaturi de alti cationi, cu amoniac
Principiu: Ionii de fier (III) formeaza cu amoniac un precipitat brun gelatinos de hidroxid de fier (III) insolubil in exces de reactiv.
Fe+3 + 3 NH4OH = Fe(OH)3 + 3 NH4+
Observatii
a) Identificarea impuritatilor de ioni fier, alaturi de ioni de aluminiu si cupru in Zinci chloridum si Zinci oxydum.
b) Identificarea impuritatilor de ioni fier si cupru in sarurile de bismut: Bismuthi subcarbonas, Bismuthi subgallas, Bismuthi subnitras, Bismuthi subsalicylas, se bazeaza pe principiul ca:
- ionii de fier si de cupru precipita cu amoniac hidroxizii respectivi. In exces de reactiv, hidroxidul de fier (III) rosu-brun este insolubil, iar hidroxidul de cupru formeaza un complex solubil tetraaminocupric /Cu(NH3)4/2+ colorat in albastru.
Ionii de bismut ai substantei de analizat nu deranjeaza controlul impuritatilor de ioni de fier si cupru. Ei precipita cu amoniac saruri bazice de bismut, albe, insolubile in exces de reactiv.
Bi3+ + 3 NH4OH = Bi(OH)2+ + 3 NH4+
Reactia se executa pentru sarurile anorganice de bismut (Bismuthi subcarbonas, Bismuthi subnitras) direct pe substanta dizolvata in acid azotic (R), iar pentru sarurile organice (Bismuthi subgallas, Bismuthi subsalicylas) pe solutia reziduului de la calcinare dizolvat in acid azotic(R).
Tehnica: Solutia de analizat, in cantitatea si concentratia mentionata in monografie, se trateaza cu amoniac 10%(R) sau 25%(R) in exces. Precipitatul format trebuie sa fie alb, iar dupa filtrare trebuie sa se obtina un lichid incolor. Un precipitat brun indica prezenta ionilor de fier, iar coloratia albastra a solutiei prezenta impuritatilor de ioni de cupru.
Decelarea impuritatilor de ioni fier alaturi de substante organice cu carbonat de sodiu
In cazul monografiei Acidum salicylicum FRX recomanda decelarea ionilor de fier, in mod particular, cu carbonat de sodiu, alaturi de impuritati organice: fenol, oxidifenil.
Principiu: Ionii de fier (III) cu carbonatul de sodiu precipita sub forma hidroxidului de fier:
2 Fe+3 + 3 Na2CO3 + 3 H2O = 2 Fe(OH)3 + 6 Na+ + 3 CO2
Fenolul si oxidifenilul se extrag in eter si se apreciaza calitativ dupa miros si cantitativ prin cantarirea reziduului obtinut prin evaporare.
Tehnica: 1g acid salicilic se dizolva in 10ml carbonat de sodiu (R); solutia trebuie sa fie limpede si incolora. Solutia se agita cu 10ml eter, se separa eterul, se filtreaza pe sulfat de sodiu anhidru(R) si se evapora intr-o capsula la temperatura obisnuita; reziduul nu trebuie sa fie mai mare decat 0.1% si nu trebuie sa aiba miros de fenol.
Evaluarea ionilor de fier in raport cu limita de tolerabilitate admisa
Pentru aprecierea concentratiei ionilor de fier in substantele medicamentoae, la care se admite o limita de tolerabilitate, se recomanda, in general, reactia cu tiocianat de amoniu. Pentru comparare se utilizeaza solutie-etalon de ioni fier.
Reactia cu hexacianoferat (II) de potasiu
Tehnica: 10ml solutie de cercetat in concentratia prevazuta in monografie se neutralizeazaa, daca este necesar, cu acid clorhidric 10%(R) sau amoniac diluat(R) si se trateaza cu 0.1ml acid azotic (R). Se fierbe amestecul 5 minute, se neutralizeaza cu hidroxid de sodiu N si, dupa racire, se completeaza cu apa la 10ml.
In paralel se executa proba-etalon, preparata din cantitatea de etalon prevazuta in monografie si diluata cu apa la acelasi volum cu proba de analizat. Se adauga in ambele eprubete cate 0.2ml acid clorhidric diluat(R) si 0.2ml hexacianoferat(II) de potasiu(R). Se agita si se compara dupa 5 minute. Solutia de analizat nu trebuie sa prezinte o coloratie albastra mai intensa decat proba etalon.
Reactia cu tiocianat de amoniu
Principiu: Ionul de fier(III) formeaza cu tiocianat de amoniu o coloratie rosie.
FeCl3 + 3 NH4SCN = Fe(SCN)3 + 3 NH4Cl
Reactia se aplica la monografia Natrii salicylas in proba de la determinarea clorurilor (FRX admite cel mult 0.0005% ioni fier).
Tehnica: 2g substanta se dizolva in 15ml de apa si se adauga 5ml acid azotic 25%(R). Se precipita cantitativ acidul salicilic, apoi se filtreaza. In filtrat se urmareste prezenta salicilatului de sodiu prin adaus de acid azotic 25%(R). In cazul in care precipitarea a fost cantitativa si filtratul ramane limpede, se trece la decelarea ionilor de fier.
10ml filtrat se compara cu 0.5ml solutie-etalon de ioni fier acidulata cu 0.5ml acid azotic 10%(R) si completata cu apa la 10ml dupa ce in ambele probe se adauga 0.25ml tiocianat de amoniu 5%(R). Nu trebuie sa apara o coloratie rosie mai intensa decat a probei etalon.
Controlul limitelor de ioni de fosfat
Avand in vedere ca fosfatii prezinta toxicitate redusa si incidenta mai scazuta, controlul impuritatilor de fosfati este destul de rar prevazut la substantele medicamentoase oficinale.
1. Decelarea impuritatilor de fosfati
Reactia cu molibdat de amoniu
Principiu: Ionul fosfat formeaza cu molibdatul de amoniu in mediu de acid azotic o sare de amoniu a acidului dodecamolibdatofosforic, care in functie de concentratie, apare ca o coloratie sau un precipitat galben, insolubil in acid azotic, solubil in amoniac:
H3PO4 + 12 (NH4)2MoO4 + 21 HNO3 = (NH4)3H4/P(Mo2O7)6/ + 21 NH4NO3
Limita de detectie este de 0.001mg ion fosfat/ml.
Precipitatul obtinut se dizolva in amoniac cu formare de molibdat de amoniu si fosfat de amoniu.
(NH4)3H4/P(Mo2O7)6/ + 24 NH4OH = 12 (NH4)2MoO4 + (NH4)3PO4 + 14 H2O
Tehnica: Cantitatea de substanta sau solutie de analizat, indicata in monografie, se neutralizeaza, daca este necesar, cu acid azotic (R) sau cu amoniac 10%(R), se trateaza cu 1ml acid azotic 25%(R) si 5ml molibdat de amoniu (R), se completeaza cu apa la 10ml si se agita. Nu trebuie sa apara in timp o coloratie sau un precipitat galben.
FRX prevede controlul fosfatilor prin reactia cu molibdatul de amoniu, conditionand absenta acestora la monografiile: Barii sulfas si Histamini dihydrochloridum.
Observatii
a) Reactia de formare a fosfomolibdatului de amoniu decurge cu viteza mica la temperatura obisnuita. Se recomanda agitarea solutiei si aprecierea rezultatului dupa 30 de minute sau chiar dupa o ora. La incalzire reactia decurge mult mai rapid, dar arseniatii interfereaza reactia, formand arsenomolibdat de amoniu, precipitat galben care apare numai la incalzire. Reactia la cald se utilizeaza pentru identificarea in bloc a fosfatilor si arseniatilor. Se formeaza alaturi de fosfomolibdatul de amoniu, arsenomolibdatul de amoniu, ambele precipitate galbene:
H3AsO4 + 12 (NH4)2MoO4 + 21 HNO3 = (NH4)3H4/As(Mo2O7)6/ + 21 NH4NO3 + 10 H2O
b) In cazul monografiei Natrii monohydrogenphosphas se prevede controlul fosfatului tertiar. Acesta hidrolizeaza alcalin si poate fi pus in evidenta prin aprecierea pH-ului solutiei in prezenta de timolftaleina(I)- domeniu de viraj 9.3-10.5 incolor-albastru.
Tehnica: 5ml solutie de analizat se trateaza cu o picatura timolftaleina(I); solutia nu trebuie sa se coloreze in albastru.
1.2. Reactia cu sulfat de magneziu si amoniac
Principiu: Ionul fosfat formeaza cu ionii de magneziu in mediu amoniacal un precipitat alb cristalin de fosfat de magneziu si amoniu:
HPO42- + Mg2+ + NH4OH = MgNH4PO4 + H2O
FRX prevede aceasta reactie la Codeini hydrochloridum.
Tehnica: 2ml solutie de analizat se trateaza cu 2ml sulfat de magneziu(R), 2ml clorura de amoniu(R) si 1ml amoniac(R); solutia nu trebuie sa se tulbure timp de 5 minute.
Reactia cu amoniac
Se executa pentru identificarea ionilor de fosfat in bloc, alaturi de ionii de aluminiu si de fier (vezi "Controlul impuritatilor de ioni de aluminiu").
FRX prevede aceasta reactie la monografiile: Calcii carbonas si Calcii chloridum.
Evaluarea impuritatilor de fosfati in raport cu limita de tolerabilitate admisa
2.1. Reactia cu molibdat de amoniu
Pentru aprecierea concentratiei fosfatilor in raport cu limita de tolerabilitate prevazuta de FRX, se utilizeaza aceeasi reactie cu molibdat de amoniu in mediu acid.
Limita de tolerabilitate se apreciaza prin comparatie cu o solutie etalon de ioni de fosfat, care formeaza cu molibdatul de amoniu o coloratie slab galbuie.
Tehnica: Cantitatea de solutie de analizat si cantitatea de solutie etalon prevazuta in monografie se trateaza cu acid azotic 25%(R) pana la pH acid, se adauga 5ml molibdat de amoniu (R) si se aduce la 10ml. Se agita si se compara dupa 30 sau 60 de minute. Solutia de analizat nu trebuie sa prezinte o opalescenta sau un precipitat galben mai intens decat proba-etalon.
Controlul impuritatilor de ioni iodat
Decelarea impuritatilor de iodati in ioduri
1.1. Reactia cu acid sulfuric
Principiu: Impuritatile de iodati prezente in iodurile medicamentoase oxideaza iodura (substanta de controlat) in prezenta acidului sulfuric la iod elementar, care se evidentiaza cu amidon prin formarea unui compus de incluziune de culoare albastra.
IO3- + 5 I- + 3 H2SO4 = 3 I2 + 3 SO42- + 3 H2O
Impuritatile de iodati sunt prevazute de FRX in iodurile medicamentoase: Kalii si Natrii iodidum.
Tehnica: 5ml solutie 10% iodura de sodiu sau potasiu se trateaza cu 5 picaturi de amidon(I) si 5 picaturi de acid sulfuric 10%(R); nu trebuie sa apara o coloratie albastra timp de 30 de secunde.
Controlul impuritatilor de ioni iodura
Iodurile polueaza bromuri, cloruri si derivati organici halogenati.
Decelarea impuritatilor de ioduri
1.1. Reactia de oxidare la iod
Principiu: Oxidarea iodurii la iod elementar cu clorura de fier (III) sau cu azotit de sodiu in mediu acid si identificarea iodului eliberat cu amidon sau prin extractie cu cloroform.
2 I- + 2 FeCl3 = I2 + 2 FeCl2 + 2 Cl-
2 I- + 2 NaNO2 + 4 HCl = I2 + 2 NO + 2 H2O + 2 NaCl + 2 Cl-
Tehnica: La 5ml solutie 10% (sol.A) se adauga 5ml apa, 0.5ml acid clorhidric 10% (R), 0.2ml clorura de fier(III) (R) sau azotit de sodiu (T) si 1ml amidon (I). Solutia nu trebuie sa se coloreze in albastru.
Decelarea impuritatilor de ioduri alaturi de bromuri in Kalii chloridum si Natrii chloridum, se efectueaza prin reactia de oxidare cu cloramina in mediu acid (vezi "Controlul impuritatilor de bromuri").
2. Evaluarea impuritatilor de ioduri alaturi de cloruri in raport cu limita de tolerabilitate admisa
Reactia cu azotat de argint
Se executa prin reactia de precipitare in bloc a clorurilor si iodurilor cu azotat de argint. Aprecierea concentratiei se face prin comparatie cu o solutie etalon de ion clorura (vezi "Controlul impuritatilor de cloruri"). Reactia este prevazuta la monografia: Chloriodhydroxychinolinum.
Controlul impuritatilor de ioni de magneziu
Impuritatile de ioni de magneziu provin din cadrul procesului tehnologic, a materiilor prime utilizate.
Decelarea impuritatilor de ioni de magneziu
1.1. Reactia cu monohidrogenfosfat de sodiu
Principiu: Ionul magneziu cu monohidrogenfosfatul de sodiu in mediu de tampon amoniacal formeaza un precipitat alb cristalin de fosfat de amoniu si magneziu:
Mg+2 + Na2HPO4 + NH3 = NH4MgPO4 + 2 Na+
Tehnica: La 5ml solutie 5% (sol.A) se adauga 0.5ml clorura de amoniu (R), 0.5ml monohidrogenfosfat de sodiu (R) si amoniac 10%(R) pana la reactie alcalina. Nu trebuie sa apara o tulbureala sau un precipitat alb timp de 5 minute.
Observatii
a) La decelarea impuritatilor de magneziu si calciu in Zinci chloridum se evita adaugarea de clorura de amoniu si se recomanda utilizarea solutiei de amoniac conc. 25%. In aceste conditii, ionii de zinc care ar deranja reactia nu precipita cu monohidogenfosfat de sodiu si raman in solutie sub forma complexului tetraaminozincic /Zn(NH3)4/2+.
- 4ml clorura de zinc 10% se trateaza cu 2ml amoniac 25%(R) si 1ml monohidrogenfosfat de sodiu; solutia trebuie sa ramana limpede.
b) Pentru controlul impuritatilor de ioni de magneziu in sarurile de calciu: Calcii carbonas si Calcii chloridum se impune indepartarea cantitativa a ionilor de calciu din solutie deoarece pe baza reactiei mentionate mai sus deranjeaza identificarea ionilor de magneziu.
Indepartarea cantitativa a substantei de controlat din solutie, respectiv a ionilor de calciu, se realizeaza, in prealabil, prin precipitare cu oxalat de amoniu in prezenta clorurii de amoniu si a unui exces de amoniac pentru evitarea precipitarii ionilor de magneziu din solutie ca oxalat de magneziu.
Tehnica: 10ml solutie 5% se trateaza cu 20ml oxalat de amoniu(R), 0.5g clorura de amoniu (R) si amoniac (R) pana la reactie alcalina. Se incalzeste la fierbere si se filtreaza. In filtrat se executa reactia cu monohidrogenfosfat de sodiu.
Controlul impuritatilor de ioni de metale grele
Denumirea de metale grele (metale cu densitate mai mare decat 5) este utilizata de Farmacopee in cadrul controlului puritatii substantelor medicamentoase in mod restrictiv. Ea cuprinde global din grupa mai mare a metalelor grele numai ionii metalelor care formeaza cu sulfura de sodiu in mediu acid precipitate negre sau brune de sulfuri. Ceilalti ioni ai metalelor grele Zn(II), Fe(II), Fe(III), As(III), As(V), Sb(III), Sb(V), care nu formeaza cu sulfura de sodiu in mediu acid precipitate negre de sulfuri, se prevad ca impuritati nominalizate si se deceleaza prin alte reactii specifice.
Prezenta impuritatilor de ioni ai metalelor grele este frecventa in substantele medicamentoase. Acesti ioni polueaza substantele medicamentoase de la inceput, din cadrul procesului tehnologic de fabricatie, fiind cedati de produsele chimice intermediare utilizate la preparare, de mantaua reactoarelor, conducte, etc. Astfel, controlul metalelor grele se prevede in FRX pentru substantele medicamentoase in proportie de 64%.
Toxicitatea pronuntata si reactivitatea marita, comparativ cu alte impuritati, impune un control riguros.
1. Decelarea impuritatilor de ioni ai metalelor grele
Reactia cu sulfura de sodiu
Principiu: Precipitarea ionilor de metale grele cu sulfura de sodiu in mediu de acid acetic:
Me2+ + S2- = MeS
In mediul acid al reactiei este posibila oxidarea ionilor de sulfura la sulf ceea ce conduce la opalescenta solutiei. Aceasta deranjeaza aprecierea precipitatului de sulfuri ale metalelor grele, eventual prezente ca impuritati. Pentru evitarea opalescentei, se preconizeaza adaugarea de formaldehida care reduce sulful la sulfura:
S + CH2O + H2O = H2S + HCOOH
Tehnica: 10ml solutie de analizat, de concentratia prevazuta in monografie, se controleaza cu hartie indicator de pH. Solutia trebuie sa fie neutra. Contrar, se neutralizeaza, dupa caz, adaugand, picatura cu picatura, fie acid acetic 30%(R), fie hidroxid de sodiu 10%(R). Neutralizarea se face cu atentie. Pentru a evita depasirea punctului de neutralitate se recomanda folosirea unor reactivi mai diluati.
Se adauga apoi 1ml acid acetic 30%, o picatura formaldehida (R) si 2 picaturi sulfura de sodiu (R). Se agita. Solutia de analizat nu trebuie sa se coloreze in brun sau sa depuna un precipitat negru.
Evaluarea impuritatilor de ioni ai metalelor grele in raport cu limita de tolerabilitate admisa
Reactia cu sulfura de sodiu
Pentru determinarea concentratiei ionilor metalelor grele in raport cu limita de tolerabilitate precizata de FRX, se utilizeaza aceeasi reactie cu sulfura de sodiu.
Limita de tolerabilitate se apreciaza prin comparatie cu o solutie etalon de ioni plumb, care in functie de concentratie, formeaza cu sulfura de sodiu o coloratie bruna sau un precipitat negru.
Pb2+ + S2- = PbS
FRX exprima cantitativ prezenta ionilor metalelor grele prin concentratia cunoscuta in ioni de plumb din solutia etalon. Limita de detectie a sulfurii de plumb este 0.0005 mg/ml.
Tehnica: 10ml solutie de cercetat de concentratia prevazuta in monografie se controleaza cu hartie indicator de pH. Solutia trebuie sa fie neutra. Contrar se neutralizeaza dupa caz cu acid acetic 30%(R) sau hidroxid de sodiu 10%. Neutralizarea se face cu atentie picatura cu picatura avand in vedere volumul adaugat.
Concomitent se pregateste solutia etalon, preparata din cantitatea de etalon prevazuta in monografie si diluata cu apa la acelasi volum cu proba de analizat (10ml + volumul reactivilor adaugati pentru neutralizare).
Se adauga in ambele eprubete cate 1ml acid acetic 30% (R), o picatura formaldehida (R) si 2 picaturi sulfura de sodiu (R). Se agita si se compara dupa 1 minut privind stratul de lichid de sus in jos pe un fond alb.
Observatii
a) Impuritatile de ioni de fier prezente in cantitate mai mare de 0.05% in substanta medicamentoasa, deranjeaza reactia cu sulfura de sodiu aplicata pe solutia de analizat obtinuta direct prin dizolvarea substantei medicamentoase in apa. In acest caz se procedeaza la indepartarea ionilor de fier din solutie prin precipitare cu amoniac sub forma de hidroxid de fier(III).
Tehnica: Solutia de analizat se incalzeste la fierbere, se alcalinizeaza cu amoniac(R) si se filtreaza. In filtrat se deceleaza ionii metalelor grele.
b) Reactia cu sulfura de sodiu pentru controlul ionilor metalelor grele in substante medicamentoase organice se executa in majoritatea cazurilor pe reziduul de la "calcinarea cu acid sulfuric".
Calcinarea se realizeaza dupa tehnica descrisa la capitolul "Determinarea reziduului prin calcinare", pe cantitatea de substanta prevazuta pentru fiecare monografie la parametrul "Reziduu prin calcinare". Reziduul obtinut prin calcinarea substantei medicamentoase cu acid sulfuric se trateaza cu 1ml acetat de amoniu (R) solutie saturata, neutralizata la fenolftaleina(I) cu hidroxid de sodiu 10%(R) si se incalzeste usor pe sita. Amestecul se dilueaza cu 5ml apa si se filtreaza intr-o capsula printr-un filtru cantitativ, in prealabil spalat cu acid acetic 10%(R) si apoi cu apa fierbinte. Creuzetul si filtrul se spala cu 3ml de apa, solutia se completeaza cu apa la 10ml si se aplica reactia cu sulfura de sodiu dupa metoda data mai sus.
c) Substantele medicamentoase oxidante (Kalii permanganas, Magnesii peroxydum, Natrii nitris), substantele care precipita cu sulfura de sodiu (Zinci chloridum, Ferrum reductum) sau cu acidul acetic (Barbitalum natricum, Amobarbitalum natricum, Phenobarbitalum natricum, Natrii benzoas, Natrii salicylas, Theobrominum natricum et natrii salicylas, Natrii thiosulfas) deranjeaza reactia cu sulfura de sodiu. In aceste cazuri, controlul ionilor metalelor grele se efectueaza dupa indepartarea substantei medicamentoase de controlat din solutie prin precipitare, descompunere sau complexarea sa in solutie.
Tehnica de prelucrare a solutiilor de analizat in acest scop s-a descris pentru Kalii permanganas, Magnesii peroxydum si Natrii nitris in cadrul capitolului "prepararea solutiei de analizat", intrucat indepartarea substantei de controlat din solutie in aceste cazuri este necesara pentru controlul mai multor impuritati.
Decelarea impuritatilor nominalizate de ioni ai metalelor grele
Nominalizarea impuritatilor de ioni ai metalelor grele se prevede in cazul substantelor medicamentoase care sunt saruri sau oxizi ai metalelor grele si care precipita cu sulfura de sodiu un precipitat brun (sarurile oficinale de bismut) sau negru (azotatul de argint, formele de argint coloidal si oxidul de plumb). Decelarea impuritatilor reprezentate de alti ioni ai metalelor grele se realizeaza prin reactii specifice, prin care se diferentiaza de substanta de controlat.
Decelarea impuritatilor de ioni argint
1.1. Reactia cu acid clorhidric
Principiu: Ionul argint precipita cu acidul clorhidric un precipitat alb branzos de clorura de argint:
Cl- + Ag+ = AgCl
FRX prevede controlul impuritatilor de ioni argint in sarurile de bismut: Bismuthi subcarbonas, Bismuthi subgallas, Bismuthi subnitras, Bismuthi subsalicylas si in preparatele coloidale de argint: Argentum colloidale, Argenti proteinas, Argenti vitellinas.
Tehnica aplicata pentru controlul ionilor de argint in sarurile de bismut
6g solutie de analizat 4% (obtinuta prin dizolvarea substantei sau a reziduului de la calcinare, pentru sarurile organice de bismut in acid azotic 10%(R) ) se trateaza cu 1ml acid clorhidric 10%(R); solutia trebuie sa ramana limpede.
Decelarea impuritatilor de ioni plumb
2.1. Reactia cu acid sulfuric
Principiu: Precipitarea ionilor de plumb cu acidul sulfuric:
Pb2+ + SO42- = PbSO4
Tehnica: 5ml solutie de sare de bismut 4% (preparata dupa tehnica indicata mai sus) sau 10ml oxid de zinc 5% (in acid acetic 30%) se trateaza cu 1ml acid sulfuric 10% si se lasa 5 minute in repaus; solutia trebuie sa fie limpede sau cel mult transparenta. Daca apare o tulbureala sunt prezente impuritati de plumb si/sau bariu.
2.2. Reactia cu amoniac
Principiu: Ionul de plumb precipita cu solutia de amoniac un precipitat alb, de hidroxid de plumb, insolubil in exces de reactiv:
Pb2+ + 2 NH4OH = Pb(OH)2 + 2 NH4+
Decelarea impuritatilor de ioni cupru
3.1. Reactia cu amoniac
Principiu: Ionul cupru formeaza cu amoniac in exces un complex tetraaminocupric, solubil, de culoare albastra:
Cu2+ + 4 NH3 = /Cu(NH3)4/2+
FRX prevede decelarea impuritatilor de ioni de cupru prin reactia cu amoniac la monografia Ferrum reductum.
Tehnica: 0.5g fier redus se dizolva in 8ml acid clorhidric 10%(R), se adauga 1ml perhidrol(R), se fierbe 5 minute si se filtreaza. Solutia se trateaza cu 20ml amoniac 10%(R). Se obtine un precipitat rosu de hidroxid de fier(III). Se filtreaza; filtratul trebuie sa fie incolor. Coloratia albastra denota prezenta ionilor de cupru.
Observatii
Impuritatile de ioni de cupru in majoritatea cazurilor, se deceleaza prin reactia cu amoniac, in bloc, alaturi de alte impuritati care precipita cu amoniac. Astfel, FRX prevede decelarea impuritatilor de:
- cupru, bismut, plumb, fier in Argenti nitras;
cupru, fier si aluminiu in Zinci chloridum si Zinci oxydum.
Controlul impuritatilor de ioni de sulfat
Impuritatile de sulfati sunt in mod frecvent prezente in substantele medicamentoase (57%). Intrucat nu reprezinta un ion toxic, sulfatii se tolereaza in anumite limite pentru majoritatea substantelor medicamentoase la care se prevede aceasta impuritate de catre FRX.
Decelarea impuritatilor de sulfati
1.1. Reactia cu clorura de bariu
Principiu: Ionul sulfat formeaza cu sarurile de bariu solubile, in functie de concentratie, o tulbureala sau un precipitat alb de sulfat de bariu, practic insolubil in acid clorhidric:
SO42- + Ba2+ = BaSO4
Limita de detectie este de 0.003 mg SO42-/ml.
Tehnica: Solutia de analizat, in cantitatea prevazuta in monografie, se trateaza cu 0.5ml acid clorhidric. Se verifica pH-ul care trebuie sa fie acid si se adauga 1ml clorura de bariu (R).Se agita. Nu trebuie sa apara o tulbureala sau un precipitat alb.
Observatii
a) Pentru apa distilata FR X prevede executarea reactiei in mediu neutru, fara adaus de acid clorhidric. Aceasta poate conduce la erori, deoarece apa distilata contine dioxid de carbon ce precipita carbonatul de bariu. De aceea, reactia se va executa cu adaus de 0,5 ml acid clorhidric 10%, sau se lucreaza cu apa fiarta si racita. In prezenta acidului clorhidric, carbonatul de bariu se dizolva, spre deosebire de sulfatul de bariu care este insolubil.
b) La monografia Natrii thiosulfas, FRX prevede identificarea impuritatilor de sulfati in bloc alaturi de sulfiti, care in prealabil, se oxideaza cu iod la sulfati (vezi "Controlul impuritatilor de sulfiti").
Evaluarea impuritatilor de sulfati in raport cu limita de tolerabilitate admisa
Reactia cu clorura de bariu:
Pentru aprecierea concentratiei impuritatilor de sulfati in raport cu limita de tolerabilitate admisa, se aplica aceeasi reactie de precipitare cu clorura de bariu.
Limita de tolerabilitate se evalueaza prin comparare cu o solutie etalon de ion sulfat.
Tehnica: 10ml solutie de analizat, de concentratia indicata in monografie, se neutralizeaza daca este necesar, cu acid clorhidric 10%(R) sau cu amoniac 10%(R).
In acelasi timp se pregateste proba etalon preparata din cantitatea de etalon indicata in monografie si diluata cu apa la acelasi volum cu proba de analizat.
Se adauga in ambele eprubete cate 0.5ml acid clorhidric 10%(R), 1ml clorura de bariu (R), se agita si se compara dupa 10 minute. Solutia de analizat nu trebuie sa prezinte o tulbureala mai intensa decat a probei etalon.
Controlul impuritatilor de ioni de sulfit
Impuritatile de sulfiti polueaza substantele medicamentoase din cadrul procesului tehnologic si, in unele cazuri, prin descompunerea substantei medicamentoase (Natrii thiosulfas).
Decelarea impuritatilor de sulfiti
1.1 Reactia cu solutie de iod
Principiu: Reducerea iodului la iodura, ceea ce se observa prin decolorarea solutiei de iod si, mai evident, in prezenta amidonului, prin distrugerea clatratului de culoare albastra:
SO32- + I2 + H2O = 2 HI + SO42-
Tehnica: Substanta, in cantitatea prevazuta in monografie, dizolvata in volumul de apa indicat, se trateaza cu un volum exact masurat de solutie titrata de iod 0.01N, 0.02N sau 0.1N in prezenta amidonului (5-10 picaturi) sau in absenta amidonului. Nu trebuie sa dispara coloratia albastra sau galbena a solutiei. In cazul in care solutia se decoloreaza si devine acida, sunt prezente impuritati de sulfiti.
Observatii
La monografiile Kalii iodidum si Natrii iodidum se prevede controlul impuritatilor de sulfiti in bloc, alaturi de tiosulfati, care, de asemenea, reduc solutia de iod, oxidandu-se la tetrationat:
I2 + Na2S2O3 = 2 NaI + Na2S4O6
Prezenta sulfitilor sau a tiosulfatilor poate fi precizata tinand seama de aspectul si reactia solutiei dupa oxidare. Daca solutia este decolorata, limpede si acida, sunt prezente impuritati de sulfiti. Daca solutia este decolorata, limpede si neutra, sunt prezente impuritati de tiosulfati. Daca solutia este decolorata, tulbure si acida, sunt prezente impuritati de sulfiti si tiosulfati.
1.2. Reactia cu permanganat de potasiu
Principiu: Reducerea permanganatului de potasiu in mediu acid, evidentiata prin decolorarea solutiei:
2 KMnO4 + 5 SO32- + 3 H2SO4 = 2 MnSO4 + K2SO4 + 5 SO42- + 3 H2O
Aceasta reactie se aplica pentru decelarea impuritatilor de sulfiti in bloc alaturi de alte impuritati reducatoare: sulfuri, tiosulfati, azotiti, care decoloreaza solutia de permanganat:
2 KMnO4 + 5 S2- + 8 H2SO4 = 5 S + 2 MnSO4 + K2SO4 + 8 H2O + 5 SO42-
8 KMnO4 + 5 S2O32- + 12 H2SO4 = 10 HSO4- + 8 MnSO4 + 4 K2SO4 + 7 H2O
2 KMnO4 + 5 NO2- + H2SO4 = 5 NO3- + K2SO4 + 2 MnSO4 + 3 H2O
Controlul impuritatilor de ioni de sulfura
Impuritatile de sulfuri se prevad de FRX la putine monografii, decelabile singure sau asociate cu alte impuritati ca: halogenuri, fosfuri, sulfati. Ele provin din cadrul procesului tehnologic, al materiilor prime si reactivilor utilizati. FRX conditioneaza in toate cazurile absenta sulfurilor, intrucat acestea confera un miros neplacut si totodata pot interfera cu diferite substante medicamentoase, in caz de asocieri generand incompatibilitati.
Decelarea impuritatilor de sulfuri
1.1. Reactia cu acetat de plumb
Principiu: Precipitarea sulfurilor cu acetat de plumb ca sulfura de plumb de culoare neagra. La concentratii mici se obtine o coloratie bruna:
S2- + Pb(CH3COO)2 = PbS + 2 CH3COO-
Reactia se executa in doua variante, utilizand solutia de acetat de plumb sau hartie de filtru imbibata cu acetat de plumb. In cazul in care se utilizeaza hartie de filtru imbibata cu acetat de plumb, solutia de analizat in prealabil se incalzeste la fierbere cu acid clorhidric. Are loc descompunerea sulfurilor la hidrogen sulfurat gazos, care se degaja.
1.2. Reactia cu azotat de argint
Principiu: Precipitarea sulfurilor cu azotat de argint la sulfura de argint neagra, insolubila in acid azotic diluat la rece, solubila la cald:
S2- + 2 AgNO3 = Ag2S + 2 NO3-
FRX prevede identificarea sulfurilor cu azotat de argint la monografia Natrii thiosulfas. In cazul tiosulfatului de sodiu, decelarea sulfurilor este posibila numai pe baza diferentelor privind viteza de reactie a sulfurii de argint. Reactia cu sulfuri decurge instantaneu, iar cu tiosulfati in timp. Tiosulfatul formeaza initial un precipitat alb de tiosulfat de argint, care trece prin hidroliza in sulfura de argint:
2 Na2S2O3 + 2 AgNO3 = Ag2S2O3 + 2 NaNO3
Ag2S2O3 + H2O = Ag2S + H2SO4
Este deci imperios necesar sa se observe modificarile care se petrec imediat in solutie.
Tehnica: 10ml tiosulfat de sodiu 10%(R) (sol.A) se trateaza cu 3 picaturi azotat de argint 0.1N; nu trebuie sa se formeze imediat un precipitat negru.
Controlul impuritatilor de ioni de zinc
Zincul este un metal greu (densitatea mai mare decat 5). Deoarece nu precipita in mediu acid cu sulfura de sodiu un precipitat negru, ci alb, nu se incadreaza din punct de vedere al controlului de puritate la parametrul desemnat de FRX prin "metale grele".
Decelarea impuritatilor de ioni zinc
1.1. Reactia cu hexacianoferat(II) de potasiu
Principiu: Ionul de zinc formeaza cu hexacianoferat(II) de potasiu, in functie de concentratie, o tulbureala sau un precipitat alb de hexacianoferat(II) de zinc si potasiu:
3 Zn2+ + 2 K4/Fe(CN)6/ = Zn3K2/Fe(CN)6/2 + 6 K+
Precipitatul de hexacianoferat(II) de zinc si potasiu este greu solubil in acizi minerali diluati, solubil in acizi concentrati si in alcalii:
Zn3K2/Fe(CN)6/2 + 12 KOH = 3 K2/Zn(OH)4/ + 2 K4/Fe(CN)6/
Limita de detectie este de 0.01 mg Zn2+/ml.
Tehnica: 10ml solutie de analizat, de concentratia indicata in monografie, se neutralizeaza daca este necesar cu acid clorhidric 10%(R) sau cu amoiac 30%(R). Se trateaza apoi cu 2ml acid clorhidric 10%(R) si 0.3ml hexacianoferat(II) de potasiu(R). Solutia trebuie sa ramana limpede.
Evaluarea impuritatilor de zinc in raport cu limita de tolerabilitate admisa
2.1. Reactia cu hexacianoferat(II) de potasiu:
Pentru aprecierea concentratiei impuritatilor de ioni zinc, se aplica aceeasi reactie cu hexacianoferat(II) de potasiu, utilizand pentru comparatie solutia etalon de ioni de zinc.
Tehnica: 10ml solutie de analizat, de concentratia indicata in monografie, se neutralizeaza daca este necesar, cu acid clorhidric 10%(R) sau cu amoniac 30%(R). In acelasi timp, se pregateste proba de etalon preparata din cantitatea de etalon indicata in monografie si diluata cu apa la acelasi volum cu proba de analizat.
Se adauga in ambele eprubete cate 2ml acid clorhidric 10%(R) si in solutia acidulata se introduc 0.3ml hexacianoferat(II) de potasiu(R), se agita si se compara dupa 10 minute. Solutia de analizat nu trebuie sa prezinte o tulbureala mai intensa decat a probei etalon.
Observatii
a) Daca substanta de analizat contine impuritati de ioni fier peste limita admisa, solutia de analizat se incalzeste la fierbere, se alcalinizeaza cu amoniac 10%(R) pentru indepartarea cantitativa a ionilor de fier si se filtreaza. In filtrat, se cerceteaza ionii de zinc dupa indicatiile de mai sus:
Zn2+ + 6 NH4OH = /Zn(NH3)4/(OH)2 + 2 NH4+ + 4 H2O
Fe3+ + 3 NH4OH = Fe(OH)3 + 3 NH4+
b) Daca substanta de analizat contine impuritati de ioni cupru, solutia de analizat se trateaza cu hidoxid de sodiu 10%(R) in exces, pentru precipitarea cantitativa a ionilor de cupru si solubilizarea hidroxidului de zinc rezultat. Se filtreaza si in filtrat se executa reactia pentru ionii de zinc dupa indicatiile de mai sus:
Zn2+ + 4 NaOH = Na2/Zn(OH)4 + 2 Na+
Cu2+ + 2 NaOH = Cu(OH)2 + 2 Na+
Controlul impuritatilor organice
Impuritatile organice prevazute de FRX in substantele medicamentoase oficinale sunt desemnate global sau individual. Nominalizarea impuritatilor desemnate global se face prin evidentierea unor particularitati de:
Structura (compusi organici clorurati, alcooli superiori, aldehide, acizi grasi liberi, fosfolipide, hidrocarburi, substante proteice);
Reactivitate chimica (substante organice neutre sau bazice, substante usor oxidabile sau substante reducatoare, substante organice straine carbonizabile cu acid sulfuric);
Comportament diferit in anumiti solventi, comparativ cu substanta medicamentoasa de analizat (substante insolubile in alcool, substante solubile in alcool, substante insolubile in eter, substante solubile in eter, substante insolubile in eter de petrol, substante insolubile in acid acetic, substante insolubile in acid clorhidric 3N).
Nominalizarea impuritatilor desemnate individual se face prin:
Denumirea chimica rationala, de exemplu: metanol, etc.
Denumirea vulgara: pirocatechina, glicerina, acroleina, etc.
Denumirea comuna internationala, in cazul in care impuritatile sunt la randul lor substante medicamentoase, de exemplu: timol, sulfatiazol, teobromina, teofilina, etc.
Pentru decelarea impuritatilor organice se utilizeaza: proprietatile organoleptice, comportamentul diferit in solventi organici, acizi, alcooli, amoniac, pH-ul solutiei si reactiile chimice specifice prin care se diferentiaza de substanta de analizat. Alaturi de aceste metode s-au promovat frecvent in FRX, in special, pentru antibiotice, hormoni, vitamine, metodele cromatografice pe hartie sau in strat subtire, utilizand etaloane si, mai rar, metodele spectrofotometrice, acestea din urma fiind aplicate cu predilectie pentru identificarea si dozarea substantelor medicamentoase.
Metode bazate pe proprietatile organoleptice
Dintre proprietatile organoleptice adesea se foloseste mirosul, prin care se pot decela impuritatile volatile direct la temperatura obisnuita sau dupa incalzirea probei de analizat. Metoda se aplica si in cazul impuritatilor care se descompun in compusi volatili sub actiunea alcaliilor sau a carbonatilor alcalini.
Decelarea impuritatilor volatile la temperatura obisnuita
Se efectueaza dupa tehnica mentionata la controlul organoleptic.
Metoda este prevazuta in FRX pentru decelarea impuritatilor de substante volatile straine in: Aether anesthesicus, a fuzelului in Alcoholum, acetonei si fuzelului in Bromoformium.
Tehnica: 10ml eter se evapora in mici portiuni pe o hartie de filtru de 10/10 cm, curata si uscata. In timpul evaporarii nu trebuie sa se perceapa miros strain, iar dupa evaporarea eterului hartia de filtru trebuie sa fie uscata si fara miros.
- 10ml alcool se dilueaza cu 5ml de apa si se adauga 5ml glicerina (R); cu acest amestec se umecteaza o hartie de filtru si se lasa sa se evapore; nu trebuie sa se perceapa un miros strain.
- 1.5ml bromoform se aduce in mici portiuni pe o hartie de filtru; in timpul evaporarii nu trebuie sa se perceapa miros strain, sufocant, intepator sau miros de fuzel.
1.2. Decelarea impuritatilor volatile prin incalzire
Metoda se aplica atat substantelor volatile la cald, cat si substantelor care se descompun in compusi volatili prin incalzire. De exemplu, FRX prevede astfel identificarea fenolului in Resorcinolum, acidului butiric in Acidum lacticum, uleiului de terebentina in Terpini hydras si benzenului in Chlorali hydras.
Tehnica: Solutia A de rezorcinol 5% incalzita la fierbere nu trebuie sa prezinte miros de fenol.
- 1ml acid lactic se dilueaza cu 4ml apa si se incalzeste la fierbere; nu trebuie sa se perceapa miros de acid butiric.
- 0.2g terpin hidrat se agita cu 10ml de apa si se incalzeste la fierbere; nu trebuie sa se perceapa miros de ulei de terebentina.
- 10ml solutie A de cloralhidrat se incalzeste la fierbere; nu trebuie sa se degaje miros de benzen.
1.3. Decelarea impuritatilor pe baza proprietatii de descompunere cu alcalii sau carbonati alcalini, in substante volatile
In mod obisnuit aceasta metoda se aplica pentru identificarea impuritatilor care prin incalzire cu alcalii degaja amoniac. Un exemplu este identificarea ciclohexilaminei in Natrii cyclamas, aminelor volatile in Suxamethonii chloridum.
Tehnica: 1g ciclamat de sodiu sau clorura de suxametoniu se trateaza cu 5ml de apa, 1g carbonat de sodiu (R) si se incalzeste; nu trebuie sa se perceapa miros de amoniac, iar vaporii nu trebuie sa albastreasca hartia rosie de turnesol.
2. Metode bazate pe comportamentul diferit in solventi organici, acizi, alcalii, amoniac
Comportamentul diferit in solventi organici, acizi, alcalii, amoniac serveste in mare masura la decelarea impuritatilor desemnate global, prin relevarea acestei proprietati, dar si in numeroase cazuri de impuritati nominalizate individual. Se deosebesc doua situatii dependente de solubilitatea impuritatii care impun procedee diferite de identificare.
Dizolvarea (extractia) impuritatii
Se aplica in cazul in care impuritatea este solubila in solventul ales, iar substanta medicamentoasa de analizat este insolubila. In principiu se procedeaza la dizolvarea (extractia) impuritatii in solventul ales, urmata de filtrare (decantare). Filtratul (supernatantul) se usuca, iar reziduul se apreciaza cantitativ prin cantarire pana la pondere constanta.
In unele cazuri, dupa extractie, impuritatea se identifica prin determinarea pH-ului (vezi determinarea acidului salicilic liber in salicilat bazic de bismut), prin reactii specifice sau aprecierea coloratiei solutiei extractive, prin comparatie cu etalonul de culoare.
Dizolvarea substantei de analizat
Se utilizeaza in cazul in care impuritatea este insolubila in solventul ales, iar substanta de analizat este solubila. Se procedeaza la solubilizarea substantei de analizat in proportia data de monografie. Impuritatile se evidentiaza prin aparitia de opalescenta, tulbureala sau particule nedizolvate.
3. Metode bazate pe determinarea pH-ului
Valoarea pH poate fi utilizata in cadrul decelarii impuritatilor de acizi, in sarurile acizilor respectivi si derivatii acestora (amide, esteri). Se procedeaza la aprecierea pH-ului solutiei de analizat sau filtratului, daca substanta de analizat este insolubila, utilizand indicatori adecvati. Cand se admite o limita de tolerabilitate, se prevede titrarea aciditatii. Exemplu:
- 5ml fenobarbital solutie 2% se trateaza cu o picatura de metiloranj (I); solutia nu trebuie sa se coloreze in rosu. In cazul in care se coloreaza in rosu, prezinta impuritati de acid fenilbarbituric.
4. Metode specifice de control chimic a impuritatilor organice
Controlul impuritatilor organice prin metode specifice de diferentiere fata de substanta de analizat se efectueaza direct cand reactiile respective nu sunt interferate de substanta de analizat. In caz contrar, ele se pot efectua numai dupa separarea impuritatii de substanta de analizat. Reactiile specifice sunt prevazute pentru impuritatile desemnate prin denumiri globale, grupate pe baza paticularitatilor de structura si respectiv de reactivitate, cat si la majoritatea cazurilor nominalizate individual.
Impuritati desemnate global
4.1.1. Compusi organici clorurati
Principiu: Mineralizarea compusilor organici clorurati prin calcinare cu carbonat alcalin si identificarea ionului clorura cu azotat de argint. Limita de tolerabilitate se apreciaza comparativ cu solutia etalon de ion clorura.
FR X prevede controlul compusilor organici clorurati la monografiile: Acidum benzoicum si Natrii benzoas, admitand o limita de cel mult 0.08% exprimata in clorura.
Tehnica: 0.1 g acid benzoic sau benzoat de sodiu se amesteca intr-un creuzet de portelan cu 0.3 g carbonat de sodiu anhidru (R) si 5 picaturi de apa. Amestecul se usuca incalzind usor, se acopera cu 0.3 g carbonat de sodiu anhidru (R) si se calcineaza. Dupa racire, reziduul se dizolva cu atentie in 12 ml acid azotic 10% (R) si se filtreaza. 3 ml de filtrat completat cu apa la 10 ml se utilizeaza pentru identificarea ionului clorura comparativ cu o proba etalon.
In acest scop, se pregateste concomitent proba etalon din 2 ml solutie etalon-ion clorura completata cu apa la 10 ml (0.02 mg ioni clor). Se adauga in ambele eprubete cate 0.5 ml acid azotic 25% (R) si 0.5 ml azotat de argint (R), se agita si se compara dupa 5 minute. Solutia de analizat nu trebuie sa prezinte o opalescenta mai intensa decat proba etalon.
4.1.2. Esteri si acizi grasi liberi
Principiu: Identificarea ambelor impuritati prin hidroliza esterilor cu alcalii si/sau neutralizarea acizilor grasi liberi.
Reactia este prevazuta de FR X la monografia Glycerolum.
Tehnica: 25 g glicerina se trateaza cu 25 ml de apa, 10 ml hidroxid de sodiu 0.1N si se incalzeste 15 minute pe baia de apa in fierbere. Dupa racire se adauga fenolftaleina (I) si se titreaza cu acid clorhidric 0.1N pana la decolorare. Nu trebuie sa se consume mai mult de 4 ml hidroxid de sodiu 0.1N. Contrar, glicerina contine peste concentratia admisa acizi grasi liberi si/sau esteri.
4.1.3. Substante proteice
Principiu: Reactia substantelor proteice cu sulfatul de cupru in mediu alcalin (reactia biuretului).
FR X prevede controlul substantelor proteice la monografia Saccharum lactis.
Tehnica: 10 ml lactoza 5% se trateaza cu 1 ml hidroxid de sodiu 30% (R) si o picatura de sulfat de cupru (R); amestecul se coloreaza in albastru. Nu trebuie sa apara o coloratie violeta specifica substantelor proteice.
4.1.4. Substante reducatoare (usor oxidabile)
Principiu: Reducerea solutiei de hidroxid diaminoargentic, permanganat de potasiu, iod sau a reactivului Fehling.
4.1.4.1.Reducerea solutiei de iod in mediu acid
FR X prevede aceasta reactie pentru identificarea substantelor reducatoare in Saccharum lactis concomitent cu alte impuritati de amidon si dextrine care, de asemenea, reactioneaza cu iodul.
Tehnica: La 10 ml lactoza 5% se adauga o picatura de acid clorhidric (R), o picatura de iod 0.1N si se agita; coloratia solutiei trebuie sa fie asemanatoare cu aceea a unei probe preparate din 10 ml apa, o picatura de acid clorhidric si o picatura de iod. Decolorarea solutiei denota prezenta substantelor reducatoare, iar colorarea sa in rosu sau albastru indica prezenta dextrinelor, respectiv a amidonului.
4.1.4.2.Substante organice "straine"
Substantele organice "straine" sunt denumite global si in mod impropriu, fara relevarea unei particularitati specifice de structura sau reactivitate. Ele cuprind de fapt impuritatile de substante organice carbonizabile cu acidul sulfuric (R) prin deshidratare, prezente in substante organice necarbonizabile cu acid sulfuric.
Tehnica: Substanta de analizat, in cantitatea indicata in monografie, se pulverizeaza foarte fin si se introduce intr-o eprubeta curata si perfect uscata. Separat, in alta eprubeta foarte curata si perfect uscata, se aduce cantitatea de acid sulfuric (R) indicata in monografie. Se raceste acidul sulfuric (R) la 100C si apoi se toarna peste substanta fin pulverizata. Daca dizolvarea substantei de analizat se face cu degajare de gaze, amestecul se agita cu o bagheta foarte curata si uscata pana devine limpede. Reactia se executa la 150C. Solutia nu trebuie sa se coloreze.
In multe cazuri, prezenta impuritatilor organice "straine" se tolereaza pana la o anumita limita. Cand se precizeaza o limita de tolerabilitate, solutia obtinuta prin tehnica mentionata mai sus, se compara dupa 5 minute cu un volum egal de etalon de culoare preparat conform indicatiilor date in monografie. Solutia probei de analizat nu trebuie sa prezinte o coloratie mai intensa decat proba etalon.
Impuritati organice in substantele anorganice se intalnesc mai rar. Ele se apreciaza simplu prin proba de calcinare pe capac de creuzet, specifica pentru diferentierea substantelor organice de cele anorganice.
FRX prevede impuritati organice in Magnesii oxydum si Magnesii subcarbonas.
Tehnica: O cantitate de substanta se incalzeste pe un capac de creuzet in mod progresiv. Substanta nu trebuie sa se coloreze in negru datorita carbonizarii.
4.2. Impuritati organice nominalizate individual
Impuritatile organice nominalizate individual prevazute pentru control in substantele medicamentoase sunt deosebit de variate. Ele au structuri asemanatoare cu substanta de analizat, provenind din procesul tehnologic sau prin degradari ulterioare. Se identifica prin reactii specifice caracteristice moleculei, care se pot aplica direct sau numai dupa separare. In cazul impuritatilor volatile cu miros caracteristic, prezenta impuritatii se poate aprecia si dupa miros.
Decelarea oxalatilor in Acidum tartaricum
Principiu: Oxidarea oxalatilor cu permanganat de potasiu in prezenta acidului sulfuric:
5 H2C2O4 + 2 KMnO4 + 3 H2SO4 = 10 CO2 + 2 MnSO4 + K2SO4 + 8 H2O
Tehnica: 10 ml solutie de analizat (acid tartric 5%) se trateaza cu 0.2 ml acid sulfuric 20% (R), 0.1 ml permanganat de potasiu 0.1% (R) proaspat preparat si se agita; dupa 10 minute solutia trebuie sa ramana colorata in roz. In caz contrar, sunt prezente impuritati de oxalati.
Decelarea amidonului si dextrinei in Glucosum
Principiu: Amidonul si dextrina formeaza cu iodul un clatrat de culoare albastra (amidon) sau roscata (dextrina).
Tehnica: 10 ml glucoza 5% se trateaza cu o picatura de iod 0.1N; nu trebuie sa apara o coloratie albastra sau roscata.
Controlul impuritatilor organice prin reactii chimice aplicabile numai dupa separarea impuritatilor din substanta medicamentoasa de controlat
Separarea impuritatilor din substanta medicamentoasa de controlat se impune in cazul in care impuritatile au functii comune cu substanta de controlat si nu pot fi decelate prin alte reactii specifice altor functii ale moleculei.
FR X promoveaza aceasta metoda in putine cazuri. In general, in asemenea situatii se prefera metodele cromatografice.
Decelarea si evaluarea m-aminofenolului in raport cu limita de tolerabilitate in Natrii p-aminosalicylas
Principiu: m-aminofenolul si acidul p-aminosalicilic, datorita functiei fenolice, se cupleaza cu p-nitroanilina diazotata. Reactia se aplica pentru m-aminofenol numai dupa extractia sa cu eter din sarea de sodiu a acidului p-aminosalicilic.
Tehnica: 0.25 g substanta se dizolva in 2 ml metanol (R) intr-un balon cotat de 50 ml, se completeaza la semn cu eter, se agita puternic si se lasa in repaus pana la separarea precipitatului.
Intr-o eprubeta de colorimetrie se introduc 5 ml p-nitroanilina (R), 0.5 ml azotit de sodiu 1% (R) si se agita; se lasa in repaus 15 minute la temperatura normala, se adauga 1 ml din solutia eterica de mai sus, 1 ml metanol (R), se agita si se lasa in repaus 10 minute. O eventuala coloratie nu trebuie sa fie mai intensa decat a unei probe martor care contine 2 ml solutie 0.005 g m-aminofenol (R) in 1000 ml metanol (R). Se admite deci cel mult 0.2%.
IX.C.13 Controlul limitelor pentru impuritati anorganice
Impuritatile anorganice in proba de analizat pot proveni din materiile prime, din procesul de fabricatie, dintr-o purificare incompleta sau dintr-o conservare necorespunzatoare. Limitele admise pentru impuritatile anorganice in proba de analizat, exprimate in grame (% m/m), se apreciaza prin comparare cu solutii-etalon, conform prevederilor din monografiile respective.
La determinarea limitelor pentru impuritatile anorganice trebuie respectate urmatoarele conditii generale:
- eprubetele in care se efectueaza reactiile trebuie sa fie identice (incolore, de aceeasi inaltime si cu diametrele- interior si exterior- egale);
- substatele din care se prepara solutiile-etalon trebuie sa corespunda conditiilor de calitate prevazute la capitolul "Reactivi";
- stabilirea modificarilor care au loc in solutii se efectueaza privind straturile de lichid orizontal, pe un fond negru (tulbureala, opalescenta), sau de sus in jos, pe un fond alb (coloratia);
- reactivii se adauga in ordinea prevazuta si, pe cat posibil, in mod identic (in acelasi timp, in volume egale, etc.), atat in solutia de analizat, cat si in solutia-etalon.
Cand pentru o anumita impuritate in monografie se prevede "nu trebuie sa dea reactia", se procedeaza astfel: la solutia de analizat se adauga reactivii prevazuti, cu exceptia reactivului principal care pune in evidenta impuritatea respectiva. Solutia se imparte in doua si unei parti i se adauga reactivul principal. Cele dioua solutii se compara intre ele. Nu trebuie sa se observe nici o diferenta.
Observatie: Ori de cate ori in cadrul controlului se deceleaza prezenta unei impuritati pe care monografia respectiva nu o prevede, aceasta trebuie semnalata.
Controlul limitelor pentru impuritati anorganice se efectueaza, daca nu se prevede altfel in monografia respectiva, conform urmatoarelor procedee:
Controlul limitei de amoniu
Ionul amoniu formeaza cu tetraiodomercuriatul (II) de potasiu in solutie alcalina un complex; in functie de concentratie apare o coloratie galbena sau se formeaza un precipitat galben-brun.
Sensibilitatea limita a reactiei este de 0,0003 mg/ml.
Tehnica de lucru 10ml solutie de analizat, de concentratia prevazuta in monografia respectiva, se neutralizeaza, daca este necesar, cu hidroxid de sodiu 10%.
In paralel, se pregateste proba-etalon, conform prevederilor din monografia respectiva.
In ambele eprubete se adauga cate 0,15ml tetraiodomercuriat (II) de potasiu-solutie alcalina (R), se agita si se compara dupa 5 minute. Solutia de analizat nu trebuie sa se coloreze in galben mai intens decat proba-etalon.
La sarurile de metale alcalino-pamantoase si la cele de metale grele, determinarea se efectueaza astfel: la solutia de analizat se adauga 2ml NaOH 10% (R) si 2ml carbonat de sodiu 10% (R), se agita si se filtreaza. Determinarea se efectueaza cu 10ml solutie filtrata, conform prevederilor anterioare.
In mod identic se peocedeaza in cazul substantelor care contin ca impuritati saruri de metale alcalino-pamantoase sau saruri de metale grele.
La substantele care contin mai mult de o,o3% fier ca si impuritate, determinarea se efectueaza astfel: la 10ml solutie de analizat se adauga 0,1ml NaOH 10% (R), 3ml tartrat de potasiu si sodiu (R) 20%, se agita, se aduga 0,15ml tetraiodomercuriat (II) de potasiu-solutie alcalina (R) si se compara cu proba-etalon.
Controlul limitei de arsen
In farmacopee sunt prevazute doua procedee pentru controlul limitei de arsen.
Procedeul I se aplica atunci cxnd arsenul din proba de analizat este sub limita de sensibilitate a reactiei cu hipofosfit de sodiu in acid clorhidric. In monografia respectiva se prevede: "nu trebuie sa dea reactia pentru arsen cu hipofosfit de sodiu in acid clorhidric (R)".
Compusii arsenului, sub actiunea hipofosfitului de sodiu in acid clorhidric, prin incalzire la fierbere, sunt redusi la arsen; in functie de concentratie, apare o coloratie bruna sau se formeaza un precipitat brun.
Sensibilitatea limita a reactiei este de 0,001mg/ml.
Tehnica de lucru Proba luata in lucru, a carei masa este prevazuta in monografia respectiva, se dizolva, dupa caz, in 3ml apa sau in acid clorhidric 25% (R), se adauga 5ml hipofosfit de sodiu in acid clorhidric (R) si se incalzeste in baia de apa timp de 20 minute, daca nu se prevede altfel. In aceste conditii, in solutia de analizat nu trebuie sa apara o coloratie bruna sau sa se formeze un precipitat brun.
Procedeul II se aplica la controlul arsenului in substante organice si se bazeaza pe reducerea compusilor arsenului la arsenura de hidrogen, care in functie de concentratie, coloreaza in galben sau in portocaliu hartia indicator pentru arsen (R).
Sensibilitatea limita a reactiei este de 0,001 mg/ml.
Dispozitivul pentru determinarea arsenului se compune dintr-un flacon de sticla de 100ml (a) prevazut cu cota (h). La flaconul (a) se ataseaza un sistem din 3 tuburi (b,c,d) cu forma si dimensiunile prevazute in figura si fixate unul intr-altul cu dopuri rodate sau cu dopuri de cauciuc lipsite de arsen. Tubul (d) are o cota (h1), iar distanta dintre cele doua cote, (h) si (h1) trebuie astfel reglata incat sa fie de 220mm. In tubul (b) se introduce o hartie de acetat de plumb (R); in tubul (c) se introduce vata de sticla cu acetat de plumb (R), iar in tubul (d) se introduce o fasie de hartie indicator pentru arsen (R).
Tehnica de lucru In functie de natura substantelor, se procedeaza in felul urmator:
A. Pentru substantele care in conditiile de reactie nu pun in libertate acid azotic, acid azotos, halogeni, sulfura de hidrogen sau dioxid de sulf, la proba luata in lucru, a carei masa este prevazuta in monografia respectiva, se adauga 20ml acid clorhidric 10% (R), in flaconul (a).
B. Pentru substantele organice si pentru substantele care in conditiile de reactie pot pune in libertate acid azotic, acid azotos, halogeni, sulfura de hidrogen sau dioxid de sulf, la proba luata in lucru, a carei masa este prevazuta in monografia respectiva, se adauga 10ml acid sulfuric (R), intr-un balon Kjeldahl. Amestecul se incalzeste la fierbere timp de 40 minute. In solutia fierbinte se adauga, treptat, pe peretii balonului, volume mici de peroxid de hidrogen-solutie concentrata (R) pana la decolorarea solutiei, se continua incalzirea inca 15 minute si amestecul obtinut se aduce cantitativ cu mici portiuni de apa in flaconul (a).
Peste amestecul obtinut la punctul A, respectiv B, se adauga 0,5ml clorura de staniu (II)-solutie pentru arsen (R), se completeaza cu apa la 50ml, se raceste si se adauga 5g Zn granule (R). Flaconul (a) se inchide repede cu dopul pe care este fixat sistemul de tuburi de sticla (b,c,d). Dispozitivul se tine la 20-25 0C timp de 20min, agitand din cand in cand. Hartia indicator pentru arsen (R) din tubul (d) se scoate si se acopera cu un strat subtire de parafina (R) topita. Coloratia hartiei indicator pentru arsen se compara cu aceea obtinuta cu o proba-etalon.
Proba-etalon se efectueaza intr-un dispozitiv identic cu cel folosit pentru proba de analizat. In flaconul (a) se introduc 5ml solutie-etalon de arsen (0,005mg arsen), 20ml acid clorhidric 10% (R), pentru substantele care se incadreaza in grupa A sau 5ml acid sulfuric (R), pentru substantele care se incadreaza in grup B si 0,5 ml clorura de staniu (II)-solutie pentru arsen (R). Se completeaza cu apa la 50ml, se raceste, se adauga 5g Zn granule (R) si in continuare se procedeaza conform prevederilor de la proba de analizat.
Controlul limitei de calciu
Ionul calciu formeaza cu oxalatul de amoniu, in functie de concentratie, o tulbureala sau un precipitat alb, microcristalin, de oxalat de calciu, practic insolubil in acid acetic si amoniac, solubil in acid clorhidric si in acid azotic.
Sensibilitatea limita a reactiei este de 0,0035 mg/ml.
Tehnica de lucru 10ml solutie de analizat, de concentratia prevazuta in monografia respectiva, se neutralizeaza, daca este necesar, cu acid acetic 30% (R) sau cu amoniac 10% (R).
In paralel, se pregateste proba-etalon conform prevederilor din monografia respectiva.
In ambele eprubete se adauga cate 1ml clorura de amoniu 10% (R), 1ml amoniac 10% (R), 1ml oxalat de amoniu 4% (R), se agita, se incalzeste in baia de apa timp de 10minute si se raceste. Solutiile se compara dupa 5 minute. Solutia de analizat nu trebuie sa prezinte o tulbureala mai intensa decat tulbureala probei-etalon.
Controlul limitei de carbonati
Ionul carbonat formeaza cu hidroxidul de bariu, in functie de concentratie, o tulbureala sau un precipitat alb de carbonat de bariu, solubil in acid azotic si in acid clorhidric.
Tehnica de lucru 10ml solutie de analizat, de concentratia prevazuta in monografia respectiva, preparata cu apa proaspat fiarta si racita, se neutralizeaza, daca este necesar, cu amoniac 10% (R).
In paralel, se pregateste proba-etalon conform prevederilor din monografia respectiva.
In ambele eprubete se adauga cate 5ml hidroxid de bariu-solutie (R), se agita si se compara dupa 10minute. Solutia de analizat nu trebuie sa prezinte o tulbureala mai intensa decat tulbureala probei-etalon.
Determinarea se efectueaza in eprubete prevazute cu dop rodat.
Controlul limitei de cloruri
Ionul clorura formeaza cu azotatul de argint, in functie de concentratie, o opalescenta, o tulbureala sau un precipitat alb, cazeos, de clorura de argint, practic insolubil in acid azotic, solubil in amoniac.
Sensibilitatea limita a reactiei este de 0,0005mg/ml.
Tehnica de lucru 10ml solutie de analizat, de concentratia prevazuta in monografia respectiva, se neutralizeaza, daca este necesar, cu acid azotic 10% (R) sau cu amoniac 10% (R).
In paralel, se pregateste proba-etalon conform prevederilor din monografia respectiva.
In ambele eprubete se adauga cate 0,5ml acid azotic 25% (R) si 0,5ml azotat de argint 2% (R), se agita si se compara dupa 5minute. Solutia de analizat nu trebuie sa prezinte o opalescenta mai intensa decat opalescenta probei-etalon.
Observatie: Aceast tehnica de lucru se poate aplica si in cazul controlului limitei de bromuri si ioduri.
Controlul limitei de fier
Ionul fier trivalent formeaza cu hexacianoferatul (II) de potasiu un complex; In functie de concentratie apare o coloratie albastra sau se formeaza un precipitat albastru.
Sensibilitatea limita a reactiei este de 0,0005mg/ml.
Tehnica de lucru 10ml solutie de analizat, de concentratia prevazuta in monografia respectiva, se neutralizeaza, daca este necesar, cu acid clorhidric 10% (R) sau cu amoniac 10% (R) si se adauga 0,1ml acid azotic (R). Amestecul se fierbe timp de 5minute, se neutralizeaza cu NaOH 1mol/l si dupa racire se completeaza cu apa la 10ml.
In paralel, se pregateste proba-etalon conform prevederilor din monografia respectiva.
In ambele eprubete se adauga cate 0,2ml acid clorhidric 10% (R) si 0,2ml hexacianoferat (II) de potasiu 5% (R), se agita si se compara dupa 5minute. Solutia de analizat nu trebuie sa se coloreze in albastru mai intens decat proba-etalon.
Observatie: Aceasta tehnica de lucru nu se poate aplica pentru controlul limitei de fier in sarurile de crom, cupru, mercur, zinc si din fosfati, pentru care se procedeaza conform prevederilor din monografiile respective.
Controlul limitei de fier in substante organice
Reziduul obtinut prin calcinare cu acid sulfuric (R) se dizolva, prin incalzire, in 2ml acid clorhidric (R), se dilueaza cu 2ml apa si se filtreaza. Filtrul se spala cu 3ml apa, solutia se neutralizeaza cu amoniac concentrat (R), se completeaza cu apa la 10ml si in continuare se procedeaza conform prevederilor anterioare.
Controlul limitei de fosfati
Ionul fosfat formeaza cu molibdatul de amoniu, in mediu de acid azotic, in functie de concentratie, o opalescenta, tulbureala sau un precipitat galben de fosfomolibdat de amoniu, solubil in amoniac, practic insolubil in acid azotic.
Sensibilitatea limita a reactiei este de 0,001mg/ml.
Tehnica de lucru: Solutia de analizat, in volumul prevazut in monografia respectiva, se neutralizeaza, daca este necesar, cu acid azotic 10% (R) sau cu amoniac 10% (R).
In paralel, se pregateste proba-etalon conform prevederilor din monografia respectiva.
In ambele eprubete se adauga cate 1ml acid azotic 25% (R) si 5ml molibdat de amoniu in acid azotic (R), se completeaza cu apa la 10ml, se agita si se compara. Solutia de analizat nu trebuie sa prezinte o opalescenta mai intensa decat opalescenta probei-etalon.
Controlul limitei de metale grele
Prin tehnica de lucru aplicata la controlul ionilor de metale grele ca impuritati se deceleaza numai ionii metalelor grele care precipita sub forma de sulfuri in mediu acid, iar limita admisa se apreciaza prin comparare cu o solutie-etalon de ion plumb.
Ionul plumb formeaza cu sulfura de sodiu, in functie de concentratie, o coloratie bruna sau un precipitat negru.
Sensibilitatea limita a reactiei este de 0,0005mg/ml.
Tehnica de lucru : 10ml solutie de analizat, de concentratia prevazuta in monografia respectiva, se neutralizeaza, daca este necesar, cu acid acetic 30% (R) sau cu hidroxid de sodiu 10% (R).
In paralel, se pregateste proba-etalon conform prevederilor din monografia respectiva.
In ambele eprubete se adauga cate 1ml acid acetic 30% (R), 0,05ml formaldehida (R), 0,1ml sulfura de sodiu-solutie (R), se agita si se compara dupa 1min, privind stratul de lichid de sus in jos, pe un fond alb. Solutia de analizat nu trebuie sa prezinte o coloratie mai intensa decat coloratia probei-etalon.
La substantele care contin mai mult de 0,05% fier ca si impuritate, solutia de analizat se incalzeste la fierbere, se alcalinizeaza cu amoniac 10% (R) si se filtreaza. In solutia filtrata se determina metalele grele conform prevederilor anterioare.
Controlul limitei de metale grele in substante organice
La reziduul obtinut prin calcinarea substantei cu acid sulfuric (R) se adauga 1ml acetat de amoniu (R) solutie saturata, neutralizata in prealabil la fenolftaleina cu NaOH 10% (R) si se incalzeste, treptat si cu precautie, pe sita. Amestecul se dilueaza cu 5ml apa si se filtreaza intr-o eprubeta printr-un filtru cu porii fini, spalat in prealabil cu acid acetic 1% (R), apoi cu apa incalzita la aproximativ 700C. Creuzetul si filtrul se spala cu 3ml apa, solutia se completeaza la 10ml si in continuare se procedeaza conform prevederilor anterioare.
Prezenta sarurilor de fier in reziduul de la calcinare nu interfereaza determinarea.
Controlul limitei de nitrati
Ionul nitrat formeaza cu acidul sulfosalicilic un nitroderivat colorat in galben; intensitatea coloratiei variaza in functie de concentratie.
Sensibilitatea limita a reactiei este de 0,062mg/ml.
Tehnica de lucru La proba luata in lucru, a carei masa este prevazuta in monografia respectiva, se adauga 5ml acid salicilic in acid sulfuric (R), intr-un balon cotat de 50ml, se lasa in repaus timp de 10min si se completeaza cu apa la 50ml. La 10ml solutie se adauga 20ml apa si 20ml amoniac concentrat (R), intr-un cilindru gradat de 50ml.
In paralel, se pregateste proba-etalon in modul urmator: volumul solutiei-etalon prevazut in monografia respectiva se evapora la sicitate pe baia de apa. Dupa racire, la reziduu se adauga 5ml acid salicilic in acid sulfuric (R), se lasa in repaus timp de 10min, se aduce cantitativ cu portiuni mici de apa intr-un balon cotat si se completeaza cu acelasi solvent la 50ml. La 10ml solutie se adauga 20ml apa si 20ml amoniac concentrat (R), intr-un cilindru gradat de 50ml.
Solutiile se compara. Solutia de analizat nu trebuie sa se coloreze in galben mai intens decat proba-etalon.
Controlul limitei de sulfati
Ionul sulfat formeaza cu sarurile de bariu, in functie de concentratie, o tulbureala sau un precipitat alb de sulfat de bariu, practic insolubil in acid clorhidric.
Sensibilitatea limita a reactiei este de 0,003mg/ml.
Tehnica de lucru Solutia de analizat, de concentratia prevazuta in monografia respectiva, se neutralizeaza, daca este necesar, cu acid clorhidric 10% (R) sau cu amoniac 10% (R).
In paralel, se pregateste proba-etalon conform prevederilor din monografia respectiva.
In ambele eprubete se adauga cate 0,5ml acid clorhidric 10% (R) si 1ml clorura de bariu 5% (R), se agita si se compara dupa 10min. Solutia de analizat nu trebuie sa prezinte o tulbureala mai intensa decat tulbureala probei-etalon.
Controlul limitei de zinc
Ionul zinc formeaza cu hexacianoferatul (II) de potasiu, in functie de concentratie, o tulbureala sau un precipitat alb, practic insolubil in acizi diluati.
Sensibilitatea limita a reactiei este de 0,001mg/ml.
Tehnica de lucru Solutia de analizat, de concentratia prevazuta in monografia respectiva, se neutralizeaza, daca este necesar, cu acid clorhidric 10% (R) sau cu amoniac 10% (R).
In paralel, se pregateste proba-etalon conform prevederilor din monografia respectiva.
In ambele eprubete se adauga cate 2ml acid clorhidric 10% (R), 0,3ml hexacianoferat (II) de potasiu 5% (R), se agita si se compara dupa 10min. Solutia de analizat nu trebuie sa prezinte o tulbureala mai intensa decat tulbureala probei-etalon.
Observatie: La substantele care contin fier ca si impuritate, solutia de analizat se incalzeste la fierbere, se alcalinizeaza cu amoniac 10% (R) pana la reactie slab alcalina si se filtreaza. In solutia filtrata se determina zincul conform prevederilor anterioare.
Controlul limitei pentru substante organice usor carbonizabile
In functie de natura substantelor la care se efectueaza controlul, impuritatile organice usor carbonizabile se determina, daca nu se prevede altfel, prin urmatoarele procedee:
Procedeul prin calcinare: Decelarea impuritatilor organice usor carbonizabile in substantele minerale incolore se efectueaza prin calcinare in flacara timp de 10min. Substanta, in prezenta acestor impuritati, prezinta particule colorate sau se coloreaza, dupa caz, in cenusiu sau in negru.
Procedeul cu acid sulfuric: Decelarea impuritatilor organice usor carbonizabile in substante organice se efectueaza prin dizolvare in acid sulfuric (R); amestecul se coloreaza datorita carbonizarii acestor impuritati. Limitele admise pentru aceste impuritati se apreciaza prin comparare cu solutii-etalon de culoare.
Eprubetele in care se efectueaza determinarea trebuie sa fie spalate, in prealabil, cu acid sulfuric (R).
Determinarea se efectueaza la temperatura de 150C, daca nu se prevede altfel. In toate cazurile, acidul sulfuric se raceste la aproximativ 100C si se adauga peste substanta pulverizata.
Cand dizolvarea substantei are loc cu degajare de gaze, amestecul se agita cu o bagheta de sticla pana cand devine limpede.
Tehnica de lucru Substanta de analizat, fin pulverizata, se dizolva in volumul de acid sulfuric (R) prevazut in monografia respectiva si se compara cu un volum egal din etalonul de culoare conform prevederilor din monografia respectiva.
Compararea se efectueaza dupa 5min de la adaugarea acidului sulfuric (R), daca nu se prevede altfel. Solutia de analizat nu trebuie sa prezinte o coloratie mai intensa decat coloratia probei-etalon.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 6497
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved