| CATEGORII DOCUMENTE |
| Bulgara | Ceha slovaca | Croata | Engleza | Estona | Finlandeza | Franceza |
| Germana | Italiana | Letona | Lituaniana | Maghiara | Olandeza | Poloneza |
| Sarba | Slovena | Spaniola | Suedeza | Turca | Ucraineana |
DOCUMENTE SIMILARE |
|
Le concept d'atome' a été élaboré comme réponse à la question si une substance matérielle peut Être infiniment divisée ou non. Il y a environ 2500 ans depuis Leucippe et, puis, Démocrite ont énoncé l'hypothÈse atomiste, c'est-à-dire l'hypothÈse de la structure discrÈte de la matiÈre. 'L'atome' (ce qui en grec veut dire 'l'indivisible') est, selon Leucippe et Démocrite, le composant fondamental de la matiÈre. La théorie antique considérait qu'il y a quatre types d'atomes: 'de terre', 'd'eau', 'd'air' et 'de feu'. Les propriétés physiques d'une substance dépendaient des proportions des quatre types d'atomes dans le mélange final.
Ainsi conçue, la théorie atomique de l'antiquité était plus un modÈle philosophique qu'une théorie scientifique, n'étant pas soumise aux essais expérimentaux obligatoires pour qu'elle soit validée.
La théorie atomiste est revenu en actualité aprÈs plus de 2000 ans, cette fois-ci comme une théorie scientifique motivée par le progrÈs de la chimie à la fin du XVIIIiÈme siÈcle. La loi des proportions multiples, formulée par Dalton en 1803, montrait que si deux substances chimiques simples peuvent former plusieurs composés chimiques, alors le rapport entre les masses de la premiÈre substance qui se combinent avec la mÊme quantité de la deuxiÈme substance est un rapport de nombres entiÈres et simples (2/1, 3/2, 5/2, etc). En partant de cette loi, Dalton a formulé l'hypothÈse selon laquelle l'atome est la plus petite 'brique' constituante d'une substance chimique simple. Les rapports en discussion sont les expressions des proportions dans lesquelles se combinent les atomes à la formation du composé chimique. Dans ces considérations a aussi son origine la définition moderne de l'atome, conformément à laquelle l'atome est la plus petite partie d'une substance chimique simple qui garde encore les propriétés chimique de la substance respective. La chimie ajoute au concept d'atome le concept de 'molécule', c'est-à-dire la plus petite structure, formée par des atomes, qui garde encore les propriétés chimique d'un composé chimique.
En 1817, Avogadro utilise la théorie atomique dans les études liées à la physique des mélanges gazeux, énonçant la loi qui porte son nom: volumes égaux des gaz différents, pris en mÊmes conditions de température et pression, contiennent le mÊme nombre de molécules.
Vers la fin du XIXiÈme siÈcle ont apparu les premiÈres évidences expérimentales qui niaient le caractÈre indivisible de l'atome. Ainsi, la découverte du phénomÈne d'électrolyse et les expériences faites avec des tubes à décharge électrique en gaz ont montré avec certitude que dans la structure de l'atome il y a des charges électriques positives et négatives, le siÈge de la charge négative étant les particules nommées 'électrons'. La loi de l'électrolyse
![]()
oÙ: m = la masse de substance déposée à l'électrode
m = la masse molaire de la substance
n = la valence de la substance
q = la charge électrique transportée à l'intérieur de l'électrolyte
F = constante expérimentale, nommée 'le nombre de Faraday', égale à 96500 coulomb/mole
a permis l'estimation de la charge d'un électron. En utilisant la théorie atomique on peut affirmer que la substance déposée à l'électrode est formée par un nombre N d'atomes, dont chacun a la masse m0. Une mole de substance contient un nombre fixe d'atomes, égal au nombre d'Avogadro: NA. Avec ces considérations, on peut réécrire la loi de l'électrolyse ainsi
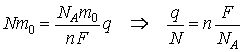
Le terme q/N est la charge électrique moyenne transportée par chaque atome, et le facteur F/NA est une constante universelle, signifiant de la charge électrique et ayant la valeur
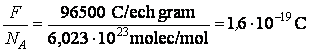
Il résulte de cela que, en fonction de sa valence, chaque atome participant au processus d'électrolyse se charge et porte une charge électrique égale à un multiple entier de la charge élémentaire, e, prise soit avec le signe plus, soit avec le signe moins.
Les expériences effectuées plus tard par Thomson et Millikan ont prouvé que de l'atome peuvent se séparer, dans certaines conditions, des particules, nommées 'électrons', ayant la charge électrique e
e = -1,6 10-19C
et la masse me
me = 9,1 10-31kg
La masse de l'électron est quelques milles fois plus petite que la masse des atomes, celle-ci représentant environ la 1780-iÈme partie de la masse du plus léger atome (l'hydrogÈne).
Pour les physiciens, le problÈme ultérieur était de trouver un modÈle structural, qui pourrait permettre l'explication des suivantes données expérimentales:
Þ la stabilité de l'atome et ses propriétés chimiques
Þ la capacité de l'atome d'absorber ou d'émettre des rayonnements électromagnétiques
Þ la propriété de l'atome d'absorber des quantités d'énergie bien précisées, comme aussi l'émission de la lumiÈre sous la forme des spectres de raies
Þ la largeur et l'intensité des raies spectrales
|
|
Le premier modÈle atomique à grande reconnaissance parmi les physiciens était celui de J. J. Thomson (modÈle de Thomson). D'aprÈs ce modÈle, l'intérieur de l'atome aurait été rempli avec un 'fluide' à charge électrique positive, caractérisé par sa densité de charge. Notant le rayon de l'atome par r et sa charge positive q = ne, oÙ n est le nombre d'électrons de l'atome, on peut calculer la densité de charge du fluide positif
![]()
L'atome de hydrogÈne contient un seul électron. Quand il se trouve à la distance x du centre de l'atome, la force électrique à laquelle il est soumis est proportionnelle avec la charge électrique positive contenue dans la sphÈre de rayon x
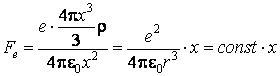
Celle-ci est l'expression d'une force élastique, qui détermine l'oscillation de l'électron, avec la fréquence
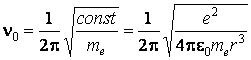
Les ondes électromagnétiques engendrées par cette oscillation auraient la longuer d'onde
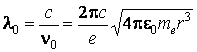
Mettant pour le rayon de l'atome r 10-10 m, on peut calculer la valeur de la longueur d'onde
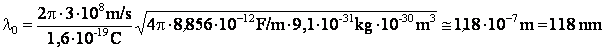
|
|
Cette valeur de la longueur d'onde a le mÊme ordre de grandeur que les longueurs d'onde des rayonnements lumineux émis ou absorbés par les atomes d'hydrogÈne, constituant de ce point de vue un argument en faveur de la validation du modÈle atomique de Thomson.
Pour confirmer ou non le modÈle de Thomson, Rutherford a réalisé une expérience d'analyse de la diffusion des particules a sur une mince feuille en or.
|
|
L'analyse des angles de diffusion pouvait offrir des informations concernant la valeur du rayon des atomes et la modalité de distribution de la charge positive. L'expérience employait des particules a parce que leur masse était comparable avec la masse des atomes, ainsi que les trajectoires des particules a n'étaient pas perturbées par les éventuelles collisions avec les électrons. La feuille diffusante était confectionné de l'or, le seul matériel qui permettait que l'épaisseur de la feuille soit extrÊmement petite (environ 100 de diamÈtres atomiques).
|
|
Les résultats de l'expérience ont été trÈs surprenants. Les estimations initiales, basées sur le modÈle de Thomson, montraient que, pratiquement, toutes les particules a incidentes auraient dÛ refléter sur la feuille. En fait, seulement une de dix milles de particules a été réfléchie, le reste traversant la feuille presque non dévié. L'interprétation de ce résultat était que la charge positive et, en mÊme temps, pratiquement l'entiÈre masse de l'atome sont concentrées dans un trÈs petit volume, par comparaison avec le volume de l'atome. Le fait qu'une seule particule a de dix milles particules est réfléchie montre que la 'surface pleine' de la feuille en or est seulement le dixiÈme de milliÈme de la surface apparente. De plus, comme la feuille est composée de 100 couches d'atomes, il résulte que la surface transversale effective d'une couche représente la millioniÈme partie de la surface apparente. La conclusion est que l'aire transversale de l'atome est 'pleine' seulement en proportion d'un à un million, ou que le rayon de la partie de l'atome occupée par la charge positive est mille fois plus petit que le rayon de l'atome. Le volume occupé par la charge positive de l'atome a été nommé noyau, et son rayon a une valeur d'environ 10-13 m.
Pour expliquer pourquoi les électrons demeurent dans le voisinage du noyau, ce qui assure la stabilité de l'atome, Rutherford a imaginé un nouveau modÈle atomique, nommé le modÈle planétaire ou le modÈle de Rutherford. Selon ce modÈle, les électrons tournent autour le noyau de la mÊme façon que les planÈtes tournent autour le Soleil. Le rôle de la force gravitationnelle est joué au niveau atomique par la force d'attraction électrostatique entre le noyau positif et les électrons négatifs. Pour le plus simple atome, celui d'hydrogÈne, la condition de stabilité sur l'orbite peut Être écrite comme ça
![]()
ou
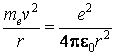
oÙ v est la vitesse de l'électron, et r le rayon de l'orbite. L'énergie totale de l'électron est composée par l'énergie cinétique et l'énergie potentielle électrostatique
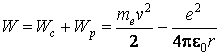
On élimine la vitesse à l'aide de la condition de stabilité et on obtient
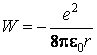
La valeur négative de l'énergie totale indique que l'électron se trouve dans un état lié, c'est-à-dire l'électron ne peut pas quitter l'atome sans recevoir de l'énergie de l'extérieur. Ainsi, pour ioniser un atome d'hydrogÈne (c'est-à-dire pour éloigner l'électron à une trÈs grande distance de noyau), en mettant pour le rayon de l'orbite la valeur r = 10-10 m, il serait nécessaire de consumer une quantité d'énergie
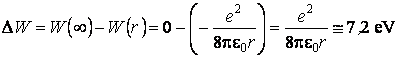
La valeur ainsi calculée était comparable avec les données expérimentales obtenues dans le cas de l'hydrogÈne DW = 13,6 eV, ce qui constituait un argument en faveur du modÈle planétaire.
Pourtant, ni le nouveau modÈle n'était pas capable à expliquer la totalité des données expérimentales. Ainsi, une des conséquences théoriques, résultant du modÈle planétaire et des lois de l'électrodynamique classique, était celle selon laquelle les électrons d'un atome, étant dans un état de mouvement permanent accéléré sur des orbites sans aucune restriction à l'égard de leurs rayons, doivent émettre en permanence du rayonnement électromagnétique au spectre continu. Mais, les données expérimentales ne confirment pas la prédiction théorique. De plus, le spectre d'émission expérimental est un spectre de raies. Dans le cas des atomes d'hydrogÈne, les longueurs d'onde des rayonnements émis obéissent à une loi, déterminée par expérience par Rydberg, de la forme suivante
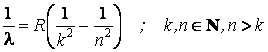
oÙ R = 109678 cm-1 s'appelle la constante de Rydberg. Les raies spectrales de l'hydrogÈne se groupent en séries spectrales, correspondantes aux valeurs du nombre entier k (k = 1: série de Lyman, k = 2: série de Balmer, k = 3: série de Brackett, etc). Parmi celles-ci, la seule trouvée dans le domaine du spectre visible est la série de Balmer. Un autre motif de désaccord entre la théorie et l'expérience est celui de la stabilité des atomes. Conformément aux lois de l'électrodynamique classique, par l'émission de rayonnement, l'énergie d'un électron devrait se diminuer en permanence, ce qui se manifesterait par la diminution du rayon de son orbite. Finalement, l'électron devrait tomber sur le noyau, fait qui conduirait à la disparition de l'atome. La valeur estimée du temps de vie de l'atome était trop petite pour Être en accord avec les données expérimentales qui montraient que les atomes étaient extrÊmement stables.
Pour éliminer les contradictions entre le modÈle théorique et les données expérimentales, Niels Bohr a conçu un nouveau modÈle de l'atome d'hydrogÈne, basé sur une série d'affirmations connues sous le nom des postulats de Bohr:
I. Le modÈle atomique planétaire de Rutherford est valable. Le but de ce postulat est de mettre en accord le modÈle avec les données qui confirment l'existence du noyau atomique.
II. Il y a certaines orbites, nommées orbites stationnaires, avec la propriété que les électrons qui y demeurent n'émettent pas de l'énergie électromagnétique. Ce postulat a comme but d'expliquer, d'un point de vue théorique, la stabilité des atomes. On doit faire mention du fait que le deuxiÈme postulat vient en désaccord avec le premier postulat, car le modÈle de Rutherford est basé sur les lois de la physique classique qui impliquent la perte d'énergie sous forme de rayonnement électromagnétique.
III.L'énergie de l'atome se modifie seulement par le saut d'un électron d'une orbite stationnaire à l'autre, processus accompagné par l'émission ou l'absorption d'un photon, dont l'énergie est égale en module avec la différence d'énergie entre les deux orbites stationnaires: hn = Wf - Wi. Ce troisiÈme postulat permet d'expliquer l'existence des raies spectrales et le fait que les atomes absorbent d'énergie seulement en quantités discrÈtes.
IV.Le moment cinétique de l'électron est quantifié, selon la relation
![]()
Si on discute ce postulat dans la lumiÈre de l'hypothÈse de de Broglie concernant l'existence des ondes associées aux microparticules, on observe que
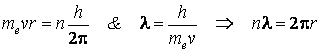
c'est-à-dire la longueur d'une orbite stationnaire est égale à un nombre entier de longueurs d'onde associées à l'électron, ou, autrement dit, l'onde associée à un électron est une onde stationnaire (ce qui explique pourquoi il n'y a pas de rayonnement énergétique).
Enfin, les postulats de Bohr doivent Être complétés avec l'affirmation: pour de grandes valeurs du nombre quantique n, le modÈle de Bohr doit offrir des résultats comparables aux ceux de la physique classique. Ce dernier postulat s'appelle aussi le principe de correspondance, et a le rôle d'établir les limites de démarcation entre la théorie quantique et la théorie classique, montrant que la théorie classique est un cas particulier de la théorie quantique.
Par l'élimination de la vitesse entre la relation de quantification du moment cinétique et la condition de stabilité sur l'orbite, on obtient les rayons des orbites stationnaires
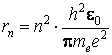
La premiÈre orbite stationnaire, nommée aussi la premiÈre orbite de Bohr, correspond au nombre quantique n = 1 et a la valeur
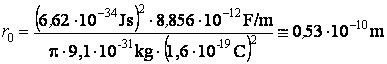
En substituant la valeur du rayon d'une orbite de Bohr dans l'expression de l'énergie totale de l'électron, on obtient l'expression de l'énergie d'une orbite stationnaire
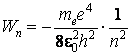
L'énergie de la premiÈre orbite de Bohr a la valeur
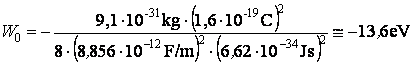
Conformément au troisiÈme postulat de Bohr, on peut obtenir aussi l'expression de la fréquence du photon absorbé ou émis quand l'électron passe d'une orbite stationnaire à l'autre
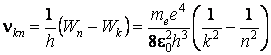
Puisque n = c/l, on obtient l'expression théorique de la loi de Rydberg
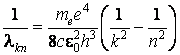
On peut calculer la valeur de la constante de Rydberg, en résultant
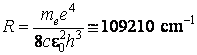
Toutes ces valeurs théoriques son en trÈs bon accord avec les mesurages expérimentaux, ce qui a fait accepter le modÈle de Bohr presque sans réserves, en dépit de toutes ses inconséquences.
L'extension du modÈle de Bohr pour d'autres types d'atomes que l'hydrogÈne a nécessité d'introduire des nouvelles conditions de quantification. Le nouveau modÈle a été nommé le modÈle Bohr-Sommerfeld. La base expérimentale de ce nouveau modÈle consiste de la loi de Moseley concernant le rayonnement X caractéristique émis par les atomes à plusieurs électrons
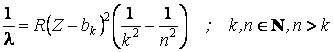
o Z représente le nombre atomique (c'est-à-dire le nombre d'ordre de l'élément dans le systÈme périodique de Mendéléev ou le nombre d'électrons de l'élément), R est la constante de Rydberg et bk est une constante, la mÊme pour toutes les éléments chimique si la valeur de k est la mÊme. Cette constante a le nom de constante de blindage. On a interprété la loi de Moseley comme la preuve de l'existence des groupes d'orbites stationnaires, la caractéristique commune d'un tel groupe étant la valeur de l'énergie. Un groupe d'orbites stationnaires entoure le noyau et forme une couche d'électrons entre le noyau et les orbites extérieures. Cette couche possÈde une charge négative qui affaiblit le champ engendré par la charge positive du noyau, ainsi que les électrons extérieurs tournent dans un champ électrique diminué. La constante de blindage bk est justement la mesure de la diminution du champ électrique du noyau par les couches inférieures à celle qui a le nombre d'ordre k. Le fait que la valeur de la constante de blindage est la mÊme pour tous les éléments chimiques conduit à la conclusion que, sans aucun rapport avec la nature de l'atome, une couche complÈte contient le mÊme nombre d'électrons. On complÈte les couches succésives par des électrons, dont l'énergie croit des couches inférieures aux couches supérieures. La derniÈre couche peut Être incomplÈte, et ses électrons sont responsables pour les propriétés chimiques de l'atome. La modalité par laquelle l'édifice intérieur de l'atome est structuré est conçue selon le modÈle Bohr-Sommerfeld comme le résultat de la quantification de quatre grandeurs physiques:
L'énergie des orbites stationnaires, quantifiée par le nombre quantique n, nommé nombre quantique principal. Toutes les orbites ayant le mÊme nombre quantique principal forment une couche.
Le moment cinétique des orbites stationnaires, quantifié par le nombre quantique orbital l. Les valeurs du l sont comprises entre 0 et n - 1. La forme des orbites stationnaires est elliptique. Plus que la valeur du nombre quantique orbital croit, plus l'excentricité de l'orbite augmente (l'orbite correspondante à la condition l = 0 étant circulaire). Le nombre des orbites elliptiques possibles pour une valeur donnée du nombre quantique principal est égal à n
Dans la présence d'un champ magnétique extérieur, la projection du moment magnétique de l'électron sur la direction des lignes de champ est aussi quantifiée. Le nombre quantique correspondant s'appelle nombre quantique magnétique. Le nombre quantique magnétique est noté par m et ses valeurs sont comprises entre -l et +l. Pour une valeur donnée du nombre quantique orbital, il y a 2l + 1 valeurs possibles du nombre quantique magnétique, chacune correspondant a une autre orientation spatiale de l'orbite de l'électron.
|
|
MÊme dans l'absence d'un facteur perturbateur, les raies spectrales du rayonnement lumineux de l'atome peuvent présenter une structure de doublet. Cette caractéristique a été interprété comme une preuve du fait que l'atome possÈde un champ magnétique propre, qui a deux orientations possibles. On peut imaginer que la source de ce champ réside dans la rotation de l'électron autour son propre axe de symétrie, de la gauche à la droite ou vice-versa. La derniÈre grandeur physique quantifiée est justement la projection du champ magnétique propre de l'électron sur la direction des lignes de champ magnétique. Le nombre quantique correspondant s'appelle nombre quantique de spin, et ses valeurs possibles sont: s =
L'ensemble de quatre nombres quantiques détermine l'état quantique de l'atome, et, conformément au principe d'exclusion de Pauli, dans un atome il n'y a pas deux électrons ayant tous les quatre nombres quantiques égaux.
En principal, le succÈs du modÈle Bohr-Sommerfeld a été dÛ à la bonne concordance entre les prédictions théoriques et les observations spectrales expérimentales, tout comme dans l'explication donnée au systÈme périodique de Mendéléev. Malgré ce succÈs, le modÈle reste une théorie inconséquente, qui 'greffe' dans la physique classique des conditions de quantification, c'est-à-dire des rÈgles qui n'ont rien à faire avec l'esprit de la physique classique. De plus, le modÈle Bohr-Sommerfeld échoue dans la tentative d'expliquer pourquoi certaines transitions quantiques sont plus probables qu'autres (ce qui se manifeste dans l'intensité des raies spectrales) ou pourquoi il y a des transitions quantiques interdites (les raies spectrales correspondantes manquent du spectre). Par ces raisons, aujourd'hui le modÈle Bohr-Sommerfeld est considéré dépassé.
Les modÈles atomiques actuels sont basés sur la mécanique quantique, sortant du cadre de la physique classique et renonçant à certaines notions traditionnelles, comme, par exemple, 'l'orbite de l'électron'. Le plus simple atome, l'hydrogÈne, est décrit dans la mécanique quantique par l'équation stationnaire de Schrödinger
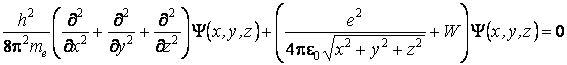
oÙ: Y(x,y,z) = la fonction d'onde de l'électron
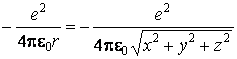 = l'énergie potentielle de l'électron
= l'énergie potentielle de l'électron
W = l'énergie totale de l'électron
Substituant les coordonnées cartésiennes x, y, z par les coordonnées sphériques r, q j, l'équation de Schrödinger devient
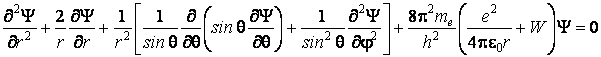
Si on écrit la fonction d'onde comme un produit de trois fonctions d'une seule variable
![]()
et on sépare les variables, il résulte un systÈme de trois équations différentielles
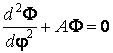
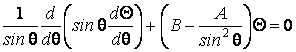
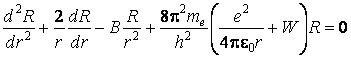
oÙ A et B sont des constantes. Pour que la solution Y vérifie les conditions nécessaires à une fonction d'onde, les constantes A, B et W doivent avoir certaines valeurs, nommées valeurs propres. Par exemple, la premiÈre équation a la solution
![]()
Pour que la fonction d'onde soit périodique (la rotation de l'électron avec l'angle 2p ne doit pas modifier l'état de l'électron) il est nécessaire que la valeur de la constante A soit égale à un nombre entier
A = m2
ainsi que les fonctions propres F ont l'expression
![]()
Puisque la fonction d'onde est normée, il est nécessaire que
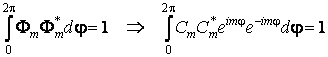
ou
![]()
Il résulte
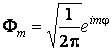
La fonction Fm est une fonction propre, et m est le nombre quantique correspondant à cette fonction propre.
Par analogie, on peut procéder de la mÊme maniÈre avec les deux autres équations, seulement que leur résolution est beaucoup plus difficile. Mais, en ce qu'il y a d'intérÊt pour nous, plus importantes que les solutions sont les conditions remplies par les valeurs propres et la signification physique qui y réside. Ainsi:
Þ les valeurs propres de l'énergie sont quantifiées
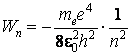
dépendant du nombre quantique principal n = 1, 2, Les valeurs propres de l'énergie sont égales avec celles calculées conformément au modÈle de Bohr.
Þ les valeurs propres du moment cinétique orbital sont aussi quantifiées
![]()
dépendant du nombre quantique orbital l = 0, 1, , n - 1. La valeur du moment cinétique orbital obtenue dans la mécanique quantique diffÈre de celle postulée par Bohr (L = lh/2p
Þ les valeurs propres de la projection du moment cinétique orbital sur l'axe Oz sont quantifiées
![]()
dépendant du nombre quantique magnétique m = 0, l. Le moment magnétique orbital de l'électron lui est aussi quantifié, étant proportionnel au moment cinétique orbital.
À la différence des modÈles démi-classiques de Bohr ou Bohr-Sommerfeld, dans la mécanique quantique on ne peut parler de plus des 'orbites' des électrons, mais seulement de la distribution spatiale de la probabilité de la présence de l'électron. Celle-ci est décrite par la densité de probabilité, égale au module carré de la fonction d'onde. La distribution de probabilité correspondante à chaque fonction propre s'appelle orbital. Les fonctions propres qui correspondent à la valeur l = 0 possÈdent une symétrie sphérique. La représentation graphique de la probabilité que l'électron soit placé à la distance r de noyau, 4pr y , en fonction de r, pour de différentes valeurs du nombre quantique principal n, donne des courbes, dont les maxima correspondent aux rayons des orbites de Bohr. Cela signifie que l'orbite, comme notion classique, représente seulement le lieu géométrique des points oÙ la probabilité de la présence de l'électron est maximum.
|
|
L'utilisation des méthodes de la mécanique quantique à l'étude des atomes à plusieurs électrons ou des autres microsystÈmes a fourni des résultats notables, ainsi que, aujourd'hui, cette science est en plein développement, en dépit des difficultés mathématiques impliquées.
On peut retenir de ce long historique du concept d'atome que la physique se développe par étapes, utilisant des modÈles temporaires qui sont abandonnés quand ils sont infirmés par l'expérience. Il doit aussi préciser que les modÈles physiques n'ont pas la prétention de décrire exactement la réalité, mais ils offrent seulement un cadre qui permet d'expliquer uns des phénomÈnes expérimentaux observés.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 612
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2024 . All rights reserved