| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Bioenergetica si metabolism oxidativ
Metabolismul reprezinta totalitatea proceselor chimice din organism in cadrul carora un numar variat de substante se convertesc in energie si produsi specifici.
1. Bioenergetica si metabolism
Procesele metabolice se desfasoara in sensul realizarii urmatoarelor obiective:
obtinerea energiei chimice din molecule "combustibil" sau din energia solara;
conversia substantelor nutritive exogene in precursori ai componentelor celulare;
asamblarea compusilor simpli (monomeri) in proteine, acizi nucleici, poliglucide;
formarea si degradarea biomoleculelor necesare diferitelor functii specifice.
Sursele de energie si de materie prima sunt diferite si, in functie de acestea, organismele se impart in mai multe grupe:
a) In functie de forma chimica a carbonului folosit:
- organisme autotrofe care folosesc drept sursa dioxidul de carbon (se hranesc singure), de exemplu plantele, unele bacterii;
- organisme heterotrofe care folosesc carbonul din mediu intr-o forma redusa (ex. glucoza), cum sunt animalele, microorganismele.
Celulele heterotrofe pot fi aerobe, folosind ca acceptor final oxigenul, si anaerobe, folosind alti acceptori. Multe celule heterotrofe sunt facultative, adaptandu-se la conditii aerobe sau anaerobe.
b) In functie de sursa de energie folosita, organismele pot fi:
- fototrofe, organismele ce folosesc lumina;
- chemotrofe cele care folosesc reactii de oxidoreducere.
Reactiile metabolice din organism se desfasoara in etape la care participa diferite substante denumite intermediari metabolici
Metabolismul are doua aspecte fundamentale contrastante: catabolism si anabolism.
Catabolismul cuprinde toate procesele degradative pe care le sufera moleculele nutritive (glucide, lipide, proteine) provenite din alimente sau din rezervele celulare.
Degradarea principiilor alimentare se caracterizeaza prin convergenta si se realizeaza in mai multe stadii (Figura 1):
Stadiul I - nutrientii sunt descompusi in unitatile constituente caracteristice;
Stadiul al-II-lea - unitatile de baza (aminoacizi, glucoza, acizi grasi) sunt degradate la un compus unitar, mai simplu, acetilCoA;
Stadiile al-III-lea si al IV-lea - reprezinta respiratia celulara si cuprinde procesele prin care acetilCoA este transformata in dioxid de carbon si apa. Prin transformarile realizate se formeaza cea mai mare parte din energia celulara sub forma de ATP.
Pe langa amoniac, dioxid de carbon, apa, ca produsi finali ai catabolismului mai rezulta acid lactic, uree, acid uric, creatinina, etc.
Anabolismul se refera la totalitatea reactiilor prin care se constituie din precursori biomoleculele complexe (proteine, acizi nucleici, polizaharide, lipide). Formarea noilor legaturi necesita o mare cantitate de energie furnizata de ATP-ul generat din procesele catabolice. Caile anabolice se caracterizeaza prin divergenta, de la un intermediar metabolic simplu putandu-se obtine pe cai diferite compusi cu functii biologice specifice.
Anumite cai metabolice centrale ale metabolismului intermediar (de exemplu ciclul Krebs) au atat rol catabolic cat si anabolic, fiind denumite cai amfibolice, cai prin care dintr-un compus simplu se formeaza o mare varietate de constituenti celulari.
Turnover celular. Componentele celulare nu raman intacte pe intreaga durata de viata a celulei. Ele se afla intr-un echilibru dinamic in care viteza relativ mare de sinteza este contrabalansata de o viteza la fel de mare de degradare. Relatia dintre acestea este denumita turnover metabolic. Turnoverul este rapid in tesuturile obligate sa se adapteze modificarilor substantelor nutritive exogene (de ex., ficat, mucoasa intestinala).
Pentru proteine hepatice, t1/2 este de 5-6 zile, in timp ce pentru cele musculare 30 zile.
Metode de studiu pentru procesele din metabolismul intermediar
Studii metabolice pe organisme intacte:
a. metode de marcare cu izotopi;
b. metode de determinare a consumului de oxigen;
c. metode de studiu pe organisme mutante.
Studii pe omogenate celulare/tisulare din care se separa fractiunile subcelulare: membrane, mitocondrii, nuclei.
Studii pe organe izolate si perfuzate.
Culturi de celule crescute pe medii cu o compozitie definita.
Studii pe microorganisme.
Studii pe sisteme acelulare prin intermediul enzimelor implicate.
Termodinamica sistemelor biologice
Procesele metabolice se desfasoara fie in sensul obtinerii de energie, fie pentru a folosi energia in reactii specifice.
Energia necesara activitatii organismului este preluata din mediu ca energie chimica sau solara si trebuie transformata in energie chimica din ATP.
Pentru a descrie schimburile de caldura, energie si materie si a stabili daca un proces este spontan sau nu trebuie aplicate legile termodinamicii.
Sistemul este portiunea din univers la care se face referire aflat in relatie cu mediul inconjurator. Sistemul poate fi:
izolat, nu schimba energie sau materie;
inchis - schimba energie;
deschis - schimba energie si materie.
Organismele vii sunt sisteme deschise.
Principiul I al termodinamicii: Intr-un sistem energia totala se conserva
Pentru ca orice forma de energie poate fi convertita in alta.
Principiul introduce o functie E, numita energie interna. E este o functie de stare si nu depinde de drumul urmat de sistem pentru a trece dintr-o stare in alta ci numai de starea respectiva.
ΔE = E2 - E1, se modifica doar daca in si din sistem iese sau intra caldura sau lucru mecanic.
ΔE = q + W
unde q - caldura absorbita din mediu
W - lucrul efectuat de mediu
W = - p ΔV;
ΔE = q - p ΔV; ΔV = ct à ΔE = q caldura transferata.
In procesele desfasurate la p = ct, ΔE este diferit de q, de aceea s-a introdus o noua marime H - entalpia.
H = E + pV.
H = E + p V = q - p V + p V = q
H este egala cu caldura transferata intr-un proces desfasurat la p=ct.
Pentru a putea compara parametri termodinamici trebuie definita o stare standard ( in solutie pentru concentratii 1M). Schimbarile de entalpie se pot determina calorimetric.
Principiul II al termodinamicii poate fi enuntat in mai multe moduri:
Sistemele tind sa mearga spre grad maxim de dezordine.
Entropia (S) sistemului si a mediului nu se modifica in procesele reversibile, dar creste in cele ireversibile.
In procesele spontane, entropia sistemului creste pana atinge echilibrul.
Entropia este S = k lnW, unde W - numarul de moduri de aranjare a componentelor sistemului fara a schimba H sau E.
Legatura dintre entropie si energia transferata este data de relatia: dS reversibil = dq/T
Pentru a stabili daca o reactie se desfasoara in sensul indicat trebuie comparate entalpia si entropia pentru reactia respectiva.
S-a introdus o marime noua - energia libera Gibbs G =H - TS .
Pentru orice proces A ↔ B reversibil, schimbul de energie ΔG =ΔH - TΔS, la p si T constante.
ΔG se defineste ca aceea parte din energia sistemului ce poate efectua un lucru mecanic cand sistemul se indreapta spre echilibru la p, T, V constante.
a. Daca ΔG = 0 - proces in echilibru
b. Daca ΔG ≠ 0 - sistemul va evolua spontan spre o stare finala cu energia libera ΔG < 0 si grad de dezordine ΔS > 0
Reactii exergonice, endergonice si cuplate Procesele metabolice se desfasoara fie in sensul obtinerii de energie, fie pentru a folosi energia in reactii specifice.
Energia necesara activitatii organismului este preluata din mediu ca energie chimica sau solara si trebuie transformata in energia chimica din ATP.
Pentru a descrie schimburile de caldura, energie si materie si a stabili daca un proces este spontan sau nu trebuie aplicate legile termodinamicii. Organismele vii sunt sisteme deschise, schimba energie si materie cu mediul inconjurator.
In functie de valoarea variatiei de energie libera ( G), reactiile biochimice pot fi:
a) reactii exergonice, G<0, procesul se desfasoara spontan in sensul indicat, cu eliberare de energie;
b) reactii endergonice, G>0, procesul are nevoie de energie pentru a se desfasura in sensul dorit, desfasurandu-se spontan in sens invers;
c) reactii cuplate, reactii prin care un proces nefavorabil termodinamic (ΔG) este transformat in unul favorabil cu ajutorul unui intermediar comun.
De exemplu:
A à B + C, ΔG = 13 kcal/mol
BàD, ΔG = - 20 kcal/mol
Reactia finala: A à C + D are ΔG = - 7 kcal/mol
De exemplu: Succinil CoA + H2O à succinat + CoA, ΔG = - 37,4 kJ/mol
GDP + Pi à GTP, ΔG = 34 kJ/mol
Reactia finala: succinil CoA + H2O + GDP + Pi à GTP + succinat + CoA, ΔG = -3,4 kJ/mol
Un numar mare de compusi mediaza transferarea energiei de la reactiile exergonice la cele endergonice: coenzimele reduse (NADH,H+, FADH2) si compusii macroergici
a) Anhidride al acidului fosforic si acizilor carboxilici;
b) Enolfosfati: fosfoenolpiruvat (PEP);
c) Fosfoguanidine cu rol de depozit de energie
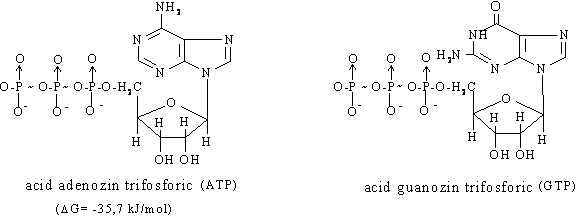
d) Nucleotid polifosfati cu rol de depozit de energie: ATP, CTP, GTP, UTP;
e) Esteri tiolici
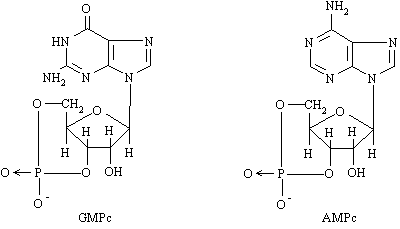
f) Nucleotide ciclice: AMPc, GMPc
g) Glucide si aminoacizi activati: S-adenozilmetionina, UDP-glucoza etc.
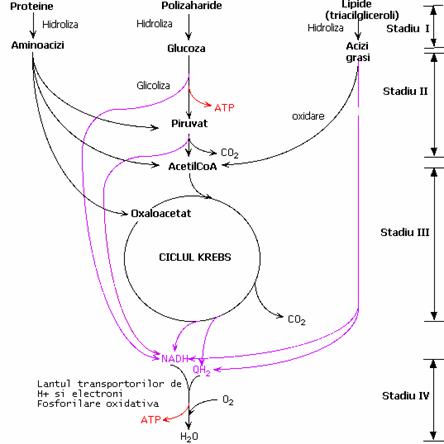
Anhidride al acidului fosforic si acizilor carboxilici: carbamoil fosfat, acid 1,3 difosfogliceric(1,3 DPG).
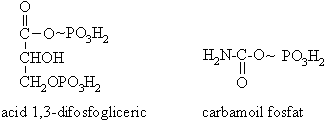
Enolfosfati: PEP
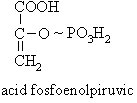
Fosfoguanidine cu rol de depozit de energie:
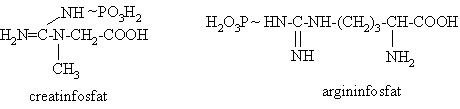
Nucleotid polifosfati cu rol de depozit

Esteri tiolici:
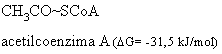
Nucleotide ciclice
In procesele biochimice, principalul intermediar comun ce inmagazineaza energia este acidul adenozintrifosforic (ATP).
ATP are in molecula doua legaturi fosfat macroergice ce se pot scinda in mod diferit:
ATP + H2O à ADP + Pi, G0 = - 7,3 kcal/mol
ATP + H2O à AMP + PPi, G0 > - 10 kcal/mol
ATP ocupa o pozitie centrala in energetica celulara functionand ca intermediar intre donorii de energie si acceptorii de energie metabolici.
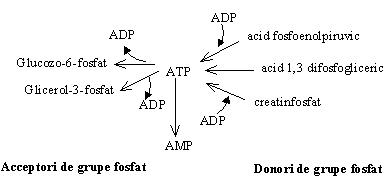
ATP este principalul compus macroergic care furnizeaza energia pentru reactiile metabolice, contractia musculara, excitatia nervoasa, transportul activ prin membrane.
Prin oxidarea unor compusi biologici rezulta piruvat odata cu eliberarea unei parti din energia inmagazinata.
In conditii de aerobioza, catabolismul piruvatului continua pana la CO2 si apa prin respiratie celulara, cu eliberarea completa a energiei inmagazinate.
Respiratia celulara reprezinta procesul general spre care converg reactiile de catabolism al tuturor principiilor alimentare (glucoza, acizi grasi, aminoacizi) si include:
a) ciclul Krebs (ciclul acizilor tricarboxilici, ciclul acidului citric);
b) lantul transportorilor de hidrogen si electroni (lantul respirator);
c) fosforilarea oxidativa (procesul de sinteza a ATP).
Localizare intracelulara. Enzimele implicate in acest proces sunt localizate fie in matricea mitocondriala, fie in diferite zone ale membranei mitocondriale.
Membrana mitocondriala nu este selectiva pentru piruvat, astfel ca acesta poate patrunde in mitocondrie pentru a se transforma in acetilCoA prin decarboxilare oxidativa.
Decarboxilarea oxidativa a piruvatului reprezinta veriga intre procesele ce genereaza piruvat (in special, glicoliza) si ciclul Krebs.
Transformarea piruvatului in acetilCoA se realizeaza treptat, sub actiunea unui sistem multienzimatic denumit piruvat dehidrogenaza care reprezinta asocierea necovalenta a trei enzime: piruvat dehidrogenaza decarboxilanta coenzima tiaminpirofosfat (TPP), lipoilreductaz transacetilaza, acid lipoic ca si coenzima, si dihidrolipoil dehidrogenaza, coenzima FAD. La procesul de decarboxilare mai participa coenzima A (CoASH) si NAD+, ce actioneaza independent in procesul ireversibil al decarboxilarii piruvatului.
Procesul de decarboxilare decurge in mai multe etape:
Etapa I:

Etapa II:
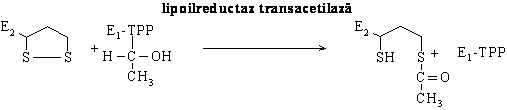
Etapa III:
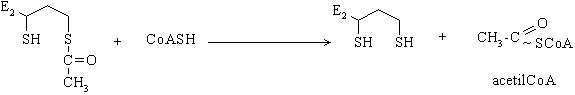
Etapa IV:
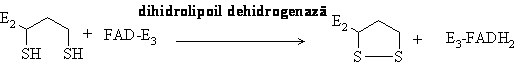
Etapa V:
![]()
Procesul se reia odata cu refacerea formei initiale a enzimelor.
i Corelatii clinice. Avitaminoza B1 determina o decarboxilare defectuoasa a piruvatului, acesta se acumuleaza in organism, in special in creier, determinand o serie de tulburari neurologice (sindromul Wernicke-Korsakoff). Simptome asemanatoare pot sa apara in cazul consumului cronic de alcool.
Ciclul Krebs (ciclul acizilor tricarboxilici, ciclul acidului citric)
Ciclul Krebs este calea metabolica prin care acetilCoA se oxideaza cu formare de dioxid de carbon odata cu cedarea hidrogenului unor echivalenti de reducere (formele reduse ale coenzimelor NAD+ si FAD). Procesul se desfasoara in mai multe etape, enzimele ce le catalizeaza fiind localizate, majoritatea in matricea mitocondriala.
Secventa ciclului Krebs
1. Etapa de initiere Are loc condensarea acetilCoA cu oxalilacetatul, reactie catalizata de citrat sintaza. Este o condensare aldolica in care componenta metilenica este acetilCoA, iar cea carbonilica este oxalilacetatul:
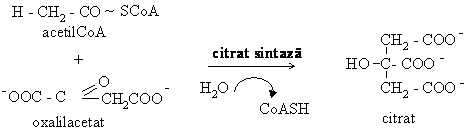
G'0 = -32,2 kJ/mol
Citrat sintaza este un dimer activat prin legarea oxalilacetatului la primul situs activ. Apare o modificare conformationala ce faciliteaza legarea acetilCoA si initierea reactiei. Inhibitorii allosterici ai acestei enzime sunt NADH,H+ si succinilCoA.
2. Izomerizarea citratului sub actiunea aconitazei:
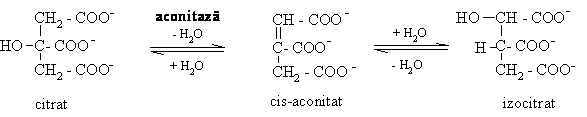
G'0= 13,3 kJ/mol
Aconitaza poate fi inhibata in vivo si in vitro de acidul fluoracetic care sub actiunea citrat sintazei formeaza fluoracetilCoA.
3. Oxidarea izocitratului sub actiunea izocitrat dehidrogenazei ( G'0=-20,9 kJ/mol).

Izocitrat dehidrogenaza prezinta si o izoenzima citoplasmatica ce este NADP+-dependenta si intervine in procesul de sinteza a NADPH, H+ necesar biosintezelor reductive. Inhibitori allosterici sunt ATP-ul si NADH,H+.
4. Decarboxilarea oxidativa a -cetoglutaratului se realizeaza sub actiunea -cetoglutarat dehidrogenazei, un complex enzimatic asemanator structural piruvat dehidrogenazei, realizand decarboxilarea -cetoglutaratului ( G'0=-33,5 kJ/mol).

Descompunerea succinilCoA in prezenta tiokinazei. Aceasta etapa presupune mai intai eliberarea CoASH cu transformarea succinilCoA in succinilfosfat, iar apoi in prezenta GDP se formeaza succinat:
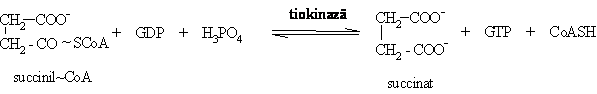
G'0=-2,9 kJ/mol).
Aceasta etapa reprezinta o fosforilare la nivel de substrat, deoarece descompunerea succinilCoA furnizeaza energia necesara fosforilarii GDP si, indirect, a ADP:
![]()
6. Oxidarea succinatului, reactie catalizata de succinat dehidrogenaza, singura enzima FAD dependenta a ciclului Krebs:
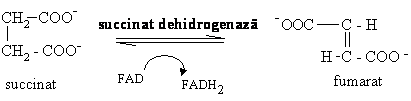
G'0= 0 kJ/mol)
Succinat dehidrogenaza este singura enzima a ciclului Krebs ce nu se gaseste in matrixul mitocondrial ci este legata de membrana interna mitocondriala. Aceasta contine grupe Fe-S ce retin electronii de la FAD si ii cedeaza lantului transportorilor de H+ si e- din membrana. Enzima este puternic inhibata competitiv de malonat.
7. Hidratarea fumaratului cu formare de L - malat in prezenta fumarazei:

G'0= -3,8 kJ/mol)
Enzima este stereospecifica in ambele sensuri.
8. Oxidarea malatului sub actiunea L-malat dehidrogenazei :
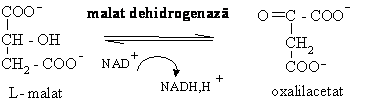
G'0= 29,7 kJ/mol)
In urma acestei reactii se formeaza continuu oxalilacetat care reia ciclul Krebs. L-malat dehidrogenaza prezinta si ea o izoenzima citoplasmatica care este implicata in procesul de gluconeogeneza.
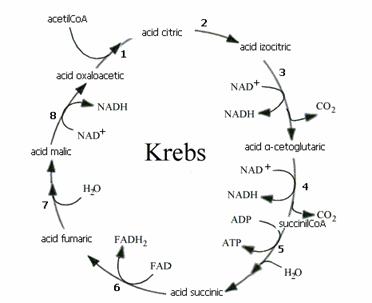
Figura 3. Secventa reactiilor din ciclul Krebs
Pe parcursul ciclului Krebs sunt 4 etape ireversibile din care rezulta echivalenti de reducere ce vor alimenta lantul transportorilor de H+ si electroni: etapele 3, 4, 6 si 8:
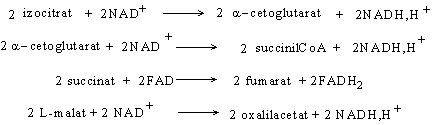
Echivalentii de reducere conserva energia rezultata la oxidarea acetil-CoA.
Reactia globala a ciclului Krebs este:
2CH3CO~SCoA + 6 NAD+ + 2FAD + 2GDP + 2Pi + 4H2O à 4CO2 + 6NADH,H+ + 2 FADH2 + 2GTP + 2CoASH
a) Citratul poate sa iasa din mitocondrie in citoplasma unde genereaza acetilCoA necesara biosintezei acizilor grasi si steroizilor.
b) -cetoglutaratul si oxaloacetatul participa la reactii de transaminare, facand legatura cu metabolismul proteic;
c) SuccinilCoA este precursorul protoporfirinei IX din structura hemului;
d) Unii intermediari ai ciclului Krebs sunt verigi importante in metabolismul aminoacizilor (Figura 4).
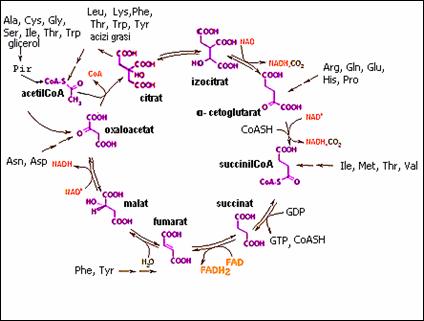
Figura 4. Ciclul Krebs - cale amfibolica
Lantul transportorilor de H+ si electroni
Lantul transportorilor de H+ si electroni este etapa a respiratiei celulare ce continua oxidarea echivalentilor de reducere formati, mai ales, in ciclul Krebs.
Acest proces este posibil cu participarea unor componente ale membranei mitocondriale, majoritatea proteinenzime, ce realizeaza reoxidarea echivalentilor de reducere (NADH, FADH2), energia obtinuta fiind canalizata ulterior spre sinteza de ATP prin procesul de fosforilare oxidativa. Procesul consta in reactii de oxidoreducere prin care electronii si protonii (H+), se deplaseaza de la formele reduse NADH, H+ pana la oxigen, acceptorul final al lantului, cu formare de apa.
Reactia globala este:
NADH,H+ + ½ O2 à NAD+ + H2O
Reactia poate fi impartita in doua reactii partiale:
NAD+ + 2H+ + 2e- à NADH,H+ + H2O, E'0 = - 0,32 V
½ O2 + 2H+ + 2e- à H2O, E'0 = 0,82 V
Variatia de potential este mare, E'0 = E'0acceptor (o2) - E'0 donor (NAD+) = 1,14V.
Lantul transportorilor de H+si electroni permite trecerea treptata a celor 2e- de la cuplul cu potentialul cel mai electronegativ (NADH/NAD+) la cel cu potentialul cel mai electropozitiv (O2) prin implicarea mai multor cupluri redox ale caror potentiale sunt intermediare intre cele doua valori.
Energia eliberata este stocata de-a lungul membranei interne a mitocondriei sub forma unui gradient de protoni (H+) ce furnizeaza energia necesara sintezei de ATP.
Componentele lantului respirator se deosebesc din punct de vedere al naturii lor:
a) flavinenzime (flavoproteine);
b) coenzima Q (ubiquinona), componenta liposolubila;
c) citocromii;
d) proteine Fe-S;
e) proteine cu cupru.
Flavoproteinele contin o grupa FMN sau FAD legata covalent si mai rar necovalent de partea proteica. Ele fac legatura intre coenzimele piridinice si lantul respirator. Pot sa transfere 1-2 e-. Sunt patru astfel de flavoproteine: NADH oxidoreductaza, succinat oxidoreductaza, acid grasCoA oxidoreductaza si glycerol-3-fosfat dehidrogenaza.
Coenzima Q (ubiquinona) este o chinona liposolubila. Functioneaza ca transportor mobil de electroni, deoarece fiind liposolubila se poate deplasa prin membrana mitocondriala.
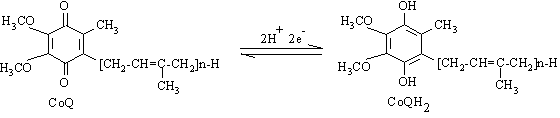
Daca n=10, forma este a coenzimei Q10
Citocromii b si c1 sunt hemoproteine localizate in lant intre CoQ si citocromul c.
Citocromii a si a3 functioneaza impreuna formand complexul citocrom oxidazei.
Citocromii functioneaza prin transferul de electroni cu modificarea valentei atomului de metal continut (fier sau cupru).
Citocromii se deosebesc prin spectrele de absorbtie, potentialele redox, modul de legare a hemului la apoproteina.
Citocromii b si c1 sunt localizati intre CoQ si citocromul c. Citocromii a si a3 functioneaza impreuna formand complexul citocrom oxidazei. Acesta mai contine proteine cu cupru care realizeaza transferul unui electron prin intermediul ionului de cupru.
cit bc1à cit cà Cu2+ à cit a a3 à O2
Proteinele Fe-S sunt proteine membranare ce contin in cantitate echimoleculara fier neheminic si sulf acidosolubil. Fierul se leaga de proteine prin intermediul unor resturi de cisteina (mai rar de histidina in proteinele Rieske). Proteinele Fe-S au structura variata in functie de numarul de atomi de fier si sulf pe care-i contin. Transfera un electron cu participarea fierului.

Prin solubilizarea membranei mitocondriale s-au izolat 4 complexe membranare pe care le formeaza aceste componente:
Complexul I: NADH CoQ oxidoreductaza;
Complexul II: succinat CoQ oxidoreductaza;
Complexul III: CoQ citc oxidoreductaza;
Complexul IV: citocrom c oxidaza.
Ele se gasesc distribuite in membrana mitocondriala in pozitii fixe.
Complexul I accepta electroni de la NADH,H+ si face legatura intre ciclul Krebs, oxidarea acizilor grasi, glicoliza si lantul transportor de H+ si electroni. La nivelul acestui complex sunt expulzati 4 protoni in membrana mitocondriala.
Complexul II include succinat dehidrogenaza, enzima ce intervine in ciclul Krebs, reprezentand o legatura directa intre acest proces metabolic si lantul respirator.
Neavand suficienta energie, complexul al II-lea nu poate sa expulzeze protoni pe fata dinspre citoplasma a membranei, asa cum se realizeaza in cazul complexului I.
Complexele I si II cedeaza electroni coenzimei Q ce reprezinta substratul pentru complexul III. La nivelul CoQ se realizeaza expulzarea a 4 protoni pe fata dinspre citosol.
Complexul IV reoxideaza citocromul c, reducand oxigenul cu formarea apei. Si la acest nivel sunt expulzati 2 protoni in spatiul intermembranar.
Secventa lantului respirator:
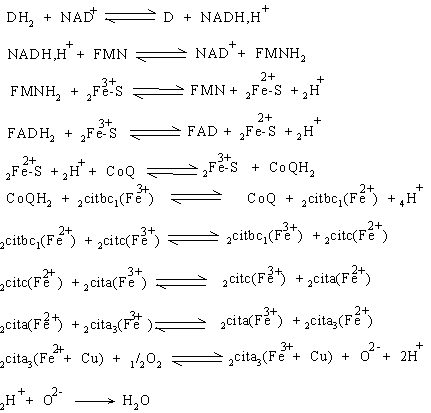
Inainte de a fi cedati citocromului a, electronii trec la un atom de cupru, iar dupa citocromul a3, electronii trec la un alt atom de cupru si de la acesta la oxigen.
Odata cu transportul electronilor, 10 H+ sunt eliberati in spatiul intermembranar, se acumuleaza pe fata dinspre citosol generand un gradient de H+ ce reprezinta o sursa enorma de energie potentiala care va fi folosita pentru sinteza ATP-ului (forta motrice a protonilor), odata cu revenirea acestora in matricea mitocondriala.
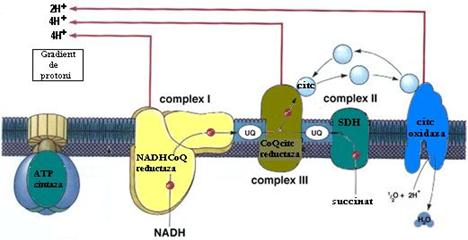
Complexele lantului transportor de protoni si electroni
In lantul respirator exista trei etape ce decurg cu o scadere a energiei mai mare de 7,3 kcal cat sunt necesare pentru sintetiza unei legaturi macroergice in ATP.
1. NADH,H+à CoQ, G'0 = - 12,2 Kcal/mol
2. citbà citc, G'0 = - 9,9 Kcal/mol
3. citc à O2, G'0 = - 23 Kcal/mol
Complexul mitocondrial ce realizeaza sinteza ATP-ului se numeste ATP-sintaza (F1 ATP-aza). Enzima are doua componente: F1, o proteina periferica de membrana, care catalizeaza sinteza ATP-ului, si F0, o proteina integrala, care reprezinta porul membranar ce formeaza canalul prin care sunt transportati H+ in matricea mitocondriala.
Enzima este localizata majoritar pe fata dinspre matrice a membranei, iar studiile facute cu enzima izolata de membrana au aratat ca ea catalizeaza doar hidroliza ATP-ului nu si sinteza (F1ATP-aza).
Eliberarea ATP-ului sintetizat in citoplasma se face cu o ATP-ADP-translocaza, ce permite introducerea a 4H+/ mol ATP sintetizat.
S-a introdus o notiune numita cat de fosforilare (P/O) ce reprezinta numarul de moli de ATP formati prin fosforilarea ADP raportat la atomii de oxigen redus.
Unii metaboliti (piruvat, izocitrat etc.) pot determina sinteza a circa 3 moli de ATP pentru fiecare atom de oxigen redus, in timp ce oxidarea altor substraturi (succinat etc.) determina sinteza a aproximativ 2 moli, deoarece intra in lant dupa primul situs de fosforilare.
Desi mecanismul cuplarii transportului mitocondrial de electroni cu sinteza de ATP a ramas incomplet elucidat, totusi se accepta una din urmatoarele ipoteze ce explica acest lucru:
a. Ipoteza cuplarii chimice (Slater) - postuleaza existenta unui intermediar chimic bogat in energie generat prin transferul electronilor in lantul respirator. Dezavantaje: nu s-au identificat intermediarii postulati si nu explica de ce este necesara integritatea membranei.
b. Ipoteza cuplarii conformationale (Boyer) - postuleaza faptul ca in urma transportului de electroni prin membrana se induce o modificare conformationala a unei proteine membranare. Starea inalt energizata formata cedeaza energia fosforilarii ADP, proteina revenind la o stare relaxata. Dezavantajul acestei ipoteze este acela ca energia produsa de modificari conformationale este mai mica de 7,3 Kcal/mol.
c. Ipoteza chemiosmotica (Mitchell) - postuleaza fomarea unui gradient de protoni in timpul transportului de electroni, generand energia necesara sintezei de ATP.
Membrana este impermeabila pentru protoni, ei se acumuleaza pe fata dinspre citosol ce devine pozitiva. Odata cu trecerea protonilor in interior si a ADP-ului din citosol in mitocondrie, protonii sunt pompati spre exterior, fiind eliberati ioni HO-.
Conform acestei ipoteze pentru substraturile ce genereaza NADH, catul P/O = 2,5, iar pentru cele care genereaza FADH2 P/O = 1,
Inhibitorii lantului transportorilor de H+ si electroni si ai fosforilarii oxidative
Procesul de respiratie celulara poate fi afectat de anumiti compusi ce impiedica transferul H+ si electronilor prin lantul respirator sau cuplarea cu fosforilarea oxidativa.
a) Inhibitori ai complexului I: rotenona(insecticid), amital (barbituric), unele antibiotice, mercuricele, demerolul (analgezic);
b) Inhibitori ai complexelor II si III (blocheaza transportul electronilor): antimicina (antibiotic din Streptomyces griseus);
c) Inhibitori ai complexului IV (blocheaza transportul electronilor de la citocromul a3 la oxigen: cianura, azida, monoxid de carbon;
d) Inhibitori ai ATP-azei: oligomicina.
Agentii de decuplare sunt compusi care actioneaza prin disiparea gradientului de H+ din membrana interna mitocondriala, de ex. 2,4-dinitrofenolul, dicumarolul.
Au posibilitatea de a functiona ca transportori de H+ de pe fata citosolica spre cea dinspre matrice a membranei, in locul ATP-sintazei. Energia eliberata de transferul de electroni este disipata sub forma de caldura.
Animalele nou-nascute, cele adaptate la frig si cele care hiberneaza au capacitatea de a genera cantitati mari de caldura prin decuplarea fosforilarii oxidative.
Tesutul adipos al acestora contine multe mitocondrii (care-i dau culoarea bruna - tesut adipos brun). Membrana interna a mitocondriilor din celulele tesutului adipos brun contin o proteina endogena denumita termogenina sau UCP-1 (uncoupling protein - 1, proteina decuplanta mitocondriala) care formeaza canalul pentru trecerea H+ dinspre citosol spre matrice, decupland ATP-sintaza.
Deoarece membrana mitocondriala este impermeabila pentru NADH,H+ trebuie sa existe niste sisteme transportoare care sa realizeze intrarea acestuia in mitocondrie.
Sistemele suveica (naveta) sunt cele ce realizeaza transportul NADH,H+ prin membrana mitocondriala spre NADH dehidrogenaza.
Sistemul malat-aspartat functioneaza in ficat, rinichi, miocard.
Actioneaza bidirectional deoarece transporta echivalentii de reducere din citosol in mitocondrie sau invers. Este nevoie de participarea izoenzimelor citosolice si mitocondriale ale malat dehidrogenazei (MDH) si aspartat aminotransferazei (AST) precum si de transportori specializati in transferul prin membrana interna mitocondriala a malatului, glutamatului, aspartatului si -cetoglutaratului.
Acest sistem asigura reoxidarea NADH,H+ citosolic cu formare a aproximativ 2,5 moli de ATP, dar si reglarea raporturilor NADH,H+/NAD+ extra si intramitocondriale.
Sistemul glicerol-3-fosfatului functioneaza in creier si muschi.
Dihidroxiacetonfosfatul, intermediar al glicolizei este redus de glicerol-3-fosfat-dehidrogenaza citosolica, enzima NAD+ dependenta, la glicerol-3-fosfat.
DHAP + NADH,H+ à glicerol-3-fosfat + NAD+
Glicerol-3-fosfatul poate patrunde in spatiul intermembranar unde este reoxidat de catre glicerol-3-fosfat-dehidrogenaza mitocondriala, la DHAP. Aceasta enzima nu este NAD dependenta ci FAD dependenta.
Glicerol-3-fosfat + FAD à FADH2 + DHAP
Echivalentii reducatori sunt cedati CoQ si intra in lantul respirator dupa primul situs de fosforilare, cu eliberarea a aproximativ 1,5 moli ATP. DHAP revine in citosol unde reia ciclul de reactii.
Acest sistem este unidirectional si are drept scop mentinerea constanta a NADH,H+ si sinteza de ATP pe seama reactiilor de dehidrogenare din citosol.
Formarea de specii reactive ale oxigenului
Majoritatea oxiarilor intracelulare au ca finalitate transferul a doi electroni unor acceptori precum NAD+ sau FAD ce sunt apoi reoxidati in lantul transportorilor de protoni si electroni unde acceptorul final este oxigenul.
Structura electronica a oxigenului favorizeaza reducerea sa si prin acceptarea unui electron. Prin transferul unui singur electron prin lant catre oxigen de la nivelul complexelor I si II catre complexul III, proces in care este implicata forma semiquinonica a CoQ, se poate forma superoxidul O2-, una din speciile reactive ale oxigenului (ROS).
Superoxidul poate forma prin reactia catalizata de superoxiddismutaza peroxid de hidrogen (H2O2). Aceasta nu este un radical, dar prin reactiile Fenton si Haber-Weiss este convertit la radicalul hidroxil (HO.), in prezenta ionilor Fe2+ sau Cu2+ din celule (vezi figura).
ROS produsi in mitocondrie prin lantul respirator sunt: superoxid, peroxid de hidrogen si radical hidroxil.
Se mai formeaza ROS si in organite: in peroxizomi ca rezultat al oxidarii acizilor grasi cu formare de peroxid de hidrogen ce este convertit rapid in radical hidroxil; in reticulul endoplasmatic prin sistemul citocromilor P450.
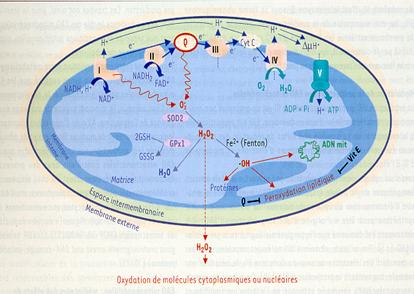
Speciile reactive ale oxigenului au si efecte benefice fiind implicate in numeroase reactii fiziologice.
In situatii fiziologice si fiziopatologice se remarca interactii intre speciile reactive ale oxigenului si speciile reactive ale azotului, importante intre acestea fiind oxidul nitric NO si peroxinitritii (ONOO ). NO se formeaza din arginina in prezenta diferitelor nitric oxid sintaze si indeplineste roluri importante: vasodilatatie si reglarea tonusului vascular, inhibitia agregarii plachetare, neuromediere.
ROS au un potential oxidant semnificativ, modificarile majore produse de speciile reactive ale oxigenului fiind :
- leziuni ale bazelor azotate din acizii nucleici urmate de distrugeri celulare si mutatii;
- perturbarea enzimelor tiol dependente;
- alterarea legaturilor covalente din proteine si lipide;
- modificarea glicoproteinelor;
- cresterea turnover-ului proteic, proteoliza, agregarea si fragmentarea proteinelor;
peroxidarea lipidelor, modificari in structura si functia membranelor datorate alterarii proteinelor membranare si transportului prin membrane.
In tabelul urmator sunt prezentate date referitoare la procesele generatoare de ROS si sistemele antioxidante ce le descompun.
Sisteme antioxidante
- enzimatice: peroxidaze (mieloperoxidaza, lactoperoxidaza, glutation peroxidaza), catalaza, superoxid dismutaze, glutation transferaze.
- neenzimatice: vitamina E (a-tocoferolul), vitamina C, acidul uric, vitamina A, seleniul, metalotioneinele, N-acetil-cisteina, chelatorii de fier, metionina, serotonina, histidina, albumina, haptoglobina, ceruloplasmina, coenzima Q10, estrogenii, flavonoidele, porfirinele, poliaminele, acizii grasi mononesaturati etc.
Tabel . SPECIILE REACTIVE ALE OXIGENULUI (SRO)
|
Radical |
Procese generatoare |
Efecte |
Sistem antioxidant |
|
Superoxid O2.- |
Lanturi transportoare de e- Activitatea macrofagelor si neutrofilelor Metabolizarea medicamentelor Activitatea xantin oxidazei, lipo si ciclooxigenazei etc. Autooxidarea catecolaminelor, melaninei, hemului etc. Surse exogene: oxidarea para- cetamolului, CCl4, actiunea radiatiilor UV, ionizante, ultrasunetelor. |
Reactii de transfer e- cu metale tranzitionale din enzime SOD:
Mnn++ H2O2 Descompunerea apei oxigenate: reactia Haber-Weiss O2.-++H2O2 O2+OH. + reactia Fenton Fe2++H2O2 Fe3++OH. + |
SOD (Superoxid Dismutaza) cu Zn si Cu, Mn si Fe, enzime cuplate cu catalaza ce metab. H2O2 |
|
Hidroxil HO. |
Interconversia superoxidului si a apei oxigenate Intoxicatii cu CO, in hiperoxie Reactii determinate de inhibitorii de monoaminooxidaza, lipopolizaharide bacteriene, subst. fotosensibilizante |
Formarea radicalilor liberi din glucide, aminoacizi, lipide, baze azotate, etanol |
Metalotioneine, Albumina, Glucoza, vitamina C, Melatonina, Captopril etc. |
|
Hidroperoxil HO2. |
Dismutare spontana a O2.- Fotoliza apei, radioliza apei, Iradierea UV |
Peroxidarea lipidelor | |
|
Peroxil ROO. |
Reactiile radicalilor cu diverse molecule organice, aditia oxigenului singlet la acizii grasi polinesaturati |
Reactii de peroxidare ce dau aldehide, radicali, etan, pentan, lipofuscina |
Majoritatea sistemelor antioxidante |
|
Oxigenul singlet 1O2 |
Fotosensibilizare cu medicamente, cosmetice, fitotoxine, porfirine Descompunerea peroxizilor Reactiile mieloperoxidazei leucocitare, lactoperoxidazei salivare |
Mutageneza, genotoxicitate |
Antioxidanti neenzimatici, 2,5-dimetil- furan |
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 7391
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved