| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Echilibrul dintre solutie si vaporii solventului poate fi
studiat si la presiune constanta. Mentinandu-se sistemul la presiunea
atmosferica, se observa o crestere a temperaturii de fierbere a solutiei Tf
fata de temperatura de fierbere a solventului pur ![]() .
.
Experimental se constata ca in solutie diluata, cresterea temperaturii de fierbere a acesteia este direct proportionala cu concentratia molala (moli solvat/ 1 kg solvent) b2 a solutiei:
![]() (5.44)
(5.44)
unde: ![]() =
temperatura de fierbere a solventului pur;
=
temperatura de fierbere a solventului pur;
![]() = temperatura de fierbere a solutiei;
= temperatura de fierbere a solutiei;
Kf = constanta ebulioscopica (cresterea ebulioscopica molala); este o constanta caracteristica solventului;
b2 = concentratia molala a solutiei.
Valoarea constantei ebulioscopice nu depinde de natura solvatului, ci numai de
natura solventului deoarece daca b2 = 1, rezulta Kf = Tf
- ![]() .
.
Relatia (5.44) se numeste ecuatie ebulioscopica.
Diferenta Tf - ![]() se numeste crestere ebulioscopica.
se numeste crestere ebulioscopica.
Cresterea temperaturii de fierbere a solutiei se poate
calcula cu ajutorul ecuatiei Gibbs-Helmholtz exprimata prin ![]() (5.24):
(5.24):
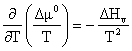
unde: Hv = caldura latenta molara de vaporizare.
![]() rezulta
din conditia de echilibru termodinamic (5.33) cand apare egalitatea
potentialului chimic al solventului in faza de vapori si in solutie.
rezulta
din conditia de echilibru termodinamic (5.33) cand apare egalitatea
potentialului chimic al solventului in faza de vapori si in solutie.
In procesul de vaporizare, solventul trece din starea initiala de solutie in cea finala de vapori, astfel ca:
![]() (5.45)
(5.45)
Impartind relatia (5.45) cu T, derivand-o in raport cu T si comparand-o cu relatia (5.24) se obtine:
![]() (5.46)
(5.46)
unde: p1 = 1 atm (presiunea la temperatura de fierbere).
Considerand Hv constant, separand variabilele si integrand ecuatia (5.46):
![]() (5.47)
(5.47)
se obtine:
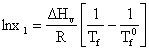 (5.48)
(5.48)
respectiv
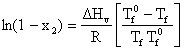 (5.49)
(5.49)
In solutii diluate x2 ≤ 1, astfel ca dupa dezvoltarea in serie a ln(1 - x2) se poate retine numai primul termen:
![]() (5.50)
(5.50)
De asemenea, considerand ![]()
![]() Tf, produsul Tf
Tf, produsul Tf![]() se poate
inlocui cu
se poate
inlocui cu ![]() . Deci
ecuatia (5.49) devine:
. Deci
ecuatia (5.49) devine:
![]() (5.51)
(5.51)
Din ecuatia (5.51) rezulta:
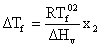 (5.52)
(5.52)
Se constata ca cresterea ebulioscopica este proportionala cu fractia molala a solvatului.
In solutii diluate ideale:
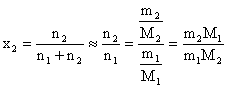 (5.53)
(5.53)
Relatia (5.52) devine:
![]() (5.54)
(5.54)
Concentratia molala a solutiei b2 este:
![]() (5.55)
(5.55)
Relatia (5.54) se poate scrie:
![]() (5.56)
(5.56)
Notand:
![]() (5.57)
(5.57)
Relatia (5.56) ia forma relatiei (5.44): Tf = Kfb2.
Deci relatia (5.56) se poate scrie astfel:
![]() (5.58)
(5.58)
Relatia (5.58) permite calcularea masei moleculare a solvatului M2 daca se cunosc Tf si Kf:
![]() (5.59)
(5.59)
Aparatul folosit pentru masurarea temperaturilor de fierbere a solutiei si a solventului pur se numeste ebulioscop.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3542
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved