| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
MECANISME DE CHEMOSORBTIE SI DE REACTIE IN CATALIZA ETEROGENA
Un ciclu catalitic este definit de o secventa inchisa de etape elementare: in prima etapa, un centru activ este transformat intr-un intermediar activ; in urmatoarele etape, fiecare intermediar activ regenereaza centrul activ liber.
Stabilirea mecanismului unei reactii catalitice eterogene necesita lamurirea urmatoarelor aspecte:
succesiunea etapelor elementare;
etapa determinanta de viteza;
natura chimica si geometria centrilor activi care participa la reactia catalitica;
structura intermediarilor activi;
contributia atomilor aflati in afara centrului de reactie.
1. Mecanismele chemosorbtiei
pe metale
Cunoasterea mecanismului de interactie a unei molecule cu suprafata presupune cunoasterea detaliata a structurii electronice a ambilor parteneri de reactie.
Un model evoluat al structurii electronice a suprafetelor metalice a fost elaborat de Knor, si se bazeaza pe interactia substratului cu electronii localizati-delocalizati (LDEI). Modelul presupune:
a). existenta orbitalilor d partial ocupati, localizati la atomii superficiali, care prezinta diferite unghiuri de emergenta in raport cu diferitele plane cristalografice;
b). existenta unei densitati mari de electroni delocalizati, proveniti de la baza benzii d si din benzile s, sp.
Atunci cand o molecula de substrat (de exemplu, o molecula A-A) se apropie de suprafata unui metal tranzitional, se formeaza o depresiune in distributia densitatii electronilor delocalizati, datorita fortelor repulsive. Astfel, se ajunge la un contact intim intre orbitalii de frontiera ai moleculei si orbitalii localizati ai metalului, formandu-se noi legaturi localizate. Noua structura electronica va caracteriza starea superficiala de tranzitie (STS).
Modelul LDEI considera ca STS are o viata suficient de lunga pentru a permite:
- relaxarea electronilor delocalizati intr-o noua distributie de densitate;
- interactia legaturilor slabite ale reactantului cu complecsii superficiali vecini sau cu alte molecule din jur;
- disocierea completa a legaturilor slabite, astfel ca ele sa poata migra separat, sa reactioneze cu alte specii sau sa se recombine dand un produs izomer. Primul proces este rapid, celelalte doua pot fi determinente de viteza.
Cu ajutorul modelului LDEI pot fi intelese o serie de efecte catalitice:
- anizotropia cristalografica a proprietatilor catalitice, care rezulta din orientarea diferita a orbitalilor localizati si din distributia diferita a densitatii electronilor delocalizati pe diferitele plane cristalografice;
- rolul componentilor din catalizatorii bimetalici sau din aliaje (acesti componenti actionand ca centrii de captare si ca regulatori ai densitatii electronilor delocalizati);
- cataliza prin oxizi ai metalelor tranzitionale depusi pe metal, care ar putea decurge prin cooperarea dintre ,,rezervorul" de electroni delocalizati (metalul) si electronii d localizati ai ionului tranzitional.
Modelul LDEI permite formularea unei reguli generale pentru alegerea unui catalizator metalic adecvat unei anumite reactii, intrucat optimul interactiei cu o molecula de gaz se obtine la un anumit raport intre densitatea electronilor localizati si a celor delocalizati, din apropierea nivelului Fermi; valorile absolute ale densitatilor amintite au, probabil, o importanta secundara.
Chemosorbtia hidrogenului
Pe langa metalele d si f, majoritatea metalelor alcalino-pamantoase chemosorb hidrogenul. Ele prezinta o activitate chemosorbtiva exceptionala, insa neselectiva, conducand la formarea de compusi cu hidrogen in interiorul solidului.
Modelul LDEI explica pozitia exceptionala a metalelor d si f in activarea catalitica si chemosorbtia hidrogenului: in apropierea nivelului Fermi exista sificienti orbitali directionati, astfel ca sa se poata gasi orbitali de frontiera cu simetria necesara stabilizarii speciilor intermediare formate de-a lungul secventei de reactie, si concomitent sa existe o densitate ridicata de electroni delocalizati, necesari slabirii anumitor legaturi din STS.
Despre tipurile si structura speciilor superficiale rezultate in urma chemosorbtiei hidrogenului, o buna sinteza apartine lui Knor, care explica existenta mai multor tipuri de stari superficiale prin:
- prezenta pe suprafata a diferitelor tipuri de hidrogen adsorbit;
-posibilitatea chemosorbtiei aceluiasi tip de particula pe centrii superficiali diferiti;
- interactia dintre diferitele particule adsorbite pe centrii adiacenti.
Desi toate metalele tranzitionale pot activa hidrogenul, selectivitatea unui anumit metal intr-o reactie particulara este influentata de taria legaturii hidrogen-suprafata.
Chemosorbtia oxigenului
Chemosorbtia oxigenului in forma moleculara (forma α) a fost observata doar la temperaturi sub 200K. In intervalul 200-300K, oxigenul chemosorbit molecular se desoarbe sau trece in forma atomica de chemosorbtie (β), mult mai stabila. La temperatura camerei si temperaturi superioare, oxigenul este chemosorbit pe metale in forma disociativa.
Chemosorbtia azotului
Majoritatea metalelor care formeaza nitruri interstitiale sunt capabile sa chemosoarba azotul. Numarul mic de metale capabile sa activeze catalitic azotul are cel putin doua cauze:
- barierele energetice ridicate ale moleculei;
- valoarea insuficient de mare a energiei de legatura metal-azot.
Azotul adsorbit la 573K pe un catalizator de fier promotat a prezentat la
termodesorbtie un varf la 770 - 820K, corespunzator formei β, in timp ce pe fier pur apare forma α .
Chemosorbtia hidrocarburilor
Pe metale, la temperaturi joase (80K), etena este chemosorbita nedisociativ, cele mai mari distorsiuni fata de geometria moleculei in faza gazoasa aparand in cazul platinei si paladiului.
Studiul chemosorbtiei si dehidrogenarii ciclohexanului pe metale l-a condus pe Balandin spre elaborarea primei teorii stiintifice a catalizei eterogene. Chemosorbtia alcanilor pe metale indica disocierea cel putin a unei legaturi carbon-hidrogen.
Chemosorbtia si activarea olefinelor este foarte mult studiata, datorita implicatiilor industriale ale proceselor de oxidare selectiva a olefinelor inferioare.
2. Mecanismele chemosorbtiei pe oxizi
Activarea moleculelor pe suprafetele oxidice reprezinta un fenomen mult mai complicat decat chemosorbtia pe suprafetele metalice. Complexitatea fenomenului are la baza cel putin urmatoarele doua cauze:
- suprafetele oxidice au minimum doi constituenti elementari;
- densitatea electronica in retea difera foarte mult, acoperind domeniul de la semiconductori tipici pana la izolatori ideali.
Apare o mare varietate de posibile interactii intre suprafata si reactantul gazos, respectiv diferite stari de reactivitate ale speciilor chemosorbite. Interpretarile fenomenelor superficiale fac apel la teoria stratului limita (chemosorbtia pe semiconductori), teoria electronica a catalizei pe semiconductori si teoria campului cristalin.
Chemosorbtia oxigenului
La adsorbtia oxigenului pe oxizi este dificil sa se stabileasca starea initiala a solidului, deoarece suprafata si straturile din apropierea suprafetei nu au compozitii riguros stoechiometrice. Ridicarea temperaturii sau micsorarea presiunii partiale a oxigenului scad continutul de oxigen din aceste straturi.
Pe suprafete oxidice, oxigenul poate fi
chemosorbit in diferite forme: molecular sau atomic, neutru sau ionizat (O2, ![]() , O-, O2-).
Ionul molecular
, O-, O2-).
Ionul molecular ![]() a fost detectat la adsorbtia oxigenului pe ZnO, TiO2,
SnO2, ZrO2, oxizi ai metalelor tranzitionale depusi pe
SiO2. La temperaturi peste 450K, ionul molecular
a fost detectat la adsorbtia oxigenului pe ZnO, TiO2,
SnO2, ZrO2, oxizi ai metalelor tranzitionale depusi pe
SiO2. La temperaturi peste 450K, ionul molecular ![]() dispare, fie prin
desorbtia ca O2, fie prin
transformarea in O2-. De
asemenea, simultan cu specia
dispare, fie prin
desorbtia ca O2, fie prin
transformarea in O2-. De
asemenea, simultan cu specia ![]() , s-a detectat prezenta speciei O-, care s-a dovedit a fi deosebit de reactiva fata de
hidrogen si oxid de carbon. Molecule neutre de oxigen au fost detectate pe TiO2,
SiO2, NiO, zeoliti continand ioni de nichel, oxizi de molibden
depusi pe suport, insa numai la temperaturi joase (desorbtia are loc la
300-400K).
, s-a detectat prezenta speciei O-, care s-a dovedit a fi deosebit de reactiva fata de
hidrogen si oxid de carbon. Molecule neutre de oxigen au fost detectate pe TiO2,
SiO2, NiO, zeoliti continand ioni de nichel, oxizi de molibden
depusi pe suport, insa numai la temperaturi joase (desorbtia are loc la
300-400K).
Chemosorbtia hidrogenului
Aspecte generale ale interactiei hidrogenului cu suprafete oxidice bine definite au putut fi interpretate cu ajutorul teoriei campului cristalin. Detalii legate de energetica si geometria speciiloe chemosorbite sunt foarte putine, chiar si pentru oxizi destul de bine studiati: ZnO, MoO3, Cr2O3, Co3O4. Natura chemosorbtiei hidrogenului pe oxizi izolatori ca MgO, SiO2, TiO2, Al2O3 nu este bine lamurita. Acesti oxizi, desi adsorb slab hidrogenul, sunt folositi mult ca suporti si stabilizatori de faza pentru catalizatorii de hidrogenare.
Chemosorbtia apei
Chemosorbtia apei pe oxizi constituie un element esential pentru caracterizarea suprafetei, atat in ceea ce priveste adsorbtia ulterioara a altor specii, cat si aproprietatilor ei catalitice. Modelul chemosorbtiei disociative a apei, pe o suprafata oxidica prepune urmatoarele: pe suprafata lipsita de apa oxigenul dispune de o pereche de electroni neparticipanti, iar zincul, de un orbital vacant; acesti centrii vor fi ocupati de apa, cu formarea unor legaturi acid/ baza puternice.
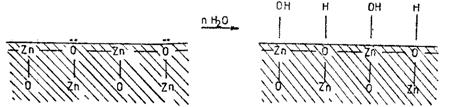
Figura 1. Modelul idealizat al chemosorbtiei apei pe o suprafata oxidica
Pe masura ce suprafata se acopera, conform modelul din figura anterioara, raman tot mai multi centri cationici si anionici singulari care pot chemosorbi apa nedisociativ prin legatura coordinativa pe un cation singular, respectiv prin legatura de hidrogen cu un anion O2- singular.
3. Analiza mecanismului de reactie- mijloc de selectie adecvata a catalizatorului
Selectia adecvata a componentelor primare ale unui catalizator constituie etapa cea mai importanta in cadrul procesului de dezvoltare industriala a unei reactii catalitice.
Procedurile aplicate implica analiza detaliata a mecanismelor de chemosorbtie si reactie superficiala, pentru a stabili:
- reactiile superficiale posibile;
- speciile superficiale care ar fi necesare;
- ce forma de chemosorbtie a reactantilor sau a produsilor de reactie este necesara si ce fel de catalizatori ar favoriza aceasta chemosorbtie;
- tipurile de transfer de sarcina propuse si daca este necesara schimbarea sarcinii ionului superficial;
- parametrii geometrici impusi suprafetei.
In concluzie, analiza mecanismului posibil al reactiei a permis restangerea
numarului de catalizatori potentiali pentru o anumita reactie.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1910
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved