| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
 Atomul oricarui element chimic este alcatuit
din doua parti distincte:
Atomul oricarui element chimic este alcatuit
din doua parti distincte:
un sistem central care se numeste nucleu;
parte exterioara nucleului, numita invelis electronic.
Diametrul nucleului reprezinta circa a 10 000-a parte din diametrul atomului si concentreaza aproape intreaga masa a acestuia. Nucleul este format din mai multe tipuri de particule elementare dintre care amintim:
protonii sunt particule materiale incarcate cu cate o
sarcina elementara electrica pozitiva (![]()
neutronii
sunt particule materiale neutre (![]() ).
).
Masa atomului (A) este egala cu suma dintre masele protonilor (Z) si a neutronilor (N).
![]()
Pentru intelegerea configuratiei invelisului electronic, Niels Bohr (1913) a formulat urmatoarele postulate:
![]()
Forta de atractie electrostatica dintre electron, cu sarcina e-, si nucleu cu sarcina e+, este conform legii lui Coulomb:
![]()
La echilibru dinamic, pentru o stare stationara, cele doua forte sunt egale, K = F, deci:
![]() sau
sau ![]()
![]() sau
sau ![]()
Orbita cu raza cea mai mica corespunde starii cu cea mai joasa energie (E1). Cand un electron, de pe orbita corespunzand numarului cuantic n = 2 si energiei E2, sare inapoi pe orbita cu n = 1, el emite o cuanta cu energia:
![]()
Asadar, absorbtia sau emisia de energie luminoasa au loc numai la salturile electronului de pe o orbita interioara pe una periferica si la revenirea lui inapoi.
![]()
 Modelul
configuratiei electronice al atomilor, Sommerfeld (1916).
Modelul
configuratiei electronice al atomilor, Sommerfeld (1916).
Sommerfeld considera ca electronul se poate roti nu numai pe orbite circulare, ci si pe orbite eliptice, unda lui extinzandu-se in jurul orbitei in zone numite orbitali. In modelul atomic al lui Bohr-Sommerfeld, electronul miscandu-se pe o orbita eliptica permisa, poseda un moment cinetic orbital.
Orbitalii sunt conceputi ca niste portiuni ale spatiului din vecinatatea atomului, diferentiati prin energia si geometria lor si care pot fi (dar nu in mod necesar) ocupati cu electroni.
Fiecare orbital este caracterizat prin 4 numere cuantice: n - numar cuantic principal; l - numar cuantic secundar; m - numar cuantic magnetic; s - numar cuantic al spinului.
Numarul cuantic principal (n) determina numarul straturilor electronice; poate avea valori n = 1,2,3...7. Stratul n=1 se numeste stratul K (stratul cel mai interior si cu nivelul energetic cel mai mic); urmand consecutiv straturile L, M, N, O, P si Q; numarul straturilor electronice ale unui element chimic este egal cu numarul perioadei in care acesta se afla.
Numarul cuantic secundar (l) determina substraturile electronice, adica orbitalii si forma lor care poate fi circulara sau eliptica. Valoarea lui l depinde de valoarea lui n, deoarece intre aceste numere cuantice exista relatia l < n -1.
Principiul lui Paully (1925) spune ca "nu pot exista electroni cu aceleasi numere cuantice".
 Astfel se pot
calcula numarul maxim de electroni pe straturi si substraturi, dupa urmatoarele
reguli:
Astfel se pot
calcula numarul maxim de electroni pe straturi si substraturi, dupa urmatoarele
reguli:
numarul maxim de electroni ce pot exista
pe un strat, cu numarul cuantic principal n este dat de relatia:![]()
numarul maxim de electroni dintr-un
substrat, cu numarul cuantic l, este dat de relatia: ![]()
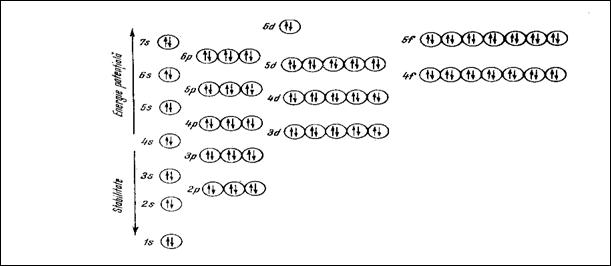
Succesiunea straturilor cu substraturile si orbitalii lor atomici (dupa Rabega C.,1975).
La completarea orbitalilor cu acelasi nivel energetic: s, p, d se aplica regula lui Hund: "cel de-al doilea electron intra in acesti orbitali, numai dupa ce sunt ocupati mai intai de un singur electron".
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2223
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved