| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
NEMETALELE
HIDROGENUL
Hidrogenul a fost descoperit, in anul 1776, de Cavendish. El l-a numit are inflamabil. In anul 1783, A.L. Lavoisier intra in compozitia apei si i-a dat numele de hidrogen(generator de apa ).
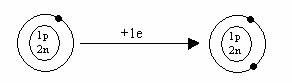
H![]() H-1(ion negativ
de hidrogen)
H-1(ion negativ
de hidrogen)
Acceptand un electron, hidrogenul capata stuctura electronica a gazului rar cel mai apropiat-Heliu.
![]()
![]()
Z=1 1p+
=>
A=21e-
Distributia electronilor pe straturi si substraturi:
K:1e-1s1
Hidrogenul a fost descoperit de faimosul fizician englez Henry Cavendish, care era cel mai bogat dintre invatati si cel mai invatat dintre bogati,dupa cum spunea unul dintre contemporanii sai. Putem adauga ca era si cel mai meticulos dintre oamenii de stiinta.Se spune ca atunci cand Cavendish la o carte din propia-i biblioteca intotdeauna isi punea in locul ei cartea de vizita.Cel mai linistit dintre savanti,devotat in intregime cercetarii stiintifice,intotdeauna absorbit de stiinta,avea reputatia unui pustnic excentric.Ori acestea erau tocmai calitatile care faceau posibila deacoperirea noului gaz,hidrogenul El a facut descoperirea in 1766,iar in 1783 profesorul francez Charles a facut sa zboare primul balon cu hidrogen.
Hidrogenul a fost si pentru chimisti a descoperire pretioasa.El I-a ajutat sa descifreze structura acizilor si bazelor,aceste foarte importante clase de compusi chimici.El a devenit un reactor de laborator indispensabil pentru precipitarea metalelor din solutiile de saruri si pntru reducerea oxizilor metalici.Si daca am presupune ca hidrogenul nu a fost descoperit in 1766,ci , sa spunem o jumatate de secol mai tarziu ( astfel de lucruri s-ar fi putut intampla),progresul chimiei in teorie si practica ar fi intarziat prea mult timp.
Cand chimistii au inceput sa-l cunoasca indeajuns de bine si practicienii sa-l foloseasca pentru producerea de substante importante,acest gaz a atras atentia fizicienilor.Studiul lui le-a furnizat multe informatii care au imbogatit considerabil cunostintele stiintifice din acea vreme.
Aveti nevoie de inca o dovada ? In primul rand hidrogenul se solidifica la o temperatura mai mica decat alte lichide sau gaze (exceptie face heliul),la -259,1 C; in al doilea rand atomul de hidrogen i-a dat posibilitatea fizicianulului danez Niels Bohrsa emita o teorie a aranjarii electronilor in jurul nucleului atomic,fara de care sensul fizic al legii periodicitatii nu ar fi putut fi patruns.Aceste realitati au constituit baza altor foarte importante descoperi.
Astfel fizicienii au trecut stafeta rudelor celor mai apropiate prin meserie,astro-
fizicienilor,care studiaza structura si compozitia stelelor.Astro-fizicienii au stabilit ca hidrogenul este elementul numarul 1 in univers.Este componenta principala a
Soarelui,stelelor,nebuloaselor si <<umplutura>> de baza a spatiilor interstelare.
In spatiul extraterestru exista mai mult hidrogen decat toate celelalte elemente
chimice laolalta.Nu ca pe Pamant ,unde continutul sau se ridica la mai putin de 1%.Oamenii de stiinta considera hidrogenul punctul de plecare a unui lung sir de transformari al nucleului atomic,sir care a dus la formarea tuturor elementelor
chimice,a tuturor atomilor, fara exceptie.Soarele nostru si toate stelele sunt luminoase datorita reactilor termonucleare care au loc intre ele,implicand transformarea hidrogenului in helui,cu eliberarea unor cantitati imense de energie.Chimist proeminent pe Pamant,hidrogenul este si un chimist remarcabil in spatiul extraterestru.O alta propietate remarcabila a hidrogenului este aceea ca atomul sau emite radiatii avand o lungime de unda de 21cm.Aceasta este considerata o constanta universala pentru ca este aceeasi in tot Universul.Oamenii de stiinta si-au pus problema realizarii de comunicatii cu alte lumi locuite de fiinte superioare utilizand unde de hidrogen.Daca aceste lumi sunt cu adevarat locuite de fiinte superioare,ele trebuie sa aiba idee ce inseamna 21cm.
OXIGENUL
Oxigenul a fost obtinut, in anul 1771, de J. Priestley. In anul 1776, A.L. Lavoisier stabileste faptul ca oxigenul este unul din principalii componenti ai aerului atmosferic.
![]()
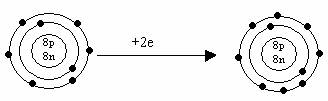
O O-2(ion negativ de oxigen)
Acceptand doi electroni, oxigenul capata structura gazului rar cel mai apropiat-Neon.
![]()
![]() Z=88p+
Z=88p+
=>
A=16 8e-
Distributia electronilor pe straturi si substraturi:
K:2e- 1s22s22p4
L:6e-
Oamenii de stiinta sint constienti de mai bine de 200 de
ani de importanta si proprietatile extrem de benefice ale oxigenului. Oxigenul
a fost descoperit ca element chimic in anul 1771 de catre englezul Joseph
Priestly. Peroxidul de hidrogen a fost descoperit in 1818 de catre chimistul
francez Louis Jacques Thenard, iar ozonul de catre Christian Friedrich
Schonbein in anul 1840. Prima incinta hiperbarica a fost creata in 1879 de
catre medicul francez J. A. Fontaine.Doctorii si oamenii de stiinta au inceput
sa trateze anumite disfunctii si boli cu ajutorul oxigenului, de mai bine de
100 de ani. Afectiunile pielii au fost la inceput tratate cu ajutorul
ultravioletelor (care activeaza procesul de oxidare cind sint absorbite in
singe), pe la sfirsitul secolului al XIX-lea de catre Niels Finsen, iar
peroxidul este folosit inca din anul
Ce este si cum functioneaza terapia cu oxigen
Toate celulele, tesuturile si organele din organismul uman au nevoie de oxigen pentru a functiona. Oxigenarea satureaza organismul cu oxigen prin folosirea gazului, citeodata la o presiune ridicata (hiperbarica), ducind la cresterea cantitatii totale de oxigen disponibile in organism. O oxigenare insuficienta poate duce la dezvoltarea agentilor patogeni, in timp ce o oxigenare in exces poate deteriora tesuturile normale. Totusi oxigenarea folosita sub control strict si sub o atenta ingrijire poate avea efecte terapeutice pozitive. Dr. Otto Warburg, laureat Nobel de doua ori, sustine ca lipsa oxigenului de la nivelul celulelor poate constitui o prima cauza pentru aparitia cancerului si ca terapia cu oxigen poate fi un tratament eficient pentru tratarea sa. El a demonstrat ca celulele normale din culturi de tesuturi, atunci cind sint lipsite de oxigen, se transforma in celule canceroase si ca oxigenul poate distruge celulele canceroase din culturile de tesuturi.
Modalitati de tratare cu ajutorul terapiei cu oxigen
Terapia cu oxigen poate fi administrata prin mai multe modalitati: oral, rectal, vaginal, intravenos, intraarterial, prin inhalare sau prin absorbtie prin piele. Oxigenul gazos in concentratii ridicate poate sa fie administrat si prin masti sau tuburi sau in incinte cu oxigen hiperbaric presurizat. Oxigenul se mai poate administra si prin injectare subcutanata (sub piele). Oxigenul ionizat, incarcat atit pozitiv, cit si negativ, se administreaza prin inhalare sau dizolvat in apa de baut sau de spalat.
Tipuri de terapii cu oxigen
Aceste terapii sint grupate in functie de tipul de proces chimic care are loc: asimilarea oxigenului in singe sau tesuturi poarta numele de oxigenare. Celalalt proces, oxidarea, este reactia de disociere a electronilor (particule incarcate electric) din orice fel de molecule chimice.Oxidarea este un proces care poate sau nu sa implice folosirea de oxigen. Ea se refera la o reactie chimica si nu neaparat la oxigenul in sine. O terapie care foloseste procesul de oxigenare este terapia prin oxigen hiperbaric, in cadrul careia este introdus oxigenul in organism intr-o incinta presurizata. Pe de alta parte, terapia prin peroxid de hidrogen foloseste procesul de oxidare. Cit despre terapia prin ozon, aceasta foloseste ambele procese chimice.Desi in Europa, timp de multi ani, au fost folosite diferite terapii cu oxigen pentru vindecarea a numeroase boli, in Statele Unite majoritatea sint extrem de controversate si neacceptate de unele asociatii de sanatate. Legalitatea folosirii terapiilor cu oxigen variaza de la stat la stat.
Terapia cu oxigen hiperbaric
Terapia cu oxigen
hiperbaric dateaza de la inceputul secolului XX, desi in Statele Unite este
folosita incepind din anul 1967. Acest tip de terapie poate fi administrata in
cadrul unor incinte individuale cu oxigen, care constau din tuburi din acril,
de aproape
Boli care pot fi tratate cu ajutorul terapiei cu oxigen hiperbaric
In Statele Unite acest tip de terapie este folosit in primul rind pentru tratarea diferitelor traume, cum ar fi accidente, arsuri, rani, cangrene (moartea unui tesut, care se produce de obicei din cauza deficientei sau a absentei aprovizionarii cu singe), intoxicare cu monoxid de carbon, ulcer decubit, staza (oprire sau incetinire a circulatiei singelui sau a unei secretii interne a corpului), necroza (distrugere a celulelor unei portiuni de tesut sau organ viu, ca urmare a unei infectii, traumatism sau a unei tulburari circulatorii etc.). Unele proceduri chirurgicale necesare pentru repararea si refacerea membrelor sectionate pot fi efectuate numai in cazul folosirii terapiei cu oxigen in timpul interventiilor respective.Terapia cu oxigen hiperbaric folosita imediat dupa interventia chirurgicala ajuta in majoritatea cazurilor la o vindecare cu 60 la suta mai rapida si garanteaza ca nu vor exista edeme chirurgicale (retinerea unor cantitati exagerate de lichide in tesuturile din organism.)In diferite tari de pe glob, terapia cu oxigen hiperbaric este folosita in scopuri specifice. Astfel, in Germania ea este folosita pe scara larga pentru a trata victimele care au suferit un atac; in Franta, pentru tratarea problemelor arteriale si de circulatie periferice; in Rusia, pentru dezintoxicarea victimelor alcoolului si drogurilor; iar in Marea Britanie, pentru tratarea pacientilor suferinzi de scleroza multipla.Crizele pulmonare precum intoxicarea cu monoxid de carbon, anemia datorata volumului redus de singe si cianoza (decolorare albastruie a pielii datorata cantitatilor anormale de hemoglobina oxigenata din singe) beneficiaza si ele de aceasta terapie. Acest tip de terapie si-a demonstrat si valoarea ca terapie adjuvanta celei cu antibiotice in tratamentul infectiilor anaerobe. A inceput sa fie folosita experimental si pentru tratarea simptomelor infectiilor cu HIV si a oboselii cronice care o insoteste.
Ce precautii sint necesare
Terapia cu oxigen hiperbaric poate cauza probleme pentru cei cu antecedente de infectii ale urechii medii, emfizem sau pneumotorax spontan datorita presiunii ridicate pe care o implica. Folosirea sa in cazul bolilor precum SIDA, boli de inima si dezintoxicarea narcomanilor si alcoolicilor este inca in dezbatere. Totusi aceasta terapie cistiga din ce in ce mai mult teren si este folosita atit in medicina conventionala, cit si in cea alternativa. Spectrul sau larg de aplicatii ii confera si pe viitor un potential ridicat de folosire ca terapie adjuvanta.
CARBONUL
Carbonul, sub forma de carbune si funingine a fost cunoscut inca din antichitate. Corpul unui om de 70 kg contine 6 kg de hidrogen, 44 kg de oxigen si 14 kg de carbon. Amestecul gazos format din 95% O2 si 5% CO2 se foloseste in oxigenoterapie.
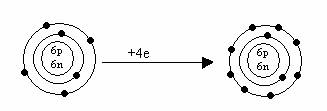
![]() C C-4(ion
negativ de carbon)
C C-4(ion
negativ de carbon)
Acceptand patru electroni, carbonul capata structura electronica a gazului rar cel mai apropiat-Neon.
![]()
![]() Z=66p+
Z=66p+
=>
A=12 6e-
Distributia electronilor pe straturi si substaturi:
K:2e- 1s22s22p4
L:4e-
Proprietati: Greutatea atomica a C este 12,01115. Cele 3 stari naturale ale carbonului sunt- diamantul, granitul si carbonul amortiu -ele sunt solide cu o temperatura de topire extrem de ridicata si sunt insolubile in toti solventii la temperaturi normale. Proprietatile fizice ale celor 3 tipuri de C nu prea difera din cauza diferentelor in structura cristalina. In diamant, cel mai dur material cunoscut, fiecare atom este in legatura cu alti 4 atomi intr-un schelet 3D, granitul consista in legaturi saptamanale de straturi de atomi care sunt aranjati in hexagon. C amorfiu este caracterizat de un grad scazut de cristalinitate. C amorfiu pur poate fi obtinut prin incalzirea zaharului la 900 grade in absenta aerului. C are abilitatea unica de a face legaturi cu alti atomi de C pentru a forma, lanturi si inele complexe. Aceasta proprietate duce la un numar aproape infinit de compusi ai carbonului cel mai comun element fiind cel care contine C si H2.Primii compusi ai C au fost identificati in materia vie la inceputul sec 19. La temperaturi normale C are o radioactivitate scazuta. La Temperaturi ridicate reactioneaza cu aproape toate metalele pentru a forma carburi, iar cu oxigenul formeaza monoxidul de carbon si dioxidul de carbon. De asemenea carbonul formeaza compusi cu multe elemente nemetalice desi unele ca si C tetraclorid trebuie format indirect.
Se gaseste: C nu este un element raspandit in natura desi este intr-un procent de 0,025% din atmosfera Pamantului. Se gaseste cel mai des sub forma de carbonat. Co2 este un compus important al atmosferei si este principala sursa de carbon incorporat in materia vie . Plantele folosind fotosinteza transforma Co2 in compusi organici de carbon care este consumat de alte organisme.
C amorfiu se gaseste in grade variabile de puritate in carbuni , cox.
In 1985 oameni de stiinta au evaporat granit pentru a forma o molecula de carbon stabil format din 60 de molecule de C avand forma unei sfere. Molecula a fost numita buckminsterfullerene.
Aplicatii stintifice: Cle mai comun izotop al C este carbon-12 ; in 1961 acest izotop a fost ales pentru a inlocui izotopul oxigenului16 ca standard al greutatii atomice, si a fost data greutatea atomica 12.
Izotopul C-13 si 4 sunt folosite extensiv ca urme in cercetarile biochimice. C14 este asemenea folosit in tehnica numita datarea cu carbon radioactiv care permite gasirea varstei fosilelor si altor materi organice. C 14 este produs in continuu in atmosfera de razele cosmice si se afla in orice materie vie.Cum carbonul 14 se descompune cu jumatate de viata de 5760 de ani.
CLORUL
Clorul este primul halogen obtinul in stare libera(1774). La inceput era considerat ca fiind o substanta compusa, dar mai tarziu(1810) s-a stabilit ca este o substanta simpla. Clorul a fost primul gaz folosit ca arma de lupta, de catre germani, in primul razboi mondial.
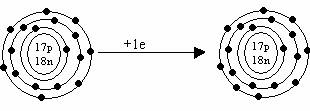
Cl ![]() Cl-1 (ion negativ de clor)
Cl-1 (ion negativ de clor)
Acceptand un electron, clorul capata structura electronica a gazului rar cel mai apropiat-Argon.
![]()
![]() Z=17
17p+
Z=17
17p+
=>
A=35,5 17e-
Distributia electronilor pe straturi si substraturi :
K :2e- 1s22s22p63s23p5
L :8e-
M :7e-
Basilius Valentinus a obtinut in a doua jumatate a secolului al XV-lea, incalzind vitriolul de fier (sulfat de fier) cu clorura de sodiu. J.R.Glauber (1648) a folosit in locul vitriolului de fier, acid sulfuric. A.L.Lavoisier (1789) l-a numit acid muriatic (muria-saramura), crezand ca acest acid este o combinatie oxigenata a unui element necunoscut.
C.W.Scheele (1774) a oxidat acidul clorhidric cu piroluzita, numind gazul care se dezvolta acid muriatic de flogisticat. Oxigenul dezvoltat cand clorul reactioneaza cu apa a fost atribuit eronat faptului ca clorul este o combinatie cu oxigenul. Asupra muriului, radicalul acidului clorhidric, s-au facut numeroase studii. J.L.Gay-Lussac si L.J.Thenard (1809) au incercat fara rezultate sa descompuna clorul si au fost primii care au indicat ca este vorba de un gaz elementar. H.Davy (1810) a aratat ca gazul nu se combina cu carbonul nici la temperatura inalta deci nu a putut extrage oxigenul din gazul oximuriatic. H.Davyn a dat acidului oximuriatic numele de clor (cloros galben verzui) din cauza culorii sale. Ideea aceasta a fost definitiv admisa dupa studiile lui J.L.Gay-Lussac si L.J.Thenard asupra iodului (1814). Ideile lui A.L.Lavoisier asupra acizilor erau atat de puternice incat C.F.Schonbein (1885) considera clorul ca o combinatie cu oxigenul. Mai corect clorul molecular se numeste diclor.
Cantitatea de clor a scoartei este de 0,045%. Clorul, ca si ceilalti halogeni nu se gaseste liber in natura din cauza puternicei tendinte de combinare. Se gaseste sub forma de depozite de clorura de sodiu (sare gema, halita) depuse prin evaporarea unor mari inchise sau lacuri. In tara noastra se gasesc saline in formatiunile tertiarului la : Ocnele Mari, Slanic, Targu Ocna, Praid, Cacica, Ocna Dej, Ocna Muresului, Ocna Sibiului etc.
Sursa cea mai importanta este apa marii in care se gasesc 3% saruri din care circa 80% este clorura de sodiu si alte cloruri in proportie mai mica (clorura de potasiu, magneziu, calciu). Lacurile sarate (marile lacuri sarate din Utah), Marea Caspica, Marea Moarta contin concentratii mult mai mari de cloruri si alte saruri.
La tarmul acestori mari apa devine saturata in clorura de sodiu care se depune la evaporarea marilor concentratia in saruri creste. Sarurile care se gasesc in concentratie mai mare si au solubilitate mai mica se separa. Se separa intai clorura de sodiu, apoi saruri duble ce contin clorura de sodiu. Se separa apoi clorura de potasiu si ulterior sarurile duble ale potasiului si magneziului. Ramane un rest bogat in diclorura de magneziu. Printr-un astfel de proces sau depus sarurile de la Stassfurt (Germania). Diclorura de magneziu hidratata se numeste bischofita MgCl2 . 6H2O . Clorul se gaseste atat in regnul vegetal cat si in cel animal. Se regaseste in cenusa plantelor si animalelor sub forma de cloruri si in lichidele organismului (sange, limfa, lapte, urina). Acidul clorhidric se gaseste in sucul gastric (0,2 0.4%) .El are un rol important in digestie.
Clorul se obtine atat in laborator cat si in industrie.Reactiile chimice de obtinere a clorului in laborator se bazeaza pe oxidarea acidului clorhidric cu dioxid de mangan, dioxid de plumb, clorura de var, clorati permanganati, dicromati etc.
Obtinerea clorului din cloruri
Au fost folosite in acest sens diclorura de magneziu diclorura de calciu, clorura de amoniu si clorura de sodiu.
1. Clorura de magneziu este usor descompusa in stare anhidra de catre oxigenul din aer
MgCl2 + O2 = MgO + Cl2
Aceasta este o reactie reversibila. Deshidratarea diclorurii de magneziu naturale (MgCl2 . 6H2O) se face in curent de acid clorhidric, deoarece din cauza hidrolizei se obtine oxiclorura. Procedeul practic W.Weldon-Pechiney (1884) consta in deshidratarea diclorurii de magneziu in aer si trecerea ei in oxiclorura. Aceasta, in cuptoare speciale, cu aerul la o temperatura mai inalta cedeaza clorul.
2. Clorura de sodiu se poate calcina in curent de aer cu sulfat de fier(II) are reactia :
8NaCl + 4 FeSO4 +3O2 = 4Na2SO4 + 2Fe2O3 +4Cl2
Reactia se aplica atunci cand clorul respectiv se foloseste pe cale umeda pentru tratarea minereurilor de cupru.
Clorura de amoniu se poate disocia la 350-400oC in amoniac si acid clorhidric. Acidul clorhidric reactioneaza cu oxidul de nichel depus pe caolin formand apa si diclorura de nichel. Aceasta clorura se descompune in curent de aer la 500-600oC, furnizand clor si din nou oxid de nichel. Mai exista si alte reactii de obtinere a clorului din cloruri. Astazi clorul se prepara exclusiv prin metoda electrolitica din clorura de sodiu. Pana in anul 1890, clorul si hidroxidul de sodiu s-au obtinut prin procedee pur chimice. Fabricare sodei dupa M.Leblanc era baza industriei alcaliilor si a clorului. Carbonatul era caustificat iar acidul clorhidric servea la obtinerea clorului si a compusilor sai. Procedeul E.Solvay a lipsit chimia clorului de baza sa practica. Punerea in functiune a procedeului electrolitic (1894) de fabricare a clorului a insemnat si nasterea elecrochimiei moderne.Prin electroliza se obtine in acelasi timp clor hidroxid alcalin si hidrogen. Electroliza clorurii de sodiu s-a dezvoltat ca urmare a cresterii necesitatii de clor in clururarea benzenului si in general in procesele de clorurare in chimia organica, industria lacurilor si materialelor plastice, a fabricari polistirenului (care necesita AlCl3), a policlorurii de vinil (care foloseste HCl ) a oxidului de etilena pentru industria detergentilor (care utilizeaza Cl2). Productia de matase artificiala necesita hidroxid de sodiu.Fabricarea clorului prin electroliza acidului acidului clorhidric.Deoarece din diferite procese rezulta acid clorhidric in cantitati ce nu pot fi desfacute pe piata s-a cautat sa se recupereze clorul prin electroliza. Procedeul este economic. Procesele care au loc sunt simple: se foloseste ca electrod grafitul. Temperatura baii este de 70oC iar concentratia acidului clorhidric 20% , deoarece la aceasta concentratie conductibilitatea este maxima. Celule constau din rame in care este fixata si chituita cate o placa de grafit. Diafragma este o foaie de panza de policlorura de vinil clorurata. Placile se alimenteaza la capete. Cele intermediare functioneaza drept conductoare bipolare (pozitive pe o parte si negative pe cealalta parte). Intre diafragme si placi se gasesc 3 bucati de grafit pentru a proteja placa de atacul clorului La temperatura ordinara, clorul este un gaz de culoare galben-verzuie (hloros=verde ) si miros sufocant. In stare lichida este tot galben-verzuiLa 0oC si 760 mm Hg un litru de clor cantareste 3,214g, deci este de circa 2,7 ori mai greu decat aerul. Densitatea sa este un indiciu ca molecula este diatomica.Gazul se lichefieaza sub presiunea de o atmosfera, la temperatura de -34,6oC (la 0oC sub presiune de 3,66 atmosfere, la 15oC sub presiune de 5,8 atmosfere si la 20oC sub presiune de 6,57 atmosfere).Temperatura critica este 144oC, presiunea critica 76,1 atm si densitatea critica 0,57.Clorul prezinta sapte izotopi 33Cl, 34Cl, 35Cl(75,4%), 36Cl, 37Cl(24,6%), 38Cl .El este un gaz putin solubil in apa. Un volum de apa dizolva circa 2,15 volume de clor la 20 oC. Solubilitatea sa mica este atribuita lipsei de polaritate a moleculei respective. Trecand un curent de clor prin apa racita cu gheata s-a putut separa un hexahidridat Cl2 . 6H2O (cristale verzui-deschis) si un octahidrat Cl2 . 8H2O. Compozitia ultimului s-a stabilit calculand caldura de disociere in clor gazos si gheata si in clor gazos si apa (I.Harris 1943).
SULFUL
Amestecul de clorat de potasiu, carbune si sulf se foloseste la fabricare chiriturilor si a artificiilor. Datorita mirosului sau neplacut, sulful se mai numeste si pucioasa. Potrivit Bibliei, orasele Sodoma si Gomora au fost distruse de o ploaie de sulf(provocata probabil de o eruptie vulcanica).
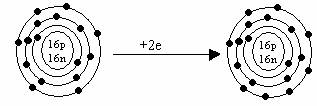
S![]() S-2(ion negativ
de sulf)
S-2(ion negativ
de sulf)
Acceptand doi electroni, sulful capata configuratia elctronica a gazului rar cel mai apropiat-Argon.
![]()
![]() Z=16 16p+
Z=16 16p+
=>
A=32 16e-
Disributia electronilor pe straturi si substraturi:
K:2e-1s22s22p63s23p4
L:8e-
M:6e-
AZOTUL
Azot inseamna fara viata. Azotul nu intretine viata fiintelor care-l inspira. Organismele vii contin 1-10% azot. Betia adancurilor, manifestata la scafandri, apare datorita crestrii concentratiei de azot din sange.
![]()
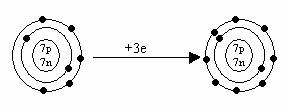
N N-3(ion negativ de azot)
![]()
![]() Acceptand
trei electroni, azotul capata structura electronica a gazului
rar cel mai apropiat-Neon.
Acceptand
trei electroni, azotul capata structura electronica a gazului
rar cel mai apropiat-Neon.
Z=77p+
=>
A=14 7e-
Distributia electronilor pe straturi si substraturi:
K:2e-1s22s22p3
L:5e-
METALELE
ALUMINIUL
Aluminiul, cel mai raspandit metal din scoarta Pamantului, a capatat in ultimul timp o importanta foarte mare. Dupa fier, acesta a devenit metalul cu cea mai larga intrebuintare dupa fier.
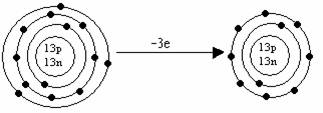
Al ![]() Al+3(ion pozitiv
de aluminiu)
Al+3(ion pozitiv
de aluminiu)
Cedand trei electroni, aluminiul capata structrura electronica a gazului rar cel mai apropiat-Neon.
![]()
![]() Z=13
13p+
Z=13
13p+
=>
A=27 13e-
Distributia electronica pe straturi si substraturi:
K:2e- 1s22s22p63s3
L:8e-
M:3e-
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 946
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved