| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
La dizolvarea unei substante intr-un solvent, concentratia solutiei nu poate creste nelimitat. Adaosul de substanta peste o anumita limita nu mai trece in solutie, ci se depune ca substanta solida. Concentratia maxima care se atinge intr-un sistem la echilibru se numeste solubilitate.
Solubilitatea depinde de natura componentilor solutiei si de temperatura.
Se considera conditia de echilibru data de egalitatea potentialelor chimice ale substantei pure si in solutie:
2p 2s (5.20)
respectiv
![]() (5.21)
(5.21)
unde: ![]() (5.22)
(5.22)
deoarece in stare
solida pura ![]() .
.
a2 = activitatea (solubilitatea) solvatului (substantei dizolvate).
Pentru a urmari influenta temperaturii asupra solubilitatii a2, se apeleaza la ecuatia Gibbs-Helmholtz (4.183) in care se inlocuieste din conditia de echilibru (5.21). Considerand procesul in sensul trecerii substantei pure in solutie, se obtine:
![]() (5.23)
(5.23)
si
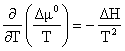 (5.24)
(5.24)
respectiv
![]() (5.25)
(5.25)
unde: H = entalpia de dizolvare care insoteste procesul.
Se observa ca pentru H < 0, derivata este negativa, adica solubilitatea substantei care se dizolva exoterm scade cu cresterea temperaturii. Daca H = 0, dizolvarea este aterma si nu este influentata de temperatura.
Integrarea ecuatiei (5.25) pentru un interval mic de temperatura permite calculul entalpiei de dizolvare din masuratori de solubilitate efectuate la diferite temperaturi.
Cristalohidratii prezinta H > 0, dizolvandu-se in apa endoterm, iar formele anhidre corespunzatoare au H < 0 si se dizolva exoterm.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1830
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved