| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Pile ireversibile Caracteristicile acestor pile vor fi discutate luand ca exemplu pila Volta, al carei lant electrochimic este:
(-) Zn | H2SO4, aq | Cu (+)
Daca pila nu debiteaza curent (in circuit deschis), la cei doi electrozi se produc transformari chimice de reducere - la catod (+), de oxidare - la anod (-), conform ecuatiilor:
(+) 2H+ + 2e → H2
(-) Zn → Zn2+ + 2e (20)
Daca pila debiteaza curent (in circuit inchis), la cei doi electrozi se produc aceleasi transformari chimice ca mai sus (ecuatiile 2.106). Transformarile chimice nu sunt in concordanta cu legea lui Faraday.
Daca pila este cuplata la o sursa externa de curent si i se aplica o tensiune V mai mare decat tensiunea electromotoare a pilei, E, reactiile la cei doi electrozi sunt cu totul altele decat cele de la debitare de curent (ecuatiile 2.106), si anume:
(+) Cu → Cu2+
+ 2e
(-) 2H+ + 2e → H2 (21)
Daca pila debiteaza curent, tensiunea acesteia scade brusc.
Sintetizand, caracteristicile pilelor ireversibile sunt:
- in circuit deschis, la cei doi electrozi se produc transformari chimice;
- in circuit inchis (la debitare de curent), transformarile chimice de la cei doi electrozi nu sunt in concordanta cu legea lui Faraday;
- la aplicarea unei tensiuni externe mai mare decat tensiunea electromotoare a pilei (pastrand polaritatea electrozilor ca la punctul 2), reactiile la cei doi electrozi sunt cu totul altele decat la debitare de curent;
- la debitare de curent, tensiunea pilei scade brusc.
Tensiunea electromotoare a unei pile electrochimice nu depinde de forma sau dimensiunea electrozilor, de dispunerea acestora etc., dar, fiind o marime termodinamica, depinde de parametrii de stare. Acestia sunt: concentratia (activitatea), temperatura, presiunea.
Relatiile care redau influenta acestor parametri asupra tensiunii electromotoare, stabilite doar pentru pilele reversibile sunt cunoscute sub numele relatii termodinamice ale tensiunii electromotoare.
Influenta concentratiei (activitatii) asupra tensiunii electromotoare. Se porneste de la o reactie globala de celula, descrisa de ecuatia:
νBB + νCC + .. + ze νMM + νNN + .. (22)
in care: B, C, .. - reactanti; M, N, .. - produsi de reactie;
- coeficienti stoechiometrici corespunzatori; z - numar de electroni implicati in reactia globala.
Pentru reactia (22) se poate scrie:
![]() (23)
(23)
unde: μM, μN, μB, μC, .. - potentialele chimice ale speciilor.
Inlocuind in relatia (23)
potentialele chimice cu forma lor explicita ![]() , se obtine:
, se obtine:
 (24)
(24)
Trecand la valoarea t.e.m. 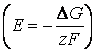 rezulta:
rezulta:
 (25)
(25)
in care: E0 - reprezinta tensiunea electromotoare standard si corespunde raportului activitatilor termodinamice egal cu unitatea). Valoarea acesteia este data de raportul:
![]() (26)
(26)
Luand ca exemplu pila Daniel-Iacobi, pentru care reactia globala pe celula este:
Zn + Cu2+ Zn2+ + Cu (27)
valoarea tensiunii electromotoare este:
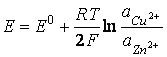
![]() (28)
(28)
deoarece aZn = 1; aCu = 1.
Influenta temperaturii asupra tensiunii electromotoare. Relatia care exprima influenta temperaturii asupra t.e.m. a pilelor se obtine prin diferentierea in raport cu temperatura a relatiei (1) obtinand:
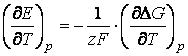 (29)
(29)
Dupa cum se stie, coeficientul de temperatura al entalpiei libere de reactie este egal cu variatia entropiei, ΔS, in timpul desfasurarii reactiei in pila:
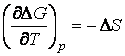 (30)
(30)
Conform Principiului al II-lea al termodinamicii, lucrul maxim furnizat de un proces este corelat cu efectul caloric prin relatia Gibbs-Helmholz:
![]() (31)
(31)
in care: ΔG - energia libera de reactie; ∆H - entalpia de reactie; TΔS - energia calorica ce nu poate fi transformata in lucru util.
Inlocuind in relatia (31) valoarea entropiei data de relatia (30), se obtine:
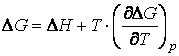 (32)
(32)
in care,
daca se introduce ![]() si
si 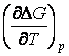 din relatia (29),
rezulta ecuatia Gibbs-Helmholz pentru t.e.m. a pilelor electrochimice:
din relatia (29),
rezulta ecuatia Gibbs-Helmholz pentru t.e.m. a pilelor electrochimice:
 (33)
(33)
in care 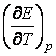 este coeficientul de
temperatura al t.e.m. la presiune constanta, iar ∆H = - JQ, (J
- echivalentul mecanic al caloriei, egal cu 4,186 Joule/cal; Q - caldura de reactie).
este coeficientul de
temperatura al t.e.m. la presiune constanta, iar ∆H = - JQ, (J
- echivalentul mecanic al caloriei, egal cu 4,186 Joule/cal; Q - caldura de reactie).
Daca 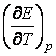 > 0, energia electrica produsa de pila este
mai mare decat energia chimica eliberata, deci pila se
raceste. La functionarea in regim izoterm, pila va absorbi
caldura din exterior.
> 0, energia electrica produsa de pila este
mai mare decat energia chimica eliberata, deci pila se
raceste. La functionarea in regim izoterm, pila va absorbi
caldura din exterior.
Daca 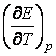 < 0, energia electrica este mai mica decat
energia chimica si pila se va incalzi. In regim izoterm, pila va
trebui sa cedeze caldura in exterior.
< 0, energia electrica este mai mica decat
energia chimica si pila se va incalzi. In regim izoterm, pila va
trebui sa cedeze caldura in exterior.
Daca 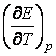 = 0 (cazuri extrem de rare: exemplu pila Daniel-Iacobi),
intre pila si mediul exterior nu se produce schimb de
caldura. In acest caz, relatia (23) devine asa numita relatie
Thomson:
= 0 (cazuri extrem de rare: exemplu pila Daniel-Iacobi),
intre pila si mediul exterior nu se produce schimb de
caldura. In acest caz, relatia (23) devine asa numita relatie
Thomson:
![]() (34)
(34)
relatie care arata ca energia chimica este transformata integral in energie electrica.
Influenta presiunii asupra tensiunii electromotoare Tensiunea electromotoare a pilelor electrochimice este influentata de presiune daca cel putin unul din electrozi este electrod de gaz si daca la reactia pe celula participa gaze.
Intr-un proces reversibil, variatia entalpiei libere de reactie cu temperatura este egala cu variatia de volum, ΔV:
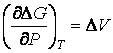 (35)
(35)
Inlocuind ![]() , se obtine:
, se obtine:
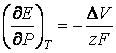 (36)
(36)
de unde dependenta de presiune a t.e.m. este data de relatia:
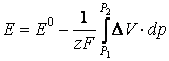 (37)
(37)
In aceste conditii, variatia de volum este:
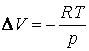 (38)
(38)
Inlocuind aceasta expresie in relatia (37) si efectuand integrarea se obtine:
![]() (39)
(39)
relatie care arata ca t.e.m. a pilei creste cu cresterea presiunii la anodul pilei (electrodul de gaz).
Tensiunea electromotoare a pilelor este tensiunea in conditii de echilibru termodinamic (in absenta unui curent electric exterior).
Tensiunea electromotoare a pilelor electrochimice nu poate fi masurata cu un voltmetru obisnuit deoarece apar erori mari datorita, pe de o parte, rezistentei interioare mici a voltmetrului in comparatie cu rezistenta interioara a pilei, iar pe de alta parte trecerii, in timpul masurarii, a unui curent prin pila, care polarizeaza electrozii si modifica potentialele de echilibru.
Pentru masuratori foarte precise se foloseste metoda indirecta, metoda compensatiei (opozitiei). Aceasta metoda consta in compensarea t.e.m. a pilei cercetate prin aplicarea unei tensiuni cunoscute, obtinute de la un acumulator, cu ajutorul unui montaj potentiometric (figura 1).
Printr-un fir metalic calibrat si omogen de rezistenta mare (AB), un acumulator (Ac) mentine o diferenta de potential (EAc). Pila X, cu tensiune necunoscuta, este legata cu un pol de capatul A al firului AB, cu celalalt pol la un galvanometru (G) si in continuare la intrerupatorul (I) si cursorul mobil (S). Pila se leaga astfel incat propria tensiune sa se opuna tensiunii acumulatorului (in opozitie, adica polul pilei la polul de acelasi semn al acumulatorului).
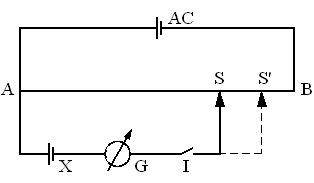
Fig. 1. Schema montajului pentru determinarea t.e.m. prin metoda compensatiei: Ac - acumulator; AB - fir metalic calibrat; X - pila de studiat; G - galvanometru; I - intrerupator; S, S1 - cursor mobil
Se inchide intermitent intrerupatorul I (intrerupator mobil) si se cauta o pozitie a cursorului mobil S pentru care acul galvanometrului nu mai indica trecerea curentului electric; la aceasta pozitie caderea de tensiune data de acumulator intre punctele A si S este compensata de t.e.m., EX a pilei X, adica:
![]() (40)
(40)
Pentru determinarea exacta a tensiunii intre A si B se inlocuieste pila X cu o pila etalon de tensiune cunoscuta (pila etalon Weston cu t.e.m. EW = 1,0183 V) si se determina o noua pozitie de echilibru, S1, pentru care se poate scrie:
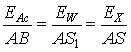 (41)
(41)
de unde:
 (42)
(42)
In practica, t.e.m. se masoara cu ajutorul unui potentiometru sau a unui voltmetru electronic (cu impedanta de intrare mare), care indica direct valoarea tensiunii electromotoare.
PROBLEME
Se considera pila:
Zn / Zn2+ (a = 0,1) // Cu2+ (a = 0,01) / Cu
Sa se precizeze tipul de pila, tipul de electrozi, polaritatea pilei, reactiile de electrod si reactia de celula si sa se calculeze t.e.m. la 25C, neglijand potentialul de difuziune.
Rezolvare
Pila data este o pila chimica complexa avand electrozi reversibili in raport cu cationii, adica electrozi de ordinul I. Polaritatea pilei este data de valorile potentialelor de echilibru ale celor doi electrozi, calculate cu ecuatia lui Nernst.
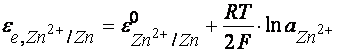
Inlocuind:
![]() = -0.763 V si
2.303RT/F = 0,0591 se obtine:
= -0.763 V si
2.303RT/F = 0,0591 se obtine:
![]() .
.
Pentru electrodul de Cu2+/Cu, se obtine:
![]() , respectiv
, respectiv
![]() .
.
Conform potentialelor de echilibru in conditiile date, electrodul de zinc este polul negativ si deci anodul pilei, iar electrodul de cupru este polul pozitiv si deci catodul pilei.
Reactiile de electrod cand pila functioneaza sunt:
-reactia anodica: ZnZn2+ + 2e
-reactia catodica: Cu2+ + 2eCu
-reactia de celula: Zn + Cu2+Cu + Zn2+
Tensiunea electromotoare se poate calcula cu ajutorul relatiei:
![]() sau cu relatia:
sau cu relatia:
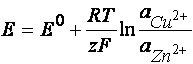
in
care: ![]()
si
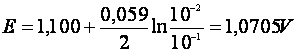 .
.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 6094
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved