| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
UNIVERSITATEA "OVIDIUS" CONSTANTA
FACULTATEA DE FIZICA, CHIMIE SI TEHNOLOGIA PETROLULUI
SPECIALIZAREA: PETROCHIMIE
PREDIMENSIONAREA UNUI REACTOR DE DEHIDROGENARE A ETILBENZENULUI CU FORMARE DE STIREN
Capitolul I. Introducere
1.1. Scopul proiectului
In acest proiect se urmareste realizarea si calculul efectiv al bilanului de materiale si a bilantului termic si predimensionarea reactorului de dehidrogenare a etilbenzenului pentru obtinerea de stiren.
Proiectul cuprinde un studiu de literatura despre procesul de obtinere a stirenului prin dehidrogenarea etilbenzenului si tipuri de reactoare utilizate pentru realizarea acestui proces, cat si calculul de predimensionare a unui astfel de reactor, cu prezentarea normelor de securitate in P.M si P.S.I. si norme privind toxicitatea din industria de fabricare a stirenului.
1.2. Stirenul - importanta practica si date despre capacitatea de productie a stirenului
Din marea gama de produse aromatice, ca derivate directe ale benzenului, o mare aplicabilitate industriala o are etilbenzenul, principala materie prima pentru obtinerea unui important monomer utilizabil in primul rand pentru fabricarea cauciucurilor sintetice - stirenul.
Stirenul, fiind un derivat direct al etilbenzenului, are, ca si acesta, o structura aromatica, este un lichid inflamabil, cu temperatura de firbere de 145.2ºC, foarte apropiata de cea a etilbenzenului care este de 136ºC, ceea ce ingreuneaza procesul de separare de etilbenzen.
Utilitatile stirenului sunt limitate in domeniul macromolecular. Monopolimerul impreuna cu copolimerii, cu acrilonitrilul, metacrilat de metil, clorura de vinil, constituie aproximativ 25-30% din productia materialelor termoplastice. Copolimerii cu divinil-benzen servesc la obtinerea de schimbatori de ioni, iar cei cu poliesteri nesaturati au capatat o mare extindere ca materiale de constructie.
Copolimerul butadiena-stiren are proprietati variate, in functie de raportul celor doi monomeri in polimer ; la continut mare de butadiena, copolimerul are, dupa vulcanizare, caracter de elastomer si reprezinta partea cea mai importanta a productiei de cauciuc sintetic.
Capacitatea de copolimerizare a stirenului este folosita si in productia de materiale peliculogene recurgandu-se la comonomeri sintetici sau naturali.
Domeniile de utilizare ale stirenului se repartizeaza orientativ, astfel : 57% polistiren ( homo si copolimeri pentru materiale plastice ), 27% cauciuc butadien-stiren, 5% poliesteri si 11% alte domenii.
Productia de stiren prezinta o dezvoltare constanta, dar mai putin spectaculoasa decat a altor monomeri, deoarece dateaza relativ de mai mult timp.
TABEL I.
Productia de stiren in principalele tari capitaliste, in mii tone
|
Tara producatoare | |||||||
|
SUA | |||||||
|
Japonia | |||||||
|
R.F.G. | |||||||
|
Anglia | |||||||
|
Franta | |||||||
|
Italia |
Productia de stiren se realizeaza in prezent aproape exclusiv prin dehidrogenarea etil-benzenului. Acesta se obtine printr-una din urmatoarele cai :
alchilarea benzenului cu etilena ;
separarea etilbenzenului din extractul aromatic ( fractiunile xilenice ) rezultat in instalatii de reformare catalitica ;
separarea etilbenzenului rezultat ca produs secundar la obtinerea izopropil-benzenului.
Pentru dehidrogenare se poate utiliza fie etil-benzen obtinut printr-una dintre operatiile enumerate, fie un amestec de etil-benzeni din provenientele aratate.
Capitolul II. Dehidrogenarea etil-benzenului la stiren. Studii de literatura
II.1. Termodinamica si cinetica procesului de dehidrogenare
II.1.1. Termodinamica procesului de dehidrogenare
Reactia de dehidrogenare a etil-benzenului este urmatoarea :
C6H5 - C2H6 → C6H5 - C2H3 + H2 ; DH = +28.7 Kcal/mol
Valorile constantei de echilibru a recatiei de dehidrogenare a etil-benzenului sunt reprezentate in urmatorul tabel :
TABEL II.
Valori ale constantei de echilibru pentru dehidrogenarea etil-benzenului.
|
Temperatura [ºC] |
DHº [Kcalmol |
DFº [Kcalmol |
Lg Kp |
Kp [ at ] |
|
2.61x10-15 |
||||
|
5.14x10-10 |
||||
|
9.65x10-5 |
||||
|
3.30x10-3 |
||||
|
4.71x10-2 |
||||
|
3.75x10-1 |
||||
|
7.87x100 |
||||
|
2.44x101 |
||||
|
2.99x102 |
Reactia de dehidrogenare a etil-benzenului poate fi insotita de formarea fenil-acetilenei prin dehidrogenarea stirenului sau prin disproportionarea a doua molecule de stiren dupa reactia :
(1) 2 C6H5-C2H3 (stiren) → C6H5-C2H (fenil-acetilena) + C6H5-C2H5 (etil-benzen) sau
(2) C6H5-C2H3 (stiren) → C6H5-C2H (fenil-acetilena) + H2
Valorile constantelor de echilibru pentru cele doua reactii sunt:
TABEL III. Valorile constantei de echilibru pentru reactia (1)
|
Temperatura [ºC] |
DHº [Kcal/mol] |
DFº [Kcal/mol] |
Lg Kp |
Kp [at] |
|
3.13x10-5 |
||||
|
3.44x10-4 |
||||
|
8.60x10-4 |
||||
|
2.10x10-3 |
||||
|
4.00x10-3 |
||||
|
5.30x10-3 |
TABEL IV. Valorile constantei de echilibru pentru reactia (2)
|
Temperatura [ºC] |
DHº [Kcal/mol] |
DFº [Kcal/mol] |
Lg Kp |
Kp [at] |
|
3.01x10-9 |
||||
|
1.15x10-5 |
||||
|
1.73x10-3 |
||||
|
5.13x10-2 |
||||
|
5.87x10-1 |
||||
|
6.32x100 |
Dupa cum se vede, fenil-acetilena este prezenta alaturi de stiren in cantitati foarte mici (p.p.m.) chiar la temperaturi joase, cantitatea crescand cu temperatura.
Temperaturile de congelare si de fierbere ale fenil-acetilenei fiind foarte apropiate de cele ale stirenului, practic nu poate fi separata de stiren.
Alte reactii secundare care au loc sunt :
C6H5C2H5 → 8C + 5H2 DH = -0.41 Kcal/mol
8C+16H2O → 8CO2 +16H2 DH = +190.08 Kcal/mol
C6H5C2H5 → C6H6+C2H4 DH = +24.3 Kcal/mol
C6H5C2H5 + H2 → C6H5 DH = -15.4 Kcal/mol
C6H5C2H5 + H2→C6H6 + C2H6 DH = -10.0 Kcal/mol
Prin reactii radicalice se mai formeaza circa 0.1% izopropil-benzen si -metil-stiren(calculat fata de stirenul produs ) si urme de butil-benzen. Se formeaza deasemenea circa 0.7% hidrocarburi cu temperatura de fierbere inalta : difenil-etan, stilben etc.
Ca urmare a reactiilor secundare, caldura efectiva consumata de reactie este de 33.2 Kcal/mol stiren.
II.1.2. Cinetica procesului de dehidrogenare
Dupa cum s-a aratat anterior, la obtinerea stirenului din etil-benzen, pe langa reactia principala avem si reactii secundare :
reactia de dezalchilare : C6H5CH2CH3 → C6H6 + CH2 = CH2 ;
reactia de demetanizare : C6H5CH2CH3 + H2 → C6H5CH3 + CH4 ,
reactii care nu influenteaza foarte mult reactia principala.
Ecuatia vitezei de reactie de dehidrogenare este data de relatia :
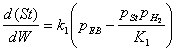 (1) in care:
(1) in care:
dSt - cantitatea de stiren produs ( Kmol/h );
W - cantitatea de catalizator ( Kg ) ;
K1 - constanta de echilibru pentru formarea stirenului ;
k1 - constanta de viteza pentru reactia de formare a stirenului ( Kmol/hxatxKg catalizator )
pEB - presiunea partiala a etil-benzenului (at) ;
pSt - presiunea partiala a stirenului (at) ;
pH2 - presiunea partiala a hidrogenului (at).
Prin integrarea ecuatiei de viteza se obtine expresia:
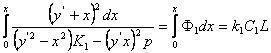 (2), in care :
(2), in care :
x - fractia de etil-benzen, transformat in stiren ;
- fractia care multiplica pe dx ;
y' - randamentul, in % ;
L - inaltimea stratului de catalizator, in m ;
P - presiunea totala, in at ;
C1 = p∫A/noK1 , unde no = debitul de etil-benzen, in Kmol/h;
∫ = densitatea aparenta a catalizatorului, in at;
A = aria sectiunii transversale a stratului de catalizator, in m2.
Pentru calculul inaltimii stratului de catalizator L, integrarea se efectueaza graphic, folosind diagrama conversie X functie de randament y', obtinuta pe baza datelor experimentale.
Din ecuatia dreptei rezulta pentru constanta de viteza a reactiei de dehidrogenare relatia :
![]() (3)
(3)
Toate aceste relatii se aplica in cazul folosirii unui catalizator cu regenerare fracventa.
Pentru determinarea constantei de viteza pentru reactia de dezalchilare s-a pornit de la ecuatia :
![]() (4), (Bz) fiind cantitatea de
benzen.
(4), (Bz) fiind cantitatea de
benzen.
Integrarea grafica folosind corelatia aproximativa y/x functie de Xa datelor experimentale, duce pentru constanta de viteza a reactiei de dezalchilare k2 la ecuatia:
![]() (5)
(5)
In mod asemanator se obtin datele privind formarea toluenului. In cazul unui catalizator autoregenerativ in prezenta unei cantitati apreciabile de abur, determinarea ecuatiilor cinetice este mai dificila, deoarece se efectueaza in conditii adiabatice, iar la trecerea prin stratul catalitic, avand loc o cadere considerabila de temperatura.
Pentru simplificare se considera ca stirenul este singurul produs al recatiei al carei echilibru este dat de relatia:
![]() (6)
(6)
Conversiile reale la echilibru sunt mai mici din cauza reactiilor secundare si formarii hidrogenului in urma arderii cocsului depus pe catalizator.
Date pentru o alta interpretare a cineticii dehidrogenarii etil-benzenului s-au cules, in intervalul de temperaturi 520-5600C la o viteza de volum intre 800 si 1000 mllh, in prezenta unui catalizator format dintr-un amestec de oxizi metalici ; viteza de reactie s-a determinat dupa cantitatea de stiren format, observandu-se o buna corelatie cu cantitatea de hidrogen degajat.
Interpretarea cantitativa a cineticii reactiilor catalitice monomoleculare a avut c abaza modelul introdus de Balandin, care presupune existenta unei corespondente structurale intre moleculele reactantilor si reteaua cristalina a catalizatorului. Reactia este precedata de un echilibru de adsorbtie a reactantului pe un sistem de doua sau trei centre active adiacente intr-o configuratie geometrica care favorizeaza legarea dintre grupul reactant si catalizator.
Pentru determinarea coeficientilor relativi de adsorbtie a produselor de reactie - stiren si hidrogen - au fost determinate, in conditii similare, vitezele de dehidrogenare ale amestecurilor binare etil-benzen-stiren si etil-benzen-hidrogen, valorile numerice ale coeficientilor relativi de adsorbtie calculandu-se cu formula :
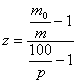 (15),
(15),
in care : m0 si m reprezinta cantitatea de produs de reactie format la trecerea substantei si a unui amestec continand p procente substanta si produsul de reactie pentru care se determina z.
Coeficientii relativi de adsorbtie a stirenului variaza de la 48, la 520oC, la 15, la 550oC. s-a constatat ca coeficientul de adsorbtie a hidrogenului nu se modifica cu temperatura si este egal cu 0.7.
Coeficientii relativi de adsorbtie ai stirenului sunt redati in urmatorul tabel :
TABEL V.
Coeficientii relativi de adsorbtie ai amestecului etil-benzen-stiren (19.5% stiren)
|
Temperatura [oC] |
mo |
m |
Z |
|
| |||
Hidrogenul nu influenteaza viteza de reactie. Adsorbtia pe centrele active are loc competitiv intre etil-benzen si stirenul produs in reactie. Fenomenul este pus in evidenta alimentandu-se reactorul de dehidrogenare cu amestecuri cu continut variabil de stirene.
II.2. Procedee de obtinere a stirenului
Desi cea mai mare parte din stirenul produs se fabrica prin dehidrogenarea etilbenzenului, exista si alte procedee de producere a acestuia si anume procese de oxidare si epoxidare.
a). Procedeul de oxidare
1). Etil-benzenul este oxidat la acetofenona pe un catalizator de acetat de mangan la 115-145oC si presiune de circa 3at conform reactiei :
C6H5-CH2-CH3 (etil-benzen) + O2→ C6H5-COCH3 (acetofenona) + H2O
Aceasta este apoi redusa la -feniletilalcool (metil-fenil-carbinol) folosind hidrogen pe un catalizator de Cu-Cr-Fe la 150oC si aproximativ 10 at :
C6H5-COCH3 (acetofenona)→ C6H5-CH(OH)CH3 (metal-fenil-carbinol)
Prin deshidratarea alcoolului pe catalizator de TiO2, H3PO4, acid oxalic anhidru si clorura de oxalil la 2800C si presiune atmosferica se obtine in final stiren.
Procedeul prezinta dezavantajul ca faza de oxidare este coroziva si se obtin randamente in stiren cu circa 10% mai mici decat in cazul dehidrogenarii. Totusi aceasta cale de obtinere a stirenului nu a fost parasita. De exemplu, in S.U.A., unde, in prezent, se obtine stiren, in cantitati mici si prin utilizarea acestei metode.
2). Distillers a experimentat in 1964 un procedeu de oxidare folosind aer si un catalizator de oxid de stibiu. Prin adaugare de halogeni la oxigen, randamentele se imbunatatesc. Ca halogen se utilizeaza iod sau brom. Acest procedeu reclama materiale speciale datorita mediului coroziv.
3). Shell a elaborat un procedeu in care etil-benzenul reactioneaza cu bioxid de sulf in prezenta unui catalizator fosfat metalic la 450-600oC iar randamentul in stiren ar fi comparabil. Acest procedeu nu a fost insa aplicat industrial.
4). Din acetofenona, stirenul se poate obtine si printr-o reactie Meerwin, Pseudorf si Verley, trecand peste gel de silice, la 350oC, un amestec de vapori de acetofenona si alcool etilic.
5). Stirenul pur se poate obtine si transformand acetofenona in α-fenil-etil-amina, care se poate apoi descompune termic, dupa ce in prealabil a fost tratata cu acid clorhidric
b). Procedeul de epoxidare
Un alt procedeu de obtinere a stirenului este procesul bazat pe reactia de epoxidare a etilbenzenului, urmata de deshidratarea metal-fenil-carbinolului format de procedeul Halcon S.D.
Reactiile principale sunt:
oxidarea in faza lichida a etilbenzenului la hiperoxid de etilbenzen:
C6H5-CH2-CH3+O2 C6H5-CHOOH-CH3
epoxidarea propenei in faza lichida, cu hidroperoxid de etilbenzen, la propenoxid, cu formare de metal-fenil-carbinol:
C6H5-CHOOH-CH3+CH3-CH=CH2 C6H5-CHOH-CH3+CH3-CH-CH2
/
O
hidrogenarea hidroperoxidului rezidual si a acetofonei rezultate ca produs la metal-fenil-carbinol:
C6H5-CO-CH3+H2 C6H5-CHOH-CH3
deshidratarea metal-fenil-carbinolului la stiren:
C6H5-CHOH-CH3 C6H5-CH=CH2+H2O
Produsele finite in acest procedeu sunt stirenul si propenoxidul, doua produse cu largi utilizari in industria petrochimica.
Procedeul prezinta dezavantajul unor coroziuni puternice in faza de oxidare, randamente scazute si implica mai multe faze in comparatie cu procedeul de dehidrogenare a etilbenzenului.
In figura 1 se prezinta schema simplificata a procedeului Halcon S.D.
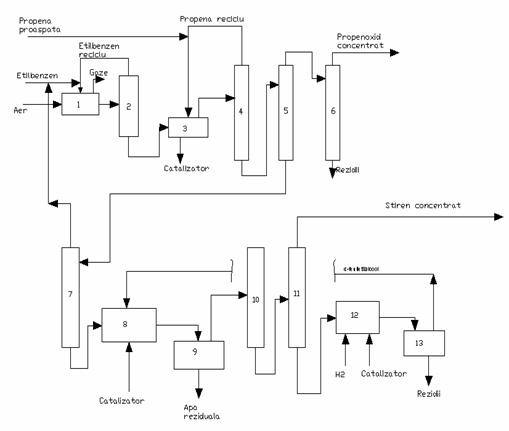
Fig.1 - schema de flux pentru
fabricarea stiren-propenoxidului
Etilbenzenul proaspat si recirculat sunt introduse in reactorul de oxidare cu aer sau oxigen, in faza lichida, la temperatura de 120-140 C si 35 bar. Selectivitatea in hidroperoxid de etilena este de 87%, obtinandu-se simultan: fenil-carbinol, acetofenona si etilbenzen nereactionat, care este recirculat la reactorul de oxidare. Hidroperoxidul concentrat se trimite la epoxidare cu propena. Reactia decurge in faza lichida, in prezenta de catalizatori la 90-130 C si 15-16 bar. In coloanele urmatoare propena nereactionata este separata si recirculata la reactorul de epoxidare, dupa care se separa propen-oxidul.
Produsele grele sunt fractionate pentru recuperarea etilbenzenului, iar amestecul fenilcarbinol si acetofenona este deshidratat la stiren, la temperaturi de 180-280 C, pe catalizator. Selectivitatea la stiren este de 95% la o conversie de 85% a etilbenzenului. Stirenul brut se purifica prin distilare si rectificare, iar produsele secundare-acetofenona si fenilcarbinolul nereactionat, precum si produsele grele sunt hidrogenate la fenilcarbinol, care dupa separare se recircula la deshidratare.
In procedele de fabricare a stirenului prin oxidarea etilbenzenului si epoxidarea propenei se foloseste la etilbenzen-min 99,5% si propena-grad chimic 90-92%.
Catalizatorii de epoxidare reprezinta un complex pe baza de Mo,V,Ti si metale solubile in hidrocarburi. Catalizatorii de deshidratare sunt pe baza de TiO2/Al2O3.
c). Alte procedee de obtinere a stirenului
1). O metoda mai veche de obtinere a stirenului consta in clorurarea etil-benzenului, urmata de dehidroclorurare.
Stirenul astfel obtinut contine urme de produse clorurate foarte greu de separat.
2). Piroliza unor fractiuni de petrol duce in anumite conditii la formarea stirenului. Fractiunea rezultata cu temperatura de fierbere cuprinsa intre 135 si 150oC contine : etil-benzen, xileni si stiren.
3). Pentru obtinerea in laborator astirenului pur se poate porni de la acid cinamic sau de la sarurile sale :
C6H5-CH=CHCOOH→C6H5-CH=CH2 + CO2
4). Se obtine stiren de foarte inalta puritate utilizabil ca etalon in scopuri analitice prin tratarea sa cu mici cantitati de n-butil-litiu sub vid inaintat; n-butil-litiul initiaza polimerizarea anionica, dar mentinand temperature sub 0oC, se poate reduce conversia la polimer. Atat initiatorul cat si polistiril-litiul ('polimerul viu') sunt foarte reactivi fata de apa, oxigen si donorii de protoni, amestecul fiind rapid purificat de astfel de impuritati. Monomerul purificat este recuperat prin distilare in vid inaintat.
II.2.1 Consideratii generale privind dehidrogenarea etilbenzenului
C6H5-CH2-CH3 C6H5-CH=CH2+H2 DH 298=125kJ/mol
In absenta catalizatorilor, reactia de obtinere a stirenului are loc la temperaturi mai ridicate, intre 700-800 C, cu conversii pe trecere de 20-30% mol si randamente globale de 50-60% mol. Echilibrul termodinamic al reactiei de dehidrogenare a etilbenzenului la stiren arata ca nu se obtin randamente ridicate in stiren la temperaturi de peste 700 C, deoarece viteza reactiilor secundare devine atat de mare incat selectivitatea reactiei de dehidrogenare scade considerabil. Deoarece reactia de dehidrogenare a etilbenzenului la stiren este insotita de o dublare a volumului, reducerea presiunii partiale a etilbenzenului are ca efect deplasarea echilibrului in sensul formarii stirenului.
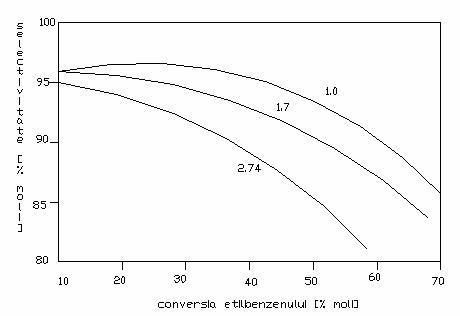
Fig. 2 - influenta presiunii asupra
conversiei si selectivitatii dehidrogenarii etilbenzenului la stiren
In afara de reactia de dehidrogenare a etilbenzenului la stiren, in aceleasi conditii mai pot avea loc numeroase reactii secundare, dintre care se mentioneaza acelea care influenteaza in mod sensibil selectivitatea dehidrogenarii etilbenzenului sau activitatea catalizatorilor si anume:
dezalchilarea etilbenzenului:
C6H5-CH2-CH3 C6H6+C2H4 DH 298 = 103,19 kJ/mol
hidrodezalchilarea etilbenzenului:
C6H5-CH2-CH3+H2 C6H5-CH3+CH4 DH 298 = -66,045 kJ/mol
hidrodezalchilarea toluenului:
C6H5-CH3+H2 C6H6+CH4 DH 298 = -42,5 kJ/mol
formarea cocsului:
C6H5-CH2-CH3 8C+5H2H4
Ca urmare a reactiilor secundare, caldura efectiva de reactie, consumata la producerea stirenului, creste la circa 138 kJ/mol.
Vaporii de apa folositi ca diluant aduc aportul caloric necesar reactiei, micsoreaza considerabil presiunea partiala a etilbenzenului, deplasand echilibrul in favoarea producerii stirenului si reduce depunerea de cocs pe catalizator, mentionandu-l intr-o forma activa, iar prezenta catalizatorilor amelioreaza conversia si selectivitatea procesului.
Conditiile specifice dehidrogenarii catalitice a etilbenzenului la stiren sunt urmatoarele: temperatura 550-650 C, viteza volumica 0,3-1h-1, presiunea 0,1-0,3A106 Pa abs in instalatiile mai vechi si sub 0,1 A106 Pa abs in instalatiile noi.
Primul catalizator folosit la obtinerea stirenului a fost constituit dintr-un amestec de trei componenti: ZnO, Al2O3, CaO, care la temperaturi de 600-675 C conduce la obtinerea unei conversii de 38% si a unei selectivitati de 82%.
In prezent se folosesc catalizatori alcatuiti exclusiv pe baza de oxizi de fier promotati cu compusi ai potasiului, cromului, vanadiului, zincului, cuprului, cu metale rare, erc. Acesti catalizatori se caracterizeaza prin: stabilitate buna in prezenta vaporilor de apa, activitate si selectivitate ridicata (randamente de circa 60%, selectivitati de peste 90 %), durata de functionare indelungata (circa 2 ani). Principalul component activ, oxidul de fier, are si rolul de suport al catalizatorului.
II.2.2 Procedee de dehidrogenare a etilbenzenului
Cele doua tipuri de reactoare difera prin modul de aducere a caldurii in zona de reactie, tinand seama de faptul ca atat etilbenzenul cat si stirenul sufera procese de descompunere termica la temperaturi mai mari de 610 C, dar ca operarea reactorului la temperaturi apropiate de aceasta valoarea conduce la conversii optime ale etilbenzenului.
In reactorul adiabatic singura sursa de caldura o constituie aburul supraincalzit cu care se amesteca etilbenzenul, inainte de a veni in contact cu catalizatorul; temperatura de intrare a amestecului in reactor este de circa 630 C, realizandu-se randamente de circa 88-91%, in stiren.
In reactorul izoterm, caldura este asigurata indirect prin intermediul unui fascicul tubular, realizandu-se o temperatura mai uniforma a stratului de catalizator, in limitele 580-610 C si randamente de 92-94%, adica cu circa 3% randamente in stiren mai bune decat in cazul reactorului adiabatic.
De mentionat este insa faptul ca reactoarele izoterme sunt mai costisitoare decat reactoarele adiabatice.
Etilbenzenul suspus dehidrogenarii trebuie sa aiba o puritate mare, neadmitandu-se un continut de peste 0,2% xileni in cazul in care se obtine prin separare din fractiunile xilenice, sau peste 0,04% dietilbenzen in cazul in care se obtine prin alchilare, acesta din urma se dehidrogeneaza la divinil-benzen, care polimerizeaza foarte repede formand polimeri insolubili si ingreunand mult exploatarea. Benzenul continut in etilbenzen nu influenteaza reactia de dehidrogenare, uneori fiind citate folosirea sa ca diluant in locul vaporilor de apa.
In procedeul adiabatic conform figurii 3 amestecul de reactie este incalzit pana la o anumita temperatura inainte de intrare in reactor. In reactor o parte din energia termica a amestecului se consuma pentru desfasurarea reactiei endoterme, astfel incat efluentul de la reactie paraseste reactorul cu o temperatura mai scazuta. In procedeul izoterm, din contra, caldura necesara reactiei endoterme este adusa indirect, incat temperatura ramane practic constanta.
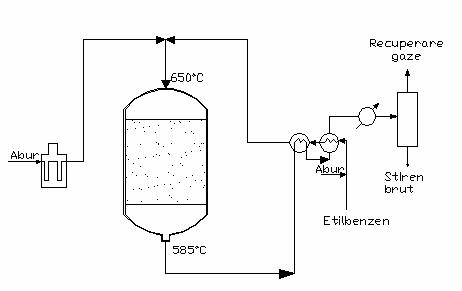
Fig. 3 - reactorul adiabatic pentru fabricarea stirenului
Procedeul adiabatic a fost elaborat initial de Dow Chemical. In reactorul adiabatic sursa de caldura este amestecarea etilbenzenului preincalzit in prealabil la 520 C cu abur supraincalzit la 710 C. Cantitatea de abur este astfel reglata incat continutul de caldura al amestecului de alimentare sa fie suficient pentru ca reactia sa decurga la o temperatura suficient de inalta. In aceste conditii temperatura amestecului de intrare in reactor este de 630 C, iar cea de iesire de aproximativ 570 C. Incalzirea etilbenzenului pana la 520 C se realizeaza prin introducerea a cca. 10% din cantitatea de abur utilizata, restul de abur de 90% fiind supraincalzit intr-un cuptor la temperatura de 710 C si amestecat cu fluxul de etilbenzen.
Procedeul izoterm
Procesul izoterm foloseste un reactor multitubular incalzit din exterior cu gaze de combustie, recirculate de catre un ventilator.
Etil-benzenul impreuna cu vapori de apa de 4at, se evapora la 2100C si apoi se supraincalzesc succesiv la 540-555oC, temperatura cu care intra in reactor.
Produsele de reactie parasesc reactorul la 585-595oC si se racesc la 320-360oC intr-un schimbator de caldura. In continuare se condenseaza si se separa o faza lichida, care trece la prelucrarea ulterioara, si o faza gazoasa folosita drept combustbil. Gazele de combustie intra in spatiul reactorului cu 700oC si-l parasesc cu 6200C. In constructia reactorului se utilizeaza tevi cu diametrul de 100-200mm. Un reactor poate produce 1800 t stiren pe luna.
Principalul avantaj al reactorului izoterm este ca reclama un consum de abur de numai 1 Kg abur/Kg etil-benzen pe de-o parte, iar pe de alta parte se obtine un randament cu circa 3% mai ridicat decat in cazul reactorului adiabatic (92%). In schimb, reactorul izoterm reclama investitii mai mari atat datorita constructiei propriu-zise cat si circulatiei gazelor arse.
II.3 Separarea stirenului
Temperaturile de fierbere foarte apropiate ale etilbenzenului (136 C) si stirenului (145,2 C) impun un numar mare de talere pentru realizarea separarii si implicit o cadere totala de presiune mare, ca suma a caderilor de presiune pe fiecare taler, deci o temperatura inalta la baza coloanelor. Pentru separarea etilbenzenului de stiren, sunt necesare aproximativ 75 de talere practice si considerand pierderea de presiune pe un taler de 4-5 mm Hg, se ajunge in baza coloanei la o suprapresiune de minimum 300 mm Hg.
Separarea prin rectificare la presiune atmosferica nu este posibila, deoarece la 100 C, intr-o ora, polimerizeaza 4 % din stiren, iar la 130 C circa 50%.
La aceasta dificultate trebuie adaugate in primul rand conditiile de inalta puritate impuse stirenului pentru polimerizare si in al doilea rand necesitatea recuperarii benzenului si toluenului la un grad de puritate care sa permita recircularea benzenului la alchilare si folosirea toluenului la nitrare.
Pentru micsorarea pericolului de polimerizare a stirenului se aplica distilarea la presiuni remanente cat mai joase: de exemplu la 30 mm Hg in prezenta inhibatorilor (sulf, p-tert-butil-pirocatechina), temperatura de fierbere este de numai 54 C, polimerizand mai putin decat 0,1% stiren/h.
II.4Caracteristici
Principalele caracteristici fizice ale stirenului sunt:
- temperatura de fierbere la 760 mmHg, C: 145,0
- temperatura de congelare, C: -30,6
- specificatie: puritate, %gr: 6
- peroxizi, ppm: 5,0
CAPITOLUL III
Predimensionarea reactorului de dehidrogenare
III.1. Datele de proiectare ale unui reactor de dehidrogenare
debit alimentare cu etilbenzen : 1kmol/h
raport de recirculare : 4:1
compozitia reciclului : 98% etilbenzen si 2% stiren
presiunea totala in sistem : 4bar
ore de functionare a instalatiei : 8000 ore/an
raport molar abur/materie prima in alimentarea reactorului : R=13
catalizatorul utilizat Fe2O3 printr-un procedeu adiabat
capacitate de productie a instalatiei: 65000 t/an
puritate stiren : 97%
pierderea in fluxul tehnologic in % fata de stiren :
- in apele reziduale : 1,5%
III.2 Descriera procesului tehnologic
III.3. Calculul bilantului de materiale
Avem un debit initial de 1kmolh EB (Etil-Benzen).
Raportul de recirculare este de 4 :1 ( 98% EB ; 2% St ).
XA = conversia EB.
nA = nA0 ( 1 - XA )
TABEL VI . Bilant de materiale pe reactoare
|
COMPONENT |
DEBITE INTRARE IN REACTOR [Kmoli/h] |
DEBITE IESIRE [Kmoli/h] |
|
EB |
(1+3.92) (1-XA) |
|
|
St |
2)XA + 0.08 |
|
|
H2 |
(1+3.92) XA |
|
|
Abur |
R(1+3.92) |
R(1+3.92) |
|
Total |
5+4.92R |
5+4.92R+4.92XA |
Reactia care sta la baza procesului este:
CH3-CH2-C6H5 ↔ C6H5-C2H3 + H2
Calculul conversiei (XA) pentru EB (etilbenzen)
Formula dupa care se calculeaza conversia este urmatoarea:
![]() ;
; ![]()
![]()
![]()
![]()
Se calculeaza KP pentru urmatoarele temperaturi:
723K→ KP = exp ( 16.2 - 21.23 ) = 0.0065
773K→ KP = exp (16.2 - 19.85 ) = 0.0259
823K→ KP = exp ( 16.2 - 18.65 ) = 0.0862
923K→ KP = exp ( 16.2 - 16.63 ) = 0.6505
973K→ KP = exp ( 16.2 - 15.77 ) = 1.5372
Din relatia presiunii partiale a EB se calculeaza XA pentru valorile KP calculate,astfel :
![]() ;
; ![]()
![]()
Pentru KP = 0.0065

Pentru Kp = 0.0259
![]()

Pentru Kp = 0.0862

Pentru Kp = 0.6505

Pentru Kp = 1.532

Se tabeleaza rezultatele intr-un TABEL VII care va contine valori ale: T , KP si XA
|
T [K] | ||||||
|
Kp | ||||||
|
XA |
|
TABEL VIII. Entalpii standard de formare
|
Caldura
de formare |
|
|
COMPONENT |
D0hj (Kj/Kmol) |
Kcal/kmol |
|
EB |
29.92 x 103 | |
|
St |
147.36 x 103 | |
|
H2 | ||
|
ABUR |
-241.82 x 103 | |
Capacitatile calorice molare variaza cu temperatura :
Cp = R ( A + BT + CT2 )
A,B,C = constante
R = 8.314 KJ/Kmol K
TABEL IX . Valori ale constantelor
|
COMPONENT |
A |
B |
C |
|
EB |
55.38 x 10-3 |
-18.476 x 10-6 |
|
|
St |
50.192 x 10-3 |
-16.662 x 10-6 |
|
|
H2 |
0.442 x 10-3 | ||
|
ABUR |
1.42 x 10-3 |
Se calculeaza Cpj pentru fiecare temperatura :
Pentru EB :
773K : Cp = 8.314 (1.124+42.80-11.03) = 273.48
873K : Cp = 8.314 (1.124+48.34-14.08) = 294.18
923K : Cp = 8.314 (1.124+51.11-15.74) = 303.41
973K : Cp = 8.314 (1.124+53.88-17.49) = 311.89
1023K : Cp = 8.314 (1.124+56.65-19.33) = 319.62
Pentru St :
773K : Cp = 8.314 (2.05+38.79-9.95) = 256.81
873K : Cp = 8.314 (2.05+43.81-12.69) = 275.77
923K : Cp = 8.314 (2.05+46.32-14.19) = 284.17
973K : Cp = 8.314 (2.05+48.83-15.77) = 291.90
1023K : Cp = 8.314 (2.05+51.34-17.43) = 298.97
Pentru H2 :
773K : Cp = 8.314 (3.249+0.341) = 29.847
873K : Cp = 8.314 (3.249+0.385) = 30.213
923K : Cp = 8.314 (3.249+0.407) = 30.395
973K : Cp = 8.314 (3.249+0.43) = 30.587
1023K : Cp = 8.314 (3.249+0.45) = 30.753
Pentru abur :
773K : Cp = 8.314 (3.47+1.09) = 37.911
873K : Cp = 8.314 (3.47+1.23) = 39.075
923K : Cp = 8.314 (3.47+1.31) = 39.740
973K : Cp = 8.314 (3.47+1.38) = 40.322
1023K : Cp = 8.314 (3.47+1.45) = 40.904
TABEL X . Valori calculate ale Cp
|
Component | |||||
|
EB | |||||
|
St | |||||
|
H2 | |||||
|
ABUR |
Se vor reprezenta grafic variatia Cp cu temperatura. Din grafic se citeste valoarea Cp pentru EB si Abur la 6500C ( 923K) si la 6800C (953K).
Se inmultesc valorile caldurilor specifice cu 10-3.
Din grafic s-au observat urmatoarele valori :
Cp EB = 303.41 Kcal/Kg ; (923K)
Cp abur = 40.10 Kcal/Kg. (953 K)
Se vor calcula fractile molare EB, St, H2, abur la iesirea din reactor,astfel :
Pentru EB :
- conversia (XEB) este 0.2
![]()
- XEB = 0.4
XEB = 0.6
- XEB = 0.8
-XSt = 0.2
nSt = 1.06 ; n total = 69.94 ; XSt = 0.015
- XSt = 0.4
nSt = 2.04 ; n total = 70.92 ; XSt =0.028
- XSt = 0.6
nSt = 3.03 ; n total = 71.91 ; XSt = 0.042
- XSt = 0.8
nSt = 4.01 ; n total = 72.89 ; XSt = 0.055
Pentru H2 :
XH2 = 0.2
nH2 = 0.98 ; n total = 69.94 ; XH2 = 0.014
XH2 = 0.4
nH2 = 1.96 ; n total = 70.92 ; XH2 = 0.027
XH2 = 0.6
nH2= 2.95 ; n total = 71.91 ; XH2 = 0.041
XH2 = 0.8
nH2 = 3.93 ; n toal = 72.89 ; XH2 = 0.053
Pentru abur :
-Xabur = 0.2
nabur = 63.96 ; n total = 69.94 ; Xabur = 0.914
Xabur = 0.4
nabur = 63.96 ; n total = 70.92 ; Xabur = 0.901
Xabur = 0.6
nabur = 63.96 ; n total = 71.91 ; Xabur = 0.889
Xabur = 0.8
nabur = 63.96 ; n total = 72.89 ; Xabur = 0.877
TABEL XI. Fractii molare calculate pentru anumite valori ale conversiei
|
Fractie molara Conversie |
XEB |
XSt |
XH2 |
Xabur |
Total |
Se calculeaza fractiile molare la intrare astfel :
EB :
![]()
St :
![]()
Abur :
![]()
Calculam Qi ( 923K ) cu formula :
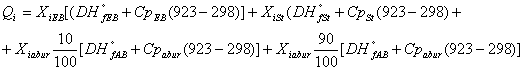 [Kj/kmol h]
[Kj/kmol h]
Qi = 0.071(29.92 x 103+ 303.41 x 625) + 0.001 (147.36 x 103 + 284.17 x 625) + 0.927 x 0.1(-241.82 x 103 + 39.740 x 625) + 0.927 x 0.9(-241.82 x 103 + 40.10 x 655)
Qi = 15588.13 + 324.96 - 20114.27 -179837.11
Qi = -184038.29 Kj/kmol h
Calculam Qe dupa formula :
Qe = xeEB [ DºhEB + CpEB ( Te - 298 )] + XeSt [ DºhSt + CpSt (Te - 298)] +
+XeH2 [ DºhH2 + CpH2 (Te-298)] + Xeabur [ Dºhabur + Cpabur (Te-298)] ; Kjkmol h.
Qe se va calcula pentru valori ale conversiei date ( 0.2; 0.4; 0.6; 0.8 ) si pentru temperaturile de iesire urmatoare : 773K ; 873K ; 923 ; 1023K.
Aceste valori ale temperaturilor au fost date pentru ca eroarea sa fie de maxim 5%.
Formula dupa care se calculeaza eroarea este urmatoarea :
![]()
Se va reprezenta grafic variatia conversiei cu temperatura.
Pentru o conversie de 0.2 avem :
Te = 773K
CpEB = 8.314 (1.124+42.80-11.03) = 273.48
CpSt = 8.314 (2.05+38.79-9.95) = 256.81
CpH2 = 8.314 (3.249+0.341) = 29.847
CpAb = 8.314 (3.47+1.09) = 37.911
Qe = 0.056 (29.92 x 103 + 273.48 x 475) + 0.015 (147.36 x 103 + 256.81 x 475) + 0.014 ( 0+ 29.847 x 475 ) + 0.914 (-241.82 x 103 + 37.911 x 475)
Qe = 8950.08 + 4040.17 + 198.482 - -204564.42
Qe = -191375.68 kj/kmol h
![]()
Te = 873
CpEB = 8.314 (1.124+48.34-14.08) = 294.18
CpSt = 8.314 (2.05+43.81-12.69) = 275.77
CpH2 = 8.314 (3.249+0.385) = 30.213
CpAb = 8.314 (3.47+1.23) = 39.075
Qe = 0.056 (29.92 x 103 + 294.18 x 575) + 0.015 (147.36 x 103 + 275.77 x 575) + 0.014 ( 0+ 30.213 x 575 ) + 0.914 (-241.82 x 103 + 39.075 x 575)
Qe = 11148.11 + 4588.91 + 243.214 - 200487.61
Qe = - 184507.37 kj/kmol
![]()
Te = 923
CpEB = 8.314 (1.124+51.11-15.74) = 303.41
CpSt = 8.314 (2.05+46.32-14.19) = 284.17
CpH2 = 8.314 (3.249+0.407) = 30.395
CpAb = 8.314 (3.47+1.31) = 39.740
Qe = 0.056 (29.92 x 103 + 303.41 x 625) + 0.015 (147.36 x 103 + 284.17 x 625) + 0.014 ( 0+ 30.395 x 625 ) + 0.914 (-241.82 x 103 + 39.740 x 625)
Qe = 12294.87 + 4874.21 + 265.956 -198322
Qe = -180886.96 kj/kmol h
![]()
Te = 1023
Cp = 8.314 (1.124+56.65-19.33) = 319.62
Cp = 8.314 (2.05+51.34-17.43) = 298.97
Cp = 8.314 (3.249+0.45) = 30.753
Cp = 8.314 (3.47+1.45) = 40.904
Qe = 0.056 (29.92 x 103 + 319.62 x 725) + 0.015 (147.36 x 103 + 298.97 x 725) + 0.014 ( 0+ 30.753 x 725 ) + 0.914 (-241.82 x 103 + 40.904 x 725)
Qe = 14652.09 + 5461.69 + 312.142 - 193918.44
Qe = -173492.51 kj/kmol h
![]()
Pentru o conversie de 0.4 avem:
Te = 773K
Qe = 0.041 (29.92 x 103 + 273.48 x 475) + 0.028 (147.36 x 103 + 256.81 x 475) + 0.027 ( 0+ 29.847 x 475 ) + 0.901 (-241.82 x 103 + 37.911 x 475)
Qe = 6552.74 + 7541.65 + 382.78 - 201654.85
Qe = -187177.68 kj/kmol h
![]()
Te = 873K
Qe = 0.041 (29.92 x 103 + 294.18 x 575) + 0.028 (147.36 x 103 + 275.77 x 575) + 0.027 ( 0+ 30.213 x 575 ) + 0.901 (-241.82 x 103 + 39.075 x 575)
Qe = 8162.01 + 8565.97 + 469.05 - 197636.03
Qe = -180439 kj/kmlol h
![]()
Te = 923K
Qe = 0.041 (29.92 x 103 + 303.41 x 625) + 0.028 (147.36 x 103 + 284.17 x 625) + 0.027 ( 0+ 30.395 x 625 ) + 0.901 (-241.82 x 103 + 39.740 x 625)
Qe = 9001.60 + 9099.05 + 512.91 - 195501.23
Qe = -176887.67 kj/kmol h
![]()
Te = 1023 K
Qe = 0.041 (29.92 x 103 + 319.62 x 725) + 0.028 (147.36 x 103 + 298.97 x 725) + 0.027 ( 0+ 30.753 x 725 ) + 0.901 (-241.82 x 103 + 40.904 x 725)
Qe = 10727.42 + 10195.17 + 601.98 - 191160.03
Qe = -169635.46 kj/kmol h
![]()
Pentru o conversie de 0.6 avem:
Te = 773K
Qe = 0.027 (29.92 x 103 + 273.48 x 475) + 0.042 (147.36 x 103 + 256.81 x 475) + 0.041 ( 0+ 29.847 x 475 ) + 0.889 (-241.82 x 103 + 37.911 x 475)
Qe = 4315.22 + 11312.47 + 581.27 - 198969.11
Qe = - 182760.15 kj/kmol h
![]()
Te = 873K
Qe = 0.027 (29.92 x 103 + 294.18 x 575) + 0.042 (147.36 x 103 + 275.77 x 575) + 0.041( 0+ 30.213 x 575 ) + 0.889 (-241.82 x 103 + 39.075 x 575)
Qe = 5374.98 + 12848.96 + 712.27 - 195003.81
Qe = - 176067.6 kj/kmol h
![]()
Te = 923K
Qe = 0.027 (29.92 x 103 + 303.41 x 625) + 0.042 (147.36 x 103 + 284.17 x 625) + 0.041 ( 0+ 30.395 x 625 ) + 0.889 (-241.82 x 103 + 39.740 x 625)
Qe = 5927.88 + 13648.58 + 778.87 - 192897.44
Qe = - 172542.11 kj/kmol h
![]()
Te = 1023 K
Qe = 0.027 (29.92 x 103 + 319.62 x 725) + 0.042 (147.36 x 103 + 298.97 x 725) + 0.041( 0+ 30.753 x 725 ) + 0.889 (-241.82 x 103 + 40.904 x 725)
Qe = 7064.40 + 15292.75 + 914.13 - 188614.32
Qe = - 165343.04 kj/kmol h
![]()
Pentru o conversie de 0.8 avem:
Te = 773K
Qe = 0.013 (29.92 x 103 + 273.48 x 475) + 0.055 (147.36 x 103 + 256.81 x 475) + 0.053 ( 0+ 29.847 x 475 ) + 0.877 (-241.82 x 103 + 37.911 x 475)
Qe = 2077.69 + 14813.96 + 751.39 - 196283.36
Qe = - 178640.32 kj/kmol h
![]()
Te = 873K
Qe = 0.013 (29.92 x 103 + 294.18 x 575) + 0.055 (147.36 x 103 + 275.77 x 575) + 0.053( 0+ 30.213 x 575 ) + 0.877 (-241.82 x 103 + 39.075 x 575)
Qe = 2587.95 + 16826.02 + 920.74 - 192371.59
Qe = - 172036.88 kj/kmol h
![]()
Te = 923K
Qe = 0.013 (29.92 x 103 + 303.41 x 625) + 0.055 (147.36 x 103 + 284.17 x 625) + 0.053 ( 0+ 30.395 x 625 ) + 0.877 (-241.82 x 103 + 39.740 x 625)
Qe = 2854.16 + 17873.14 + 1006.83 - 190293.65
Qe = - 168559.52 kj/kmol h
![]()
Te = 1023 K
Qe = 0.013 (29.92 x 103 + 319.62 x 725) + 0.055 (147.36 x 103 + 298.97 x 725) + 0.053( 0+ 30.753 x 725 ) + 0.877 (-241.82 x 103 + 40.904 x 725)
Qe = 3401.37 + 20026.22 + 1181.68 - 186068.35
Qe = - 161459.08 kj/kmol h
![]()
Din grafic rezulta XAf = 0,44 la Te = 825 K.
TABEL XII
|
COMPONENT |
DEBITE INTRARE IN REACTOR [Kmoli/h] |
DEBITE IESIRE [Kmoli/h] |
|
EB | ||
|
St | ||
|
H2 | ||
|
Abur | ||
|
Total |
Calculul fluxurilor :
Fluxul 11
![]()
unde 104 = Masa Moleculara a St.
Puritatea St este de 97%, ceea ce rezulta ca :
![]()
Pierderi :
in ape reziduale :
![]()
DmSt ( debit mediu St total) = 75.77+78.12 = 153.89 kmol/h stiren
4.92 x 0.44 .... 0.08St
153.89 .......x St
x = 5.69 St => 153.89 + 5.69 = 159.58 kmol/h St
TABEL XIII
|
Debit [Kgh] |
Component |
Debit [Kmolh] |
|
EB | ||
|
St | ||
|
H2 | ||
|
Abur | ||
|
Total |
Fluxul 12 - nimic
Fluxul 6 = fluxul 7
4.92 x 0.44 .... 0.08St
153.89 .......x St
x = 5.69 St => 153.89 + 5.69 = 159.58 kmol/h St
159.58 kmol/h .... 2.24 kmol/h St
x ....... 2.75 kmol/h Eb
x = 195.91 kmol/h Eb
159.58 kmol/h St ..... 2.24 kmol/h St
y .......... ...2.16 kmol/h H2
y = 153.88 kmol/h H2
159.58 kmol/h St ...... 2.24 kmol/h St
z ............63.96 kmol/h Ab
z = 4556.57 kmol/h Ab
TABEL XIV
|
COMPONENT |
DEBITE [Kmoli/h] |
DEBITE [Kg/h] |
|
EB | ||
|
St | ||
|
H2 | ||
|
Abur | ||
|
Total |
Fluxul 5
4.92 ....... 2.75 kmol/h Eb
x ........ 195.91 kmol/h Eb
x = 350.50 kmol/h Eb
0.08 ..... 2.24 kmol/h St
y ....... 159.58 kmol/h St
y = 5.69 kmol/h St
63.96 ...... 63.96 kmol/h Ab
z ....... 4556.57 kmol/h Ab
z = 4556.57 kmol/h Ab
TABEL XV
|
COMPONENT |
DEBITE [Kmoli/h] |
DEBITE [Kg/h] |
|
EB | ||
|
St | ||
|
H2 | ||
|
Abur | ||
|
Total |
Fluxul 9 = hidrogenul care iese din ractor 153.88 kmol/h
TABEL XVI
|
COMPONENT |
DEBITE [Kmoli/h] |
DEBITE [Kg/h] |
|
EB | ||
|
St | ||
|
H2 | ||
|
Abur | ||
|
Total |
Fluxul 8 = 4556.57 + 1.17 = 4557.74 kmol/h
TABEL XVII
|
COMPONENT |
DEBITE [Kmoli/h] |
DEBITE [Kg/h] |
|
EB | ||
|
St | ||
|
H2 | ||
|
Abur | ||
|
Total |
Fluxul 10 = fluxul 7 - (fluxul 9 + fluxul 8) = 5065.94 - ( 153.88 + 4557.74) = 354.32 kmol/h
Fluxul 2 = 10% din cantitatea de abur ce intra in reactor
![]()
TABEL XVIII
|
COMPONENT |
DEBITE [Kmoli/h] |
DEBITE [Kg/h] |
|
EB | ||
|
St | ||
|
H2 | ||
|
Abur | ||
|
Total |
Fluxul 3 = 90% din cantitatea de abur ce intra in reactor
![]()
TABEL XIX
|
COMPONENT |
DEBITE [Kmoli/h] |
DEBITE [Kg/h] |
|
EB | ||
|
St | ||
|
H2 | ||
|
Abur | ||
|
Total |
Fluxul 13 = fluxul 10 - fluxul 11 = 354.32 - 78.12 = 276.2 kmol/h
100 kmol/h .... 98 kmol/h Eb ..... 2 kmol/h St
276.2 ..... x kmol/h Eb ....... y kmol/h St
x = 270.67 kmol/h Eb
y = 5.52 kmol/h St
TABEL XX
|
COMPONENT |
DEBITE [Kmoli/h] |
DEBITE [Kg/h] |
|
EB | ||
|
St | ||
|
H2 | ||
|
Abur | ||
|
Total |
Predimensionarea reactorului
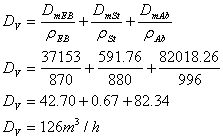

CAPITOLUL IV
Norme de P.M si P.S.I si toxicitate
Etil-benzenul este o substanta inflamabila.Temperatura de inflamabilitate este de 15oC, iar cea de autoinflamare de 553oC. Vaporii formeaza cu aerul amestecuri explozive. Toxicitatea este asemanatoare xilenilor.
Stirenul este si el un lichid inflamabil. Temperatura de inflamabilitate este de 30oC, iar cea de autoinflamare de 5300C. amestecul de vapori de de stiren si aer cu conc de 1.1-6.1 % vol. stiren explodeaza.
Stirenul polimerizeaza incet la temperaturi normale. Prin incalzire polimerizarea poate deveni violenta.
Polimerizarea stirenului este un proces exoterm, astfel incat reactia se poate accelera de la sine conducand la temperaturi si presiuni ridicate in rezervorul de depozitare si chiar la explozia acestuia. Ea poate fi incetinita prin adaugare de inhibitori ca tert-butilcatechina in cantitati de 10-15 ppm.
Desi oxigenul degradeaza stirenul, s-a dovedit ca mici cantitati de oxigen au un efect de inhibare a polimerizarii. Ca urmare nu se recomanda ca stirenul sa fie mentinut sub 'perna' de gaz inert in timpul depozitarii lui.
Inhibat, stirenul poate fi depozitat la temperaturi obisnuite timp indelungat. Daca temperatura normala depaseste 350C, este necesara golirea rezervorului. Pentru confectionarea rezervoarelor se pot utiliza otel, aluminiu. Se vor evita cuprul sau aliaje de cupru, intrucat acestea formeaza cu stirenul combinatii colorate.
Stirenul este toxic. Nu s-au observat iritatii la contactul cu pielea.
s-a constatat ca stirenul este detoxificat in organism prin producerea ixidativa a dublei legaturi.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 4869
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved