| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
PROCEDEE DE DEDURIZARE A APEI
1 APA - GENERALITATI
Apa este cea mai raspandita substanta compusa, ocupand ¾ din suprafata globului terestru. Ea constituie factorul principal al intretinerii si dezvoltarii vietii, fiind de o importanta primordiala. Multa vreme apa a fost considerata drept un element, si anume pana in anul 1783, cand Lavoisier dovedeste pe cale experimentala ca apa este o substanta compusa, trecand vaporii de apa peste fier inrosit.
In natura apa se gaseste sub toate starile de agregare :
Ø solida (gheata, zapada, grindina
Ø lichida (apa de ploaie, ape subterane, oceane, mari, fluvii);
Ø gazoasa (vaporii de apa din atmosfera
Apa se mai gaseste in organisme animale si vegetale, precum si in cristalohidrati, sub forma de apa de cristalizare. Apele naturale contin, dizolvate cantitati variate de diferite substante.
Apa se gaseste in atmosfera in hidrosfera si in sol sub forma de:
Ø ape meteorice;
Ø ape de suprafata;
Ø ape subterane;
Dintre toate apele naturale, apa de ploaie este cea mai curata. Ea dizolva in drumul ei, prin atmosfera mai ales, bioxid de carbon, iar in regiunile industriale, bioxid de sulf si hidrogen sulfurat.
O parte din apa cazuta pe pamant cu un continut ridicat de bioxid de carbon, strabatand straturile de pamant, dizolva carbonatii de calciu si magneziu, transformandu-i in bicarbonati solubili.
Daca intalnesc straturi impermeabile aceste ape se aduna, formand apele subterane. Apele subterane se pot clasifica dupa mai multe criterii:
Ø dupa gradul de mineralizare
o ape dulci (dau un reziduu sub 1g/l);
o ape minerale (dau un reziduu peste 1g/l).
Ø dupa compozitia chimica
Ø ape bicarbonatate;
Ø ape carbonatate;
Ø ape sulfatate;
Ø ape clorurate;
Ø ape feruginoase.
Ø dupa pozitia panzei de apa:
Ø ape din panza freatica;
Ø ape din panza de adancime medie ;
Ø ape din panza de adancime mare.
PROPRIETATI FIZICO - CHIMICE ALE APEI
Apa pura este:
Ø un lichid incolor in strat subtire (privita in straturi groase are culoarea albastruie);
Ø nu are miros nici gust;
Ø este rau conducatoare de caldura si electricitate;
Ø la presiunea atmosferica apa pura se solidifica (ingheata)la 00C;
Ø fierbe la 1000C.
In unele privinte apa se comporta diferit decat alte lichide.
De exemplu:
Ø greutatea specifica a apei este maxima la 40C si este egala cu unitatea;
Ø deasupra si sub aceasta temperatura, greutatea specifica scade la 00C;
Ø la temperatura de inghet, densitatea apei lichide este de 0,99987 si a ghetii 0,9167 (deci gheata este de 1/11 ori mai usoara decat apa, ceea ce o face sa pluteasca pe suprafata apei);
Ø apa este un bun solvent, in apa se dizolva un mare numar de combinatii chmice, atat minerale, cat si organice;
Ø apa dizolva de asemenea un numar mare de electroliti, dand solutii in care acestia se gasesc sub forma de ioni hidrati, dand solutii terminat de dipoli de apa in jurul lor;
Ø apa prezinta o mare stabilitate; numai la temperaturi extrem de ridicate 1300 0 C are loc desfacerea apei in elementele componente
Ø 2H2O = 2H2 + O2
apa reactioneaza cu unele metale chiar la temperatura obisnuita, punand in libertate hidrogenul:
Ø 2H2O Û 2H2 + O2 ΔH = +136,8 kcal
Ø apa reactioneaza si cu unele nemetale; astfel, vaporii de apa reactioneaza cu carbunii inrositi, formand oxizi de carbon si hidrogen:
Ø H2O + C = H2 + CO
Ø apa reactioneaza cu oxizii unor metale formand hidroxizi,
Ø H2O + Na2O = 2NaOH
Ø H2O + CaO = Ca(OH)2
Ø dar si ai unor nemetale formand acizi:
Ø H2O + SO2 Û H2SO3
Ø H2O = SO3 = H2SO4
Ø 6H2O + P4O10 = 4H3PO4
Ø apa este o substanta foarte activa;
Ø reactioneaza cu unele metale, punand in libertate H2,
Ø se combina cu multi oxizi, dand baze si acizii
Ø provoaca hidroliza unor saruri.
3. IMPORTANTA SI UTILIZARILE APEI
Apa, aerul si solul sunt constituenti ai biosferei, cunoscuti sub denumirea de factori de mediu. In fiecare din acestia se dezvolta o fauna specifica pentru care trebuie sa se asigure un mediu ambiant, sanatos si curat, necesar supravietuirii. Cunoasterea conditiilor de viata din cadrul fiecarui mediu, conduce la protectie eficienta a mediului.
Pentru aceasta, este necesar sa se cunoasca sursele de poluare, respectiv poluantii, modul de dispersie a poluantilor asupra mediului si masurile de prevenire si combatere a poluarii factorilor de mediu pentru a crea conditii propice vietii pe pamant.
Apa determina natura lumii fizice si biologice pe planeta noastra si reprezinta cea mai importanta substanta chimica.
Apa este un constituent major al corpului animal si al mediului inconjurator in care traim.
Apa are urmatoarele intrebuintari:
Ø este folosita ca:
Ø materie prima;
Ø ca agent de incalzire sau de racire (in procese de dizolvare, cristalizare, distilare, hidroliza );
Ø ca mediu de reactie;
Ø este indinspensabila pentru priza cimentului in constructii;
Ø in industria alimentara apa este folosita la obtinerea diferitelor conserve sau produse alimentare.
DURITATEA APEI - GENERALITATI
Prin duritatea apei se intelege cantitatea totala de calciu si magneziu exprimata in mg oxid de calciu, continuta intr-un litru de apa.
Exprimarea duritatii se face in grade de duritate.
Un grad de duritate corespunde la 10 mg oxid de calciu/litru de apa sau la 7 mg oxid de magneziu/litru de apa
Duritatea apei poate fi:
Ø Duritatea temporara ,
notata cu D t , se datoreaza prezentei bicarbonatilor de calciu si de magneziu.
Aceasta duritate poate fi indepartata prin:
Ø fierberea apei, cand carbonatii acizi se descompun si formeaza carbonati insolubili, conform reactiilor chimice:
Ø Ca(HCO3)2 fierbere CaCO3 ¯ + CO2 + H2O
Ø Mg(HCO3)2 fierbere MgCO3 ¯ + CO2 + H2
Ø sau prin tratarea apei cu var stins ( hidroxid de calciu), cand precipita carbonatii neutri.
Ø CaSO4 + Na2CO3 = CaCO3 ¯ + Na2SO4
Ø CaCl2 +Na2CO3 → CaCO3 ¯ + 2NaCl
Ø Duritatea permanenta
se noteaza cu Dp este data de saruri de calciu si magneziu, de acizi tari (cloruri, sulfati, azotati etc.).
Acest tip de duritate se poate indeparta prin :
Ø tratarea apei cu var- soda, sau cu schimbatori de ioni:
Ø Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 ¯ +2H2O
Ø Mg(HCO3)2 + Ca(OH)2 → CaCO3 ¯ + MgCO3 ¯ +2H2O
Ø CaSO4 + Na2CO3 = CaCO3 ¯ + Na2SO4
Ø CaCl2 +Na2CO3 → CaCO3 ¯ + 2NaCl
Ø MgCl2 + 2NaOH → Mg(OH)2 ¯ + 2NaCl
Ø Duritatea totala, se noteaza cu DT sau D si reprezinta suma duritatilor temporare si permanente:
DT = Dt + Dp
Duritatea apei se exprima in grade de duritate (o), a caror semnificatie difera de la o tara la alta:
o un grad german de duritate = 10mg CaO/l ;
o un grad francez de duritate = 10mg CaCO3/l ;
o un grad american de duritate = 1mg CaCO3/l ;
o un grad englez de duritate = 14,3mg CaCO3/l ;
Unitatea universala de exprimare a duritatii este numarul de miliechivalenti /l (1mEchiv/l = 2,8 grade germane).
In functie de duritate, apele se impart in:
o ape foarte moi (0-40);
o ape moi (5-80);
o ape semidure (9-120);
o ape dure (13-180);
o ape foarte dure ( >18)
4.1. DETERMINAREA DURITATII APEI IN LABORATOR:
In laboratorul chimic determinarea duritatii temporare a apei se face cel mai simplu prin titrare cu o solutie de HCl 0,1N in prezenta de metiloranj.
Modul de lucru:
Ø se masoara cu precizie V ml (de exemplu 100ml) apa de analizat care se trece intr-un pahar Erlenmeyer de 250ml, se adauga 2-3 picaturi de metiloranj si se titreaza cu HCl 0,1N cu factor F cunoscut pana la virarea culorii galben-portocaliu;
Ø se fierbe solutia cateva minute pentru a indeparta CO2;
Ø dupa racire, daca culoarea a devenit galbena, se continua titrarea pana la nuanta galben-portocaliu, cand se citeste la biureta volumul Ve;
Ø se calculeaza duritatea temporara cu relatia :
Ve F
![]() DT =
DT =
V
in care:
Ø V reprezinta volumul probei de analizat (cm3);
Ø Ve reprezinta volumul solutiei de HCl folosit la titrare (cm3) ;
Ø F reprezinta factorul de HCl 0,1N;
Ø 2,8 reprezinta cantitatea de CaO in mg care corspunde la 1cm3 solutie de HCl 0,1N ;
Determinarea duritatii totale se poate face prin doua metode:
1. Determinarea duritatii totale prin titrare cu "amestec alcalin" consta in trecerea bicarbonatilor de calciu si de magneziu in alte saruri sub actiunea unui acid care (exemplu HCl) urmat de precipitarea carbonatilor de calciu si magneziu folosind un "amestec alcalin" de hidroxid de sodiu si carbonat de sodiu.
Au loc urmatoarele reactii:
Ø Ca(HCO3)2 + 2HCl → CaCl2 +2CO2 +2H2O
Ø Mg(HCO3)2 + 2HCl → MgCl2 +2CO2 +2H2O
Ø CaCl2 +Na2CO3 → CaCO3 ¯ + 2NaCl
Ø MgCl2 + 2NaOH → Mg(OH)2 ¯ + 2NaCl
Modul de lucru:
o se prepara un amestec 1:1 de solutii de Na2CO3N si NaOH 0,1N (cu factor de corectie cunoscut) - "amestec alcalin";
o se masoara cu precizie un volum V de apa de analizat (V cuprins intre 100-200ml) care se trece intr-un pahar Erlenmeyer de 250ml;
o se adauga 2-3 picaturi de metiloranj si se titreaza cu solutie de HCl 0,1N pana la aparitia culorii rosii;
o se fierbe solutia pana se aduce prin evaporare, la un volum de 50ml;
o se neutralizeaza solutia adaugand solutie de NaOH 0,1N pana la virarea culorii de galben-portocaliu;
o se adauga cu biureta 50ml "amestec alcalin";
o se fierbe solutia 2-3 minute pentru indepartarea CO2;
o dupa racire, solutia se filtreaza, prinzandu-se filtratul intr-un balon cotat de 200ml;
o se spala precipitatul cu apa distilata care se prinde in acelasi balon cotat si apoi acesta se aduce la semn cu apa distilata si se omogenizeaza solutia prin agitare;
o din balon se iau cu pipeta 100ml solutie care se trece intr-un pahar Erlenmeyer si se titreaza cu solutia de HCl 0,1N in prezenta de metiloranj;
o se noteaza volumul de echivalenta Ve;
o se calculeaza duritatea totala cu formula:
(25 - Ve FHCL)
![]() DT = ml
DT = ml
10 V
in care:
Ø 25ml reprezinta volumul real de "amestec alcalin" intrat in reactie;
Ø Ve reprezinta volumul solutiei de HCl folosit la titrare (cm3) ;
Ø FHCl reprezinta factorul de HCl 0,1N ;
Ø 2,8 reprezinta cantitatea de CaO in mg care corspunde la 1cm3 solutie de HCl 0,1N ;
Ø V reprezinta volumul probei de analizat (cm3)
Determinarea duritatii totale prin titrare complexonometrica consta in transformarea cationilor responsabili de duritatea apei in combinatii complexe stabile, prin titrare cu soluie Complexon III in prezenta de indicator Eriocrom negru T.
Modul de lucru in cazul apelor care nu contin bicarbonati si carbonati alcalini:
o se masoara cu precizie V ml de apa de analizat (de exemplu 25ml) care se trec intr-un pahar Erlenmeyer de 100ml;
o se adauga 1ml solutie tampon NH3 - NH4Cl cu pH = 10, 0,1 indicator Eriocrom negru T si 25ml apa distilata;
o se titreaza cu solutia de ComplexonIII 0,01M pana la virarea culorii de la rosu la albastru si se determina volumul de echivalenta Ve;
o duritatea totala se calculeaza cu formula:
0,5608 Ve 56,1 Ve
![]()
![]() DT
=
DT
=
10 V Vq
in care:
Ø 0,5608 reprezinta cantitatea de CaO in mg care corespunde la 1ml solutie de ComplexonIII 0,01M;
Ø Ve reprezinta volumul solutiei de HCl folosit la titrare (cm3);
Ø 10 reprezinta cantitatea de CaO in mg, care corespunde la un grad de duritate german.
5. DEDURIZAREA APEI - GENERALITATI
Dedurizarea apelor industriale are ca scop imbunatatirea calitatii apelor pentru a corespunde anumitor intrebuintari si se realizeaza dupa scheme tehnologice complexe, in care se pot utiliza pocedee fizice sau chimice in functie:
o de scopul urmarit;
o de sursa de apa bruta;
o de conditiile economice;
o de prelucrare.
o
Dedurizarea apei este procedeul tehnologic de eliminare a ionilor de calciu si magneziu din apa.
In prezent se cunosc mai multe procese de dedurizare a apei care se aplica in practica in functie de:
o natura duritatii apei;
o gradul de dedurizare cerut de diverse folosinte ale apei.
Astfel pentru apele cu duritate temporara mare se aplica procedeul termic. Se pot aplica si procedee chimice cum ar fi:
o procedeul cu var si soda;
o procedeul cu schimbatori de ioni.
DEDURIZAREA APEI PRIN PROCEDEE CHIMICE.
PROCEDEUL VAR - SODA
DESCRIEREA PROCEDEULUI
Procedeul var-soda, se numeste astfel pentru ca foloseste ca reactivi chimici:
Ø varul stins (hidroxid de calciu);
Ø soda (carbonatul de sodiu).
Principiul metodei consta in precipitarea carbonatilor acizi care dau duritate temporara apei, in carbonati neutri.
Precipitarea este facuta de hidroxidul de calciu care neutralizeaza si dioxid de carbon.
Acest procedeu de dedurizare se poate realiza in doua variante:
Ø cu var rece;
Ø cu var cald.
Procedeul cu var cald se intrebuinteaza mai ales pentru purificarea
apei folosite la alimentarea cazanelor de aburi.
Fazele procesului industrial sunt urmatoarele:
Ø incalzirea apei cu aburi reziduali;
Ø introducerea in instalatie a varului si a sodei;
Ø realizarea reactiei de dedurizare;
Ø filtrarea apei dedurizate;
Ø spalarea periodica a filtrului si evacuare a namolului din instalatie.
Au loc urmatoarele reactii:
Ø Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 ¯ +2H2O
Ø Mg(HCO3)2 + Ca(OH)2 → CaCO3 ¯ + MgCO3 ¯ +2H2O
CaCO3, precipitand, poate fi indepartat prin MgCO3 solubil, reactioneaza mai departe trecand in Mg(OH)2
Ø MgCO3 + Ca(OH)2 → CaCO3 + Mg(OH)2
restul sarurilor de calciu si magneziu reactioneaza astfel:
Ø MgCl2 + Ca(OH)2 → Mg(OH)2 + CaCl2
Ø CaCl2 +Na2CO3 → CaCO3 ¯ + 2NaCl
Ø CaSO4 + Na2CO3 → CaCO3¯ + Na2SO4
Ø MgSO4 + Na2CO3 + Ca(OH)2 → Mg(OH)2 + CaCO3+Na2SO4
Ø CO2 + H2O + Ca(OH)2 → CaCO3 ¯ + 2H2O
Din analiza reactiilor se observa ca sarurile de magneziu care dau duritatea permanenta consuma atat var cat si soda, in timp ce sarurile de calciu consuma numai soda. Aceasta inseamana ca eliminarea sarurilor de magneziu este mai costisitoare decat a celor de calciu.
Inainte de tratare apa este analizata pentru a cunoaste cantitatea de var si soda necesara. Prin incalzirea apei de purificat :
Ø se accelereaza reactiile;
Ø este favorizata depunerea namolului;
Ø se produce descompunerea partiala a bicarbonatilor.
Apa bruta intra prin conducta 1, de unde este distribuita prin tuburile 2, 2¢, 2" cu debite reglate automat cu dispozitive de flotare. Apa care intra prin tubul 2 dizolva Na2CO3, iar cea care intra prin 2" dizolva Ca(OH)2, formind laptele de var. Prin 2' intra cantitatea cea mai mare de apa pentru purificarea apei.
Laptele de var trece din dozatorul 3 in vasul de limpezire 5, de unde intra in epurator pe la partea superioara, intalnind aici apa bruta ce vine prin tubul 2'. Are loc precipitarea carbonatilor. Suspensia trece prin conducta 6, in partea de jos a epuratorului, unde intalneste solutia de Na2CO3 ce vine din dozatorul 4. Are loc completarea dedurizarii; namolul se depune, iar apa purificata trece prin filtrul 7 si se evacueaza prin conducta 8.
Pentru purificarea mai avansata, dupa aplicarea metodei var-soda se mai aplica apei un tratament care consta in:
Ø adaugarea unui mic exces de Na2CO3 (circa 0,07g/l), care micsoreaza solubilitatea carbonatilor de calciu si magneziu;
Ø noua purificare cu fosfat trisodic, cand se formeaza un precipitat de fosfat tricalcic, mai putin solubil si mai usor de decantat decat carbonatul de calciu;
Ø 3CaCO3 + 2Na3PO4 → Ca3(PO4)2 + 3Na2CO3
Ø adaugarea aluminatului de bariu pentru precipitarea aluminatului de calciu.
Apa dedurizata cu var si soda prezinta un grad variabil de corosivitate, care depinde de cantitatile de Na2SO4 si NaCl, formate in reactia de precipitare.
5.1.2 SCHEMA INSTALATIEI DE DEDURIZARE PRIN PROCEDEUL
VAR-SODA
5.2 PROCEDEUL CU SCHIMBATORI DE IONI
5.1 DESCRIEREA PROCEDEULUI
Procedeul cu schimbatori de ioni este cel mai simplu si eficient.
Fenomenul schimbului dintre ionii solutiei unui electrolit ce trece peste o anumita substanta solida, insolubila si ionii acestei substante a fost pus in evidenta de geologi si agronomi cu peste o suta de ani in urma.
Schimbatorii de ioni din solutie sunt fie de natura organica (acizi humici sau humanati), fie de natura anorganica (alumosilicati).
Dupa materialele folosite se deosebesc doua tipuri de procedee.
Procedee cu permutiti (obtinuti pe cale de sinteza sau zeoliti naturali). Permutitul este un alumo-silicat de sodiu hidratat care corespunde formulei generale Na2O R2O3 nSiO2 XH2O , unde R2O3 este Al2O3 sau Fe2O3 ,
n =5 si x reprezinta cantitati variabile de apa. El retine ionii de calciu si magneziu din solutie si cedeaza ionii de Na.
Ø Na2(P) + Ca(HCO3)2 → Ca(P) + 2NaHCO3
Ø Na2(P) + CaCl2 → Ca(P) + 2NaCl
Ø Na2(P) + Mg(HCO3)2 → Mg(P) + 2NaHCO3
Ø Na2(P) + MgCl2 →Mg(P) + 2NaCl
Ø Na2(P) +CaSO4 → Ca(P) + Na2SO4
Dupa completa epuizare, permutitul se regenereaza cu o solutie saturata de NaCl 10-15%.
Ø Ca(P) + 2NaCl(exces) → Na2(P) + CaCl2
Dedurizarea cu permutiti se realizeaza in epuratoare, constituite dintr-un vas cilindric, in care se gaseste un strat de permutiti, deasupra unui strat de nisip cuartos, peste care trece apa proaspata dupa ce a traversat un strat de carbonat de calciu (pentru extragerea bioxidului de carbon). Dupa epuizare se regenereaza permutitul cu o solutie de clorura de sodiu, preparata intr-un dozator.
Acest procedeu prezinta avantajul ca poate functiona fara o reglare speciala, chiar daca duritatea apei variaza de la o zi la alta.
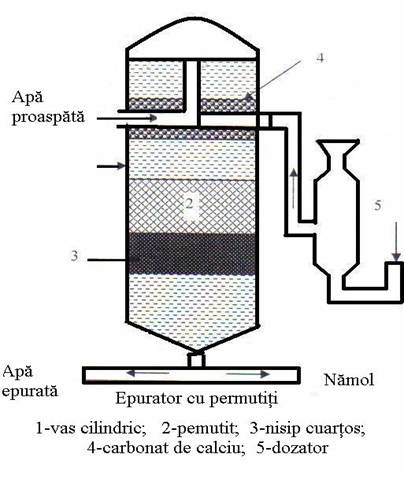
Procedee cu schimbatori de ioni de natura organica
Acesti schimbatori de ioni, obtinuti pe cale sintetica, se impart in cationiti si anioniti. Cationitii sunt rasini sintetice de tipul fenol-formaldehidica sau polistirenice sulfonate.
Schimbul are loc intre hidrogenul activ al gruparii sulfonice si cationul sarurilor din apa dupa reactiile:
Ø Ca(HCO3)2 + 2HSO3R → Ca(SO3R)2 + +2CO2 +2H2O
Ø Mg(HCO3)2 + 2HSO3R → Mg(SO3R)2 + +2CO2 +2H2O
sulfatii si clorurile dau reactiile:
Ø CaSO4 + 2HSO3R → Ca(SO3R)2 + H2SO4
Ø NaCl + HSO3R → NaSO3R + HCl
rezulta acizi liberi care aciduleaza apa. Regenerarea in acest caz se face cu acid sulfuric:
Ø Ca(SO3R)2 + H2SO4 (exces)→ 2HSO3R ? CaSO4
Ø 2 NaSO3R + H2SO4 → 2HSO3R + Na2SO4
Regenerarea poate fi facuta si cu NaCl, cand se obtine sarea de sodiu a schimbatorului, care functioneaza mai departe cu permutitii.
Puterea de schimb a cationitilor este foarte mare. Cu ajutorul lor se poate micsora duritatea apei de la 35 la 00.
Apa acida rezultata este apoi neutralizata in prezenta anionitilor care se obtin prin policondensarea aminelor cu aldehida formica.
Reactia de neutralizare care are loc este urmatoarea:
Ø R'2NR" + HCl → R2'N(HCl)R"
unde R' = H
Regenerarea anionitilor este data de reactia:
Ø Ca(P) + 2NaCl (exces) → Na2(P) + CaCl2 + CO2 + H2O
Prin acest procedeu se elimina cationii de calciu si de magneziu din apa initiala. Instalatia consta dintr-un rezervor cilindric in care se introduce stratul de permutit sau zeolit asezat in mod obisnuit pe un strat de pietris si dintr-un numar de doua rezervoare auxiliare folosite pentru depozitarea saramurii. Apa de purificat se introduce sub presiune, strabate stratul de permutit si se evacueaza la partea inferioara. Spalarea si regenerarea stratului de permutit are loc in sens invers. Acest procedeu este avantajos, pentru ca nu necesita o reglare speciala in conditii in care duritatea apei variaza de la o zi la alta. Dintre zeolitii naturali, in industrie, cel mai utilizat este gluconitul, care prezinta o capacitate de schimb cationic. Cationul de schimb din gluconit este potasiul. Glauconitul natural este cunoscut sub denumirea de nisip verde si are compozitia:
Ø SiO2 : 45-50% ;
Ø Fe2O3 : 20-25% ;
Ø Al2O3 : 7-15% ;
Ø K2O : 5-15% ;
Ø CaO : 2-3% ;
Ø Na2O : max. 1% ;
Ø apa de constructie 10% .
Glauconitul se reactiveaza prin calcinarea la 600-800 0C.
Permutitul este un zeolit artificial si se poate prepara prin incalzirea la 13000C a unui amestec de
Ø caolin;
Ø cuart;
Ø carbonat sau sulfat de sodiu;
Ø carbune.
Aplicand aceste procedee apa este complet deionizata.
Procedeele cu schimbatori de ioni elimina dezavantajele epurarii
chimice clasice constand in:
Ø scheme tehnologice complexe;
Ø instalatii voluminoase si complicate;
Ø controlul permanent al apei brute si epurate.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 6288
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved